氮元素
- 格式:ppt
- 大小:875.50 KB
- 文档页数:26

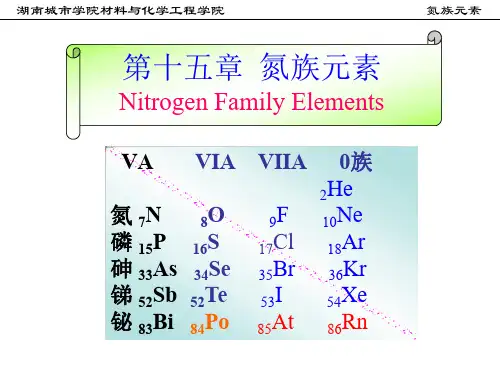
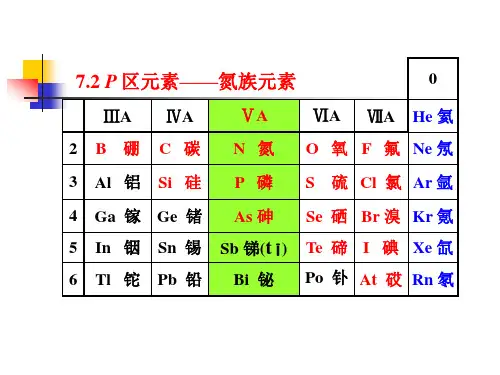
氮族元素氮族元素氮族元素是指元素周期表中第15族的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和钋(Bi)。
这些元素都具有一些相似的化学性质和电子结构特征。
在自然界中,氮族元素广泛存在于岩石、土壤、空气、生物体等不同环境中,并且在地球上具有重要的地球化学循环。
首先,我们来了解一下氮。
氮是地球上气体态元素的主要成分之一,占据了近地表大气的78%左右。
它属于非金属元素,具有两个共价键,通常以N2的形式存在。
氮气是一种非常稳定和惰性的分子,这使它在常温常压下不易与其他元素或化合物反应。
因此,人们通常称氮气为惰性气体。
此外,氮还是生物体中许多重要化合物,如氨基酸、蛋白质和核酸的组成部分。
接下来是磷。
磷是一种非金属元素,其化学性质相对活泼。
它在地球上的存在主要以磷酸盐的形式,广泛分布于矿石、岩石、土壤和水体中。
磷是生命体中重要的元素之一,是细胞核酸和蛋白质的组成部分,同时也在能量代谢和骨骼形成中起着重要的作用。
然后是砷。
砷是一种半金属元素,具有金属和非金属元素的一些特性。
它在地壳中以砷化物的形式存在,砷酸盐也是一种常见的矿石。
砷具有较强的毒性,对人类和其他生物有害。
然而,它在医药和农业领域中的一些化合物也有一定的用途。
接下来是锑。
锑是一种典型的金属元素,具有良好的导电性和热导性。
它在地壳中主要以硫化锑的形式存在。
锑的化合物在冶金、制造电池和半导体器件等方面有广泛应用。
最后是钋。
钋是一种放射性元素,也是自然界中含量极稀少的元素之一、它主要以铋矿石中的放射性钋-210的形式存在。
钋的放射性衰变产物被广泛用于科学研究和医学诊断等领域。
氮族元素在自然界中的存在和它们的化学特性对地球的生态平衡和人类的生活都具有重要影响。
例如,氮是生命体中蛋白质和核酸的组成部分,它是植物生长所必需的。
磷则在植物的能量代谢和骨骼形成中扮演着重要角色。
此外,氮和磷也是水体富营养化的主要原因之一、砷和锑的毒性对环境和人类健康构成了一定的威胁,因此对于它们的环境污染和诊断治疗的研究非常重要。

氮元素的介绍氮元素是地球上最常见的元素之一,占据了大气中的78%。
它在自然界中以N₂的形式存在,是生物体中的关键元素之一。
氮元素在生物体中的作用非常重要,它参与了生命体系中的许多基本生物化学过程。
例如,氮元素在蛋白质合成、核酸合成和氨基酸代谢等方面都起着至关重要的作用。
除了在生物体中的重要性外,氮元素还在人类活动中扮演着重要的角色。
氮元素的来源非常广泛,主要包括大气中的氮气、土壤中的氮化合物以及水体中的氮化合物等。
大气中的氮气通过闪电、太阳辐射和工业活动等方式被固定为其他形式的氮化合物,进入了土壤和水体中。
土壤中的氮化合物可以通过细菌的作用转化为植物可利用的氮源,从而为植物的生长提供充足的养分。
水体中的氮化合物则主要来源于工业排放、农业活动和城市污水等,但过多的氮化合物会导致水体富营养化,对水生生物造成危害。
在人类活动中,氮元素的利用和排放已经成为一个重要的环境问题。
随着工业化和农业生产的发展,大量的氮化合物被排放到大气和水体中,导致空气和水质的污染。
例如,汽车尾气中的氮氧化物会对大气产生不良影响,导致酸雨和光化学烟雾等问题。
农业活动中使用的化肥和农药也会导致土壤和水体中的氮化合物过度积累,对生态环境造成破坏。
因此,如何合理利用氮元素、减少氮污染已经成为当前环保工作中亟待解决的问题。
总的来说,氮元素在自然界和人类活动中都起着至关重要的作用。
它是生命体系中不可或缺的元素,但也是环境污染的源头之一。
只有合理利用氮元素、减少氮污染,才能实现人类与自然的和谐共生。
希望未来能够加强氮元素研究,推动环保工作,为建设美丽地球做出更大的贡献。

氮元素全部知识点总结1. 氮元素的基本性质氮元素是地球上自然存在的元素之一,它的原子序数为7,原子量为14.007 u,是在化学元素周期表中位于第15族元素。
在常温下,氮气是一种无色、无味、无毒的气体,它在空气中占据了78%的比例。
氮气的沸点为-195.8°C,熔点为-210°C。
与大部分其他气体一样,氮气是不可燃的,不支持燃烧。
2. 氮元素的化合物氮元素主要形成的化合物包括氨、硝酸、硝酸盐等。
其中,氨是氮元素最常见的化合物之一,它是由一个氮原子和三个氢原子组成的化合物。
氨在农业中用作化肥,同时也是工业上的重要化学原料。
硝酸是另一种重要的氮化合物,它主要用于生产肥料和炸药。
硝酸盐则是硝酸和金属离子结合形成的化合物,常见的硝酸盐包括硝酸钠、硝酸铵等,它们也被广泛应用于农业和工业。
3. 氮元素的应用氮元素在农业、工业、医药等领域有着广泛的应用。
在农业中,氮元素主要以化肥的形式施用于土壤,促进植物的生长和发育。
在工业上,氮元素被用于合成化肥、硝酸、氨、硝酸盐等化学品。
此外,氮气也被用于气体保护焊接和气铁器。
在医药领域,氮元素被用于制备一些重要的药物,如硝化甘油等。
4. 氮元素与环境影响氮元素在地球生态系统中起着非常重要的作用,但同时过量的氮元素也会对环境产生负面影响。
通过人类活动排放的氮氧化物和氨等化合物,会导致土壤酸化和土壤养分失衡,对植物和水域生态系统造成破坏。
此外,过量的氮元素被排放到大气中也会导致大气污染问题,加剧酸雨等环境问题。
总的来说,氮元素是地球上非常重要的元素,它在生命系统中起着至关重要的作用。
通过对氮元素的深入了解和科学利用,可以更好地保护环境,维护地球生态平衡的稳定。
希望通过本文的总结,能够为读者提供了解氮元素的全面知识,进而更好地认识和关注这一重要元素。

氮元素简介
氮(Nitrogen)是化学元素周期表中的第7个元素,符号N,原子序数7。
氮是一种无色无味的气体,在标准温度和压力下(25°C,1大气压)氮气是稳定的,占地球大气体积的大约78%。
氮是宇宙中第五丰富的元素,也是构成生命的基本元素之一。
物理性质
- 氮气(N2)是一种分子,由两个氮原子组成,是一个双原子分子。
- 氮气在常温常压下是一种惰性气体,不支持燃烧,也不与其他元素轻易反应。
- 氮气沸点为-195.79°C,在工业上常用液氮的形式存在,由于其低温性质,液氮常用于制冷和医疗 applications。
化学性质
- 虽然氮气在常温下不活泼,但在高温或放电条件下,氮气可以与氧气和其他元素发生反应。
- 氮是形成氨基酸、蛋白质和核酸等重要生物分子的关键元素。
- 氮的化合物在自然界和工业中都非常重要,包括氨(NH3),硝酸(HNO3)和硝化作用中的中间产物。
工业应用
- 氮气在工业上广泛用作保护气体,以防止金属在焊接和热处理过程中与氧气反应。
- 氨是合成尿素、硝酸和其他化学品的重要原料,这些化学品用于肥料和工业溶剂。
- 氮气也被用作食品保鲜的防腐剂,因为它的化学稳定性可以防止食品变质。
生物作用
- 植物通过根部的根瘤菌固定大气中的氮气,转化为可利用的氨,这是植物生长和发育所必需的。
- 动物通过食用植物或食用其他动物来获取氮,氮是构成它们体内蛋白质和核酸的重要成分。
由于氮在地球生态系统中的循环至关重要,人类活动对氮循环的影响,如化石燃料的燃烧和农业肥料的使用,已经成为环境科学研究的重要议题。

氮元素完全燃烧产物
氮元素在完全燃烧时的产物是氮气(N2)。
当氮元素与氧气(O2)反应时,会生成氮气。
化学反应方程式如下:
N2 + O2 → 2NO2
在一些特殊条件下,氮气(N2)也可以进一步与氧气(O2)反应形成其他氮氧化物。
这些氮氧化物包括:
1. 一氧化氮(NO):当氮气和氧气在高温下反应时,会生成一氧化氮。
化学反应方程式如下:
N2 + O2 → 2NO
2. 二氧化氮(NO2):一氧化氮进一步与氧气反应,可以形成二氧化氮。
化学反应方程式如下:
2NO + O2 → 2NO2
3. 三氧化二氮(N2O3):当氮气和氧气在低温下反应,可以生成三氧化二氮。
化学反应方程式如下:
N2 + O2 → 2N2O3
4. 二亚硝酸(HNO2):一氧化氮和水反应,可以生成二亚硝酸。
化学反应方程式如下:
3NO + H2O → 2HNO2 + NO
总的来说,在完全燃烧条件下,主要的氮元素燃烧产物为氮气(N2),而在特殊条件下,还可以生成其他氮氧化物。

氮元素知识点总结氮元素是化学元素周期表中的第七个元素,原子序数为7,化学符号为N。
它是地壳中广泛存在的一种元素,占地壳总重量的约78%,是空气中的主要成分之一。
氮元素在生物体系中起着重要的作用,是生命的基本组成部分之一。
1. 氮元素的特性氮元素是一种无色、无味、无臭的气体,在常温下为双原子分子N2。
氮气是一种不活泼的气体,不易与其他元素发生化学反应,因此被称为惰性气体。
氮气具有弹性,可被液化成液态氮。
2. 氮元素的发现氮元素最早是由苏格兰化学家丹尼尔·隆德斯特德在1772年通过将氧气和一些物质反应而得到的。
他将一只蜡烛放在一个密封的容器中燃烧,然后收集生成的气体。
他发现这种气体不能支持燃烧,也不能使动物在其中生存,因此将其称为“无味燃素”。
3. 氮元素在生物体系中的作用氮元素是生命体系中的重要元素之一,是蛋白质、核酸、氨基酸等生物分子的主要组成成分。
生物体内的氮元素主要来源于土壤中的无机氮化合物,如亚硝酸盐、硝酸盐、氨等,这些无机氮化合物通过植物的吸收和利用进入生物体系中,并随着食物链的传递而进入更高级生物体内。
氮元素的循环在生态系统中起着至关重要的作用。
4. 氮元素的工业应用氮元素在工业中有广泛的应用,主要包括合成氨、合成硝酸、合成氮化合物等。
合成氨可以用于生产化肥,合成硝酸可以用于制备硝化甘油等爆炸物,合成氮化合物可以用于合成化工产品和材料。
5. 氮元素的环境问题氮元素在环境中的循环和利用受到了人类活动的干扰,大量化肥的施用、工业污染等导致了土壤和水体中氮元素的过量积累,引发了一系列的环境问题,如土壤酸化、水体富营养化等。
因此,有效管理和利用氮元素资源,减少人为的氮元素排放成为了当前环境保护和可持续发展的重要课题之一。
总的来说,氮元素是地球上广泛存在的一种元素,它在生命体系中发挥着重要的作用,也在工业生产中有着广泛的应用。
然而,氮元素的循环和利用受到了人类活动的干扰,导致了一系列的环境问题。


氮元素的形态-概述说明以及解释1.引言1.1 概述氮是自然界中常见的元素之一,作为生命体和生态系统中不可缺少的组成部分,氮元素的存在形态和循环方式对地球生态系统的平衡具有重要影响。
本文将对氮元素的形态、在自然界中的循环以及对环境的影响进行深入探讨,旨在揭示氮元素在生态环境中扮演的重要角色。
通过对氮元素的研究,可以更好地认识和利用自然界中的资源,同时也有助于保护生态环境的可持续发展。
1.2 文章结构文章结构:本文将首先介绍氮元素的存在形态,包括氮气、氨、硝酸盐等形式,然后探讨氮元素在自然界中的循环过程,包括氮的固氮、腐解、硝化、还原等过程,最后分析氮元素对环境的影响,包括对水体、土壤和大气的影响。
通过对氮元素形态和循环过程的全面了解,可以更好地认识氮元素在自然界中的作用和对环境的影响,为环境保护和可持续发展提供科学依据。
1.3 目的目的部分的内容应该明确阐述本文的写作目的,即对氮元素的形态进行深入的探讨和分析,包括氮元素存在的不同形态、在自然界中的循环过程以及其对环境的影响。
通过本文的阐述,读者可以更全面地了解氮元素在自然界中的存在形态和重要性,促进人们对氮元素的认识和理解,以便更好地保护环境和促进可持续发展。
2.正文2.1 氮元素的存在形态氮元素在自然界中存在着多种形态,主要包括氮气(N2)、氨(NH3)、硝酸盐(NO3-)、亚硝酸盐(NO2-)、氮化合物和有机氮。
其中,氮气是大气中最主要的氮形态,占据了大气中78的成分,是地球上最丰富的元素之一。
氮元素的有机形态主要存在于植物和动物的生物体内,以及土壤中的有机物中。
此外,氮元素还以无机形式存在于土壤中的氨、硝酸盐和亚硝酸盐等形式。
这些形态的存在对于生物体和生态系统的生长和营养具有重要意义。
2.2 氮元素在自然界中的循环氮元素在自然界中的循环是一个复杂而重要的过程。
氮元素主要以气体氮的形式存在于大气中,占据了大气中78的成分。
在自然界中,氮元素通过氮固定、氮硝化、氮化还原等过程不断循环。

氮元素化学式-概述说明以及解释1.引言1.1 概述概述是文章引言的第一个部分,用于引入主题并介绍文章内容。
在本文中,我们将探讨氮元素的化学式及其相关性质、反应和应用领域。
氮元素是一种非金属元素,化学符号为N,原子序数为7。
它在自然界中广泛存在于空气、土壤和有机物中,是地球上最丰富的元素之一。
氮元素具有丰富的化学性质,包括高电负性、不活泼、无色无味以及低溶解度等特点。
它可以与许多元素发生反应,如氢、氧、卤素等。
氮元素最著名的特点是其稳定的三键共价键结构,使其形成氮气(N2),这是大气中最主要的气体之一。
在化学反应中,氮元素可以与其他元素形成多种化合物,例如氨(NH3)、硝酸盐(NO3-)和亚硝酸盐(NO2-)等。
这些化合物在生物、工业和农业等领域有着广泛的应用。
氨是制造肥料和化肥的关键原料,可以提供植物所需的氮源。
硝酸盐则用于制造炸药和农药,具有重要的工业用途。
亚硝酸盐则用于食品加工过程中的保鲜和着色。
正是由于氮元素在生命、环境和工业中的广泛应用,对其性质和反应的深入研究具有重要意义。
通过深入了解氮元素的化学式及其特性,我们可以更好地利用和控制它的应用。
本文将重点介绍氮元素的基本性质、化学反应和应用领域,为读者提供对氮元素的全面了解和认识。
接下来,我们将在正文部分详细介绍氮元素的基本性质、化学反应和应用领域,以及对其未来的展望。
通过对氮元素的深入研究,我们可以更好地利用和开发其潜在的应用价值,为人类的生活和发展做出更大的贡献。
1.2 文章结构文章结构部分的内容应该包括对整篇文章的组织和概述,以及各个章节的主题和内容安排。
下面是文章结构部分的内容:文章结构本文将全面介绍氮元素的化学式、基本性质、化学反应以及应用领域。
文章共分为三个主要部分:引言、正文和结论。
引言部分将对氮元素进行概述,介绍其重要性和普遍存在的地方。
随后,会对文章的结构进行说明,并阐明本文的目的。
正文部分将详细探讨氮元素的基本性质、化学反应以及应用领域。
氮元素相对分子质量氮元素的相对分子质量是14.0067。
哎呀,这氮元素啊,可真是化学世界里的一个小明星呢。
咱就说啊,在好多化学反应里,氮元素那可是相当活跃的角色。
你看啊,氮气在空气中占了那么大的比例,差不多有78%呢。
氮元素组成的氮气,就像一个低调的守护者一样,虽然平时不怎么显山露水,但在很多时候可起着至关重要的作用。
比如说,在一些食品包装里,会充入氮气来防止食品被氧化,这样就能让食品保存得更久啦。
就像薯片,要是没有氮气的保护,可能很快就变得不酥脆了呢。
再说说含氮的化合物吧,氨啊,硝酸啊,这些都是氮元素的重要化身。
氨的气味那叫一个特别,刺鼻得很,但是在工业上可有用处了。
它可以用来制造化肥,这化肥一撒到地里,农作物就像得到了神奇的魔法一样,蹭蹭地长。
还有硝酸呢,这可是一种很厉害的强酸,在化工生产里也是个重要角色。
在制造炸药的时候,硝酸可是不可或缺的原料。
你想啊,要是没有硝酸,那些炸药可就制造不出来啦,当然啦,炸药是用在正当的地方,像开山修路之类的工程。
氮元素在生物体内也有着不可替代的地位。
蛋白质里面就有氮元素,而蛋白质可是生命活动的主要承担者啊。
要是没有氮元素参与构建蛋白质,我们的身体可就没法正常运转啦。
从小小的细胞,到整个生物体,氮元素就像一个隐藏在幕后的导演,指挥着各种生命活动的进行。
像我们每天吃的食物里,肉啊,蛋啊,奶啊,这些富含蛋白质的食物,都是氮元素进入我们身体的重要途径。
所以啊,氮元素虽然看起来就是一个小小的元素,但它的影响可真是无处不在,从我们呼吸的空气,到吃的食物,再到身边的很多化工产品,都有它的身影。
氮元素就像化学世界里的一个小精灵,以各种不同的形态穿梭在不同的物质之间,默默地发挥着自己的力量。
无论是在自然环境中,还是在人类的生产生活里,它都有着不可忽视的重要性。
元素化学知识总结(6)—氮族元素1.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第V A族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;③在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.性质的比较](1)电闪雷鸣时:N2+O22NO(2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾]NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里(2)单质磷的化学性质:①与O2反应:4P+5O22P2O5②磷在C12中燃烧:2P+3C12(不足量) 2PCl32P+5Cl2(足量) 2PCl5明它们都是由磷元素形成的单质白磷红磷证——[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P 2O 5是酸性氧化物,与水反应:P 2O 5+3H 2O 2H 3PO 4(2)磷酸的性质、用途:磷酸(H 3PO 4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.游离态和化合态 只有化合态N 2+O 22NO(易)4P+5O 22P 2O 5(难)N 2 +3H 22NH 3 2P(蒸汽) + 3H 22PH 32.铵盐 [氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH 3的电子式为,结构式为,氨分子的结构为三角锥形,N 原子位于锥顶,三个H 原子位于锥底,键角107°18′,是极性分子. (3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH 3分子与H 2O 分子结合成NH 3·H 2O(叫一水合氨).NH 3·H 2O 4+和OH -: NH 3 + H 23·H 2NH 4++ OH -a .氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH 3·H 2O 不稳定,故加热氨水时有氨气逸出:NH 4++ OH -NH 3↑+ H 2Ob .氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH 3、NH 3·H 2O 、H 2O)和3种离子(NH 4+和OH -、极少量的H +).c .氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d .有关氨水浓度的计算:氨水虽然大部分以NH 3·H 2O 形式存在,但计算时仍以NH 3作溶质. ②跟氯化氢气体的反应:NH 3 + HCl = NH 4C1说明 a .当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH 3与盐酸挥发出来的HCl 化合生成的NH 4C1晶体小颗粒.b .氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c .氨气与不挥发性酸(如H 2SO 4、H 3PO 4等)反应时,无白烟生成. ③跟氧气反应: 4NH 3 + 5O 24NO + 6H 2O说明 这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一. (4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂. [铵盐]铵盐是由铵离子(NH 4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水. (1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。
氮元素对植物的作用原理
氮元素是植物生长所必需的重要元素之一,它的作用原理主要体现在以下几个方面:
1. 氮元素是植物合成蛋白质的重要元素之一。
植物体内的蛋白质是由氨基酸组成的,而氨基酸中含有大量的氮元素。
因此,缺少氮元素会导致植物体内蛋白质合成受阻,从而影响植物的生长发育。
2. 氮元素是植物体内各种酶的组成成分之一。
植物体内的各种代谢过程都需要有酶的参与,而酶的合成也需要氮元素的参与。
因此,缺少氮元素会导致植物体内酶合成不足,从而影响植物体内各种代谢过程的进行。
3. 氮元素还能影响植物体内的叶绿素合成。
叶绿素是植物体内进行光合作用所必需的色素,而叶绿素的合成也需要氮元素的参与。
因此,缺少氮元素会导致植物体内叶绿素合成不足,从而影响植物的光合作用和光合产物的积累。
综上所述,氮元素对植物的作用原理主要体现在促进植物合成蛋白质、酶和叶绿素等物质的合成,从而促进植物的生长发育和光合作用的进行。
- 1 -。
氮的循环生态系统中的氮元素氮是地球上最常见的元素之一,它在生态系统中扮演着重要的角色。
氮的循环是一种复杂的过程,涉及到氮的转化和利用。
了解氮的循环对于我们理解生态系统的健康和平衡具有重要意义。
氮元素的不同形式氮在自然界中存在着不同的形式,包括氮气(N2)、氨(NH3)、亚硝酸盐(NO2-)和硝酸盐(NO3-)等。
氮气是大气中最主要的形式,占据了大气氮的绝大部分,但它对大多数生物来说是不可利用的。
氨是一种在土壤和水中广泛存在的形式,它可以被植物和微生物利用。
亚硝酸盐和硝酸盐是土壤中的重要形式,它们是植物的主要氮源。
氮的转化过程氮的转化过程涉及到氮的不同形式之间的相互转化。
这些转化包括氮的固氮、氨化、硝化、反硝化和氮化等过程。
固氮是指将大气中的氮气转化为氨或亚硝酸盐的过程,这个过程主要由一些细菌和蓝藻完成。
氨化是将氮气或亚硝酸盐转化为氨的过程,这个过程由一些细菌和真菌负责。
硝化是将氨或亚硝酸盐转化为硝酸盐的过程,这个过程由一些细菌完成。
反硝化是将硝酸盐还原为氮气的过程,这个过程由一些细菌完成。
氮化是指将氮气转化为氮化合物的过程,这个过程主要发生在工业生产中。
氮的利用过程氮的利用是指氮被生物体吸收和利用的过程。
植物通过根系吸收土壤中的氮元素,然后利用它们合成蛋白质和其他有机物。
动物通过摄食植物或其他动物来获取氮元素,并将其合成为自己的蛋白质和DNA 等。
微生物在土壤和水中利用氮元素进行生物合成和能量产生。
氮的利用过程是氮循环中至关重要的一部分,它可以维持生态系统的稳定和平衡。
氮的流失和污染氮的循环过程中,可能会发生氮的流失和污染。
流失是指氮元素从一个环境转移到另一个环境的过程,这可能会导致氮在某些环境中过量积累或在其他环境中不足。
氮的流失通常发生在土壤和水体中,可以通过冲刷和渗漏等途径发生。
氮的污染是指环境中氮浓度过高,超出了生态系统的承受能力。
氮污染常常来自农业排放和工业废水等,会对水体和土壤造成污染,并对附近的生物体产生负面影响。
氮的化学结构氮是一种常见的元素,其化学结构对于我们理解氮的化学行为至关重要。
本文将探讨氮的化学结构及其在不同化合物中的存在形式和性质。
1. 基本信息氮的原子序数为7,元素符号为N。
它是周期表中主族元素的一员,位于氧和碳之间。
氮原子的电子配置为1s² 2s² 2p³,其中2p轨道上有三个未配对电子。
这使氮具有较高的反应活性和较强的亲电性。
2. 氮气(N₂)氮气是地球大气中最主要的气体组成之一,占据大约78%的体积比例。
在氮气分子中,两个氮原子通过三重键连接在一起,形成了一个非常稳定的分子。
由于三重键的强度和能量较高,氮气具有较高的解离能和熔点,使其在常温常压下形成稳定的气体状态。
3. 氨(NH₃)氨是氮的一种普遍存在的化合物,具有强烈的刺激性气味。
氨分子由一个中心的氮原子和三个氢原子组成,形成一个三角锥形结构。
氮和氢之间通过共价键连接,氮原子上的孤对电子增加了氨分子的亲核性。
氨是一种碱性物质,能够与酸反应形成盐。
4. 氮的氧化物氮存在多种氧化态,形成了多种氮的氧化物。
其中最常见的是一氧化氮(NO)和二氧化氮(NO₂)。
一氧化氮是无色气体,具有特殊的化学活性。
它可与氧气反应生成二氧化氮,后者是一种红棕色的有毒气体,具有强烈的刺激性气味。
氮的氧化物在大气中和其他化合物相互作用,参与了氮循环和大气污染的过程。
5. 氮的有机化合物氮在有机化学中也扮演着重要角色,形成了许多重要的有机化合物。
例如,氨基酸、蛋白质、核苷酸和维生素中都含有氮原子。
此外,许多药物和化学品也包含氮元素,其化学结构决定了它们的性质和用途。
在总结中,氮的化学结构具有多样性和重要性。
从氮气到氮的氧化物,再到有机化合物,氮的化学结构对于我们理解氮的性质和应用具有重要意义。
只有深入理解氮的化学结构,我们才能更好地探索其在大自然和实验室中的各种化学反应和应用。