2012版分子原子离子
- 格式:doc
- 大小:283.50 KB
- 文档页数:4

分子原子离子讲评课(教案)第一章:分子的概念与特性1.1 分子定义:物质的最小粒子,保持物质化学性质的实体1.2 分子特性:1.2.1 分子质量小,体积小1.2.2 分子不断运动1.2.3 分子之间有间隔1.2.4 分子在化学变化中可以再分第二章:原子的概念与结构2.1 原子定义:物质的基本粒子,构成分子的实体2.2 原子结构:2.2.1 原子核:由质子和中子组成,质子带正电,中子不带电2.2.2 电子:绕原子核运动的负电荷粒子2.2.3 原子序数:质子数,决定元素种类第三章:离子的形成与性质3.1 离子定义:带电的原子或原子团3.2 离子形成:3.2.1 原子失去电子成为阳离子3.2.2 原子获得电子成为阴离子3.3 离子性质:3.3.1 离子具有电荷,可吸引相反电荷3.3.2 离子在溶液中可自由移动3.3.3 离子化合物在固态时有较高的熔点和沸点第四章:化学键的类型4.1 离子键:阴阳离子之间的电荷吸引力4.2 共价键:非金属原子间共享电子对4.3 金属键:金属原子间电子云的共享4.4 氢键:氢原子与电负性较大的原子间的相互作用第五章:分子间作用力5.1 范德华力:分子间的瞬时偶极相互作用5.2 氢键:氢原子与电负性较大的原子间的较强作用力5.3 离子键:阴阳离子之间的电荷吸引力5.4 疏水作用:非极性分子间的相互吸引力第六章:分子的极性与分子的溶解性6.1 分子极性的判断:根据分子的电子云分布不对称性6.2 极性分子的性质:6.2.1 极性分子通常具有较高的沸点和熔点6.2.2 极性分子在极性溶剂中溶解性较好6.3 非极性分子的性质:6.3.1 非极性分子通常具有较低的沸点和熔点6.3.2 非极性分子在非极性溶剂中溶解性较好第七章:原子的电子排布与元素周期表7.1 电子排布:原子核外电子的分布7.2 元素周期表:根据原子序数和电子排布排列的表格7.3 周期表的规律:7.3.1 周期:电子层数相同的元素排列成一行7.3.2 族:具有相同外层电子数的元素排列成同一列7.4 元素周期律:元素性质随原子序数的周期性变化第八章:化学反应中的电子转移8.1 氧化还原反应:涉及电子转移的化学反应8.2 氧化剂:接受电子的物质8.3 还原剂:提供电子的物质8.4 电子转移的方向:从还原剂到氧化剂第九章:离子化合物与分子的化学性质9.1 离子化合物的性质:9.1.1 通常具有较高的熔点和沸点9.1.2 易溶于水,形成离子溶液9.1.3 具有明显的电解性质9.2 分子化合物的化学性质:9.2.1 分子间作用力的变化影响物质的物理性质9.2.2 分子内部的化学键性质决定分子的化学反应性第十章:分子间作用力与物质的物理性质10.1 分子间作用力对物质状态的影响:10.1.1 增强分子间作用力,物质熔点、沸点升高10.1.2 减弱分子间作用力,物质熔点、沸点降低10.2 分子间作用力对物质溶解性的影响:10.2.1 相似相溶:极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂10.2.2 溶剂极性影响溶解性:极性溶剂可溶解极性分子,非极性溶剂可溶解非极性分子第十一章:分子间作用力与物质的相态11.1 物质的相态:固态、液态和气态11.2 分子间作用力与相态的关系:11.2.1 固态:分子间作用力强,排列有序11.2.2 液态:分子间作用力较弱,流动性好11.2.3 气态:分子间作用力非常弱,自由运动第十二章:分子间作用力与物质的溶解性12.1 溶解性:物质在溶剂中均匀分散的能力12.2 分子间作用力与溶解性的关系:12.2.1 相似相溶:极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂12.2.2 溶剂极性影响溶解性:极性溶剂可溶解极性分子,非极性溶剂可溶解非极性分子第十三章:分子间作用力与物质的吸附性13.1 吸附性:物质在固体表面或界面上的附着能力13.2 分子间作用力与吸附性的关系:13.2.1 物理吸附:分子间作用力较弱,吸附力可逆13.2.2 化学吸附:分子间作用力较强,吸附力不可逆第十四章:分子间作用力与物质的催化性14.1 催化性:物质改变化学反应速率的能力14.2 分子间作用力与催化性的关系:14.2.1 催化剂的活性:与分子间作用力密切相关14.2.2 催化剂的稳定性:与分子间作用力稳定性有关第十五章:分子间作用力在实际应用中的实例15.1 分子间作用力在材料科学中的应用:15.1.1 高分子材料:分子间作用力影响材料性质15.1.2 纳米材料:分子间作用力决定材料结构15.2 分子间作用力在药物化学中的应用:15.2.1 药物与靶标之间的相互作用:分子间作用力影响药物效果15.2.2 药物溶解性与生物利用度:分子间作用力影响药物溶解性和生物利用度重点和难点解析本教案主要围绕分子、原子、离子的概念、性质和化学反应进行讲解,重点内容包括:1. 分子、原子、离子的定义和基本性质。
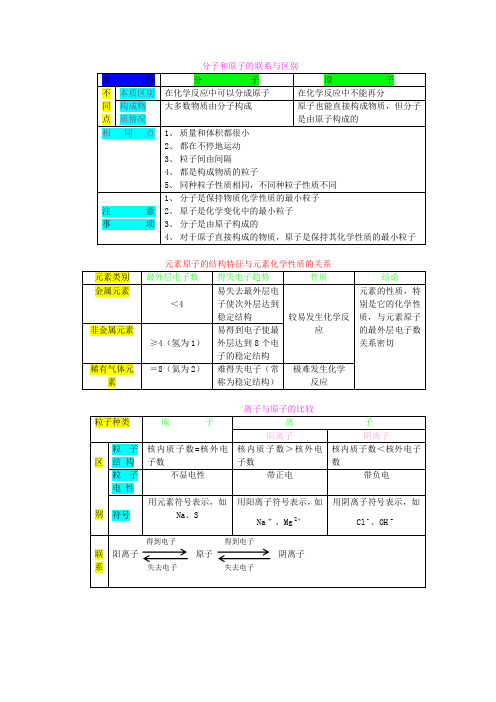


化学专题复习—分子原子离子(讲评课)姓名:李英单位:大口屯中学分子原子离子讲评课教案一、教学目标1、知识与技能(1)巩固分子、原子、离子相关知识。
(2)建立微观粒子之间的联系。
(3)练习中考题型,加深学生对知识的理解。
2、过程与方法(1)通过习题,巩固学生原有知识。
(2)通过对习题的剖析,引导学生对知识进行归纳总结,逐步提高学生解题能力、语言组织能力和表达能力。
3、情感、态度与价值观培养学生之间的合作意识,小组之间的竞争意识,形成和谐的学习氛围。
二、教学过程(一)课题导入【教师】“我们生活的物质世界存在着3000多万种物质,这3000多万种物质是由100多种元素组成的,那么从微观角度分析,构成这些物质的粒子又有哪些呢?”【学生】“分子、原子、离子”【教师】“老师这里有几种常见物质,看看哪位同学能更快更准的找出构成这些物质的粒子。
”【教师】展示幻灯片(1)【学生】抢答构成铁、石墨、水、氧气、氯化钠等物质的粒子是什么。
【教师】大千世界形形色色,但从微观的角度来看,构成这些物质的粒子却只有三种即:分子、原子和离子,今天我们来系统的复习一下分子、原子、离子的相关知识。
【教师】展示幻灯(2),并板书课题分子原子离子(二)内容展开【教师】我们知道碳有两种氧化物,一氧化碳和二氧化碳,两者在化学性质上存在着较大的差异,如一氧化碳具有可燃性而二氧化碳却不能燃烧,这是什么原因造成的呢?【教师】给学生时间思考【学生】思考问题【教师】解答:“这是由于构成两种物质的分子不同,分子的化学性质不同,一氧化碳分子具有可燃性,所以一氧化碳物质具有可燃性,而二氧化碳分子不具有可燃性,所以二氧化碳不具有可燃性。
由此我们可知什么是分子呢?”【学生】回答分子定义。
【教师】提问:“为什么不说是保持物质性质的最小粒子呢?那么分子能不能保持物质的物理性质?”【学生】举例说明。
【教师】“同学们,我给大家做个魔术,请大家仔细观察。
”【教师实验】蘸取酚酞溶液在滤纸上画一个笑脸,然后再将此滤纸放在盛有浓氨水的烧杯上方,让学生观察实验现象,再在空气中放置一会儿,再观察现象,让学生解释原因。

2024年初中化学分子、原子和离子必考知识点总结____年初中化学考试中关于分子、原子和离子的必考知识点总结如下:一、分子和原子1. 原子概念- 原子是物质的基本单位,由质子、中子和电子组成。
- 质子带正电荷,位于原子核内;电子带负电荷,绕原子核运动;中子是电中性的,位于原子核内。
2. 分子概念- 分子是由两个或更多原子通过化学键结合而成的粒子。
- 分子的结构决定了物质的性质。
3. 原子间力和分子间力- 原子或分子之间相互作用的力被称为原子间力或分子间力。
- 原子间力包括电子云间的斥力和吸引力,分子间力包括范德华力、氢键等。
4. 原子的排列方式- 原子可以排列成链状、环状、网状等不同的结构,影响物质的性质。
5. 元素和化合物- 由同种原子组成的物质称为元素,如金属铁、非金属氧等。
- 由两种或多种不同元素组成的物质称为化合物,如水(H2O)。
6. 化学键- 化学键是原子之间的吸引力,使原子组合成分子或离子。
- 化学键包括共价键、离子键和金属键等。
二、离子1. 离子概念- 离子是带电荷的原子或原子团。
- 正离子带正电荷,由失去一个或多个电子而形成;负离子带负电荷,由得到一个或多个电子而形成。
2. 金属离子和非金属离子- 金属离子是由金属原子失去一个或多个电子而形成的离子。
- 非金属离子是由非金属原子得到一个或多个电子而形成的离子。
3. 离子键和离子晶体- 离子键是金属离子和非金属离子之间的强电子吸引力。
- 离子晶体是由大量离子通过离子键结合而成的稳定结构。
4. 电负性和共价键- 电负性是原子吸引和结合电子的能力。
- 共价键是由共享电子对形成的。
5. 极性分子和非极性分子- 极性分子中,正负电荷分布不均匀,有正负电极。
- 非极性分子中,正负电荷分布均匀。
三、化学式和化学方程式1. 化学式- 化学式是用符号和数字表示化合物中元素的种类和比例关系。
- 分子式表示分子中各元素的个数,离子式表示离子中各离子的个数。

原子分子离子质子电子的区别原子由原子核和在原子核和带负电的电子组成。
(原子核一般由带正电荷的质子和不带电的中子构成。
)量子是一个比拟广泛的概念~应该是指量子力学中研究的各种粒子 ,包括质子 ,中子 ,电子⋯⋯粒子也是比拟广泛的概~泛指各种微粒。
离子是带电微粒~因为量子,粒子X围太大,没法比拟。
能确定大小的最小的是电子吧~1、分子是保持物质化学性质的最小粒子〔原子、离子也能保持物质的化学性质〕。
原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D〔氯分子〕〔 A 、Cl B 、Cl- C 、2Cl D 、 Cl2 〕。
保持CO2 化学性质的最小粒子是 CO2 分子;保持水银的化学性质的最小粒子是汞原子。
在电解水这一变化中的最小粒子是氢原子和氧原子。
原子中:核电荷数〔带正电〕=质子数 =核外电子数相对原子质量 =质子数 +中子数原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子〔正电〕、中子〔不带电〕、电子〔带负电〕。
一切原子都有质子、中子和电子吗?〔错!一般的氢原子无中子〕。
某原子的相对原子质量=某原子的质量 /C 原子质量的1/12 。
相对原子质量的单位是“1,〞它是一个比值。
相对分子质量的单位是“1。
〞由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性〔即电中性〕。
2、①由同种元素组成的纯洁物叫单质〔由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。
〕②由一种分子构成的物质一定是纯洁物,纯洁物不一定是由一种分子构成的。
③由不同种元素组成的纯洁物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。
纯洁物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。
氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
初中化学必考知识点归纳:分子、原子、离子1、学生会成立以来,学生会搞了一系列的活动,而且都取得了较好的成果。
通过各部的互相努力,我们获得了不少阅历。
初中化学必考学问点归纳:分子、原子、离子1、必考学问点一原子:化学改变中的最小微粒。
〔1〕原子也是构成物质的一种微粒。
例如少数非金属单质;金属单质;稀有气体等。
〔2〕原子也不断地运动着;原子虽很小但也有肯定质量。
对于原子的认识远在公元前5世纪提出了有关“原子”的观念。
但没有科学试验作根据,直到19世纪初,化学家道尔顿依据试验事实和严格的规律推导,在1803年提出了科学的原子论。
〔马上点标题下蓝字初中化学关注可获取更多学习方法、干货!〕分子:保持物质化学性质的最小粒子。
〔1〕构成物质的每2、一个分子与该物质的化学性质是一致的,分子只能保持物质的化学性质,不保持物质的物理性质。
因物质的物理性质,如颜色、状态等,都是宏观现象,是该物质的大量分子聚集后所表现的属性,并不是单个分子所能保持的。
〔2〕“最小”不是肯定意义上的最小,而是保持物质化学性质的最小。
分子的性质〔1〕分子质量和体积都很小。
〔2〕分子总是在不断运动着的。
温度升高,分子运动速度加快,如阳光下湿衣物干得快。
〔3〕分子之间有间隔。
一般说来,气体的分子之间间隔距离较大,液体和固体的分子之间的距离较小。
气体比液体和固体简单压缩,不同液体混合后的总体积小于二者的原体积之和,都说明分子之间有间隔。
〔4〕同种物质的分子性质相同,3、不同种物质的分子性质不同。
我们都有这样的生活体验:若口渴了,可以喝水解渴,同时吃几块冰块也可以解渴,这就说明:水和冰都具有相同的性质,因为水和冰都是由水分子构成的,同种物质的分子,性质是相同的。
2、必考学问点二质子:1个质子带1个单位正电荷原子核。
中子:不带电原子不带电。
电子:1个电子带1个单位负电荷。
〔1〕构成原子的粒子有三种:质子、中子、电子。
但并不是全部的原子都是由这三种粒子构成的。
分子原子离子的区别
分子、原子、离子是物理化学中三个重要的概念,它们之间存在着重要的区别。
首先,让我们来谈谈分子和原子。
分子是一种物质的最小组成单位,它由至少两个原子组成,它们之间的原子通过化学键连接在一起。
分子是一种能够被观察到的有形物质,它们可以被用来研究物质的性质和特性,例如它们的结构、形状、熔点、沸点等。
原子是物质最小的组成单位,它没有可被看到的形状,但它具有一定的量和质量,就像一颗微小的“弹子”,它由核、中子和电子组成,每一种原子都有其独特的特性,它们能够通过化学反应进行结合形成分子,从而形成不同的物质。
其次,让我们谈一下离子和原子的区别。
离子其实就是原子的一种特殊形式,和原子不同的是,离子已经失去了电子,因此它比原子要小。
离子具有一种充满活力的特性,它们可以通过游离的形式参与化学反应,从而形成不同的化合物。
另外,离子也可以通过介电性现象、营养运输和体外代谢发挥其作用,以及某些细胞电位的调节等。
最后,本文讨论了分子、原子和离子之间的区别。
分子是一种物质的最小组成单位,它们结合在一起形成物质,而原子则是物质中最小的组成单位,而离子则是原子的一种特殊形式,它们可以与其他元素形成化合物,发挥其作用。
总之,分子、原子和离子是物理化学中的三个重要概念,它们的区别对于我们的理解物质有着重要的意义。
- 1 -。
分子原子离子讲评课(教案)第一章:分子概念的引入1.1 教学目标让学生了解分子的定义和特点使学生掌握分子在物质中的作用1.2 教学内容分子定义:介绍分子的概念,分子是由两个或多个原子通过共价键连接而成的粒子。
分子特点:解释分子的稳定性、运动性和相互作用。
分子在物质中的作用:探讨分子在物质组成和性质中的重要性。
1.3 教学方法采用讲解和实例相结合的方法,让学生理解分子的概念和特点。
通过实验或图片展示,使学生观察分子在物质中的作用。
1.4 教学评估提问学生关于分子的定义和特点,检查他们对分子的理解程度。
让学生进行小组讨论,探讨分子在物质中的作用,并展示他们的结论。
第二章:原子的结构2.1 教学目标让学生了解原子的结构使学生掌握原子的基本组成和电子排布2.2 教学内容原子结构:介绍原子的核和电子云结构,解释原子核由质子和中子组成,电子在不同的能级上排布。
基本组成:介绍原子的质量数、原子序数和电子数等基本参数。
电子排布:解释电子在原子轨道上的排布规律和能量级。
2.3 教学方法采用讲解和图示相结合的方法,让学生了解原子的结构。
通过实验或模拟演示,使学生观察原子的基本组成和电子排布。
2.4 教学评估提问学生关于原子的结构和基本组成,检查他们对原子的理解程度。
让学生进行小组讨论,探讨电子排布的规律,并展示他们的结论。
第三章:离子的形成3.1 教学目标让学生了解离子形成的原理和过程使学生掌握离子的特点和命名规则3.2 教学内容离子形成原理:介绍离子是通过原子或分子失去或获得电子而形成的。
离子形成过程:解释正负离子形成的条件和机制。
离子特点:介绍离子的电荷、稳定性和溶解性等特性。
命名规则:讲解离子的命名规则和常用符号。
3.3 教学方法采用讲解和实例相结合的方法,让学生了解离子形成的原理和过程。
通过实验或图片展示,使学生观察离子的特点和命名规则。
3.4 教学评估提问学生关于离子形成的原理和过程,检查他们对离子的理解程度。
分子原子离子讲评课(教案)第一章:分子概念及其特性1.1 分子定义:物质的最小粒子,保持物质化学性质不变。
1.2 分子特性:分子具有质量、体积很小,不断运动,分子之间有间隔等特点。
1.3 分子与物质的宏观性质:分子的性质决定了物质的宏观性质,如颜色、气味、溶解性等。
1.4 分子模型:通过模型展示分子的结构,帮助学生理解分子概念。
第二章:原子概念及其结构2.1 原子定义:物质的基本组成单位,由原子核和核外电子组成。
2.2 原子结构:原子核由质子和中子组成,核外电子分层排布。
2.3 原子性质:原子具有质量、电荷、半径等特性,原子之间通过电磁力相互作用。
2.4 原子模型:通过模型展示原子的结构,帮助学生理解原子概念。
第三章:离子概念及其形成3.1 离子定义:带电的原子或原子团。
3.2 离子形成:离子通过原子或分子失去或获得电子而形成,分为阳离子和阴离子。
3.3 离子性质:离子具有电荷、质量、半径等特性,离子之间通过电磁力相互作用。
3.4 离子化合物:离子通过静电作用形成的化合物,如氯化钠(NaCl)。
第四章:分子、原子、离子的关系4.1 分子、原子、离子的联系:原子通过得失电子形成离子,离子通过得失电子形成分子。
4.2 分子、原子、离子的区别:分子是由两个或多个原子组成的,原子是分子的基本组成单位,离子是带电的原子或原子团。
4.3 分子、原子、离子在化学反应中的作用:化学反应实质是分子破裂成原子,原子重新组合成新分子的过程。
第五章:分子、原子、离子在生活中的应用5.1 生活中的分子:水、空气、食物等都是由分子组成的。
5.2 生活中的原子:金属、矿物质等都是由原子组成的。
5.3 生活中的离子:食盐、酸碱盐等都是由离子组成的。
5.4 分子、原子、离子在科技发展中的应用:如纳米技术、材料科学等。
第六章:化学键与分子间作用力6.1 化学键概念:原子之间通过电子的共享或转移形成的强相互作用。
6.2 化学键类型:离子键、共价键、金属键等。
夯实基础强化训练初三化学精选(三)
一、选择题
1、下列物质中,前者为纯净物,后者为混合物的是( )
A.海水、雨水
B.新鲜空气、硫粉
C.氧气、优质矿泉水D.四氧化三铁、氧气
2、下列物质中存在氧分子的是( )
A .高锰酸钾B二氧化碳 C.空气 D.双氧水
3、每个人都有独特的气味。
训练有素的警犬可以根据人体气味识别犯罪嫌疑人。
从微观角度分析,警犬能闻到犯罪嫌疑人气味的原因是()
A.分子质量小
B.分子不断运动
C.分子间隔小
D.分子体积小
4、下列变化中分子本身发生变化的是()
A.乙醇挥发
B.空气液化
C.硫在氧气中燃烧
D.石蜡融化
5、氧化汞受热时的变化可用下图表示(图中大圆圈表示汞原子,小圆圈表示氧原子,据图得出的下列结论错误的是( )
A.氧化汞受热能分解成汞和氧气B.原子是化学变化中的最小粒子
C.分子在化学变化中可以再分D.所有物质都是由分子构成的
6、下列叙述中错误的是()。
①原子是化学变化中的最小粒子②原子是不能再分的粒子③一切物质都是由原子直接构成的④一切原子核都是由质子和中子构成的⑤原子不显电性⑥原子之间有间隔
A.①和②B.②③和④C.③和⑤D.③和⑥
7、下列粒子在化学反应中容易得到电子的是( )
A.B.C.D.
8、决定元素分类以及化学性质的是()
A.质子数
B.核外电子数
C.最外层电子数
D.核电荷数
9、关于钠原子和钠离子的认识不正确的是()
A、它们的质子数相同;
B、它们的电性不同
C、Na比Na+少1个电子;
D、钠原子变为钠离子后质量几乎不变。
10、原子失去最外层电子或在最外层得到电子后,不发生变化的是( )
①元素种类②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数⑧核外电子数
A.①③⑤B.②④⑥⑧C.②⑤D.①④⑤
11、下列各种粒子中,核外电子数相等的是( )
A.Na+与Cl-B.Cl-与Ar C.Mg与Mg2+ D.S与S2-
12、某元素原子的最外层电子数为2,则该元素( )
A.肯定是金属元素B.肯定是非金属元素
C.肯定是稀有气体元素D.可能是金属元素或稀有气体元素
13、下图是钠与氯气(Cl2)反应生成氯化钠的模拟图,从图示可知下列说法不正确的是( )
A.反应中钠原子转移一个电子给氯原子
B. 反应中氯气分子分成氯原子
C.核外电子在化学反应中起着重要作用
D.氯化钠由氯化钠分子构成
14、已知核内有6个质子和6个中子的碳原子的质量为m kg,一个钼原子的质量为8mkg,则钼的相对原子质量为()。
A.96 B.72 C.48 D.36
15、(不定项)在下列示意图表示的粒子中,属于原子的有(用序号填空,下同)________,属于阴离子的有________,属于阳离子的有________,属于同种元素的有________,达到稳定结构的有________,具有相同的电子层结构的是________。
二、填空题
1、从分子观点看,由分子构成的物质,纯净物由__ __构成,混合物由__ __构成。
2、下列物质属于纯净物的是__ __ _,属于混合物的是__ ____。
①液态氧②水银③洁净的空气④海水⑤冰水混合物⑥牛奶
3、分子是保持____ _____的一种微粒。
分子之间有一定的_________。
物质的三态,主要是由于___________发生变化的缘故。
分子是在不断地___________。
同种物质的分子性质______ ____,不同物质分子性质___________。
4、下列粒子中带正电荷的是。
(填序号)
①电子②质子③中子④原子核⑤原子⑥分子
5、金属原子的最外层电子数4,易电子,变成离子,带电;非金属原子的最外层电子数4,易电子,变成离子,带电。
6、1996年科学家在宇宙深处发现了H3+离子和H3分子。
请回答:
(1)1个H3+离子含有个质子,个电子;
(2)构成了H3分子的原子的结构示意图是;
7、一个碳原子(原子核内有6个质子和6个中子)的质量是mkg,R原子的相对原子质量是n/3,则一个R原子的质量应是。
8、二氧化氮是大气污染物,是红棕色的、有毒的、密度比空气大的气体
如图3-2抽去中间的玻璃片,上下瓶口对准,过一会儿,
可以看到什么现象?
用分子观点解释这一现象。
9、元素周期表是学习化学的重要工具。
下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
⑴第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易______ (填“得”或“失”)电子;
⑵元素的化学性质与原子结构中的_____ _ ________数关系密切;
⑶在同一族中,各元素的原子结构呈现的规律有________________ (任写一点);
⑷研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。
我分析第三周期从11~17号元素原子半径变化规律是________________________ _ ________。
(5)表中具有相对稳定结构的元素是__ _ ___ 。
(6)钠镁铝等元素在周期表中处于同一周期的原因是__ _____。
10
根据上表,可以得出如下结论:
(1);(2);(3);(4);
11、⑴向容积为250 mL的细颈玻璃仪器A中加水至虚线处,
再滴几滴红墨水,一段时间后,
A中的现象是_____ ________,
说明__________ ____。
⑵继续向A中加酒精至凹液面最低处正好与刻度线相切。
塞紧玻璃塞,将A中液体倒转摇匀,重复2次。
静置一段时间后,
A中的现象为_________ __ ___,说明________ ______。
仪器A细颈部的作用是___________ ____________。
12、A元素原子的原子核内有1个质子。
B元素的负一价阴离子的核外电子层结构与氩原子相同。
C元素的原子最外层是第二层,其最外层电子数是次外层的两倍。
D元素的原子比C元素的原子多1个电子层,其阳离子带1个单位正电荷。
试写出下列符号:
A原子;B负一价阴离子;C原子;D离子;
13、某粒子结构示意图如右图所示,请回答问题。
(1)m表示,该粒子有个电子层,n与粒子的关系密切。
(2)当m—n=10,该粒子为(填类别)。
(3)当n=8时,该粒子带有2个单位的负电荷,该粒子的符号为。