铁、铜及化合物的应用教学设计
- 格式:doc
- 大小:42.50 KB
- 文档页数:6


铁铜的化合物及应用教案
铁铜的化合物及应用
铁铜是化学元素,可以与其他元素形成不同的化合物。
以下是铁铜的一些常见化合物及其应用:
1. 氧化铁铜(FeCuO):氧化铁铜是由铁、铜和氧元素组成的化合物。
它可以用作磁性材料、涂料和颜料。
2. 氯化铁铜(FeCuCl):氯化铁铜是一种含铜氯化物,可以用作染料、胶体溶剂和印染剂。
3. 硝酸铁铜(FeCu(NO3)3):硝酸铁铜是一种黄色晶体粉末,可以用作氧化剂和催化剂。
4. 碳酸铁铜(FeCuCO3):碳酸铁铜是一种蓝色的粉末,可以用作涂料和颜料。
5. 硫酸铁铜(FeCuSO4):硫酸铁铜是一种广泛应用的化合物,可以用于工业、农业和制药工业。
它可以用作电解脱盐、兽药、杀菌剂和漂白剂。
6. 醋酸铁铜(FeCu(C2H3O2)4):醋酸铁铜是一种常用的颜料,可以用于涂料、印刷油墨和塑料。
此外,它还可以用作催化剂和离子交换树脂。
总体来说,铁铜的化合物具有广泛的应用。
从颜料和涂料到电解和制药,在许多工业中都需要使用铁铜化合物。
同时,铁铜的化合物还可以用作催化剂和溶剂,这对于其他工业,如化学工业和制药工业,也是非常重要的。

Fe2+、Fe3+的检验及转化教材分析:本节内容是专题三第二单元的内容,是继钠、镁、铝等常见金属元素之后的一种金属及其化合物的知识,既有金属的通性,又有金属变价的新问题,也是所学氧化还原反应知识的实际应用,体现了铁元素的特殊性。
Fe2+、Fe3+转化规律的应用可以帮助人们解决生产生活中的实际问题,展示出化学科学的实用性。
采用实验设计、实验探究的方法得出规律,体现了化学学科以实验为基础的特点,也体现学科魅力。
学情分析:本节课之前,学生已经学习了铁的单质、氧化物、氢氧化物的基本性质,知道如何分析氧化还原反应,能够在给定试剂的条件下设计实验方案并进行验证,解释实验结果。
教学目标:学会用化学方法鉴别Fe2+、Fe3+尝试设计实验方案,实现Fe2+、Fe3+之间的相互转化在了解、掌握Fe2+、Fe3+的性质的同时,学习科学的思维方法和学习方式体会Fe2+、Fe3+转化规律的应用对人类生活产生的影响教学重难点Fe2+、Fe3+的鉴别Fe2+、Fe3+之间的相互转化教法讲授法、实验探究法教学程序板书设计:Fe2+、Fe3+的检验及转化一、Fe2+、Fe3+的检验1、外观2、加NaOH溶液3、加KSCN溶液Fe3+ + 3SCN- = Fe(SCN)3 (血红色)二、Fe2+、Fe3+的检验及转化Fe2+→Fe3+,加氧化剂:O2, Cl2, Br2, HNO3, KMnO4, H2O2Fe3+→Fe2+,加还原剂:Fe, Cu, H2S, I-2FeCl2 + Cl2 = 2FeCl32Fe2+ + Cl2 = 2Fe3+ + 2Cl-2FeCl3 + Fe = 3FeCl22Fe3+ + Fe = 3Fe2+。


《铁元素与人体健康》教学设计——补血剂中的活性成分的检验高中化学学科核心素养是学生发展核心素养的重要组成部分,包括“宏观辨识与微观探析”、“变化观念和平衡思想”、“证据推理和模型认知”、“科学探究与创新意识”和“科学精神与社会责任”5个维度,全面展现了学生通过化学课程学习形成的关键能力和必备品格。
本文认为,基于化学核心素养的教学是指教学目标的确定、教学内容的组织、教学过程的实施、教学结果的改进、教学评价的设计等一系列教学环节均以化学核心素养的发展作为衡量准则,培养学生的关键能力和必备品格。
具体来说,教学目标源于化学学科核心素养、教学内容基于真实情境、教学过程的实施(教学方法)有利于素养的内化,积极实施“教、学、评”一致性,有效开展化学日常学习评价,促进学生化学学科核心素养的提升。
一、教材分析本节课内容选自苏教版化学1专题3第二单元。
铁是生产、生活中应用量最大、应用最广泛的金属,在人类文明发展进程中起着十分重要的作用。
教材选取铁这种金属是为了让学生认识金属元素及其化合物的相关性质,了解化学与人类生活的密切关系,进一步掌握元素化合物知识的一般研究方法。
本节课教材知识体系从人们熟悉的铁及其化合物在生产生活中的应用实例着手,引导学生复习铁离子及亚铁离子的检验及转化,并学会用其解决实际问题。
二、教学目标1.宏观辨识与微观探析:掌握Fe2+与Fe3+的检验及鉴别方法;掌握Fe2+与Fe3+的相互转化2.变化观念与平衡思想:运用氧化还原理论分析Fe2+与Fe3+的相互转化;3.证据推理与模型认知:学会从信息提示与资料卡中,提取有用信息,并能合理利用解释化学问题;能根据实验证据推出合理结论;构建Fe2+与Fe3+的转化模型,运用模型解释化学问题;4.科学探究与创新意识:学习设计鉴别补血剂中的亚铁离子的实验方案,小组合作完成实验设计;5.科学精神与社会责任:了解铁元素与人体的紧密联系,体会化学与生活息息相关;三、教学重难点:补血剂中活性成分的检验实验设计、Fe2+与Fe3+的相互转化;四、设计思路素养是人在特定情境中综合运用知识、技能和态度解决问题的高级能力与人性能力。
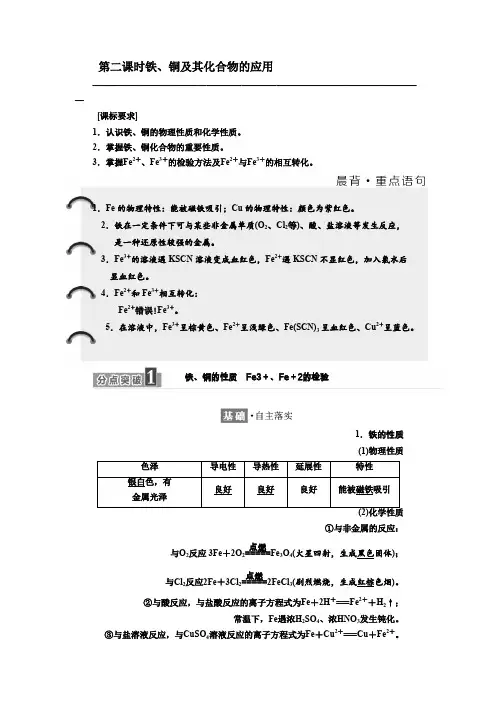
第二课时铁、铜及其化合物的应用——————————————————————————————————————[课标要求]1.认识铁、铜的物理性质和化学性质。
2.掌握铁、铜化合物的重要性质。
3.掌握Fe 2+、Fe 3+的检验方法及Fe 2+与Fe 3+的相互转化。
1.Fe 的物理特性:能被磁铁吸引;Cu 的物理特性:颜色为紫红色。
2.铁在一定条件下可与某些非金属单质(O 2、Cl 2等)、酸、盐溶液等发生反应, 是一种还原性较强的金属。
3.Fe 3+的溶液遇KSCN 溶液变成血红色,Fe 2+遇KSCN 不显红色,加入氯水后显血红色。
4.Fe 2+和Fe 3+相互转化:Fe 2+错误!Fe 3+。
5.在溶液中,Fe 3+呈棕黄色、Fe 2+呈浅绿色、Fe(SCN)3呈血红色、Cu 2+呈蓝色。
铁、铜的性质 Fe3+、Fe +2的检验1.铁的性质 (1)物理性质①与非金属的反应:);固体黑色火星四射,生成(4O 3Fe =====点燃2反应 3Fe +2O 2与O )。
色烟红棕剧烈燃烧,生成(32FeCl =====点燃2反应2Fe +3Cl 2与Cl ②与酸反应,与盐酸反应的离子方程式为Fe +2H +===Fe 2++H 2↑;常温下,Fe 遇浓H 2SO 4、浓HNO 3发生钝化。
③与盐溶液反应,与CuSO 4溶液反应的离子方程式为Fe +Cu 2+===Cu +Fe 2+。
2.铜的性质(1)物理性质紫红颜色:良好。
色;导电性、导热性和延展性:(2)化学性质①与非金属反应:与O2反应:2Cu+O2高温,2CuO;与Cl2反应:Cu+Cl2点燃,CuCl2。
(剧烈燃烧,生成棕黄色烟)②与盐溶液反应:与AgNO3溶液反应的离子方程式为Cu+2Ag+===Cu2++2Ag。
3.Fe3+、Fe2+的检验(1)检验方法(2)Fe3+与KSCN反应的离子方程式为Fe3++3SCN-===Fe(SCN)3。

教学设计名称:《F e2+和Fe3+的相互转化》所属课程:苏教版必修一所属专业:化学《F e2+和Fe3+的相互转化》教学设计案例一、教学内容分析:“Fe2+、Fe3+的转化”是新课标苏教版高中化学必修一专题三第二单元《铁、铜的获取及应用》的重点之一。
本节课首先让学生通过了解铁在人体中的重要作用,提出“为什么补铁的时候需要同时服用维C效果会更好”。
然后结合专题一和专题二的氧化还原的有关知识,推测Fe3+和Fe2+之间是否能发生转化?再通过实验进行探究,最后总结出Fe3+和Fe2+之间转化的条件,从而解决一开始提出的补铁问题。
实现了从生活走向化学,又从化学回归生活。
在教学过程中,力图使学生将“铁离子的检验”与“氧化还原反应”、“铁盐转化”等知识有机结合来解决实际问题,从而提高学生的思维能力和动手能力。
二、教学目标:知识与技能:1.掌握Fe2+和Fe3+的还原性和氧化性。
2.通过探究实验进一步理解氧化还原反应的相关知识,同时培养学生的探究能力。
过程与方法:1.通过Fe2+和Fe3+的相互转化探究实验,学生学会氧化还原反应原理。
2.预测和验证未知物性质的科学方法。
情感态度与价值观:1.体会氧化还原反应的普遍存在,并能举例说明生活、生产中常见的氧化还原反应。
2.通过了解铁与人体健康的内容,知道化学无处不在,真正感悟到生命健康与化学的紧密关系。
三、教学重点难点:1.学生掌握Fe3+和Fe2+的相互转化关系,进一步巩固氧化还原反应的知识。
2.实验探究方案的设计。
3.用氧化还原反应原理预测和验证物质性质的科学方法。
四、学生情况分析本节课是在学生学习氧化还原反应原理以及离子反应之后一次非常重要的综合升华,由于课时的限制学生对上述知识的掌握不太到位,给本节课的教学带来了不小的困难,同时这节课本身也属于高中知识的难点,学生的表达能力以及设计实验的能力还没有达到要求,所以,想要更好的实现教学目标,在课堂的设计和组织上要多花点心思。

铁及其化合物【学习目标】1.知道铁的物理性质,了解铁及其化合物在生活中的应用;2.熟悉铁元素常见的三种价态;3.学会使用化学方法检验Fe 2+和Fe 3+;4.掌握Fe 2+和Fe 3+的主要性质以及相互转化。
【学习重难点】重点:Fe 2+和Fe 3+的检验;难点:Fe 2+和Fe 3+的相互转化【前置作业】根据初中所学知识,Fe 能和哪些物质发生反应呢?请写出具体的化学反应方程式,如果是离子反应的,请写出离子反应方程式。
如果是氧化还原反应,请指明氧化剂和还原剂。
(1)______________________________________氧化剂:_______,还原剂:_______(2)______________________________________氧化剂:_______,还原剂:_______(3)______________________________________氧化剂:_______,还原剂:_______(4)______________________________________氧化剂:_______,还原剂:_______(5)______________________________________氧化剂:_______,还原剂:_______【情境创设】铁锅炒菜能补铁?问题1:如何确定铁锅炒菜后,菜中的铁元素为三价铁?而不是二价铁?涉及方程式:问题2:铁在什么情况下转变为+2价?什么情况下转变为+3价?按照如此推理,菜中增加的铁元素应为______价铁。
问题3:铁锅炒菜后,为什么菜中增加的铁元素为+3价?请你从氧化还原的角度分析。
Fe 2+ →Fe 3+:化合价______,说明Fe2+具有一定的_________性。
实现这一转化,需要加入________剂。
在炒菜过程中,最有可能充当这一角色的是_________。
实验设计:Fe2+ →Fe3+①试剂:FeSO4溶液②下列可选作本实验的氧化剂的是_______A.新制氯水B.酸性高锰酸钾溶液C.铜D.双氧水E.稀盐酸③用__________检验Fe2+是否变为Fe3+④请写出相关的离子方程式:____________________________________⑤延伸思考:这个实验能用来检验Fe2+吗?问题4:为什么维生素C能够帮助人体吸收铁元素?实验验证:取2mL FeCl3溶液于试管中,滴加KSCN溶液,溶液变为_______,随后加入维生素C,振荡,溶液颜色_________。


高三化学学科一体化教学案编写人景均编号28 课时课时28—铁、铜的获取及应用专题三从矿物到基础材料一、考纲要求:1.了解铜的物质性质,掌握铜的化学性质及其应用2.掌握铜的氧化物和氢氧化铜的性质及其应用3.了解硫酸铜等铜盐的性质及其应用4.了解铜及其化合物间的相互转化二、知识结构:(一)、铜的结构、存在、性质和用途1.铜的结构、存在:铜元素在元素周期表中位于第四周期第ⅠB族,原子结构示意图为:电子排布式为:1s22s22p63s23p63d104s1 地球上有少量单质铜,主要以化合态存在。
黄铜矿CuFeS2,孔雀石CuCO3·Cu(OH)22.物理性质铜是硬度较小的紫红色金属,具有良好的延展性、导电性和导热性3.化学性质(1)与非金属反应:①在加热时氧气反应,生成黑氧化铜:_2Cu+O2=2CuO在含有二氧化碳的潮湿空气中放久后:2Cu+O2+H2O+CO2=C u2(O H)2C O3②与硫反应:2 Cu+S △==Cu2S③与氯气反应:Cu+Cl2△==CuCl2(2)与酸反应:①与浓硫酸的反应:Cu +2H2SO4(浓) △==CuSO4+SO2↑+2H2O②与浓硝酸的反应:Cu +4HNO3 (浓) =Cu(NO3)2+2NO2↑+2H2O③与稀硝酸的反应:3Cu +8HNO3 (稀) =3Cu(NO3)2+2 NO ↑+4H2O④在氧气的存在条件下与稀硫酸的反应:_2Cu+O2+2H2SO4_=CuSO4+2H2O〖描述〗铜与稀硝酸在烧瓶中反应的现象铜片表面有气泡,铜片逐渐减小直止消失;溶液由无色变为蓝色;试管内为无色,到试管口变为红棕色。
注:实验现象描述的应用固、液、气三个角度来考虑。
那么每个角度从哪些方面来思考呢?(3)与盐的反应①与硝酸银溶液反应:Cu+2Ag(NO3)2=2Ag↓+Cu(NO3)2②与氯化铁溶液反应:Cu+2FeCl3=CuCl2+2FeCl2铜表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里,这样反复操作几次,闻生成物的气味,并观察铜丝表面的变化。

案例十七
《铁、铜及化合物的应用》教学设计
师大二附中王玺
教学目标:
认知性目标:知道铁铜的色,态等物理性质;
掌握铁及其化合物的化学性质,会写出Fe与酸,非金属单质及
盐的化学反应方程式;
学会利用SCN-的方法来检验及通过加还原剂或氧化剂的方法进
行转化并会写出相应的化学方程式。
技能性目标:初步学会用氧化还原原理来进行实验探究;
学习科学的思维方法和学习方法;
通过对探究Fe2+、Fe3+转化过程来提高实验能力和实验方案设计
能力。
体验性目标:培养学生事实求是的科学精神;
培养学生严谨的学习态度。
重点:Fe2+、Fe3+的检验方法及探究其转化
难点:Fe2+、Fe3+的检验方法及探究其转化
教学过程:
板书设计:
铁、铜及化合物的应用
一、物理性质
铁:银白色固体、能被磁铁吸引;铜:紫红色固体。
铁、铜都是热和电的良导体都有延展性。
二、化学性质
[注意事项]①铁、铜反应中都充当还原剂
②铁跟氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为亚铁化合物。
③铁跟氧化性较强的氧化剂(如氯气、硝酸等)反应转化为+3价铁的化合物。
④铜在反应中一般转化为+2价铜的化合物。
三、Fe2+、Fe3+的鉴别
1.观察溶液颜色:Fe2+是浅绿色溶液;Fe3+是棕黄色溶液。
2.与KSCN反应:Fe3+能与SCN-发生反应,使溶液变成血红色。
Fe2+而不行。
3.与NaOH反应:Fe2+发生白色沉淀迅速变灰绿色最后呈红褐色;而Fe3+立即产生红褐色沉淀。
四:Fe2+、Fe3+的相互转化
Fe2+→Fe3+化合价升高,需加入氧化剂;
Fe3+→Fe2+化合价降低,需加入还原剂。