双液系的气-液平衡相图
- 格式:ppt
- 大小:265.50 KB
- 文档页数:14
双液系气-液平衡相图的绘制一、实验目的(1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。
找出恒沸点混合物的组成及恒沸点的温度。
(2)掌握测定双组分液体的沸点及正常沸点的测定方法。
(3)了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。
二、实验原理2.1液体的沸点液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。
2.2双液系的沸点双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
理想的二组分体系在全部浓度范围内符合拉乌尔定律。
结构相似、性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x (y )图。
大多数情况下,曲线将出现或正或负的偏差。
当这一偏差足够大时,在T-x (y )曲线上将出现极大点(负偏差)或极小点(正偏差)。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。
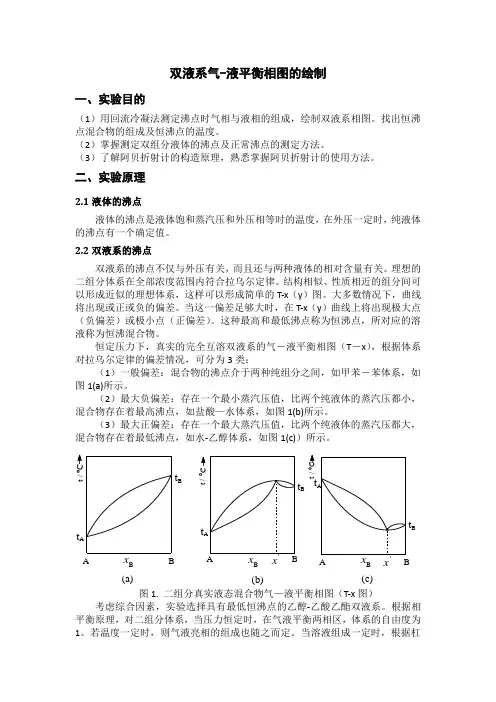
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图1(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点,如水-乙醇体系,如图1(c))所示。
图1. 二组分真实液态混合物气—液平衡相图(T-x 图)考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。
根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1。
若温度一定时,则气液亮相的组成也随之而定。
当溶液组成一定时,根据杠t AtAt At Bt B t Bt / o Ct / o t / o x Bx Bx B ABAABB(a)(b)(c)x 'x '杆原理,两相的相对量也一定。

实验七、双液系气—液平衡相图的测绘专业:11化学姓名:赖煊荣座号:32 同组人:黄音彬时间:2013.12. 3Ⅰ、目的要求1.测定相应组成时的沸点并制作常压下环已烷—无水乙醇双液系的平衡相图。
2.从沸点组成图了解分馏原理。
3.了解沸点的测定技术,掌握两组分液体沸点的测定方法。
4.掌握折光率与组成的关系及阿贝折光仪的使用方法。
Ⅱ、基本原理一、气—液相图两种液态物质混合而成的二组分体系称为双液系。
两个组分若能按任意比例互相溶解,称完全互溶双液系。
液体的沸点是指液体的蒸气压与外压相等时的温度。
在一定的外压下,纯液体的沸点有其确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
根据相律:自由度=组分数-相数+2 。
因此,一个以气—液共存的二组分体系,其自由度为2。
只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。
在T—x相图上,还有温度、液相组成和气相组成三个变量,但只有一个自由度。
一旦设定某个变量,则其它两个变量必有相应的确定值。
二、沸点测定仪沸点仪的构造特点满足:正确测定沸点、便于取样分析、防止过热及避免分馏等。
如图2,是一只带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
溶液中事先加入沸石以减少溶液沸腾时的过热现象及防止暴沸。
三、组成分析本实验选用的环已烷和乙醇,两者折光率相差颇大,而折光率测定又只需少量样品,平衡体系两相组成的获得由事先测得的折光率——组成的工作曲线查得。
折光仪的原理及使用详见参考资料。
Ⅲ、仪器与试剂沸点测定仪一套,普通温度计一支、超级恒温器一套(配接触点温度计、温度计各一支),酒精灯一个、铁架台一附、阿贝折光仪一台、长滴管、烧杯、移液管、擦镜纸等。
环已烷(分析纯)、无水乙醇(分析纯)、丙酮(分析纯)、重蒸馏水等。
Ⅳ、实验步骤1.联接超级恒温器与阿贝折光仪。
调节超级恒温器恒温水浴温度为设定温度25℃,与阿贝折光仪温度一致。

实验二双液系的气—液平衡相图1. 目的要求(1) 绘制在p0下环己烷-乙醇双液系的气-液平衡相图,了解相图和相律的基本概念。
(2) 掌握测定双组分液体沸点的方法。
(3) 掌握用折光率确定二元液体组成的方法。
2. 基本原理任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系;若只能在一定比例范围内溶解,称为部分互溶双液系。
环己烷-乙醇二元体系就是完全互溶双液系。
双液系蒸馏时的气相组成和液相组成并不相同。
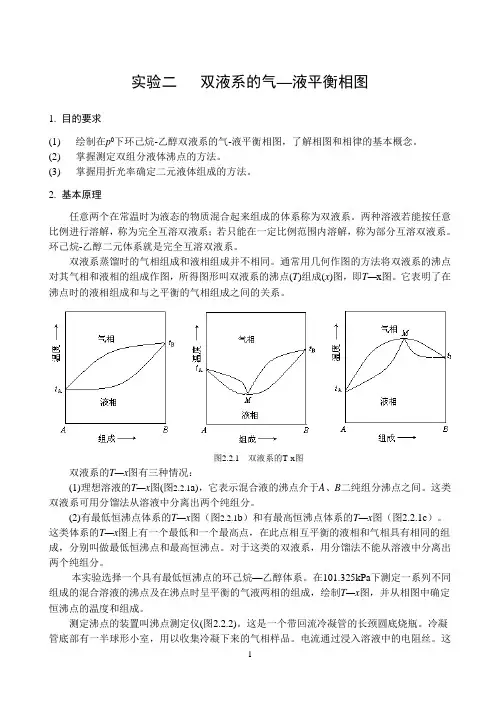
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点(T)组成(x)图,即T—x图。
它表明了在沸点时的液相组成和与之平衡的气相组成之间的关系。
图2.2.1 双液系的T-x图双液系的T—x图有三种情况:(1)理想溶液的T—x图(图2.2.1a),它表示混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
(2)有最低恒沸点体系的T—x图(图2.2.1b)和有最高恒沸点体系的T—x图(图2.2.1c)。
这类体系的T—x图上有一个最低和一个最高点,在此点相互平衡的液相和气相具有相同的组成,分别叫做最低恒沸点和最高恒沸点。
对于这类的双液系,用分馏法不能从溶液中分离出两个纯组分。
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。
在101.325kPa下测定一系列不同组成的混合溶液的沸点及在沸点时呈平衡的气液两相的组成,绘制T—x图,并从相图中确定恒沸点的温度和组成。
测定沸点的装置叫沸点测定仪(图2.2.2)。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流通过浸入溶液中的电阻丝。
这样可以减少溶液沸腾时的过热现象,防止暴沸。
测定时,温度计水银球要一半在液面下,一半在气相中,以便准确测出平衡温度。
而折光率的测定又只需少量样品,溶液组成分析:由于环己烷和乙醇的折光率相差较大,4.实验步骤(1) 纯液体折光率的测定:分别测定乙醇和环己烷的折光率,重复2次~3次。

实验四 双液系的气-液平衡相图的绘制一、目的要求1.用沸点仪测定大气压下乙醇—环己烷或异丙醇-环己烷双液系气-液平衡时气相与液相组成及平衡温度,绘制温度—组成图,确定恒沸混合物的组成及恒沸点的温度。
2.了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3.进一步理解分馏原理。
二、预习要求1.理解分馏原理,了解影响双液系气-液平衡的因素。
2.熟悉阿贝折光仪的使用方法,了解折射率与物系组成的关系。
3.掌握如何由实验数据绘制t x -相图的方法。
三、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系。
两种液体若能按任意比例互相溶解,称为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分互双液系。
双液系的气液平衡相图t x -图可分为三类。
如图4.1。
图 4.1 二元系统t x -图这些图的纵轴是温度(沸点),横轴是代表液体B 的摩尔分数B x 。
在t x -图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点时与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
例如图4.1(a)中对应于温度t 1的气相点为y 1,液相点为1l ,这时的气相组成y 1点的横轴读数是g B x ,液相组成点1l 点的横轴读数为lB x 。
y 1l 1t 1g B x l B x A B t/℃(a )气液t/℃A B B x →(b )t/ ℃气液A B B x →(c )如果在恒压下将溶液蒸馏,当气液两相达平衡时,记下此时的沸点,并分别测定气相图。
(馏出物)与液相(蒸馏液)的组成,就能绘出此t x图4.1(b)上有个最低点,图4.1(c)上有个最高点,这些点称为恒沸点,其相应的溶液称为恒沸混合物,在此点蒸馏所得气相与液相组成相同。
四、仪器和药品1.仪器玻璃沸点仪一套;阿贝折光仪一台;WLS系列可调式恒流电源一台;SWJ型精密数字温度计一台;SYC超级恒温槽一台。
2.药品无水乙醇(AR)或异丙醇(AR);环己烷(AR)。

双液系的气液相平衡图1 引言在一定压力下,两组分系统气液达到平衡时,表示液态混合物的沸点与平衡时气液中两组分关系的相图,称为沸点-组成(T-x)相图。
本实验的目的是测定常压下环己烷-乙醇双液系的沸点-组成图,由于该双液系对拉乌尔定律有较大的正偏差,故相图大致如图1所示,可见,欲测定此图,需在气液平衡后同时测定溶液的沸点、气相和液相组成。
前者可由沸点仪实现,而后者可用折射仪及由不同浓度溶液得到的工作曲线测得。
图1 环己烷-乙醇双液系的沸点-组成相图2 实验操作2.1实验药品、仪器及测试装置示意图2.1.1 实验仪器自制沸点仪,阿贝折射仪,调压器,温度传感器,锥形瓶,分析天平(AR2140),5ml 及10ml吸量管,洗耳球2.1.2 实验药品环己烷,无水乙醇2.1.3 实验装置示意图图21.冷却水入口2.气相冷凝液储存小泡3.温度计4.喷嘴5.电热丝6.调压器2.2 实验条件温度:室温(具体数值未知)气压:未知湿度:未知2.3实验操作步骤及方法要点a.按下表配比配制不同浓度的环己烷-乙醇溶液,并在空瓶时m0、加入环己烷后m1、加入无水乙醇后m2(本实验先加入环己烷后加入无水乙醇)分别进行称量并记录。
注意:所用锥形瓶要事先干燥;由于浓度是根据称量的数值由两组分的质量进行计算,所以每次加入液体的体积不必太精确。
表1 环己烷-无水乙醇混合溶液配比b.根据所测得的质量,用公式ω=(m1-m0)/(m2-m0) 公式1计算环己烷的质量分数,其中ω指环己烷的质量分数。
c.用阿贝折射仪测定以上配好的不同浓度环己烷-乙醇溶液的折射率以及纯环己烷和无水乙醇的折射率,记录数据。
注意:每次测量折射率后,要将折射仪的棱镜打开,用洗耳球吹干,以备下次使用。
d.根据上一步测得的折射率,用线性拟合的方法做工作曲线,检查数据是否可靠,若不可靠应重复测量。
e.由于不同浓度的各样品已经事先装入沸点仪,所以直接选定一个浓度的样品,接通电源,加热样品。


广西民族大学物理化学实验报告2018年10月24日姓名:指导老师:实验步骤及装置图1.用移液管量取异丙醇25mL,倒入干燥的沸点测定仪中。
开通冷却水。
开启电源,温度开始上升,不久仪器内液体沸腾,回流至温度不再升高和气相冷凝液充满,读取沸点,关闭电源。
2.用移液管量取1mL环己烷,加入沸点测定仪中。
开启电源,温度开始上升,不久仪器内液体沸腾,回流至温度不再升高和气相冷凝液充满,读取沸点,关闭电源。
用干燥滴管吸取气相冷凝液,测其折光率。
再用另一干净滴管吸取液相样品,测其折光率。
3.用移液管量取5mL、9mL、10mL环己烷,以同样的方法,顺序测定含环己烷的各溶液的沸点及气相、液相组分的折光率。
4.用移液管量取25mL环己烷,重复步骤15.用移液管量取0.5mL、1.5mL、4mL、5mL异丙醇,以同样的方法,顺序测定含异丙醇的各溶液的沸点及气相、液相组分的折光率。
实验原理常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
双液体系的沸点不仅与外压有关,还与双液体系的组成有关。
恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T-X 图。
通常,如果液体与拉乌尔定律的偏差不大,在T-X图上溶液的沸点介于A、B二纯液体的沸点之间见图1 (a) 而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T-X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图1(b), (c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验所用沸点仪如图所示。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流经变压器和粗导线通过浸于溶液中的电热丝。
这样既可以减少溶液沸腾时的过热现象,还能防止暴沸。

实验三完全互溶双液系的气-液平衡相图一、实验目的1.绘制常压下环己烷-乙醇双液系的T—X图,并找出最低恒沸点和最低恒沸混合物的组成。
2.学会阿贝折射仪的使用。
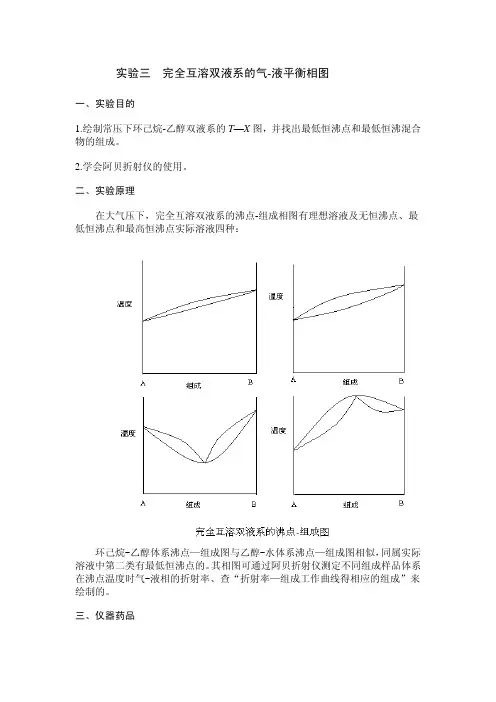
二、实验原理在大气压下,完全互溶双液系的沸点-组成相图有理想溶液及无恒沸点、最低恒沸点和最高恒沸点实际溶液四种:环己烷-乙醇体系沸点—组成图与乙醇-水体系沸点—组成图相似,同属实际溶液中第二类有最低恒沸点的。
其相图可通过阿贝折射仪测定不同组成样品体系在沸点温度时气-液相的折射率、查“折射率—组成工作曲线得相应的组成”来绘制的。
三、仪器药品1、仪器阿贝折射仪1台; 沸点仪1套; 恒温槽1台;0.1刻度水银温度计(0-100℃)2支;带磨口塞子的小样品管(2mL)16支;移液管(2mL)2支;胶头滴管2个; 50mL 烧杯10只(公用);50mL量筒10只(公用)。
2、药品(1)无水乙醇(AR);环己烷(AR); 二次蒸馏水。
(2)在样品瓶中依次加入环己烷10mL、20mL、30mL、40mL、50mL、60mL、70mL、80mL、90mL和乙醇90mL、80mL、70mL、60mL、50mL、40mL、30mL、20mL、20mL已知浓度的标准溶液(按纯样品的密度,换算成物质的量分数)9份。
(3)环己烷物质的量分数约为0.05、0.15、0.30、0.45、0.55、0.65、0.80、0.95的环己烷-乙醇溶液样品。
四、实验步骤1、测已知浓度的标准的折射率,作环己烷-乙醇的折射率-组成工作曲线(1)调节超级恒温槽水浴温度,使阿贝折射仪上的温度为250.1±℃左右。
(2)依次测已知浓度的标准溶液及纯乙醇和环己烷的的折射率(棱镜不能触及硬物如滴管,擦拭棱镜用擦镜纸)。
2、按图安装好沸点仪-沸点仪将一干燥、洁净的磁子放入已洗涤、干燥的沸点仪内,按图安装在实验室特制的磁力加热电热套内(250mL、只可覆盖圆底烧瓶底部1/5);一支温度计离圆底烧瓶约0.5cm,另一支温度计水银球上沿与支管口下沿相齐。
双液体系气—液平衡相图的绘制一、实验目的1. 绘制环己烷—异丙醇双液体系的沸点组成图,确定其恒沸组成和恒沸温度。
2. 掌握回流冷凝管法测定溶液沸点的方法。
3.掌握阿贝折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不 同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
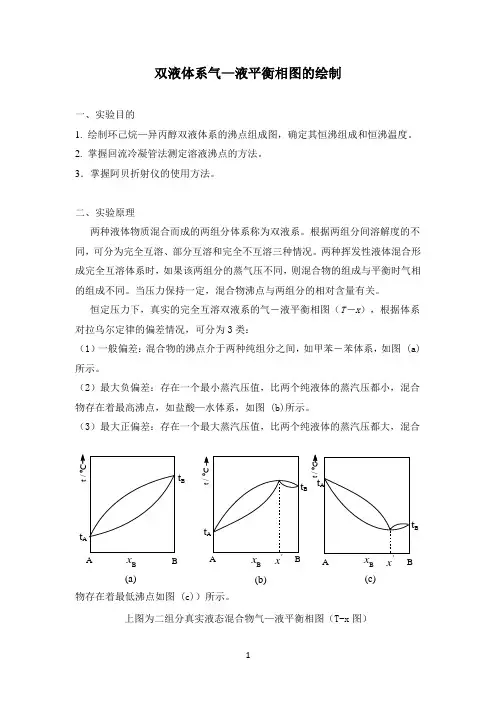
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图 (a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图 (b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图 (c))所示。
上图为二组分真实液态混合物气—液平衡相图(T-x 图)t At AtAt Bt B t Bt / o Ct / o t / o x Bx Bx BABAABB(a)(b)(c)x 'x '后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-异丙醇为体系,该体系属于上述第三种类型,在沸点仪中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
本实验中两相的成分分析均采用折光率法测定。
三、仪器与试剂1、仪器:沸点仪1台;调压变压器1台;阿贝折射仪1台;温度计(0-100℃) 1支;长滴管1个;短滴管2支;2、试剂:环己烷(分析纯);异丙醇(分析纯)异丙醇—环己烷标准溶液(异丙醇分别为0.20,0.40,0.50,0.60,0.80,0.90)四、主要实验步骤1. 测定环己烷、异丙醇及标准溶液的折射率调节阿贝折射仪,用一支干燥的短滴管吸取环己烷数滴,注入折射仪的加液孔内,测定其折射率n,读数两次,取其平均值。
实验七 双液系气液平衡相图一 实验目的1. 测定异丙醇-环己烷双液系在常压下气-液平衡数据,绘制标准压力的T—X 图。
2. 确定体系的恒沸温度及恒沸混合物的组成。
3. 了解阿贝折射仪的测量原理,掌握其使用方法。
二 实验原理两种液态物质混合时所形成的二组分体系称为双液系,若组成体系的两个组分可以任意比例相互溶解时,则称为完全互溶双液系。
完全互溶双液系恒定压力下的沸点组成图(T—X )可分为三类。
第一类 溶液沸点介于两纯组分沸点之间图7-1;第二类 溶液存在最低沸点图7-2;第三类 溶液存在最高沸点图7-3。
从这三类体系的T -X 图可以看出,对于第一类的混合物可以利用一般精馏法分离出两种纯物质;而对于第二、三类的混合物只能分离出一种纯物质和另一种恒沸混合物。
而且第二、三类体系的溶液在最高或最低沸点时的气液两相组成相同。
加热蒸发时,只能使气相的总量增加,气液相组成及溶液沸点均保持不变。
这时的温度称之为恒沸温度(或恒沸点),相应的组成称为恒沸组成。
不难看出,恒沸温度组成是这些相图的特征参数。
异丙醇-环己烷是完全互溶的双液系,其沸点-组成图(即T -X 图)属于具有最低恒沸点的类型(见图7-2)。
在101325Pa 下异丙醇的沸点为 82.45℃,环己环的沸点为80.75℃。
实验要求在恒压下,测定整个浓度范围内所选定的几个不同组成溶液的沸点T 和平衡时气相组成y 和液相组成X ,然后绘制沸点-组成图(即T -X 图)。
为了获得上述测定数据,本实验利用沸点仪(见图7-4),采用回流冷凝法,当气液两相的相对量一定时,体系的温度也将保持恒定,沸点即沸腾温度可由温度计读取。
分别由蒸气冷7-4沸点仪1- 温度计; 2- 加液口;3 -电热丝4-分馏液取样口;5-分馏液图7-3图 7-1 图 7-2凝的凹形槽中取样分析平衡气相组成;从加液口取样分析平衡液相组成,试样分析使用的仪器是阿贝折射仪。
实验所测定的是试样的折射率,还需将折射率转换成组成。
双液系的气——液平衡相图数据处理一、蒸馏水、乙酸乙酯和无水乙醇的折光率值室温:295K 大气压:101.325KPa 样品 n 1 n 2 n 3 n 平均 n 理论 △n n 校正 H 2O 1.33280 1.33290 1.33280 1.33283 1.33281 0.00002 —— 乙酸乙酯 1.37120 1.37130 1.37130 1.37137 —— —— 1.37135 无水乙醇 1.360701.360901.360801.36090————1.36088无水乙醇方程:y=-9551.1x+13098; 乙酸乙酯方程:y= 9551.1x-12998。
根据所测得实验过程中的折光率,查上图的工作曲线,可得下表2。
二、未知液的组成溶液沸点/℃ 液相气相 n 1 n 2 n 3 n 平均校正 x 乙酸乙酯 n 1 n 2 n 3 n 平均校正 y 乙酸乙酯 0.05 77.431.36111.3611 1.3612 1.361213 0.022286 1.3628 1.3624 1.3624 1.362113 0.156001 0.20 75.05 1.362 1.3619 1.3621 1.36208 0.105062 1.3634 1.3634 1.3636 1.363647 0.245145 0.30 73.99 1.3626 1.3626 1.3624 1.362947 0.156001 1.3647 1.3649 1.3647 1.36518 0.369309 0.40 73.06 1.3633 1.3632 1.3634 1.363813 0.229226 1.3653 1.3652 1.3653 1.366713 0.417065 0.50 72.46 1.3646 1.3645 1.3647 1.36468 0.353391 1.3659 1.3657 1.3657 1.368247 0.46482 0.6072.121.36591.36581.3661.3655470.4775551.3661.36621.36621.369780.4998410.70 71.97 1.36731.36721.3671.3664130.5985361.36691.36681.36681.3713130.5666990.95 74.4 1.369 1.369 1.36941.367280.7863741.36891.36891.3691.3728470.767272用上表所得的数据绘制作图如下:由上图中读出其最低恒沸点为71.97℃,乙酸乙酯摩尔分数为0.5285。
双液系的气—液平衡相目的要求(1) 绘制在pΘ下环己烷-乙醇双液系的气-液平衡相图,了解相图和相律的基本概念。
(2) 掌握测定双组分液体沸点及正常沸点的方法。
(3) 掌握用折光率确定二元液体组成的方法。
基本原理一、气-液相图两种液态物质混合而成的二组分体系称为双液系。
两种组分若能按任意比例互相溶解,称为完全互溶双液系。
液体的沸点是指液体的蒸气压与外界压力相等时的温度。
在一定的外压力下,纯液体的沸点有其确定的值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
根据相律,自由度=组分数-相数+2因此,一个气-液共存的二组分体系,其自由度为2.只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。
例如,在一定温度下,可以画出体系的压力p和组分x的关系图,如体系的压力确定,则可作温度T对x的关系图。
这就是相图。
在T-x相图上,还有温度,液相组成和气相组成三个变量,但只有一个自由度。
一旦设定某个变量,则其他两个变量必有相应的确定值。
图Ⅱ-5-1以苯-甲苯为例表明,温度T这一水平线指出了在此温度时处于平衡的液相组分x和气相组分y的相应值。
苯与甲苯这一双液系基本上接近理想溶液,然而绝大多数实际体系与拉乌尔定律有一定偏差。
偏差不大时,温度-组分相图与图Ⅱ-5-1相似,溶液的沸点仍介于两纯物质的沸点之间。
但是,有些体系的偏差很大,以至其相图将出现极值。
正偏差很大的体系在T-x图上呈现极小值,负偏差很大时则会有极大值。
这样的极值称为恒沸点,其气,液两相的组成相同。
例如,H2O-HCl体系的最高恒沸点在P0时为108.5,恒沸物的组成含HCl20.242%。
通常,测定一系列不同配比溶液的沸点及气、液两相组成,就可绘制气-液体系的相图。
压力不同时,双液系相图将略有差异。
本实验要求将外压校正到1个大气压力。
二、沸点测定仪各种沸点仪的具体构造虽各有特点,但其设计思想则都集中于如何正确测定沸点、便于取样分析、防止过热及避免分馏等方面。
【最新整理,下载后即可编辑】实验目的与要求:1. 绘制常压下环己烷-乙醇双液系的气液平衡相图(T—X图),了解相图和相律的基本概念;2. 掌握测定双组分液体的沸点及正常沸点的方法;3. 掌握用折光率确定二元液体组成的方法。
实验原理:常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
双液体系的沸点不仅与外压有关,还与双液体系的组成有关。
恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T—X图。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图1 (a)。
而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
图1 完全互溶双液系的相图图2 沸点仪 1.温度计;2.加料口;3.加热丝;4.气相冷凝液取样口;5.气相冷凝液本实验采用回流冷凝的方法绘制环己烷-乙醇体系的T —X 图。
其方法是用阿贝折射仪测定不同组分的体系在沸点温度时气相、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制T —X 图 仪器与试剂:沸点仪1套 超级恒温槽1台WZS -I 型阿贝折光仪25ml 量筒、小漏斗、滴管、大烧杯无水乙醇 , 环己烷,x 环己烷 各为0.1,0.3,0.5,0.7,0.95的乙醇溶液。
(250mL 试剂瓶盛装)注:x 环己烷 为环己烷的物质的量分数浓度,定义为乙醇环己烷环己烷环己烷n n n x +=个人实验图乙醇/环己烷平衡相图温度/℃908070600.000.200.400.600.80 1.00 1.20环己烷%最低恒沸物的沸点64.9℃。