元素周期律(第二课时)金属性递变规律
- 格式:docx
- 大小:465.95 KB
- 文档页数:65




《必修Ⅱ第1章第2节元素周期律》(第2课时)【课标要求】1、通过实验操作,培养学生实验技能。
2、掌握元素的金属性和非金属性随原子序数的递增而呈现周期性变化规律。
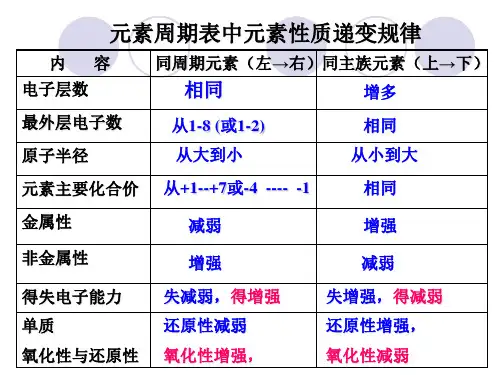
【重点难点】1、从原子结构角度预测和解释元素的某些性质2、形成依据“位-构-性”关系研究元素周期律的方法【基础知识】一、元素的金属性、非金属性强弱判断依据。
二、第三周期元素性质变化规律[实验一] Mg、Al和水的反应:分别取一小段镁带、铝条,用砂纸去掉表面的氧化膜,放入两支小试管中,加入2~3 ml水,并滴入两滴酚酞溶液。
观察现象。
过一会儿,分别用酒精灯给两试[实验二]Mg、Al与稀盐酸反应比较[总结]1、第三周期元素Na Mg Al Si P S Cl,金属性逐渐,非金属性逐渐。
2、非金属性越强,其最高价氧化物对应的水化物的酸性也越。
三、同周期元素性质递变规律同周期从左到右,金属性逐渐,非金属性逐渐。
四、元素周期律(1)定义:。
(2)实质:。
【自我测试】1.下列各组元素性质的递变情况错误的是 ( )A.Li、Be、B原子最外层电子数依次增多 B.P、S、C1元素最高正价依次升高C.N、O、F原子半径依次增大 D.Na、K、Rb的电子层数依次增多2.某元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子A.4 B.5 C .6 D.7 ( )3.某元素x的气态氢化物化学式为H2X,下面的叙述不正确的是 ( )A.该元素的原子最外层上有6个电子 B.该元素最高价氧化物的化学式为XO3C.该元素是非金属元素 D.该元素最高价氧化物对应水化物的化学式为H2XO34.元素的性质呈周期性变化的根本原因是 ( )A.元素相对原子质量的递增,量变引起质变 B.元素的原子半径呈周期性变化C.元素原子的核外电子排布呈周期性变化 D.元素的金属性和非金属性呈周期性变化5.下列递变规律正确的是 ( )A.O、S、Na、K原子半径依次增大 B.Na、Mg、A1、Si的还原性依次增强C.HF、HCl、H2S、PH3的稳定性依次增强 D.KOH、Ca(OH)2、Mg(OH)2、A1(OH)3的碱性依次增强6.下列叙述中,能肯定A金属比B金属活泼性强的是 ( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多 C.常温时,A能从水中置换出H2,而B不能.D.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多7.超重元素“稳定岛”的预言:自然界中可能存在着原子序数为114的元素的稳定同位素x。


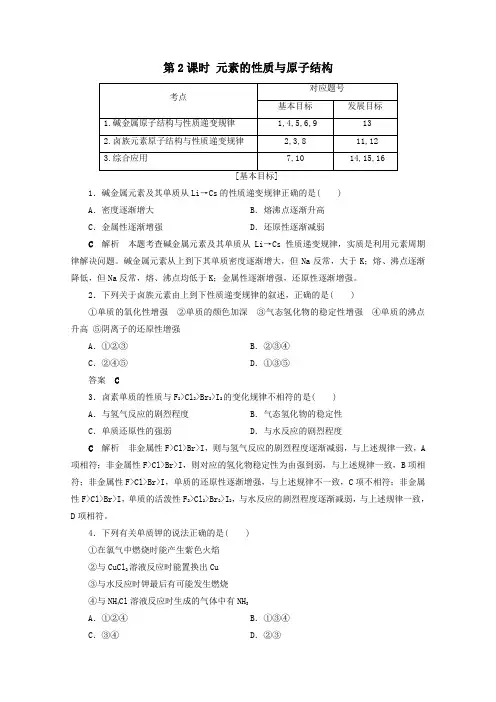
第2课时元素的性质与原子结构1.碱金属元素及其单质从Li→Cs的性质递变规律正确的是( )A.密度逐渐增大B.熔沸点逐渐升高C.金属性逐渐增强D.还原性逐渐减弱C解析本题考查碱金属元素及其单质从Li→Cs性质递变规律,实质是利用元素周期律解决问题。
碱金属元素从上到下其单质密度逐渐增大,但Na反常,大于K;熔、沸点逐渐降低,但Na反常,熔、沸点均低于K;金属性逐渐增强,还原性逐渐增强。
2.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )①单质的氧化性增强②单质的颜色加深③气态氢化物的稳定性增强④单质的沸点升高⑤阴离子的还原性增强A.①②③B.②③④C.②④⑤D.①③⑤答案C3.卤素单质的性质与F2>Cl2>Br2>I2的变化规律不相符的是( )A.与氢气反应的剧烈程度B.气态氢化物的稳定性C.单质还原性的强弱D.与水反应的剧烈程度C解析非金属性F>Cl>Br>I,则与氢气反应的剧烈程度逐渐减弱,与上述规律一致,A 项相符;非金属性F>Cl>Br>I,则对应的氢化物稳定性为由强到弱,与上述规律一致,B项相符;非金属性F>Cl>Br>I,单质的还原性逐渐增强,与上述规律不一致,C项不相符;非金属性F>Cl>Br>I,单质的活泼性F2>Cl2>Br2>I2,与水反应的剧烈程度逐渐减弱,与上述规律一致,D项相符。
4.下列有关单质钾的说法正确的是( )①在氯气中燃烧时能产生紫色火焰②与CuCl2溶液反应时能置换出Cu③与水反应时钾最后有可能发生燃烧④与NH4Cl溶液反应时生成的气体中有NH3A.①②④B.①③④C.③④D.②③B解析钾元素的焰色反应呈紫色,①正确;钾与盐溶液反应时首先与水剧烈反应生成碱与氢气,生成的碱再与盐发生复分解反应,②错误,④正确;与水反应时钾的反应现象比钠更剧烈,在相同时间内放出的热量更多,温度升高得更多,故钾有可能燃烧,③正确。

元素周期表中主族元素性质递变规律金属性强弱的判断依据1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。
如,说明溴的非金属性比碘强。
6.相互化合后的价态:如,说明O 的非金属性强于S。
7.其他:如CuCl2,所以C1的非金属性强于S。
•元素周期律定义:元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中主族元素性质递变规律:微粒半径大小的比较方法:1.同周期元素的微粒同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒同主族元素的原子或离子半径随核电荷数增大而增大,如半径:3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径:(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
专题一 第一单元教学案 原子核外电子排布与元素周期律元素周期律(第二课时)课程学习目标:(1)了解同一周期和同一主族元素性质的递变规律。
(2)掌握元素金属性和非金属性的变化规律、比较方法。
(3)掌握理解元素原子结构对元素性质的影响,并能尝试运用这一规律预测元素的性质。
(4)运用元素周期表,理解位置、结构、性质三者的关系,培养分析和推理能力。
(5)通过对元素周期表的学习,了解相关的实际应用,树立爱科学、用科学、为科学努力学习的高贵品质。
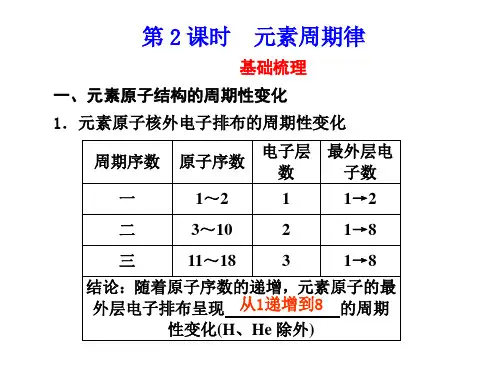
知识体系梳理:原子的最外层 原子半径 元素性质随 电子数从1个 主要化合价 原子序数的 增加到饱和 原子得失电子能力 递增而呈现 (2个或8个) 金属性和非金属性 周期性变化 的稳定结构 课前预习:一、我们以第三周期为例,通过实验探究元素的金属性和非金属性的递变规律。
科学探究:钠、镁、铝与水(或酸)的反应 金属镁与沸水的反应:(填表)镁、铝与盐酸的反应此处留白,学生填写预习中不明白的课前检测:1、同周期从左到右,金属性逐渐,非金属性逐渐。
2、11—17号元素最高化合价和最低化合价的变化规律是:。
3、元素周期律(1)定义:。
(2)实质:。
课程达标检测:1、X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是:HZ> H2Y >H3X,下列说法中正确的是()A、原子序数: X>Y>ZB、非金属性:X<Y<ZC、原子半径: X<Y<ZD、离子半径:X3-<Y2-< Z-2、已知HNO3的酸性强于H3PO4,则N元素的非金属性于P元素的非金属性。
3、已知:Ca(OH)2的碱性强于Mg(OH)2,则Ca 元素的金属性强于镁元素的金属性。
4、元素的以下性质,随着原子序数的递增不呈现周期性变化的是()A、化合价B、原子半径C、元素的得电子能力和失电子能力D、相对原子质量课后练习:1.下列递变规律正确的是 ( ) A.O、S、Na、K原子半径依次增大B.Na、Mg、A1、Si的还原性依次增强 C.HF、HCl、H2S、PH3的稳定性依次增强D.KOH、Ca(OH)2、Mg(OH)2、A1(OH)3的碱性依次增强2.下列叙述中,能肯定A金属比B金属活泼性强的是 ( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多D.常温时,A能从水中置换出H2,而B不能.3.下列关于元素周期表和元素周期律的说法错误的是 ( )A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第二周期元素从Li到F,非金属性逐渐增强C.因为Na比K容易失去电子,所以Na比K的还原性强D.O与S为同主族元素,且O比S的非金属性强4.下列叙述正确的是( )A.同周期元素中,第ⅦA族元素的原子半径最大 B.现已发现的零族元素的单质在常温常压下都是气体C.第ⅥA族元素的原子,其半径越大,越容易得到电子D.所有的主族元素的简单离子的化合价与其族序数相等。
元素周期律知识点总结元素周期律学问点总结 1一.元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数二.元素的性质和原子结构(一)碱金属元素:2.碱金属化学性质的递变性:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数渐渐增多,原子核对最外层电子的引力渐渐减弱,原子失去电子的力量增加,即金属性渐渐增加。
所以从Li到Cs的金属性渐渐增加。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的推断依据:与水或酸反应越简单,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
3.碱金属物理性质的相像性和递变性:1)相像性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):①密度渐渐增大(反常) ②熔点、沸点渐渐降低3)碱金属原子结构的相像性和递变性,导致物理性质同样存在相像性和递变性(二)卤族元素:2.卤素单质物理性质的递变性:从F2到I21)卤素单质的颜色渐渐加深;2)密度渐渐增大;3)单质的熔、沸点上升3.卤素单质与氢气的反应: X2 + H2 = 2 HX卤素单质与H2 的猛烈程度:依次减弱;生成的氢化物的稳定性:依次减弱4. 非金属性的强弱的推断依:1. 从最高价氧化物的水化物的酸性强弱,或与H2反应的难易程度以及氢化物的稳定性来推断。
2. 同主族从上到下,金属性和非金属性的递变:同主族从上到下,随着核电核数的增加,电子层数渐渐增多,原子核对最外层电子的引力渐渐减弱,原子得电子的力量减弱,失电子的力量增加,即非金属性渐渐减弱,金属性渐渐增加。
3. 原子结构和元素性质的关系:原子结构打算元素性质,元素性质反应原子结构。
同主族原子结构的相像性和递变性打算了同主族元素性质的相像性和递变性。
三.核素(一)原子的构成:(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽视。
元素周期律递变规律中国古代伟大的理论物理学家黄宪生在《五行术》中提出了“元素周期律”,即化学元素呈现出一定的排列规律。
他认为重量按照由低到高依次为水、木、金、火。
经过后人的发展,元素周期律逐渐形成了一种递变规律,目前我们所认识的元素周期律已经基本确立。
元素周期律的递变规律主要有两种:一种是根据原子号将元素依照原子序数从小到大排列;而另外一种是根据原子核各层大小,将元素依照原子序数从小到大排列,阴离子从外到内,阳离子从内到外。
基于原子号分析,元素周期规律呈现出由元素周期根式(高中物理课本里所学过的十二列、八列)构成的递变规律。
第一列(低序原子号)元素,如氢、氦、锂、铍、硼、氮等,主要是半导体元素,其原子半径一般较小,多用作掺入元素;第二列至第十列(低序原子号),如铁、铜、氧、氟、碘、氪等,是常见的金属元素,其原子半径半径一般较大;第十一列和第十二列,如锶、氡、钚、钫、铈、铯等,则主要是有机无机化合物里的重要组成成分,其原子半径一般较小。
基于原子核层数分析,元素周期规律的递变规律则更加复杂,主要是以阴离子最外层从1s到7s,再跳阳离子从1p到6p,再到高级原子外层d和f层的排列顺序,构成动态的周期性效应的图解。
由于每一层的原子半径大小一般是按照从最大到最小从外到内从大到小排列,所以通常也可以把元素周期律作为一种原子间距依次减小的递变规律来观察。
元素周期律递变规律虽然有古老的历史,但今天这一理论对于许多化学反应的研究和新物质的发现仍具有重要的作用,使我们对自然界的规律有了更加清晰的认识。
它不仅帮助我们更好地记忆化学元素,而且也为我们提供了解把握化学因果关系的新思路。
元素周期律(第二课时)金属性递变规律元素周期律(第二课时)金属性递变规律课堂观察研究案例安徽省教育科学研究院夏建华一、教学设计[教学目标]⑴•知识与技能:①.能描述原子的结构异同,知道同主族金属元素原子结构递变规律。
②.通过有关数据和实验事实,了解原子结构与元素性质之间的关系。
认识原子结构相似的一族元素在化学性质上表现出的相似性和递变性。
③.学会用实验现象推测金属性递变规律。
(2).过程与方法:①.通过查找元素周期表发现史,学会运用查阅资料获取信息。
②.通过分析和处理数据得出结论,形成概念,发现规律的思维方法。
③.在元素周期律的教学中,体验科学探究的过程,学习运用以实验为基础的实证研究方法。
④通过交流讨论,培养学生敢于质疑、合作解决问题的意识。
(3).情感态度与价值观:①.在元素周期律的教学中,通过探究规律,体验科学探究的艰辛和喜悦,感受化学世界的奇妙与和谐。
②.设计多种交流和探究活动,在活动中培养严谨求实的科学态度。
[教学重、难点]元素周期表是元素周期律的具体表现形式,是学习化学的重要工具。
元素周期表在第一节已经有详细的介绍,学生已经知道了元素周期表的大体结构,并会用元素周期表查找常见元素的相关知识,但对元素性质及其在周期表中的位置与原子结构的关系还没有更深的理解。
因此,本节教学的主要目的在于帮助学生能够从原子结构的角度进一步认识元素周期律。
教学重点:(1).元素在元素周期表中的位置、原子结构及其性质的递变规律。
(2).元素性质和原子结构的关系。
教学难点:(1).元素在元素周期表中的位置及其性质的递变规律。
(2).元素周期律的涵义和实质,元素性质与原子结构的关系。
[学情分析]学生在初三对原子结构和元素周期表都有初步了解,在必修2第一节中对原子结构和元素周期表又有了一个比较详细的认识。
但在学习中较多是用机械记忆的方法,对知识的理解不够深刻,易遗忘,解决实际问题的能力较低。
本节内容在如何激发学生的学习兴趣,如何引导学生从方法的高度来构建知识体系便成为教学设计的关键。
[教学过程][投影]18世纪中叶至19世纪中叶的一百年间,一系列新元素不断被发现。
关许这些元素的性质,也积累的相当丰富。
但使科学家们不断追寻和探索的,却是这些元素之间的内在联系。
让我们记住一个个令人起敬的名字和他们的发现:1789 年法国拉瓦锡提出四类元素分类法1829 年法国德贝莱纳提出三元素组学说1864 年德国边耶尔发表八兀糸表1865 年英国纽兰兹提出兀素八首律1869 年俄国门捷列夫发现元素周期律[教师]恩格斯给门捷列夫以高度的评价,称他为——化学之父[投影]门捷列夫的第一张元素周期表[活动]请你扮演门捷列夫18张列有元素相关性质的卡片,将其排列顺序[教师]你是依据什么规则来给这18张卡片安排位置的呢?[学生讨论]原子核外电子排布,主要化合价,原子半径[教师]很好,这三个排列原则就是上一节课我们学习的元素周期律的一部分内容[投影]元素周期律原子核外电子排布呈周期性变化原子半径呈周期性变化元素主要化合价呈周期性变化[教师]归根结底,原子结构的周期性变化引起了其他方面的周期性变化,既然原子的结构决定了其在周期表中的位置,那么根据元素在周期表中的位置,能否推测其化学性质的递变呢?[板书]碱金属元素性质递变相似点:都是金属元素,最外层只有一个电子不同点:电子层数递增,原子半径递增[投影]碱金属与水反应Li Na K Rb Cs[教师]上一节课大家做了Na, K与水反应的实验,请两位同学回顾实验现象[学生1]Na与水反应时,浮在水面上,四处浮动,有响声,熔化成光亮的小球。
反应后在溶液中滴加酚酞,溶液变红[学生2]K与水反应时,现象比Na与水反应剧烈许多,K甚至可以变成紫色的火球[教师]非常好,Na与水可以剧烈反应,而K与水的反应比Na还要剧烈,那么,大家能不能推测,Li,Rb,Cs与水的反应剧烈程度如何呢?[活动]学生讨论,选出代表发言[投影]Li,Rb,Cs分别与水反应的实验视频[教师]果然与大家的推测一致,Li与水的反应不剧烈,而Rb,Cs与水反应极其剧烈,这是为什么呢?[学生]原子结构递变引起的化学性质递变[投影]Li Na K Rb Cs半径增大,失电子能力增强,金属性逐渐增强[板书]2Li+2H 2O=2LiOH+H 2T2K+2H 2O=2KOH+H 2?[教师]接下来我们再来讨论同周期金属性质的递变Na Mg Al Si PS Cl Ar[板书]Na Mg Al的金属性[探究]实验一,镁、铝与水的反应分别取一小段镁条和铝带,用砂纸去掉表面的氧化膜,放入两支小试管,加入2ml水,滴入2-3滴酚酞,观察现象。
过一会,分别用酒精灯加热两支试管,至液体沸腾,移开酒精灯,观察现象。
[投影]现象和结论NaMg Al与冷水反应与冷水剧烈反应反应缓慢,产生少量气泡无明显现象滴入酚酞呈红色滴入酚酞不变红与热水反应表面出现较多气泡,溶液无明显现象为浅红色结论Na与冷水剧烈反应,Mg能与沸水反应,Al与沸水难反应金属性Na>Mg>AI[板书]2Na+2H 2O=2NaOH+H 2TMg+2H 2O=Mg(OH) 2+H 2?[投影]实验二,镁、铝与盐酸反应向盛有已除去氧化膜的镁条和铝片的试管中各加入2ml、2mol/L稀盐酸,观察现象[投影]现象和结论MgAl与盐酸反应反应剧烈反映较慢产生大量气体产生少量气泡结论Mg、Al都能与盐酸反应放出气体,Mg比Al剧烈金属性Mg>Al[板书]Mg + 2HCI == MgCl 2 + H z f2AI + 6HCI == 2AICI 3 + 3出匸[投影]实验三AI(OH) 3性质向少量AICI3溶液中加入氨水至产生大量白色沉淀,将沉淀分两份,分别加入3mol/L NaOH溶液和3moI/L稀盐酸[投影]现象和结论力口入NaOH 溶液加入稀盐酸现象沉淀溶解沉淀溶解结论既能与酸反应,又能与碱反应,AI(OH) 3是两性氢氧化物[板书]AICI 3 + 3NH3H2O == AI(OH) 3 ;+ 3NH4CI AI(OH) 3 + NaOH == NaAIO 2 + 2H2O (酸性)AI(OH) 3 + 3HCI == AICI3 + 3H2O(碱性)NaOHMg(OH) 2碱性AI(OH) 3强碱中强碱两性氢氧化物结论元素金属性越强,最高价氧化物水化物碱性越强[教师]根据刚才几组实验,我们[判断出金属性Na>Mg>AI那么,金属性强弱的判断可以用什么规律?[投影]小结:金属性强弱判断依据(1)单质与水或酸反应放出的H2 的难易程度(2)最高价氧化物水化物的碱性强弱[总结]元素金属性与其在周期表中位置关系[课后思考]1、元素非金属性的判断标准2、它与元素在周期表中的位置有何关系?判断金属性强弱还有何依据?[作业]1、钫是人工合成的金属元素,根据它在周期表中的位置,你能推测它的一些性质吗?2、镁与钙都可与水反应生成氢气,镁反应慢,钙反应快,推测Be、Ba与水反应剧烈程度( 合肥一中化学组谢芸)二、教学实录师:上课生:老师好师:在我们学习新的内容之前,请大家跟我一起看一段小资料,我们一起看大屏幕上向我们介绍的这段小文章。
屏幕展示师:从十八世纪中叶到十九世纪中叶这一百年间,一系列新的元素不断的被发现。
科学家们对这些元素的性质掌握的比较完整,但是他们还在追寻这些元素之间的内在的联系。
那么,在这一百年中,涌现出了许多优越的科学家,那我们现在来认识他们,以及记住他们这些比较著名的说法。
生:观看大屏幕师:好,第一位我们比较熟悉的仃89年法国著名化学家拉瓦锡,他提出了四类元素分类法,他把当时发现的元素分为四类。
在其后的1829年, 法国科学家德贝莱那提出了三素族学说。
但是当时只能把十五种元素归纳到三素族学说里面去。
好,紧接着1864年,德国科学家迈耶尔发表了六元素表,但六元素表所能囊括的元素种类还不及当时元素种类的一半。
那么,在其后的186年,英国科学家纽兰茨发表了元素性质的八音律,和我们今天所学的音乐非常象。
但是他的学这100年间,很少有科学家能提出一个完整的规律,能囊括所有元素的性质。
直到1869年,出现了一位俄国科学家,他的名字叫做门捷列夫。
这是门捷列夫当时发表的第一章元素周期表。
屏幕展示生:观看大屏幕师:因为他对化学做出了巨大的贡献,所以恩格斯称他为化学之父。
那么,门捷列夫是如何发现元素之间的规律的呢?他是把所有元素的性质做成小卡片,每天就在玩弄这些小卡片,以找出这些卡片之间的内在的联系。
那么,现在请大家也来扮演门捷列夫。
我们在这个实验台上,每四位同学有一组小卡片,请你们大家相互合作一下,把这十八张卡片按照规律来排一排顺序。
其他同学也可以看一下大屏幕上的这个东西。
大家自己动手,四位同学合作(前后)。
生:排卡片师:来你们两个到这边来生:走上讲台排卡片师:指导学生排卡片师:好,大家排好没有?对照你排出的顺序和黑板这两位同学排出的顺序,看看一样不一样?那么,请这两位男同学告诉我们,你们是按照什么规律把这18个元素卡片排成这样的规则的?好,请你回答。
生:核外电子排布师:核外电子排布有一定的变化规律,还有没有了?生:竖列电子层的递增师:噢,竖列电子层的递增了,横着是最外层电子数增加了,是不是?生:原子半径师:原子半径。
我们看给出的数据,原子半径也呈现出一定的变化规律。
还有没有?生:化合价。
师:好的。
每一纵列的化合价基本上都有相似的规律,横行,你看,正的增加,负的减小。
好的, 请坐。
生:坐下师:那么我们从这个排列的规律上,就可以巩固我们上一节所学习的规律。
我们上一节就学习了元素周期律的前三项内容。
第一项规律,原子的核外电子层排布呈现周期性变化。
由这个周期性变化又导致原子半径从左到右,从上到下,呈现周期性的变化。
从而又进一步影响了元素的主要化合价也呈现出周期性变化。
好,那么,元素原子半径呈现周期性变化,主要化合价呈现周期性变化,归根结底都是由原子结构呈现周期性变化决定的。
我们也学习过这样一句话,结构决定位置,位置决定性质。
原子的结构决定它在周期表中所占有的位置,那么我们这一节课就来学习一下,元素在周期表中的位置关系会不会影响元素的化学性质关系呢?生:听讲,思考师:那么我们首先来看,在元素周期表中,我们分为横行和纵行,我们首先来讨论纵行元素性质的递变。
我们现在抽出左边第一纵行的5种金属:锂、钠、钾、铷、铯屏幕显示生:看大屏幕师:我们来讨论这5种元素,它们的性质有什么递变规律。
好,我们首先从它的原子结构入手。
请大家根据大屏幕上给出的这些信息,找一找这5种原子,它们的原子性质上有哪些相似点,有哪些不同的地方?大家可以相互讨论一下。
元素符号、名称、原子模型都给出来了。