第13章 羧酸衍生物
- 格式:doc
- 大小:1.05 MB
- 文档页数:12
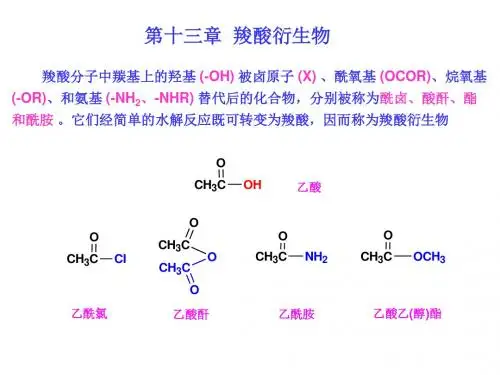




第十三章羧酸衍生物第一节羧酸衍生物的结构和命名一、羧酸衍生物的结构羧酸衍生物在结构上的共同特点是都含有酰基(),酰基与其所连的基团都能形成P-π共轭体系。
二、羧酸衍生物的命名酰卤和酰胺根据酰基称为某酰某。
酸酐的命名是在相应羧酸的名称之后加一"酐"字。
例如:酯的命名是根据形成它的酸和醇称为某酸某酯。
例如:三、羧酸衍生物的光谱性质1.IR:醛、酮、羧酸、酰卤、酸酐、酯和酰胺都含有羰基,因此,在IR都有C=O的强吸收峰。
醛、酮的νC=O 1705~1740cm-1 ,羧酸衍生物的C=O伸缩振动扩大到了1550~1928 cm-1. 这是因为:酸酐:在1800-1860cm-1(强)和1750-1800cm-1(强)区域有两个C=O伸拉振动吸收峰,这两个峰往往相隔60cm-1左右。
对于线形酸酐,高频峰较强于低频峰,而环状酸酐则反之。
另外:C-O的伸拉振动吸收在1045~1310/cm(强)。
酯:酯的C=O伸缩振动稍高于酮,在1735~1750cm-1处,与芳基相连的则降至1715~1730 cm-1 ,酯在1015~1300 cm-1 区域内有两个强的C-O伸缩谱带。
可以与酮相区别。
一级酰胺,-NH2的N-H吸收为两个峰。
二级酰胺N-H为一个尖峰。
2.核磁共振(NMR):酯:RCOOCH δ=3.7~4.1ppm。
酰胺:RCONH δ=5~8ppm。
往往不能给出一个尖锐的峰。
四.羧酸衍生物的亲核取代反应分为加成-消除两步:加成一步取决于电子因素和空间因素。
消除一步取决于L的碱性和稳定性。
L碱性越弱,越容易离去;L 越稳定,越容易离去。
就酰氯、酸酐、酯、酰酐、酰胺而言,L的碱性为:Cl-< R-COO-< R'O-< NH2-;L的稳定性为:Cl->R-COO-> R'O-> NH2-,所以羧酸衍生物的活性为:羧酸的衍生物在碱性或酸性条件下比在中性溶液中更容易水解,这是可以理解的:碱性溶液提供给氢氧根离子,它充当一种强的亲核试剂;酸性溶液提供给氢离子,它接到羰基氧上从而使分子易受弱亲核试剂,即水的进攻。




第十三章 羧酸衍生物1. 说明下列名词:酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂。
答案:酯:是指酸和醇之间脱水后的生成物,它包括无机酸酯和有机酸酯,如硫酸酯,磷酸酯和羧酸酯。
油酯:是指高级脂肪酸与甘油之间形成的酸类化合物,通常称为甘油三酯。
皂化值:是完全水解1克油脂所需的氢氧化钾毫克数。
油脂在碱催化下水解反应称为皂化。
干性:是指空气中会逐渐就有韧性的固态薄膜的油脂。
油的这种结膜牲叫做干性。
干性油通常是由不饱和脂肪酸组成的甘油三酯。
碘值:是指100克不饱和脂肪酸甘油酸通过C=C 键的加成反应所能吸叫的碘的质量(克)。
碘值的大小反映了油脂的不饱和程度的高低,它是油脂分析的一项重要指标。
非离子型洗涤剂:是指一类中性的具有OCH 2CH 2OHn结构单元的即告醚表面活性剂。
最常用的非离子型洗涤剂为C 8H 17OCH 2CH 2OHn2. 试用方程式表示下列化合物的合成路线: (1) 由氯丙烷合成丁酰胺; (2) 由丁酰胺合成丙胺;(3) 由邻氯苯酚、光气、甲胺合成农药“害扑威”答案: (1)CH 3CH 2CH 2Cl CH 3CH 2CH 2CONH 2CH3CH 2CH 2Cl乙醚CH 3CH 2CH 2MgClCH 3CH 2CH 2COOHNH 3CH 3CH 2CH 2COONH 4CH 3CH 2CH 2CONH 2+H 2O(2)CH 3CH 2CH 2CONH 2CH 3CH 2CH 2NH 2CH 3CH 2CH 2CONH 2NaOHCH 3CH 2CH 2CONHNaBr 2CH 3CH 2CH 2CONHBrNaOH-HBrCH 3CH 2CH 2CONCH 3CH 2CH 2NC OH 3O +CH 3CH 2CH 2NH 2(3)COCl 2+CH 3NH 2ClCNHCH 3OClOCONHCH 3Cl OH3.用简单的反应来区别下列各组化合物:答案:CH 3CHCH 2COOH +H 2OCH 3CHCH 2COOCl+H 3O无明显热效应CH 3CH 2CH 2COCl +H 2OCH 3CH 2CH 2COOH +HCl(1)(2)CH 3CH 2CH 2COOC 2H 5+NH 2OH .HClCH 3CH 2CH 2COONHOH+C 2H 5OHCH 3CH 2CH 2COONHOH +FeCl 3C 3CH 2CONHFe3+HCl 3CH 3CH 2CONH 2+NH 2OH .HCl无反应(3)CH 3COOC 2H 5+NaHCO 3无反应CH 3OCH2COOH +NaHCO 3CH 3OCH 2COONa +CO 2(4)CH 3COONH 4+NaOH CH 3COONa +NH 3CH 3CONH 2+NaOH CH 3CONHNa +H 2O(5)(CH 3CO)2O +H 2O 2CH 3COOH放热反应CH3COOC 2H 5+H 2O无反应答案:CH 2+HBr 过氧化物CH 2BrNaCNCH 2CN答案:CH 3COCH 3Mg TiCl 3COH OH3C OH OHCH HCH 3CC(CH 3)3O2,(CH 3)3CCOOH +CHBr 3答案:Mg乙醚(CH 3)2CHBr(CH 3)2CHMgBr 环氧乙烷(CH 3)2CH 2CH 2OMgBrPBr 3(CH 3)2CHCH 2CH 2Br HCCNa +CH 3CH 2CH 2CH 2BrHC CCH 2CH 2CH 2CH 3NaNH 2NaC CCH 2CH 2CH 2CH 3(CH 3)2CHCH 2CH 2Br(CH 3)3HCH 2CH 2CCCH 2CH 2CH 2CH 3H ,Pd-BaSO CCHCH 2CH 2CH 2CH 3H(CH 3)3CHCH 2CH 2答案:CH 2CH(CH 2)8COOHBrCH 2(CH 2)9COOHCH 3COCH 2COOEt2BuLiLiCH 2COCHLiCOOEtBrCH (CH )COOH (1)H 3O +EtOOCCH 2COCH 2CH 2(CH 2)9COOH4EtOOCCH 2CH(CH 2)11COOHOHCH(CH 2)11COOHEtOOCCHH 2,NiEtOOC(CH 2)11COOHEtOOC(CH 2)11COOEt答案:COOHCOOH C 2H 5OOHH COOC 2H 5OHCOOC 2H 5OH 25OCOOC 2H 525OCOOC 2H 525OCOOC 2H 5C 2H 5(1)-H 3OOCOOHC 2H5OC 2H 5答案:CH 2(COOC 2H 5)22C 2H 5ONaNaCH 2(COOC 2H 5)22BrC 2H 5BrCH 2CH(COOC 2H 5)2CH 2CH(COOC 2H 5)2C 2H 5ONa2CHC(COOC 2H 5)2CH 2C(COOC 2H 5)2BrC 2H 5BrCOOC 2H 5CC COOC 2H 5OOH 5C 2OH 5C 2O(1)-H 3O COOHCOOH答案:CH3CH3KMnO4COOHCOOHLiAlH4CH2OHCH2OH PBr3CH2BrCH2BrCH2CNCH2CNHClC2H5OHCH2COOC2H5CH2COOC2H5C H ONaOCOOC2H5O(1)OHH3O+(2)答案:OHHOClSO3HOHHOHO3S SO3HHNO324OHHOHO3S SO3HNO23+OHHONO2答案:+CH 3+OOO3CH 3COOH多聚磷酸CH 3OONaBH 4CH 3HOOHCH 3答案:3O答案:++OOOAlCl 3OCOOH多聚磷酸OMgBrOMgBr15.某化合物A 的熔点为85°C,MS 分子离子峰在480m/e,A 不含卤素、氮和硫。
第13章 羧酸衍生物§13.1 命名、结构及其物理性质13.1.1 羧酸衍生物的命名和结构 1、羧酸衍生物的定义羧基中的羟基被其他原子或基团(卤素-X 、酰氧基RCOO —(羧酸根)、烷氧基-OR ’、氨基-NH 2)取代后的生成物它们都含酰基R -C =O ,统称酰基化合物。
而羧酸衍生物指那些经水解能转变成羧酸的化合物。
2、羧酸衍生物的结构和分类R C OX R C OO C OR R C OO R R C ONH 2(R) R C N 酰卤 酸酐 酯 酰胺 腈酰基中羰基碳原子为sp 2杂化,具有平面结构,未参与杂化的p 轨道与氧原子p 轨道重叠形成π键。
与酰基直接相连的杂原子(X 、O 、N )上都具有未共用电子对,它们所占据的p 轨道与羰基的π轨道形成p-π共轭体系,未共用电子对向羰基离域,使C-L 键具有部分双键的性质。
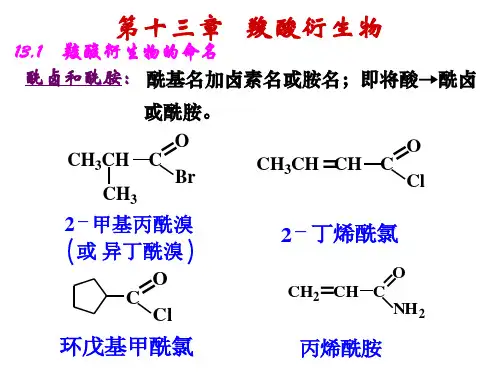
3、命名 (1)酰卤在命名时可作为酰基的卤化物,在酰基后加卤素的名称即可。
如:(2)酸酐由两个羧酸的名称加上“酐”字来命名。
相同羧酸形成的酸酐称为单酐;不同羧酸形成的酸酐称为混酐。
混酐命名时,通常简单的羧酸写在前面,复杂的羧酸写在后面。
如:CH 3COCH 3C OO CH 3CO CH 3COCH 2O CC OO 乙酸酐 乙丙酸酐邻苯二甲酸酐(3)酯a )一元醇酯由相应的羧酸和醇中的烃基名称组合后加“酯”字来命名,酸的部分包括酰基C 原子。
如:b )多元醇酯由先写醇名后面接酸名,最后加酯。
如:c )分子中含有―CO―O―结构的环状化合物称为内酯,内酯需标明羟基的位次。
如:(4)酰胺a )命名时把羧酸名称放在前面将相应的酸字改为酰胺即可;b )由酰基和胺或某胺组成。
若氮原子上连有取代基,在取代基名称前加“N”标记,表示该取代基连在氮原子上;c )分子中含有―CO―NH―结构的环状化合物称为内酰胺。
CH 3CONHCO N (CH 3)2NO 2NCH 3O 乙酰苯胺 N,N —二甲基—3—硝基苯甲酰胺 N —甲基—5—己内酰胺 CH 3(5)腈a )命名时要把CN 中的碳原子计算在内,并从此碳原子开始编号,根据腈分子中所含碳原子的数称为某腈;b)或以烃作为母体,氰基作为取代基,此时氰基碳原子不计在内。
13.1.2 羧酸衍生物的物理性质 1、物态✧ 低级的酰卤和酸酐是具有刺激性气味的无色液体; ✧ 低级的酯则是具有芳香气味的易挥发性无色液体;✧ 酰胺除甲酰胺和某些N-取代酰胺外,由于分子内形成氢键,均是固体; ✧ 低级腈为液体,高级腈为固体。
2、沸点:酰胺>羧酸>酸酐>酯>酰氯✧ 酰卤、酸酐和酯分子中无氢,不能形成分子间氢键,所以沸点较相近分子量的酸低;与分子量相近的醛酮大体相近;✧ 酰胺的熔点和沸点均比相应的羧酸高。
当酰胺氮原子上的氢原子被烃基取代后,分子间不能形成氢键,熔点和沸点都降低;✧ 一般情况下,酰氯和酯的熔点比较低,酰胺的熔点较高,不同的酸酐的熔点变化是较大的。
✧ 腈是较强的极性化合物,其沸点比相对分子质量相近的烃、醚、醛、酮和胺的沸点高,与醇相近,但比羧酸的沸点低。
3、溶解性✧ 酰氯和酸酐不溶于水,低级的遇水分解;✧ 低级的酰胺(如N,N-二甲基甲酰胺)能与水混溶,是优良的非质子极性溶剂。
随着相对分子质量增大,在水中溶解度逐渐降低✧ 低级腈易溶于水,随着碳原子数的增加,在水中溶解度降低。
例如,乙腈与水混溶,丁腈以上难溶于水。
✧ 所有羧酸衍生物均能溶于乙醚、氯仿、丙酮、苯等有机溶剂。
§13.2 羧酸衍生物的化学性质13.2.1 亲核取代反应 1、反应机理羧酸的亲核取代反应实际上是按加成——消去(nucleophilic addition-elimination )机理进行的,亲核试剂先对酰基进行亲核加成,然后再脱去一基团完成反应。
R C LO δ-δ+2、影响反应速度的因素分析(电子效应和空间效应)a )反应生成四面体中间体的步骤是关键,酰基碳的正电性越大,立体障碍越小,越有利于加成;b )离去基团(:L —)的碱性越弱,离去能力越强,越有利于消除。
(1)电子效应①R 和L 的-I 越大,双键碳的正电性越强,增加反应活性; ②L 的+C 越大,双键碳的正电性越弱,减小反应活性;③离去基团(L —)碱性越弱,越容易离去。
L 的碱性为: Cl -<R-COO -<HO —<R’O -<NH 2----2-⇨ 亲核取代的活性:亲核加成反应使酰基碳原子由sp 2杂化变成杂化sp 3,平面三角形结构转变为四面体结构。
如果羰基碳原子连接的基团过于庞大,形成的四面体结构空间拥挤,体系能量升高,反应活性降低。
例如:2,4,6-三甲基苯甲酸乙酯按一般酸碱催化水解是不行的。
须将羧酸先溶于浓H 2SO 4,使其⇨亲核试剂碱性: NH3>ROH ,H 2O >RCOOH >HCl 、水解反应——【反应机理】以酯的水解为例:同位素实验证明:大多数2o和 1o醇的羧酸酯水解发生酰氧键断裂;3o 醇的羧酸酯的水解发生烷氧键断裂。
A 、酸催化水解B 、碱催化水解C 、3o醇的羧酸酯水解:SN 1机制4、醇解反应——酰氯、酸酐和酯都能进行醇解,生成酯。
酰胺却难于醇解。
(1)酰氯的醇解反应(用于通过酰氯制备酯)R'OHRC OOR'RC OCl+Et 3N or 吡啶Et 3NHClNH Cl or• 碱的作用:吸收产生的 HCl 和催化。
(2)酸酐的醇解反应(合成上用于制备酯)(3)酯的醇解反应(酯交换反应)反应可逆,用过量的醇 R ”OH 和除去生成的醇 R ’OH 使反应进行完全。
∙ 酸或碱对反应是必需的;∙ 反应机理?(参考酯的水解机理)。
(4)酰胺的醇解反应NHR'的离去能力比OR'差)合成上意义不大(合成酯类化合物的方法有更好的方法)**反应相对不易进行(因为羧酸衍生物的醇解反应的意义①由羧酸与醇反应难以制备的酯(酚酯和叔醇酯都不能用羧酸与酚或叔醇直接合成),可用活性较大的酰氯或酸酐与醇反应制取。
②酸酐比酰卤易于制备和保存,应用更广泛。
例如乙酐与水杨酸作用生成乙酰水杨酸。
③酯交换反应(transesterification)在有机合成上用途很广,常用来由价廉的酯、醇生产其他的酯、醇。
、氨解反应——反应的伯或仲胺的碱性比离去的胺碱性强并且过量的情况下,才能得到N-烷基酰 胺。
叔胺不能与酰胺发生氨解反应。
(1)酰氯的胺(氨)解(2)酸酐的胺(氨)解• 酰卤和酸酐与氨反应活性高,得到酰胺和铵盐。
• 酰氯和酸酐的胺解是制备酰胺的主要方法 (3)酯的胺(氨)解:无水、过量氨(4)酰胺的胺解——胺的交换,合成上意义不大应用:NBS 合成丁二酰亚胺与溴作用生成N -溴代丁二酰亚胺(NBS ),是一重要的溴代试剂,常用于烯烃的α、与R ’MgX 反应酰卤、酸酐、酯和腈都可与R ’MgX 反应生成3°醇。
酰氯、酸酐 取代 酮 3°醇 、酯(1)酰卤与R ’MgX 反应 低T 、R’MgX 不过量 控制反应停留在酮CH 3(CH 2)2CH 2MgBrCH 3 C BrCH 3C Br OCH 3 C CH 2(CH 2)2CH 3O(C 2H 5)2 OOMgBr CH 2(CH 2)2CH 3-BrMgBrCH 3(CH 2)2CH 2MgBr-H 2OCH 3 C CH 2(CH 2)2CH 3OHCH 2(CH 2)2CH 3(2)酸酐和酯与R ’MgX 反应CH 3CH 2CH 2CH 2MgBr + H C OC 2H 5OO+ 2 CH 3CH 2MgClEt 2O+CH 3CH 2 C CH 2CH 2CH 2CH 2OHOHCH 2CH 3OEt 2OH O +CH 3CH 2CH2CH 2CHCH 2CH 2CH 2CH 3OHC O CO O+ 2 CH 3MgI Et 2O+C CH 3OH CH 3由于酮分子中的羰基比酸酐和酯分子中的羰基活性高,生成的酮会继续与Grignard 试剂反应生成叔醇,但甲酸酯则生成一个对称的2°醇。
(3)酰胺与R ’MgX 反应酰胺与Grignard 试剂的反应在有机合成上应用较少,含活泼氢的酰胺还有分解Grignard 试剂的性质。
7、与 R 2Cd 、R 2CuLi (不活泼金属试剂)反应13.2.2 还原反应 1、催化氢化说明羧酸衍生物的活性比羧酸高,可以被催化加氢还原,分子内有其它对催化加氢敏感的基团也同时被还原。
◆ Rosenmund 还原——酰氯 醛 催化剂:Pd/BaSO 4,S ,喹啉2、Stephen 还原3、金属氢化物还原——LiAlH 4还原4还原。
还原反应的实质是LiAlH 4分子中的H —离子对羰基的加成反应。
采用LiAlH 4还原,反应不能停留在醛酮,会直接还原到醇,但分子中的双键、叁键保留,不会被还原。
R C L [ R C L ]4AlLi R C H RCH 2OH _OO O -_____HLiAlH 44- 1. LiAlH 42. H 3O( L = -Cl , -OR', -OOCR' )(1)酰卤、酸酐和酯⇒1°醇R C X RCH 2OH + HXR C O C R + LiAlH 4 RCH 2OH + HOCH 2R'R C OR' RCH 2OH + HOR'________O O O O 3+2(2)酰胺⇒需过量的LiAlH 4⇒产物可以是不同类型的胺R C NH 2RCH 2NH2R C NHR' + LiAlH 4 RCH 2NHR'R C NR 2 RCH 2NR 2______O O O 3+Et 2O ''(3)腈的还原⇒1°胺4、酯的金属钠-醇还原⇒两分子醇(一分子来自酯中酸的部分,另一分子来自酯中醇的部分)——鲍维特--勃朗克还原(Bouveault -Blanc 还原)RCOOR 1RCH 2OH + R 1OH Na-无水乙醇【反应机理】RCOR'O NaCO -Na +OR'Na-Na +RC -Na +O R OR'R''OHCHO R OR'O+ RO -RCH 2OH13.2.3 羧酸衍生物上α-H 的反应(Claisen 缩合反应) 1、Claisen 缩合反应 具有α-H 的酯,在醇钠作用下能发生类似醇醛缩合反应。
即一分子酯的α-H 被另一分子酯的酰基取代生成酮酸酯,称为酯缩合反应或 Claisen 缩合反应。
_ORCH 22H 5 + H CHC OC 2H 5 RCH 2C CHC OC 2H 5 + C 2H 5OH O ___252. H 3O+_O O CH 3C OC 2H 5 + CH 3C OC 2H CH 3C CH 2 C OC 2H 5 + C 2H 5OH1. C 2H 5ONa+_____O O O O R R两种均含α-H 的酯进行酯缩合时,可有4种产物,无实用价值。