植物生理学实验--组织逆境伤害程度测定
- 格式:ppt
- 大小:2.53 MB
- 文档页数:15

逆境对植物组织的伤害实验报告逆境对植物组织的伤害实验报告引言:植物作为生物界的重要组成部分,面临着各种逆境的挑战,如干旱、高温、寒冷等。
这些逆境条件对植物的生长和发育产生了不可忽视的影响。
本实验旨在研究逆境对植物组织的伤害程度,并探讨植物在逆境环境下的适应机制。
实验设计:为了模拟逆境环境,我们选择了盐胁迫和低温胁迫两种常见的逆境条件。
实验使用拟南芥(Arabidopsis thaliana)作为研究对象,分别将拟南芥种子分成两组,一组置于含有高浓度盐溶液中,另一组则置于低温环境中。
同时,还设置了对照组,将种子置于正常生长条件下。
实验结果:经过一段时间的处理,我们观察到逆境条件对植物组织产生了明显的伤害。
在盐胁迫组中,拟南芥的根系生长受到了抑制,根长和根毛数量明显减少。
叶片也出现了黄化和枯萎的现象。
而在低温胁迫组中,拟南芥的生长速度明显减缓,叶片呈现出紫色或红色,叶片边缘出现冻伤的迹象。
讨论:逆境条件下,植物组织受到伤害的原因主要是由于逆境条件导致植物细胞内外环境的紊乱。
在盐胁迫条件下,高浓度盐溶液会破坏细胞膜的完整性,导致水分和营养物质的流失,进而影响植物的正常生长。
在低温胁迫条件下,低温会引起细胞内的冻结现象,破坏细胞膜结构,导致细胞失去正常的功能。
然而,植物在面对逆境条件时也会采取一系列的适应机制来减轻伤害并保持生存。
在盐胁迫条件下,植物会积累特定的溶质物质,如脯氨酸和脯氨酸衍生物,以调节细胞内的渗透压,维持细胞内外的水分平衡。
同时,植物还会通过增加抗氧化酶的活性来清除过量的活性氧自由基,减轻氧化损伤。
在低温胁迫条件下,植物会合成特定的抗冻蛋白,如冷凝素,以增强细胞膜的稳定性,并防止细胞内的冻结。
结论:本实验结果表明,逆境条件对植物组织造成了明显的伤害,但植物也能通过一系列的适应机制来减轻伤害并保持生存。
进一步研究逆境适应机制对于揭示植物的抗逆性和生存策略具有重要意义。
未来的研究可以进一步探索逆境信号传导途径和相关基因的功能,以期为植物逆境抗性的改良提供理论依据和技术支持。


实验五逆境对植物组织的伤害—电导率法检测植物细胞质膜透性和愈创木酚法测定过氧化物酶活性一、实验目的:1.了解研究植物抗逆生理的实验方法,学会使用DDS-11A型电导率仪,掌握绝对电导率和相对电导率的概念;2.熟悉植物组织过氧化物酶活性的测定方法,学会分光光度计的“动力学”测量程序二、实验原理:(P78和P97)三、实验材料:绿豆幼苗四、实验步骤:1.材料处理:10株幼苗为一组分别置于45℃(纯水最好预热至该温度)和室温中(在上课之前请先处理好材料,以课堂小组为单位)。
2.电导率的测定:2h后小心取出幼苗,冷却至室温后测定浸出液和纯水的电导率。
(不必测材料煮沸后的电导率)3.过氧化物酶(POD)活性测定P973.1POD的提取:材料1g,加入KH2PO4冰浴研磨成匀浆,低温4000rpm离心15min,收集上清液,定容至25mL,低温保存3.2POD的测定:先在分光光度计的“动力学”或“时间扫描”程序上设置好参数取比色杯2个,1个将对照液放入参比杯按照程序调零,另一个比色杯拉出加入20μL酶液,再加入1mL KH2PO4 ,最后加入3mL反应混合液,立即测量。
❖723G型分光光度计“动力学”测定❖【3按“按“按“ENT”后,出现:测量出图谱后,按“ESC”返回到界面:按“3”进入活性测量功能,出现如下界面:按“SET”进行具体设置,按“ENT”可得出相应值。
按“4”进入图谱处理功能,出现如下界面:其中按“1”可见原始图谱,按“2”可进行峰谷检测,按“3”通过横纵坐标的缩放可达到图谱缩放功能,方便观察图谱。
按“4”具有具体的实验查询功能。
思考题1.电导率的测定主要有哪些影响因素?2.相对电导率和绝对电导率的概念?3.请说出电导率和电导度的概念区别。
4.温度和CO2会影响电导度的测定结果吗?在操作中应注意什么?5.影响酶提取、纯化和活性测定的因素有哪些?6.测定时酶活性的测定应当定在什么时间范围内?测定植物组织过氧化物酶活性的意义与用途。

植物组织逆境伤害程度的测定实验37 植物组织逆境伤害程度的测定——电导法【原理】植物组织受到逆境伤害时,由于膜的功能受损或结构破坏,而使其透性增大,细胞内各种水溶性物质包括电解质将有不同程度的外渗,将植物组织浸入无离子水中,水的电导将因电解质的外渗而加大,伤害愈重,外渗愈多,电导度的增加也愈大。
故可用电导仪测定外液的电导度增加值而得知伤害程度。
【仪器与用具】电导率仪1台;真空泵(附真空干燥器)一套;恒温水浴1具;水浴试管架1个;20ml具塞刻度试管10支;打孔器1套(或双面刀片1片);10ml移液管(或定量加液器)1个;试管架1个;铝锅1个;电炉1个;镊子1把;剪刀1把;搪瓷盘1个;记号笔1支;去离子水适量;滤纸适量;塑料纱网(约3cm2)6片。
【方法】1.容器的洗涤电导法对水和容器的洁净度要求严格,水的电导值要求为1~2μS (微西门子);所用容器必须彻底清洗,再用去离子水冲净,倒置于洗净而垫有洁净滤纸的搪瓷盘中备用。
为了检查试管是否洁净,可向试管中加入电导值在1~2μS的新制去离子水,用电导仪测定是否仍维持原电导。
2.试验材料的处理分别在正常生长和逆境胁迫的植株上取同一叶位的功能叶若干片。
若没有逆境胁迫的植株,可取正常生长的叶片若干片,分成两份,用纱布擦净表面灰尘。
将其中一份放在﹣20℃左右的温度下冷冻20min (或置40℃左右的恒温箱中处理30min)进行逆境胁迫处理。
另一份裹入潮湿的纱布中放置在室温下作对照。
3.测定(1)将处理组叶片与对照组叶片用去离子水冲洗两次,再用洁净滤纸吸净表面水分。
用6~8mm的打孔器避开主脉打取叶圆片(或切割成大小一致的叶块),每组叶片打取叶圆片30片,分装在三支洁净的刻度试管中,每管放10片。
(2)在装有叶片的各管中加入10ml的去离子水,并将大于试管口径的塑料纱网放入试管距离液面1cm处,以防止叶圆片在抽气时翻出试管。
然后将试管放入真空干燥箱中用真空泵抽气20min(也可直接将叶圆片放入注射器内,吸取10ml的去离子水,堵住注射器口进行抽气)以抽出细胞间隙的空气,当缓缓放入空气时,水即渗入细胞间隙,叶片变成透明状,沉入水下。

实验报告课程名称:植物生理学及实验实验类型:探索、综合或验证实验项目名称:利用电导法监测不良环境对植物的伤害一、实验目的和要求掌握生物膜受损程度的测定方法,了解生物膜受损原理。
二、实验内容和原理原理:不良环境条件(高温、低温、干旱等)可导致植物细胞膜受到伤害,使膜的透性增大,细胞内的盐类和小分子有机物外渗。
外渗量可反映植物细胞膜受到伤害的程度。
因外渗物中含有大量离子,就可用电导法检测植物细胞膜受到伤害。
三、主要仪器设备实验材料:云南黄素馨枝条主要仪器:烧杯、剪刀、量筒、镊子、注射器、电导仪等。
四、操作方法与实验步骤1.准备实验用具:确保所有用具(烧杯、剪刀、量筒、镊子等)洁净干燥。
2.准备实验材料,做好相应处理:3.对照——新鲜植物样;4.处理——根据需要进行,本次-4℃冰冻24 h。
5.方法:称云南黄素馨枝条(1.00g),清洗后,剪成约0.5cm小段,放入50mL注射器。
加去离子水30mL,反复抽压至材料完全下沉;倒去水分,去离子水冲洗3次;再加30mL去离子水在30 ℃恒温置30min后,测电导率。
记号笔液面刻度做记号,煮沸2min,冷却到室温,并补加去离子水到原体积,测电导率。
注:小括号内为所测时显示温度相对电导率(%)=煮前电导率/煮后电导率×100对照相对电导率(%)=33.6/151×100=22.25(%)处理相对电导率(%)=83.5/249.3×100=33.49(%)伤害程度= 处理相对电导率/对照相对电导率= 33.49/22.25=1.505六、实验结果与分析处理经过-4℃冰冻处理后膜的透性增大,细胞内的盐类和小分子有机物外渗,使得电导率大于对照。
而经过煮沸后(高温),同样有物质外渗,对照和处理的电导率都大大增加。
处理的相对电导率大于对照。
伤害程度1.505可以大致反映植物材料的相对受害程度。
七、讨论、心得1.从测定结果分析冻害对生物膜的影响①冻害会使生物膜的透性变大(从富有柔性的液态晶转化为固性的凝胶态),膜相发生改变。

逆境生理指标的测定要求:选三个指标一、植物组织中超氧物歧化酶活性的测定催化下列反应: 2 +2H + → H 2O 2 + O 2 反应产物H 2O 2可被过氧化氢酶进一步分解或被过氧化物酶利用。
因此SOD 有保护生物体免受活性氧伤害的能力。
已知此酶活力与植物抗逆性及衰老有密切关系,故成为植物逆境生理学的重要研究对象。
原理本实验依据超氧化物歧化酶抑制氮蓝四唑(NBT )在光下的还原作用来确定酶活性大小。
在有可被氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生 , 可将氮蓝四唑还原为蓝色的化合物,蓝色化合物在560nm 处有最大吸收,而SOD 可清除 从而抑制了蓝色化合物的形成。
因此光还原反应后,反应液蓝色愈深说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
试剂0.05mol/L 磷酸缓冲液(pH7.8);130mmol/L 甲硫氨酸(Met )溶液:称1.9399g Met 用磷酸缓冲液定容至100ml ;750μmol/L 氮蓝四唑溶液:称取0.06133g NBT 用磷酸缓冲液定容至100ml 避光保存; 100μmol/L EDTA-Na 2溶液:取0.03721g EDTA -Na 2用磷酸缓冲液定容至100ml ;20μmol/L 核黄素溶液:取0.00753g 核黄素用磷酸缓冲液定容至1000ml 避光保存(当天配制)。
方法1、酶液提取 取一定部位的植物叶片(视需要定,去叶脉)0.5g 于预冷的研钵中,加1ml 磷酸缓冲液在冰浴下研磨成浆,加缓冲液使终体积为5ml 。
取2~3ml 于10000rpm 下离心10分钟,上清液即为SOD 粗提液。
2、显色反应 取5ml 试管(或指形管,要求透明度好)7支,3支试管为测定管,另4支为对照管,按表1加入各溶液。
混匀后将1支对照管置暗处,其他各管置于4000lx 日光灯下反应20min (要求各管受光情况一致,反应室的温度高时反应时间可以缩短,温度低时反应时间可适当延长(温度范围30~37℃)。

一、实验目的通过本实验,了解植物在逆境条件下的生理反应和适应机制,探究不同逆境对植物生长的影响,以及植物如何通过生理和形态上的变化来适应逆境环境。
二、实验原理植物在逆境条件下,如干旱、盐害、低温等,会经历一系列的生理和形态变化。
这些变化包括细胞膜透性增加、渗透调节物质积累、光合作用减弱、呼吸作用变化等。
通过观察和分析这些变化,可以了解植物逆境生理的机制。
三、实验材料与方法1. 实验材料选用小麦(Triticum aestivum L.)作为实验材料,分为对照组和实验组。
2. 实验方法(1)干旱处理:将实验组小麦置于干旱条件下,对照组小麦正常浇水。
(2)盐害处理:将实验组小麦置于盐浓度分别为0、50、100、150、200 mmol/L的盐溶液中,对照组小麦正常浇水。
(3)低温处理:将实验组小麦置于4℃低温条件下,对照组小麦正常生长。
(4)生理指标测定①细胞膜透性:采用电导率法测定细胞膜透性。
②渗透调节物质含量:采用比色法测定脯氨酸和可溶性糖含量。
③光合作用强度:采用光合仪测定光合有效辐射(PAR)和光合速率。
④呼吸作用强度:采用氧气消耗法测定呼吸速率。
⑤形态指标:观察植物叶片的萎蔫程度、叶片颜色变化等。
四、实验结果与分析1. 干旱处理实验结果显示,随着干旱时间的延长,实验组小麦的细胞膜透性逐渐升高,渗透调节物质含量增加,光合作用强度降低,呼吸作用强度先升高后降低。
与对照组相比,实验组小麦的叶片萎蔫程度明显加重,叶片颜色变黄。
2. 盐害处理实验结果显示,随着盐浓度的增加,实验组小麦的细胞膜透性逐渐升高,渗透调节物质含量增加,光合作用强度降低,呼吸作用强度先升高后降低。
与对照组相比,实验组小麦的叶片萎蔫程度和叶片颜色变化均随盐浓度增加而加重。
3. 低温处理实验结果显示,实验组小麦在低温条件下,细胞膜透性升高,渗透调节物质含量增加,光合作用强度降低,呼吸作用强度降低。
与对照组相比,实验组小麦的叶片萎蔫程度明显加重,叶片颜色变紫。

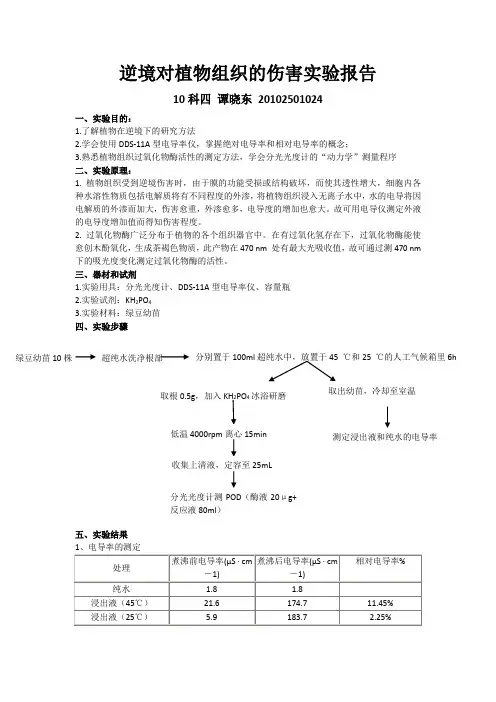
逆境对植物组织的伤害实验报告10科四 谭晓东 20102501024一、实验目的:1.了解植物在逆境下的研究方法2.学会使用DDS-11A 型电导率仪,掌握绝对电导率和相对电导率的概念;3.熟悉植物组织过氧化物酶活性的测定方法,学会分光光度计的“动力学”测量程序 二、实验原理:1. 植物组织受到逆境伤害时,由于膜的功能受损或结构破坏,而使其透性增大,细胞内各种水溶性物质包括电解质将有不同程度的外渗,将植物组织浸入无离子水中,水的电导将因电解质的外渗而加大,伤害愈重,外渗愈多,电导度的增加也愈大。
故可用电导仪测定外液的电导度增加值而得知伤害程度。
2. 过氧化物酶广泛分布于植物的各个组织器官中。
在有过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,此产物在470 nm 处有最大光吸收值,故可通过测470 nm 下的吸光度变化测定过氧化物酶的活性。
三、器材和试剂1.实验用具:分光光度计、DDS-11A 型电导率仪、容量瓶2.实验试剂:KH 2PO 43.实验材料:绿豆幼苗 四、实验步骤五、实验结果 绿豆幼苗10株 超纯水洗净根部分别置于100ml 超纯水中,放置于45 ℃和25 ℃的人工气候箱里6h 取根0.5g ,加入KH 2PO 4冰浴研磨取出幼苗,冷却至室温 测定浸出液和纯水的电导率 低温4000rpm 离心15min 收集上清液,定容至25mL 分光光度计测POD (酶液20μg+反应液80ml )25℃处理下绿豆根尖吸光值 45℃处理下绿豆根尖吸光值25℃处理下绿豆叶(200µL )吸光值45℃处理下绿豆叶(200µL )吸光值六、分析与讨论1、电导率法检测植物细胞质膜透性植物细胞膜起调节控制细胞内外物质交换的作用,它的选择透性是其最重要的功能之一。
膜结构破坏的程度与逆境的强度、持续的时间、作物品种的抗性等因素有关。
当植物受到逆境影响时,如高温或低温,干旱、盐渍、病原菌侵染后,细胞膜遭到破坏,膜的透性增加,选择透性丧失,细胞内部分电解质外渗,其中包括盐类、有机酸等,这些物质进入环境介质中,如果环境介质是蒸馏水,那么这些物质的外渗会使蒸馏水的导电性增加,将植物组织浸入去离子水中,水的电导将因电解质的外渗而加大,伤害愈重,外渗愈多,电导率愈大。


(完整版)逆境生理指标的测定逆境生理指标的测定要求:选三个指标一、植物组织中超氧物歧化酶活性的测定催化下列反应:2 +2H + → H 2O 2 + O 2 反应产物H 2O 2可被过氧化氢酶进一步分解或被过氧化物酶利用。
因此SOD 有保护生物体免受活性氧伤害的能力。
已知此酶活力与植物抗逆性及衰老有密切关系,故成为植物逆境生理学的重要研究对象。
原理本实验依据超氧化物歧化酶抑制氮蓝四唑(NBT )在光下的还原作用来确定酶活性大小。
在有可被氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生,可将氮蓝四唑还原为蓝色的化合物,蓝色化合物在560nm 处有最大吸收,而SOD 可清除从而抑制了蓝色化合物的形成。
因此光还原反应后,反应液蓝色愈深说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
试剂0.05mol/L 磷酸缓冲液(pH7.8);130mmol/L 甲硫氨酸(Met )溶液:称1.9399g Met 用磷酸缓冲液定容至100ml ;750μmol/L 氮蓝四唑溶液:称取0.06133g NBT 用磷酸缓冲液定容至100ml 避光保存;100μmol/L EDTA-Na 2溶液:取0.03721g EDTA -Na 2用磷酸缓冲液定容至100ml ;20μmol/L 核黄素溶液:取0.00753g 核黄素用磷酸缓冲液定容至1000ml 避光保存(当天配制)。
方法1、酶液提取取一定部位的植物叶片(视需要定,去叶脉)0.5g 于预冷的研钵中,加1ml 磷酸缓冲液在冰浴下研磨成浆,加缓冲液使终体积为5ml 。
取2~3ml 于10000rpm 下离心10分钟,上清液即为SOD 粗提液。
2、显色反应取5ml 试管(或指形管,要求透明度好)7支,3支试管为测定管,另4支为对照管,按表1加入各溶液。
混匀后将1支对照管置暗处,其他各管置于4000lx 日光灯下反应20min (要求各管受光情况一致,反应室的温度高时反应时间可以缩短,温度低时反应时间可适当延长(温度范围30~37℃)。
逆境对植物组织的伤害实验报告逆境对植物组织的伤害实验报告植物是生命力顽强的生物,它们能够适应各种环境条件并生长繁衍。
然而,当植物遭受逆境时,如极端温度、干旱、盐碱土壤等,它们的生长和发育可能会受到严重的伤害。
为了进一步了解逆境对植物组织的影响,我们进行了一系列实验。
实验一:极端温度对植物叶片组织的伤害我们选择了常见的一种室内观赏植物,龙舌兰(Sansevieria)。
将龙舌兰分成两组,一组置于常温下(25摄氏度),另一组置于高温环境中(40摄氏度)。
经过一周的观察,我们发现高温组的龙舌兰叶片出现了明显的干枯和褪色现象,而常温组的叶片保持了正常的绿色和饱满的水分。
进一步的组织切片观察显示,高温组的叶片细胞出现了明显的变形和变色,叶肉组织的细胞壁也出现了破裂现象。
这表明,极端温度对植物叶片组织的伤害主要是通过破坏细胞结构和细胞壁的完整性来实现的。
实验二:干旱对植物根系组织的伤害为了研究干旱对植物根系的影响,我们选择了小麦(Triticum aestivum)作为实验材料。
将小麦分成两组,一组正常浇水,另一组停止浇水。
经过一段时间的观察,我们发现停止浇水组的小麦根系出现了明显的干瘪和凋谢,而正常浇水组的根系仍然保持了饱满的状态。
进一步的根系切片观察显示,停止浇水组的根毛数量明显减少,根尖细胞也出现了明显的变形和死亡。
这表明,干旱对植物根系组织的伤害主要是通过破坏根毛和根尖细胞的正常结构和功能来实现的。
实验三:盐碱土壤对植物叶片组织的伤害为了研究盐碱土壤对植物叶片的影响,我们选择了番茄(Solanum lycopersicum)作为实验材料。
将番茄分成两组,一组种植在正常土壤中,另一组种植在盐碱土壤中。
经过一段时间的观察,我们发现种植在盐碱土壤中的番茄叶片出现了明显的黄化和萎缩现象,而种植在正常土壤中的番茄叶片保持了正常的绿色和饱满的水分。
进一步的叶片切片观察显示,盐碱土壤组的番茄叶片细胞壁出现了破裂和变形,叶肉组织的细胞液也出现了明显的浓缩。
设计实验不同植物材料抗逆性比较逆境条件下,植物会受到不同程度的伤害,如:蛋白质变性、膜损伤。
但是、植物也可以通过本身的代谢变化,如:吸水力降低、蒸腾减弱、光合下降、呼吸增高或降低、激素改变、保护性酶增多、渗透物质(可溶性糖、脯氨酸)增加等来适应逆境。
农业生产上,可通过选育高抗品种、逆境锻炼、化学诱导和农业措施提高植物的抗逆性。
本组综合实验采用不同品种或对植物进行化学诱导和锻炼的方式研究逆境条件下的生理生化变化,为逆境生理研究打下基础,并培养综合分析能力和科研能力。
[研究方案]一、研究题目1、不同品种抗逆性生理指标比较2、几种外源物质浸种对种子萌发、幼苗生长和抗性的影响3、生长调节剂处理对植物抗逆性生理指标的影响4、逆境(低温、高温、干旱等)预处理对植物抗逆性的效应可在上述几个大题目下具体确定小题目。
二、实验材料准备实验材料主要采用幼芽和幼苗。
可用培养皿和瓷盘培养发芽材料1~2周。
三、实验内容根据不同研究题目,可在以下测定项目中选择:1、生长测量:芽长、根长、根数、地上部鲜重、地下部鲜重。
2、生理生化指标测定:植物抗逆性的鉴定(电导仪法);丙二醛含量的测定;脯氨酸含量的测定(酸性茚三酮法);过氧化氢酶活性测定(高锰酸钾滴定法);超氧物歧化酶活性测定(NBT还原法);植物蒸腾速率的测定(快速称重法);叶绿体色素的定量测定(分光光度法);植物体内可溶性糖的测定,(蒽酮法);植物组织中游离氨基酸总量的测定,(茚三酮显色法);植物组织中可溶性蛋白含量的测定(考马斯亮蓝G-250染色法)。
各研究题目的生理生化指标测定,根据教学安排和研究内容选做3~4个。
[实验安排]自由组合小组,选出组长,由组长安排实验材料和重复。
9~12学时、分3~4次进行。
[数据处理和结果统计]一、数据记录实验中要及时记载原始数据,以便计算和核对。
每个研究题目应设计专门的记录表。
二、结果统计通过实验获取的原始数据要及时照各实验方法计算出结果,并将结果统一列于结果统计表中,每个研究题目应设计专门的结果统计表,便于分析与比较。
《植物生理学实验》教学大纲课程名称:植物生理学实验实验学时:32学分:1学分适应专业:本科生物科学专业一、实验的地位、目的植物生理学实验是生物科学本科专业重要的专业基础课和必修课,独立设置课程,单独考核。
通过做实验加深学生对植物生理学基础理论的理解,掌握植物生理学研究中一些基本的实验方法和实验技术,更重要的是训练同学们操作技能,锻炼学生的动手能力,培养学生的观察能力、综合能力和创新能力,增强学生分析问题和解决问题的能力,促进创造性思维的形成。
二、实验教材与指导书实验教材:《植物生理学实验》,赵世杰等编著,中国农业出版社,2015年版;教学参考书:《现代植物生理学实验指南》,中国科学院上海植物生理研究所,科学出版社,1999;《植物生理学实验指导》,张志良,瞿伟菁主编,高等教育出版社,2003三、考核方式及成绩评定1、考核方式:综合考核实验成绩,包括实验报告成绩、笔试成绩和平时成绩2、期末考试形式、时间及分值考试形式:技能测试;考试时间:100分钟。
3、成绩组成:平时成绩占50%,其中出勤考核占10%,上课表现占10%,实验报告成绩占30%;期末课程考核成绩占50%四、实验项目开设表共有10个实验,其中选8个实验必做材料2 植物组织水势的测定必做液体交换法测定植物水势,掌握测定方法的原理和操作方法。
3 植物根系活力的测定必做采用TTC法测定。
4 叶绿素的提取分离及理化性质选做练习叶绿体色素的提取方法,验证理化性质。
5 叶绿素的定量测定必做用分光光度计定量测定叶绿素a、b和类胡萝卜素含量,掌握叶绿素计的测定原理和使用方法。
6 植物组织中可溶性蛋白质含量的测定必做考马斯亮蓝染色法测定植物组织中蛋白质的含量。
7 生长素对植物的影响必做利用幼苗芽鞘的生长可被生长素特异地诱导这一特性可用以测定生长素类物质,掌握生长素物质的生物特性及其与植物生长的关系8 植物组织逆境伤害程度的测定(MDA含量)必做利用电导仪测定处理液电导度的变化,确定各种逆境对植物的伤害程度,并了解细胞膜透性与受伤害程度的关系9 植物组织中过氧化物酶活性的测定必做通过测定植物过氧化物酶活性,了解某一组织其再植物体内的带些变化,掌握愈创木酚法测定过氧化物酶。