高一化学 元素周期律
- 格式:ppt
- 大小:864.50 KB
- 文档页数:20
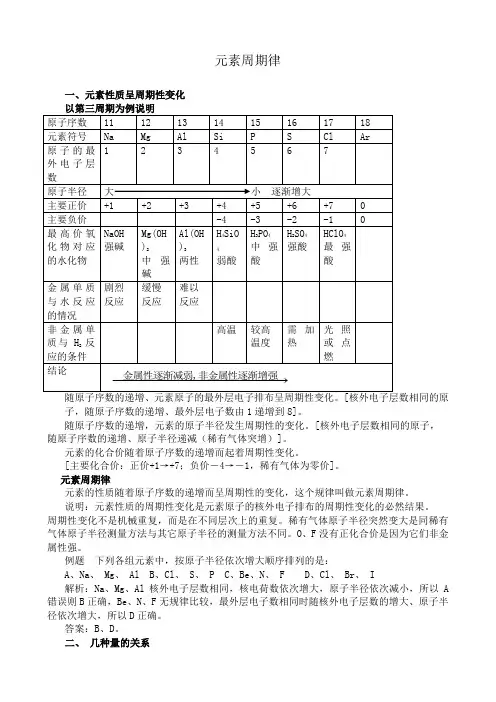
元素周期律一、元素性质呈周期性变化子,随原子序数的递增、最外层电子数由1递增到8]。
随原子序数的递增,元素的原子半径发生周期性的变化。
[核外电子层数相同的原子,随原子序数的递增、原子半径递减(稀有气体突增)]。
元素的化合价随着原子序数的递增而起着周期性变化。
[主要化合价:正价+1→+7;负价-4→-1,稀有气体为零价]。
元素周期律元素的性质随着原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
说明:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
周期性变化不是机械重复,而是在不同层次上的重复。
稀有气体原子半径突然变大是同稀有气体原子半径测量方法与其它原子半径的测量方法不同。
O、F没有正化合价是因为它们非金属性强。
例题下列各组元素中,按原子半径依次增大顺序排列的是:A、Na、 Mg、 AlB、Cl、 S、 PC、Be、N、 FD、Cl、 Br、 I解析:Na、Mg、Al核外电子层数相同,核电荷数依次增大,原子半径依次减小,所以A 错误则B正确,Be、N、F无规律比较,最外层电子数相同时随核外电子层数的增大、原子半径依次增大,所以D正确。
答案:B、D。
二、几种量的关系(1)最外层电子数=最高正化合价(2)|最低负化合价|+最高正化合价=8例2、元素R 的最高价含氧酸的化学式为H n RO 2n -2,则在气态氢化物中R 元素的化合价为多少?解析:由H n RO 2n -2知R 的最高价为+(3n -4),R 在气态氢化物中为负价:-[8-(3n -4)]=-12+3n 。
三、两性氧化物和两性氢氧化物 (1)两性氧化物:既能与酸起反应生成盐和水,又能与碱起反应生成盐和水的氧化物。
例:A12O 3A12O 3+6HCl=2AlCl 3+3H 2O A12O 3+2NaOH=2NaAlO 2+H 2O(2)两性氢氧化物:既能跟酸起反应,又能跟碱起反应的氢氧化物。
例:Al(OH)3, 2Al(OH)3+3H 2SO 4=Al 2(SO 4)3+6H 2O A1(OH)3+NaOH =NaAlO 2+2H 2O 四、重点、难点突破2.微粒半径大小比较中的规律 (1)同周期元素的原子或最高价阳离子半径从左至右渐小(稀有气体元素除外) 如:Na>Mg>Al>Si ;Na +>Mg 2+>Al 3+。

高一化学元素周期律知识点归纳高一的化学学习十分重要,高一的化学知识掌握情况将会直接影响以后高年级的化学学习,其中化学元素周期律是一个最基础的知识点。
下面是店铺为大家整理的高一化学必备的知识,希望对大家有用! 高一化学元素周期律知识1.原子结构所有的元素的原子核都由质子和中子构成。
正例:612C、613C、614C三原子质子数相同都是6,中子数不同,分别为6、7、8.反例:只有氕(11H)原子中没有中子,中子数为0。
2.所以原子的中子数都大于质子数正例:613C 、614C 、13H 等大多数原子的中子数大于质子数。
绝大多数元素的相对原子质量(近似等于质子数与中子数之和)都大于质子数的2倍。
反例1.氕(11H)没有中子,中子数小于质子数。
2.氘(11H)、氦(24He)、硼(510B)、碳(612C)、氮(714N)、氧(816O)、氖(1020Ne)、镁(1224Mg)、硅(1428Si)、硫(1632S)、钙3.具有相同质子数的微粒一定属于同一种元素正例:正例:同一元素的不同微粒质子数相同:H+ 、H- 、H等。
反例1:不同的中性分子可以质子数相同,如:Ne、HF、H2O、NH3、CH4 。
反例2:不同的阳离子可以质子数相同,如:Na+、H3O+、NH4+ 。
反例3:不同的阴离子可以质子数相同,如:NH4+ 、OH-和F-、Cl和HS。
4.电子云氢原子电子云图中,一个小黑点就表示有一个电子。
含义纠错:小黑点只表示电子在核外该处空间出现的机会。
5.元素周期律元素周期律是指元素的性质随着相对原子质量的递增而呈周期性变化的规律。
概念纠错:元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律。
6.元素周期律难失电子的元素一定得电子能力强。
概念纠错:反例1:稀有气体元素很少与其它元素反应,即便和氟气反应也生成共价化合物,不会失电子,得电子能力也不强。
反例2:IVA的非金属元素,既不容易失电子,也不容易得电子,主要形成共价化合物,也不会得失电子。





高一化学必背元素知识点化学是一门研究物质的科学,而元素则是组成物质的基本单位。
在高中化学学习中,必须掌握一些重要的元素知识点,下面将为大家介绍一些高一化学必背的元素知识点。
一、主要元素的原子结构和周期性规律1. 氢元素(H)- 原子序数:1- 原子结构:质子数为1,电子数为1- 周期性规律:位于元素周期表的第1周期和第1组,是唯一的非金属元素2. 氦元素(He)- 原子序数:2- 原子结构:质子数为2,电子数为2- 周期性规律:位于元素周期表的第1周期和第18组,在填充电子壳层时遵循“2-8-8”规律3. 锂元素(Li)- 原子序数:3- 原子结构:质子数为3,电子数为3- 周期性规律:位于元素周期表的第2周期和第1组,是一种活泼的金属元素4. 氧元素(O)- 原子序数:8- 原子结构:质子数为8,电子数为8- 周期性规律:位于元素周期表的第2周期和第16组,在填充电子壳层时也遵循“2-8-8”规律5. 氮元素(N)- 原子序数:7- 原子结构:质子数为7,电子数为7- 周期性规律:位于元素周期表的第2周期和第15组,是一种非金属元素二、主要元素的性质和用途1. 金属元素金属元素具有良好的导电性、热传导性、延展性和韧性等特点。
常见的金属元素包括铁、铜、锌、铝等。
它们在日常生活和工业生产中有广泛的应用,如铁用于制作建筑和机械设备,铜用于导电导热和制作电线,锌用于防腐和制作电池等。
2. 非金属元素非金属元素的导电性、热传导性和延展性较差,常见的非金属元素包括氧、氮、碳、氢等。
它们在环境保护、生物化学和制药等领域发挥重要作用,如氧气用于呼吸和维持生物体代谢,氮气用于保鲜食品和制造氨等。
三、主要元素的离子和化合价1. 离子离子是带有电荷的原子或分子。
金属元素通常失去电子形成阳离子,而非金属元素通常获得电子形成阴离子。
例如,氯离子(Cl-)是氯原子接受了一个电子而形成的。
2. 化合价化合价是指元素在化合物中的相对价值。

高一化学知识点元素周期律元素周期律是化学中最重要的基础知识之一、它是指将元素按照一定规律排列起来的周期表,其中包括元素的周期性变化和周期规律。
元素周期律的发现和建立对于化学科学的发展具有划时代的意义。
下面将介绍元素周期律的发现和基本原理,以及与元素周期律相关的知识点。
元素周期律的发现和建立可以追溯到19世纪初。
当时,科学家们正在发现和研究新的元素。
德国化学家多贝林提出了"三元素周期律",即将元素按照质量递增的顺序排列,发现其中一种元素的性质和前一个元素有相似之处,这就是元素周期律的最初雏形。
然而,多贝林的"三元素周期律"存在一些缺陷,无法解释一些元素的性质。
直到俄国化学家门捷列夫在1869年提出了现代元素周期律。
门捷列夫将元素按照质量递增的顺序排列,并将他们放在一个周期表中,同时发现了元素周期表中的周期性规律。
元素周期律中的一些重要概念包括周期、族、周期表和周期性规律。
周期是指周期表中的横行,从左到右一共有七个周期。
族是指周期表中的竖列,从上到下一共有十八个族。
周期表将元素按照周期和族的顺序排列,元素周期律的基本原则是:元素的性质和它们的原子结构有关,而原子结构的规律与元素周期表中的元素顺序相关。
元素周期表中的周期性规律主要有电子结构、原子半径、电离能和电负性。
电子结构是指元素原子中电子的分布情况,决定了元素的化学性质。
原子半径是指元素原子的大小,原子半径在周期表中有一定的规律,一般来说,原子半径随周期数增加而减小,随族数增加而增大。
电离能是指从一个原子中去掉一个电子所需的能量,电离能在周期表中也有一定的规律,一般来说,电离能随周期数增加而增大。
电负性是指原子吸引和结合电子的能力,电负性在周期表中也有一定的规律,一般来说,电负性随周期数增加而增大。
元素周期律的应用非常广泛。
它可以用来预测元素的性质和化学反应的发生方式。
通过对周期表的研究,科学家们可以发现新的元素并研究它们的特性。

高一化学元素周期律知识点元素周期律是化学中重要的基础知识,它是按照原子核的电子结构和化学性质等规律性的变化,将元素有序地排列在一起的表格,可以为我们理解和记忆元素的性质提供便利。
下面将介绍高一化学中与元素周期律相关的几个重要知识点。
一、元素周期表的组成元素周期表是按照原子序数从小到大将元素排列在一起的表格。
它由横向的周期和纵向的族组成。
周期代表着元素原子核外层电子的能级,而族代表着元素原子核外层电子的数量。
二、元素周期表的周期规律1. 周期规律:元素周期表的横向周期呈现出一些规律性变化。
原子半径随周期增加而减小,电离能、电负性和原子的氧化态也呈现出周期性变化。
这些规律的存在,使我们能够根据元素在周期表中的位置推测其性质。
2. 原子半径的变化:从左到右,原子半径逐渐减小,原因是电子层不断填充,核电荷也逐渐增加,吸引外层电子的能力增强;从上到下,原子半径逐渐增大,原因是电子层增加,外层电子与原子核的吸引力减小。
3. 电离能的变化:从左到右,原子的电离能逐渐增加,即元素更难失去电子形成正离子;从上到下,原子的电离能逐渐减小,即元素较容易失去电子。
4. 电负性的变化:从左到右,原子的电负性逐渐增加,即元素更容易接受电子形成负离子;从上到下,原子的电负性逐渐降低,即元素较不容易接受电子。
三、元素周期表中的主要族元素周期表中的主要族包括:1. 碱金属族:位于周期表的第一组,具有非常活泼的金属性质,易与氧气和水反应。
2. 碱土金属族:位于周期表的第二组,比碱金属更活泼,但比较稳定。
3. 铁系过渡族:位于周期表中间,具有良好的导电性、机械性能和催化性能。
4. 卤素族:位于周期表的第七组,非常活泼,常以阴离子形式存在。
5. 惰性气体:位于周期表的第八组,具有极低的反应性,稳定性极高。
四、元素周期表的应用元素周期表的应用十分广泛,主要包括以下几个方面:1. 元素性质预测:根据元素在周期表中的位置,可以预测其一些基本性质,如电子亲和力、电离能等。

高一化学元素周期律知识点总结
一、什么是元素周期律
元素周期律是第二大械分类法,是按元素原子序数重复排列的律性现象,指某一行或列元素的元素性质呈现的一定的重复性的械种规律,
称为元素周期律,也叫周期性规律。
二、元素周期律的规律
1、元素周期律的原理:元素周期律主要是元素原子内最外层能够电子
数从上到自然相对次序逐次增加,以及同一属中原子半径逐次减小的
原理来探索它的规律。
2、外层电子数增加:当元素原子往右移动时,同一行原子最外层电子
数都会逐次增加,因此,任何排在这一行中的元素都有着增加的趋势,所以同一行的元素的性质也会增强。
3、原子半径减小:当元素原子往下移动时,同一型的元素原子半径也
会逐次减小,这样一来,任何排在这一列的元素都有着强化的趋势,
所以同一列的元素的性质也会减弱。
4、周期性影响:由于元素周期性律的存在,元素离子们根据原子序数
进行排列,一旦发生反应,也会随着周期的变化而产生相似的反应。
三、元素周期律的应用
1、用于确定物质性质:可以根据元素周期律确定某一种物质的性质,
进而了解其用途。
2、预测物质的反应:当物质发生反应时,可以根据元素周期律来分析
两种反应物的性质,从而预测出反应产物及用量。
3、为药物研发提供理论指导:有了元素周期律,可以根据元素周期性
律来设计合适的生物活性物质,为抗癌药物的研发提供理论指导。
四、总结
元素周期律是一种元素性质呈一定的重复性规律的现象,是金属和非
金属材料分类的基础,用于预测物质反应,同时也可以指导药物开发。
对于高中生来说,元素周期律是一个有趣而重要的课题,所以要把它
牢记在心,加深理解。
高一化学知识点:元素周期表高一化学知识点:元素周期表一、元素周期表原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、周期序数=电子层数;主族序数=最外层电子数3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数二二质子数+中子数:A==Z+N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
七大方法助你告别化学“差生”一.尽快去找化学老师,让他告诉你以前学过的关键知识点,在短期内掌握,目的是能够大致跟上现在的教学进度,以听懂老师讲授的新知识。
要想进步,必须弄清楚导致化学成绩差的根本原因是什么?是常用的几个公式、概念没记住,还是很重要的几个基本解题方法不能熟练应用,或者是以前的一些重点知识没有理解透彻等等。