催化原理复习题-2018.
- 格式:doc
- 大小:824.00 KB
- 文档页数:33
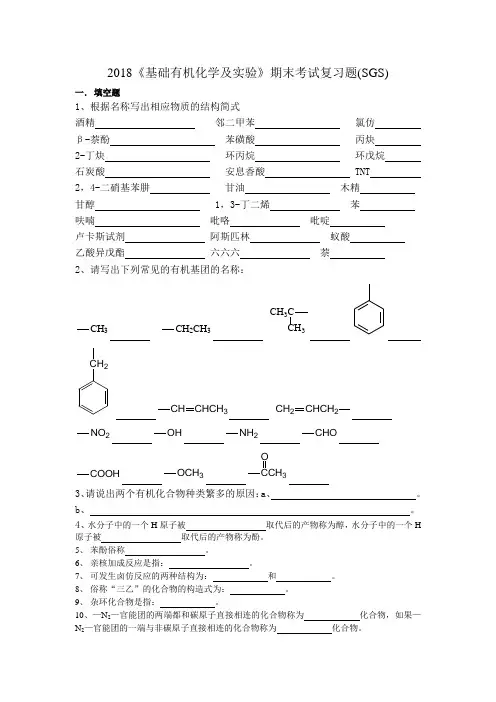
2018《基础有机化学及实验》期末考试复习题(SGS)一.填空题1、根据名称写出相应物质的结构简式酒精邻二甲苯氯仿β-萘酚苯磺酸丙炔2-丁炔环丙烷环戊烷石炭酸安息香酸 TNT 2,4-二硝基苯肼甘油木精甘醇 1,3-丁二烯苯呋喃吡咯吡啶卢卡斯试剂阿斯匹林蚁酸乙酸异戊酯六六六萘2、请写出下列常见的有机基团的名称:CH3CH2CH3CH3C3CH2CHCH3CH CHCH2CH2NO2OH NH2CHOCOOH OCH33O3、请说出两个有机化合物种类繁多的原因:a、。
b、。
4、水分子中的一个H原子被取代后的产物称为醇,水分子中的一个H 原子被取代后的产物称为酚。
5、苯酚俗称。
6、亲核加成反应是指:。
7、可发生卤仿反应的两种结构为:和。
8、俗称“三乙”的化合物的构造式为:。
9、杂环化合物是指:。
10、—N2—官能团的两端都和碳原子直接相连的化合物称为化合物,如果—N2—官能团的一端与非碳原子直接相连的化合物称为化合物。
11、蜜峰蛰人时产生的肿痛是由于分泌了所致。
12、水杨酸构造式为:,硝化甘油构造式为:,苦味酸构造式为:,13、亚硫酸氢钠可与,,反应析出白色结晶。
14、苯酚酸性比羧酸,比碳酸。
15、饱和一元羧酸的烃基上连有吸电子基团时,其酸性会。
饱和一元羧酸的烃基上连有供电子基团时,其酸性会。
16、饱和一元羧酸中,最强的为。
17、根据俗名写出相应物质的结构简式:偶氮苯苦味酸呋喃三乙胺硝化甘油18、饱和一元脂肪族羧酸的烃基上连有吸电子基团时,其酸性会。
19、只与一个碳原子相连的碳原子叫伯碳原子,与两个碳原子相连的碳原子叫仲碳原子,与三个碳原子相连的碳原子叫叔碳原子,与四个碳原子相连的碳原子叫季碳原子。
17.在对烷烃进行命名时,根据主链碳原子的数目,把母体称为某烷。
当碳原子数分别为1-10个时,分别用天干名称:来表示甲,乙,丙,丁,戊,己,庚,辛,壬,癸。
20、碳原子数相同的烯烃和环烷烃互为同分异构体,碳原子数相同的炔烃和环烯烃、二烯烃互为同分异构体。
2018年全国II 卷1. 化学与生活密切相关。
下列说法错误的是A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒C.氢氧化铝可用于中和过多胃酸D.碳酸根可用于胃肠X 射线造影检查2. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
下列叙述错误的是A.5NH.NO,B.雾霾中含有硝酸铉和硫酸铉/,燃料燃烧雾和霾的分散剂相同C.3.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
CH,和6饱和食盐水光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是A. D.A. AB.C. CD. DB 4.W 、X 、Y 和Z 为原子序数依次增大的四种短周期元素。
W 与X 可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。
下列叙述正确的是A.X与其他三种元素均可形成两种或两种以上的二元化合物B.Y与其他三种元素分别形成的化合物中只含有离子键C.四种元素的简单离子具有相同的电子层结构D.W的氧化物对应的水化物均为强酸5.M代表阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,124gP4中所含P—P键数目为4N aB,100mL lmol-L-1FeCl3溶液中所含Fe’+的数目为0.1MC.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2MD.密闭容器中,2mol SO2和1mol O2催化反应后分子总数为2M6,我国科学家研发了一种室温下“可呼吸”的Na—CO?二次电池。
将NaC104溶于有机溶剂作为电解液,钠和负载碳纳米管的镣网分别作为电极材料,电池的总反应为:3CQ2+4N a7——^.2Na2C03+Co下列说法错误的是A,放电时,C10「向负极移动B.充电时释放CO?,放电时吸收CO?D,充电时,正极反应为:Na*+e-=Na 7,下列实验过程可以达到实验目的的是C.放电时,正极反应为:3C02+4e-=2C032-+C编号实验目的实验过程A配制0.4000mol•L-1的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸德水溶解,转移至250mL容量瓶中定容B探究维生素C的还原性向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化C制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH 溶液、浓硫酸和KMnO,溶液D 探究浓度对反应速率的影响向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H202溶液,观察实验现象8.我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiCh和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:2稀f酸O r ZnO锌粉1浮选精於f焙广H:浸H氧彳V杂—1还:除杂f滤液f电解»锌气体滤渣1滤渣2波渣3金属离子T73+Zn Cd2+Fe T72+Fe72+开始沉淀的pH 1.5 6.3 6.27.4沉淀完全的pH 2.88.38.29.4相关金属离子[co(M"+)=O.l moLL』]形成氢氧化物沉淀的pH范围如下:回答下列问题:(1)焙烧过程中主要反应的化学方程式为o(2)滤渣1的主要成分除SiO2外还有;氧化除杂工序中ZnO的作用是,若不通入氧气,其后果是o(3)溶液中的CcP+可用锌粉除去,还原除杂工序中反应的离子方程式为o (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回________工序继续使用。

专题十一反应历程与新信息悟考法考点1反应历程与微粒变化1.[浙江2022年1月·24,2分]某课题组设计一种固定CO2的方法,原理如图。
下列说法不正确的是()A.反应原料中的原子100%转化为产物B.该过程在化合物X和I-催化下完成C.该过程仅涉及加成反应D.若原料用,则产物为2.[北京2020·9,3分]硫酸盐(含SO42-、HSO4-)气溶胶是PM2.5的成分之一。
近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:下列说法不正确的是( )A .该过程有H 2O 参与B .NO 2是生成硫酸盐的氧化剂C .硫酸盐气溶胶呈酸性D .该过程没有生成硫氧键3.[浙江2021年6月·24,2分]制备苯甲酸甲酯的一种反应机理如图(其中Ph—代表苯基)。
下列说法不正确的是( )A .可以用苯甲醛和甲醇为原料制备苯甲酸甲酯B .反应过程涉及氧化反应C .化合物3和4互为同分异构体D .化合物1直接催化反应的进行4.[湖北2021·12,3分]甲烷单加氧酶(s -mmo)含有双核铁活性中心,是O 2氧化CH 4生成CH 3OH 的催化剂,反应过程如图所示。
下列叙述错误的是( )A .基态Fe 原子的核外电子排布式为[Ar]3d 64s 2B .步骤③有非极性键的断裂和极性键的形成C .每一步骤都存在铁和氧元素之间的电子转移D .图中的总过程可表示为CH 4+O 2+2H ++2e -――→s -mmoCH 3OH +H 2O5.[全国Ⅱ2020·11,6分]据文献报道:Fe(CO)5催化某反应的一种反应机理如图所示。
下列叙述错误的是()A.OH-参与了该催化循环B.该反应可产生清洁燃料H2C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化6.[全国Ⅰ2020·10,6分]铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。

《催化原理》复习题一.填空1.“催化作用”一词最早是由瑞典化学家_________于_________年提出的。
2.在已开发的使用催化剂中,有四类催化剂最具特色,它们分别是_________,_________,_________和_________。
3.在同一个化学反应中,之所以有不同的选择性有以下三种原因,第一个原因是由于_________导致的,第二个原因是由于_________引起的,第三个原因是由于_________造成的。
4.气体在固体表面的吸附可分为两类:_________和_________。
化学吸附类似于化学反应,吸附后,反应物分子与催化剂表面原子之间形成_________,组成表面络合物。
在多相催化过程中,化学吸附是个重要的阶段,催化过程之所以能加快反应速度,一般来说,是由于_________。
5.Langmuir吸附等温式所依据的模型是①___ ______ ②__ _______ ③______ ___ ④____ _____。
6.高活性催化剂常易被外来分子污染而中毒,那些具有_________的分子,如氨、磷化氢、一氧化碳、二氧化硫、硫化氢等分子能与催化剂表面形成_________,因此这些分子是毒性很强的毒物。
7.一个好的固体催化剂必须具有_________;_________ ;________和_________。
8.氧化铝按晶型可分为八种,所有这些氧化铝都是用希腊字母来命名的。
它们可归纳为两大类,低温氧化铝(在低于6000C煅烧而得),包括_________四种;高温氧化铝(在高于6000C煅烧而得),包括_________四种;_________为终态,俗称刚玉。
9.分子筛的基本结构单元是硅氧四面体。
_________原子在四面体的中心,_________占据四面体的顶点。
四面体中的_________原子可被_________原子取代,便成为铝氧四面体。
10.由于人类生产实践的不断扩大,在地球范围内,催化剂出现了许多新的应用领域,这些新的应用领域主要是_________;_________;_________;_________。

专题十二化学能与热能备考方向导航考点1 化学反应中能量变化的有关概念1.[2020天津,10,3分]理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。
下列说法错误的是( )A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·mol-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热2.[2018北京,7,6分]我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如图。
下列说法不正确的是( )A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C—H键发生断裂C.①→②放出能量并形成了C—C键D.该催化剂可有效提高反应物的平衡转化率3.[2018海南,12,4分][双选]炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。
活化过程的能量变化模拟计算结果如图所示。
活化氧可以快速氧化二氧化硫。
下列说法正确的是( )A.每活化一个氧分子吸收0.29 eV的能量B.水可使氧分子活化反应的活化能降低0.42 eVC.氧分子的活化是O—O的断裂与C—O键的生成过程D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂考点2 热化学方程式4.[2021四川石室中学开学考试]H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。
下列说法错误是( )A.有MnO2条件下的变化曲线是bB.该反应能量变化类型与氢气燃烧反应的相同C.加MnO2后,正反应速率增大,逆反应速率减小D.该反应的热化学方程式为H2O2(l)H2O(l)+1O2(g) ΔH=(E1-E2) kJ·mol-125.[2017全国卷Ⅰ,28(2),5分]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、,制得等量H2所需能量较少的是。
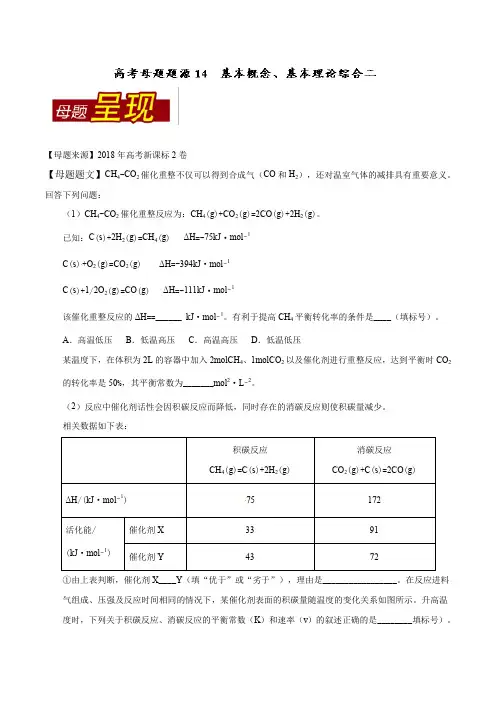
【母题来源】2018年高考新课标2卷【母题题文】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
回答下列问题:(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol−1C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol−1C(s)+1/2O2(g)=CO(g) ΔH=-111kJ·mol−1该催化重整反应的ΔH==______ kJ·mol−1。
有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。
(2)反应中催化剂话性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:75①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。
升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
A.K积、K消均增加B.v积减小,v消增加C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。
在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则p a(CO2)、p b(CO2)、p c(CO2)从大到小的顺序为________________。

催化原理复习题催化原理复习题催化反应是化学中一种重要的反应方式,它通过催化剂的作用,降低反应的活化能,加速反应速率。
催化原理是化学学习中的重要内容之一,下面我们来复习一些催化原理的相关问题。
1. 什么是催化剂?它在催化反应中起到什么作用?催化剂是指在化学反应中能够降低反应活化能,促进反应进行的物质。
催化剂在反应中不参与化学反应,因此在反应结束后仍能够重新使用。
催化剂通过提供新的反应路径,使得反应能够以更低的能量进行,从而加速反应速率。
2. 催化剂的选择与反应速率有什么关系?催化剂的选择对反应速率有重要影响。
合适的催化剂能够提供更佳的反应路径,降低反应的活化能,从而加速反应速率。
不同的反应需要选择适合的催化剂,以达到最佳的催化效果。
3. 催化剂的作用机理是什么?催化剂的作用机理主要有两种:表面机理和溶液机理。
表面机理是指催化剂与反应物在催化剂表面发生反应,生成中间体,然后再解离为产物。
溶液机理是指催化剂与反应物在溶液中发生反应,生成中间体,然后再解离为产物。
4. 什么是催化剂的活性中心?催化剂的活性中心是指催化剂中能够与反应物发生作用的部位。
催化剂的活性中心通常是一个或多个原子、离子或分子,具有特定的结构和性质。
活性中心能够吸附反应物,降低反应的活化能,促进反应进行。
5. 催化剂的选择与反应选择性有何关系?催化剂的选择对反应选择性有重要影响。
不同的催化剂能够引导反应物在不同的反应路径上进行,从而产生不同的产物。
合适的催化剂能够提高反应的选择性,使得产物得到更好的纯度和收率。
6. 催化剂的失活是什么原因造成的?催化剂的失活是指催化剂在反应中逐渐失去催化活性的现象。
催化剂的失活原因有多种,包括物理失活和化学失活。
物理失活是指催化剂的物理性质发生变化,如表面积减小、孔隙堵塞等。
化学失活是指催化剂与反应物或产物发生反应,形成不活性物质。
7. 如何减缓催化剂的失活?减缓催化剂的失活可以采取多种方法。
一种方法是定期对催化剂进行再生或修复,恢复其催化活性。

微专题一催化剂与活化能催化剂在高考试题中的呈现以陌生反应为载体,以反应历程图、物质转化图、数据表格以及直接叙述的方式给出信息,以选择题或填空题形式考查催化剂及活化能的相关知识。
是高频考点,分值高、难度大、得分率低。
催化剂与活化能在近几年全国高考中考查统计命题方向为什么工业上热衷于催化剂人教版选修4-p4化学反应理论模型催化剂与反应速率一、催化剂如何影响反应速率二、催化剂对反应速率影响有多大结论:催化剂对反应速率影响远远大于温度对反应速率影响(催化剂高效性)工业上提高生产效率首选“催化剂”三、单峰变双峰(化学选修4 p-22)练习:1、已知H2O2分解反应为:2H2O2=2H2O+O2。
在含少量I-的溶液中,H2O2分解机理为:①.H2O2+I-═H2O+IO- △H>0 慢②.△H>0 快写出反应②离子反应方程式。
思维模型催化剂参与反应历程,确定分反应或总反应方法①判断催化剂和中间产物②反应过程反应物A+催化剂=中间产物中间产物+反应物B=产物+催化剂③配平,相加得总化学反应式高考对催化剂考查新角度一、催化剂判断与催化机理2、(2017年江苏高考题-18)②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。
Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。
M'的化学式为______。
/3、(2016年北京高考题-27)(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:i:2Fe2++ PbO2+4H++SO42−2Fe3++PbSO4+2H2Oii: ……①写出ii的离子方程式:________________。
4、(2018年全国高考I卷-28)(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:第一步 N2O5NO2+NO3快速平衡第二步 NO2+NO3→NO+NO2+O2慢反应第三步 NO+NO3→2NO2快反应其中可近似认为第二步反应不影响第一步的平衡。
第7讲化学反应速率与化学平衡一、选择题(本题包括7个小题,每小题7分,共49分)1.(2017北京朝阳模拟)2017年2月3日国务院总理李克强主持召开国务院常务会议。
通过“十三五”国家食品和药品安全规划,有效保障人民健康福祉。
下列食品添加剂中,其使用目的与反应速率有关的是()A.抗氧化剂B.调味剂C.着色剂D.增稠剂2.(2017吉林四平模拟)下列有关颜色的变化不能用勒夏特列原理解释的是()A.平衡状态的H2、I2、HI混合气体体积压缩时颜色变深B.平衡状态的NO2和N2O4混合气体体积压缩时颜色先变深后变浅C.平衡状态的NO2、CO、NO、CO2混合气体升温时颜色变深D.向Fe(SCN)3溶液中滴加几滴浓KSCN溶液后颜色变深3.(2017辽宁大连二模)大量燃烧化石燃料产生的CO2被视为全球变暖的“元凶”,但在催化剂作用下,用CO2和H2可制备用途广泛的甲醇。
已知下列三个热化学方程式:①H2(g)+CO2(g)H2O(g)+CO(g)ΔH1②2H2(g)+CO(g)CH3OH(g)ΔH2③3H2(g)+CO2(g)H2O(g)+CH3OH(g)ΔH3三个反应的平衡常数分别为K1、K2、K3,这些平衡常数与温度的关系如表所示:平衡常数K1K2K3温度/℃500 1.00 2.50800 2.500.15下列说法正确的是()A.反应②为吸热反应B.K3(500 ℃)=3.50C.K3(800 ℃)=2.35D.ΔH3=ΔH1+ΔH24.(2017江苏徐州模拟)一定温度下,在3个体积均为 1.0 L的恒容密闭容器中反应2H2物质的平衡浓度/(mol·L-1) 容器c(H2)c(CO)c(CH3OH)c(CH3OH)Ⅰ4000.200.1000.080Ⅱ4000.400.200Ⅲ500000.100.025A.该反应的正反应吸热B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大5.(2017海南高考,11)已知反应CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0。

催化原理期末复习题催化原理期末复习题催化原理是化学领域中的一个重要概念,它涉及到许多化学反应的加速和控制。
在本篇文章中,我们将回顾一些与催化原理相关的重要概念和问题,以便更好地理解这个领域。
1. 什么是催化反应?催化反应是指通过加入催化剂来加速化学反应速率的过程。
催化剂可以降低反应的活化能,从而使反应更容易发生。
它们参与反应但在反应结束时不发生永久改变。
2. 催化剂的种类有哪些?催化剂可以分为两类:同质催化剂和异质催化剂。
同质催化剂与反应物在相同的物理状态下存在,例如溶液中的酸碱催化剂。
异质催化剂与反应物处于不同的物理状态,例如固体催化剂与气体或液体反应物。
3. 催化剂如何影响反应速率?催化剂通过提供一个新的反应路径来降低反应的活化能。
在催化剂的作用下,反应物分子可以更容易地达到过渡态,从而加速反应速率。
此外,催化剂还可以通过吸附反应物分子来增加它们之间的碰撞频率,从而促进反应发生。
4. 催化剂的选择与反应条件有关吗?是的,催化剂的选择通常与反应条件密切相关。
不同的催化剂对不同的反应有不同的催化活性和选择性。
因此,在设计催化反应时,需要考虑催化剂的特性以及反应条件(如温度、压力、反应物浓度等)对催化剂的影响。
5. 催化剂的失活是什么意思?催化剂的失活是指催化剂活性的降低或完全丧失。
失活可以由多种原因引起,如催化剂表面的积聚物、中毒物质的吸附以及催化剂的物理或化学变化等。
失活不仅会降低反应速率,还可能导致催化剂的寿命缩短。
6. 如何提高催化剂的效率?提高催化剂的效率可以通过多种方法实现。
一种方法是改进催化剂的设计,例如优化催化剂的结构和组成,以增加其催化活性和选择性。
另一种方法是优化反应条件,如调整温度、压力和反应物浓度等,以使催化剂在最佳工作条件下运行。
7. 催化剂与可持续发展的关系是什么?催化剂在可持续发展中发挥着重要作用。
通过使用催化剂,可以降低化学反应的温度和压力要求,减少能源消耗和废物产生。

2018八(下)科学期末复习探究题精选A(20题)1.小科从网购鲜花附赠的说明书中看到:鲜花插入花瓶前需要用剪刀以45°角斜剪,去掉茎杆下端1-3 厘米,并用合适的保鲜液保鲜。
小科查阅资料发现:柚子皮的提取液有明显的杀菌作用。
能否利用柚子皮的提取液来延长鲜花保鲜的时间呢?小科设计的实验方案如下表:组别玫瑰花培养液添加剂其他条件A 5 枝1000 毫升10 毫升清水相同且适宜B 5 枝1000 毫升10 毫升柚子皮提取液(1)一段时间后,小科若观察到___________________________________________________ ,则说明柚子皮的提取液可以延长鲜花的保鲜时间。
(2)除题目中提到因素外,你认为还有哪些因素会影响鲜花保鲜的时间?(写出一种)_________。
2.如图是一个验证光合作用需要二氧化碳的实验装置.实验步骤如下:①将天竺葵放在黑暗处足够长的时间;②将锥形瓶、药品、橡皮塞、枝条等按图示装置连接固定好,静置5分钟时间;③光照2~3h。
取下叶片A和B,将叶片进行褪色处理、清洗;④用碘液分别检验A、B叶片,观察现象。
(1)步骤①的作用是。
(2)B的作用是为了与A做对比,在B中应加入的与A等量的25℃的。
(3)步骤④用碘液分别检验A、B叶片,观察到的现象是。
3.合理储藏有利于水果保鲜。
科研人员为了探究某因素对蓝莓保鲜的影响,测定了蓝莓在密闭容器内产生CO2的速率,结果见图甲和图乙。
试回答下列问题:(1)上述实验的假设是会影响蓝莓的呼吸作用,从而影响水果的保鲜。
(2)分析图甲或图乙可知,随着蓝莓储藏时间的增加,产生CO2的速率均有下降。
原因是密闭容器内的CO2浓度会逐步,从而抑制了蓝莓细胞的呼吸作用。
(3)某同学拟验证上述实验结果,设计如下方案:①将两等份同一品种、成熟度相同的蓝莓分别装入甲、乙两只相同的烧杯中;②将甲、乙两烧杯分别置于25℃和-5℃条件下观察,每隔一段时间测定CO2浓度;③重复上述过程,记录实验数据并分析。
催化原理考试复习题一概念离子交换法:利用载体表面存在着可进行离子交换的离子,将活性组分通过离子间的变换而附载在载体上的方法。
化学键合法:通过化学键(离子键、共价键、配位键)把络合物催化剂与高分子载体相结合的过程.吸附法:利用载体对活性组分的吸附作用来制备负载型催化剂的方法。
超均匀共沉淀:是将沉淀分两步进行,首先制备盐溶液的悬浮层,并将这些悬浮层立即混合成为超饱和溶液,然后由超饱和溶液得到均匀沉淀。
二、填空1。
沉淀老化时,颗粒长大方法有:再凝结、凝聚2.正加法加料时,溶液的PH值由低到高3。
竞争吸附时,当反应由外扩散控制时,球形催化剂上活性组分的分布以蛋壳型为益,由动力学控制时,均匀型为益三、简答题1。
固体催化剂制备方法:①原料准备②催化剂(母体)的制备③成型④活化2。
催化剂制备可粗分为:干法和湿法干法包括热熔法、混碾法与喷涂法湿法包括胶凝法、沉淀法(共沉淀法,均匀沉淀法和超均匀沉淀法)、浸渍法、离子交换法、沥滤法.3。
催化剂在工业得到应用满足的条件★催化性能:具有良好的活性,选择性和稳定性★机械性能:有一定的机械强度,合适的形状,颗粒大小和分布★有一定的抗毒性能:最好能活化再生,使用寿命长★催化剂制备方面:要求原料能稳定供应,制备工艺能适合于大规模工业生产,环境友好,最好无”三废”污染。
4。
选择原料的基本原则:A原料中要包括催化剂所需要的全部组分,同时也要考虑到原料中的杂质能适合生产中的要求.B原料中不含对催化剂有害的成分,或对环境有污染的成分C来源充足,价格便宜D使用活性组分含量高,用量少的原料。
5。
催化剂组成的表示方法:固体催化剂…主催化剂,助催化剂,载体配合物催化剂~助催化剂和助催化剂酶催化剂:酶蛋白和辅酶6.金属溶解一般选用稀HNO3原因:★大多数金属(除Au,Pt)可溶解在硝酸中制成硝酸盐★NO3在加热时,能除去,不会使之留在催化剂中。
★节省原料角度,稀硝酸好★溶液制好后,还要加碱中和沉淀,所以过剩酸量越少越好。
2018年⾼⼆化学期末考试及答案 2018年将要来临,⾼⼆学⼦们正紧张复习迎接期末考试,多做⼀些试题可以测试出⾃⼰的⽔平,在考试的时候也可以由个底。
下⾯是店铺带来的2018年⾼⼆化学期末考试。
2018年⾼⼆化学期末考试 ⼀、选择题(每⼩题3分,共20个⼩题60分) 1、下列热化学⽅程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)===2CO2(g )+3H2O(g) ΔH=-1 367.0 kJ•mol-1(燃烧热) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ•mol-1(中和热) C.S(s )+O2(g)===SO2(g) ΔH=-296.8 kJ•mol-1(反应热) D.2NO2===O2+2NO ΔH=+116.2 kJ•mol-1(反应热) 2、关于如图所⽰装置的叙述,正确的是 A.铜是阳极,铜⽚上有⽓泡产⽣ B.铜⽚质量逐渐减少 C.电流从锌⽚经导线流向铜⽚ D.铜离⼦在铜⽚表⾯被还原 3、下图各容器中盛有海⽔,铁在其中被腐蚀时由快到慢的顺序是 ( )A.④>②>①>③B.②>①>③>④C.④>②>③>①D.③>②>④>① 4、在可逆反应中,改变下列条件⼀定能加快反应速率的是 ( )A.增⼤反应物的量B.升⾼温度C.增⼤压强D.使⽤催化剂 5、在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离⼦的溶液中,缓慢加⼊AgNO3稀溶液,析出三种沉淀的先后顺序是( )A. AgCl、AgBr、AgIB. AgI、AgBr、AgClC. AgBr、AgCl、AgID. 三种沉淀同时析出 6、⼀定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是( ) A.N2、H2和NH3的物质的量分数不再改变 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 C.N2与H2的物质的量之和是NH3的物质的量的2倍 D.单位时间⾥每增加1 mol N2,同时增加3 mol H2[ 7、0.1 mol / L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,若溶液温度从室温升⾼到60℃,则溶液( ) A.pH增⼤ B .c(CH3COOH)增⼤C.CH3COOH电离程度增⼤D.c(H+)×c(OH-)=1×10-14 8、醋酸溶液中存在电离平衡:CH3COOH CH3COO- + H+ 下列叙述不正确的是( ) A.CH3COOH溶液中离⼦浓度的关系满⾜: B.0.1 mol / L 的CH3COOH 溶液加⽔稀释,溶液中c( )减⼩ C.CH3COOH溶液中加⼊少量CH3COONa固体.平衡逆向移动 D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7 9、常温下,体积相同,pH相同的盐酸和醋酸两种溶液中,下列两者的量相同的是A.电离程度B.酸的物质的量浓度C.与Zn反应开始时的反应速率D.与⾜量的Zn反应产⽣H2量 10、下列电离⽅程式正确的是A.H2S 2H+ + S2-B. HF = H+ + F-C.NaHSO3 = Na+ + H+ +SO32-D.H2CO3+ H2O H3O+ + HCO3- 11、⽤⾷⽤⽩醋(醋酸浓度约1mol/L)常温下进⾏下列实验,能证明醋酸为弱电解质的是( ) A. ⽩醋中滴⼊⽯蕊试液呈红⾊ B. 实验测得该⽩醋的pH为2.3 C. 蛋壳浸泡在⽩醋中有⽓体放出 D. ⽩醋加⼊⾖浆中有沉淀产⽣ 12、pH=2的A、B两种酸溶液各1mL,分别加⽔稀释到1L(其pH与溶液体积V的关系 如图所⽰),下列说法正确的是( ) A.a=5时,A是强酸,B是弱酸; B.若A、B都是强酸,则5>a>2; C.稀释后,A酸溶液的酸性⽐B酸溶液强; D.A、B两种酸溶液的物质的量浓度⼀定相等。
催化原理期末考试复习习题及答案一、给出下面概念和术语的定义1、催化剂的活性:是指催化剂影响反应进程变化的程度。
2、Bronsted 酸、Bronsted 碱:能给出H +的物质为Bronsted 酸,简称B 酸;能接受H +的物质为Bronsted 碱,简称B 碱。
3、金属分散度:金属在载体上微细的程度用分散度D 表示,其定义为:)(总的金属原子数表面的金属原子数催化剂g n n D t s == 4、载体:载体是催化活性组分的分散剂、黏合物或支撑体,是负载活性组分的骨架。
5、结构不敏感反应:结构非敏感反应是涉及H-H 、C-H 或O-H 的断裂或生成的反应,它们对结构的变化、合金化的变化或金属性质的变化敏感性不大,称这种反应为结构非敏感反应。
6、化学吸附:是借助于化学键力,遵从化学热力学和化学动力学的传统定律,具有选择性,吸附热大(40~800kJ/mol),一般是不可逆的,尤其是饱和烃分子的解离吸附。
化学吸附为单分子层吸附,具有饱和性。
7、择形催化:分子筛结构中存在均匀的晶孔,当反应物和产物的分子线度与晶内孔径相近时,反应的选择性常取决于分子与孔径的比。
这种选择性称为择形催化选择性。
8、催化剂的骨架密度:当测量的体积仅是催化剂的实际固体骨架的体积时,测得的密度称为真密度,又称为骨架密度。
9、催化剂的比孔容:每克催化剂颗粒内所有孔的体积总和称为比孔体积,或比孔容,亦称孔体积(孔容)。
10、努森(Knudsen)扩散:是分子与催化剂孔壁间的碰撞,且孔道的平均直径小于分子平均自由程时出现的内扩散。
11、催化剂的化学稳定性:在反应温度、反应物、产物和杂质的作用下,活性组份和状态稳定存在的能力,它包括活性组份的流失和化学态的改变。
12、催化剂:是一种物质。
它可加速热力学上可行的化学反应速率,且不改变该反应的标准Gibbs自由焓变化,反应结束后,自身没有任何消耗。
13、催化剂的稳定性:是指它的活性和选择性随时间变化的情况。