电位滴定实验
- 格式:ppt
- 大小:905.50 KB
- 文档页数:12

一、实验目的1. 熟悉电位滴定的基本原理和操作技术;2. 学习运用电位滴定法测定陈醋中醋酸的含量;3. 掌握滴定终点判断方法,提高实验数据处理能力。
二、实验原理陈醋是一种常见的调味品,其主要成分是醋酸。
本实验采用电位滴定法测定陈醋中醋酸的含量。
电位滴定法是一种基于电极电势变化来确定滴定终点的滴定方法。
在滴定过程中,随着滴定剂的加入,溶液中的醋酸浓度逐渐降低,电极电势也随之发生变化。
当滴定剂加入至恰好与醋酸反应完毕时,溶液中的氢离子浓度达到平衡,电极电势发生突跃,此时即为滴定终点。
三、实验仪器与试剂1. 仪器:酸度计、滴定管、移液管、烧杯、玻璃棒、电极等。
2. 试剂:陈醋、0.1mol/L NaOH标准溶液、酚酞指示剂、去离子水等。
四、实验步骤1. 配制0.1mol/L NaOH标准溶液;2. 将陈醋用去离子水稀释至一定浓度;3. 在烧杯中加入适量的陈醋溶液,插入玻璃电极和参比电极;4. 打开酸度计,调整电极平衡;5. 用移液管吸取一定体积的NaOH标准溶液,缓慢滴加至陈醋溶液中,同时不断搅拌;6. 观察酸度计显示屏,当电极电势突跃时,停止滴定;7. 记录消耗的NaOH标准溶液体积;8. 重复实验三次,取平均值。
五、数据处理1. 计算陈醋溶液中醋酸的浓度(C1);C1 = C2 × V2 / V1式中,C1为陈醋溶液中醋酸的浓度(mol/L),C2为NaOH标准溶液的浓度(mol/L),V2为消耗的NaOH标准溶液体积(mL),V1为陈醋溶液的体积(mL)。
2. 计算陈醋中醋酸的含量(X);X = C1 × M1 / M2 × 100%式中,X为陈醋中醋酸的含量(%),M1为醋酸的摩尔质量(g/mol),M2为陈醋样品的质量(g)。
六、实验结果与分析1. 实验结果本次实验三次滴定消耗的NaOH标准溶液体积分别为23.50mL、23.60mL、23.55mL,平均消耗体积为23.55mL。

实验十电位滴定法测定某弱酸的Ka值一.实验原理电位滴定法是一种用电压(即电势差)来判定和测定混合溶液中若干参与反应的各物质种类及它们之间存在的平衡位置的方法。
利用两溶液间电势差(电位差)来检验溶液间是否存在电解质或离子,以及确定混合溶液中某一离子间的移动平衡的方法,叫作电位滴定法。
用这种方法,可以同时检验和测定出参与反应物质的粒子种类,相对关系,平衡常数以及各种活性常数所需要的物质条件。
电位滴定法是一种电化学分析法,它能够精确地检测溶液中弱酸HX(H代表一个多体酸,X代表氢离子)的移动平衡,从而确定HX在溶液中的活性程度,最终得到它的Ka值,称为Ka滴定法。
二.实验步骤准备工作:1.准备酸性标准溶液(0.1mol/L的硝酸铵盐溶液)和碱性标准溶液(0.1mol/L的氢氧化钠溶液);2.在实验玻璃杯中混合酸性溶液和碱性标准溶液,当混合溶液的电位降低到稳定时,表示溶液已经达到平衡;3.把实验玻璃杯里的混合溶液加入弱碱溶液,直至溶液的PH值达到7.0;4.将实验玻璃杯接入阴阳极,启动电位仪,调节电位仪,观察混合溶液的电位仪变化;5.将酸性标准溶液、酸入混合溶液中,一滴一滴加入,直至溶液的电位达到稳定状态;6.记录加入酸的滴数和每滴加入酸后实验溶液的动态变化,并在相应的数据表中记录,求出每滴加入酸时溶液的电位;7.滴定结束后,根据记录的数据,计算混合溶液中HX的Ka值。
三.实验数据处理在实验数据中,由于溶液是一系列接近的点,每一条电位-滴数曲线只能提示该反应的某种特征性质,而不能精确确定反应的准确特征。
根据Ka滴定法,可以求出混合溶液中HX的Ka值,通常可以用以下公式:Ka=a1/a2其中a1为表示加入碱溶液的酸性溶液的离子乘积,即:a1=C1*H1C1代表加入酸性溶液的定量,H1代表加入酸性溶液的离子浓度;a2表示加入酸性溶液的碱溶液的离子乘积,即:从上面的公式可以看出,求出Ka值,首先要确定好C1、C2和H1、H2等参量,从而得到最终的Ka值。

电位滴定操作方法电位滴定是一种通过测量电位变化来确定溶液中物质浓度的方法。
它主要用于酸碱滴定、氧化还原滴定以及络合滴定等分析实验中。
下面将详细介绍电位滴定的操作步骤和注意事项。
一、实验器材:1. 电位滴定仪:包括电位计和磁力搅拌器等部件。
2. 滴定管:可容纳滴定溶液和待测溶液的容器。
3. 滴定burette:用于逐滴加入滴定液的玻璃柱状器械。
4. 玻璃棒:用于搅拌溶液。
5. p H 电极:用于测量溶液的pH 值。
6. 受控温度电磁搅拌器:可控制溶液温度和搅拌速度。
二、实验步骤:1. 标定电位滴定仪:首先,要在实验开始前对电位滴定仪进行校准和标定。
将pH 电极放入pH = 7.00 的标定缓冲溶液中,调整电位计读数为7。
然后,用pH = 4.00 和10.00 的缓冲溶液依次进行标定,确保电位计读数准确无误。
2. 准备滴定溶液:根据实验设计和需要,准备好要滴定的溶液和滴定液。
滴定液一般为强酸或强碱,待测溶液则可以是酸碱溶液、氧化还原溶液或络合物溶液等。
3. 清洗玻璃仪器:使用去离子水和相应的试剂清洗滴定burette、滴定管、p H 电极等玻璃仪器,以避免交叉污染。
4. 将滴定液放入burette:将滴定液倒入burette,注意防止滴定液的溅出和浪费。
5. 准备滴定装置:在电位计的电极接口处插入p H 电极,并将磁力搅拌器置于滴定溶液中。
确保电极和搅拌器安装正确,并与电位计连接。
6. 开始滴定:将滴定burette 安装到电位滴定仪上,并用磁力搅拌器搅拌被滴定溶液。
初始时,滴定burette 的阀门应关闭,先将滴定溶液缓慢加入待测溶液中,直到p H 值变化不再明显。
7. 快速滴定:当靠近等值点时,将滴定液逐滴加入待测溶液中,同时注意记录电位计读数和滴定液的滴数。
8. 确定等值点:当滴定液的加入导致电位计读数急剧变化时,即达到等值点。
记录此时的滴定液滴数。
9. 计算结果:通过等值点的滴定液滴数和滴定液的浓度,可以计算出待测溶液中物质的浓度。


电位滴定法确定滴定终点的方法简介电位滴定法是一种常用的化学分析方法,用于确定溶液中某种物质的浓度。
它基于电位变化来判断滴定终点,通过测量溶液中的电位变化来确定反应的终点。
本文将详细介绍电位滴定法确定滴定终点的方法。
原理在电位滴定法中,我们通常使用指示剂和参比电极来监测溶液中的电位变化。
指示剂是一种能够在特定条件下改变颜色的物质,当反应达到滴定终点时,指示剂会发生颜色变化。
参比电极则用于提供一个稳定的参考电势,以便准确测量溶液中的电位。
在进行电位滴定时,我们首先需要根据所研究物质的性质选择合适的指示剂和参比电极。
然后,将待测溶液与标准溶液逐渐混合,并同时记录下测量得到的电位值。
当溶液中出现明显颜色变化时,并且伴随着突变式的电位变化时,可以判断滴定反应已经达到终点。
实验步骤以下是进行电位滴定法确定滴定终点的一般实验步骤:1.准备工作:选择合适的指示剂和参比电极,并进行校准,确保测量结果准确可靠。
2.准备标准溶液:根据所需测定物质的浓度,配制出一定浓度的标准溶液。
3.准备待测溶液:将待测溶液与适量的试剂混合,以达到滴定所需的反应条件。
4.开始滴定:使用滴定管将标准溶液缓慢加入待测溶液中,并同时记录下每次加入后的电位值。
5.监测颜色变化:注意观察溶液颜色的变化情况,在颜色发生明显改变时停止加入标准溶液,并记录下此时的电位值。
6.数据处理:根据实验数据绘制曲线图,分析曲线上出现突变式电位变化的位置,确定滴定终点。
注意事项在进行电位滴定法实验时,需要注意以下事项:1.选择合适的指示剂和参比电极,确保实验结果准确可靠。
2.控制滴定速度,避免过快或过慢导致滴定终点的判断错误。
3.注意观察溶液颜色的变化情况,及时停止加入标准溶液。
4.实验室操作要规范,注意安全。
应用领域电位滴定法广泛应用于化学分析和质量控制领域。
它可以用于测定酸碱度、氧化还原反应、络合反应等不同类型的滴定分析。
在环境监测中,电位滴定法可以用于测定水体中重金属离子的浓度。

一、实验目的1. 掌握电位滴定法的操作及确定计量点的方法;2. 学习用电位滴定法测定弱酸的pKa的原理及方法;3. 了解多元酸滴定过程中的pH变化规律。
二、实验原理电位滴定法是一种基于溶液中离子浓度变化引起的电位差变化来测定溶液中物质含量的方法。
在磷酸的电位滴定实验中,利用NaOH标准溶液滴定磷酸,通过测量滴定过程中溶液pH值的变化,确定化学计量点,进而计算磷酸的浓度。
磷酸为多元酸,其电离过程如下:H3PO4 ⇌ H2PO4- + H+ (Ka1)H2PO4- ⇌ HPO42- + H+ (Ka2)HPO42- ⇌ PO43- + H+ (Ka3)在滴定过程中,随着NaOH的加入,磷酸逐渐被中和,溶液中的氢离子浓度发生变化,从而导致pH值的变化。
当溶液中的H3PO4浓度与生成的H2PO4-浓度相等时,即半中和点时,溶液中的氢离子浓度即为电离平衡常数Ka1的负对数,即pH =pKa1。
三、仪器与试剂1. 仪器:pHS-3C型精密pH计、电磁搅拌器、25mL滴定管、移液管、100mL烧杯;2. 试剂:0.1mol·L-1磷酸液、0.1mol·L-1NaOH标准溶液、pH4.00、6.86、9.18标准缓冲溶液。
四、实验步骤1. 准备滴定体系:用移液管准确移取25.00mL 0.1mol·L-1磷酸液于100mL烧杯中,加入适量的蒸馏水,用pH计测定溶液的初始pH值;2. 滴定:用25mL滴定管准确移取10.00mL 0.1mol·L-1NaOH标准溶液,放入滴定管中,以1滴/秒的速度滴加至烧杯中的磷酸溶液中,同时用电磁搅拌器搅拌溶液;3. 测量:在滴定过程中,每隔一定时间用pH计测量溶液的pH值,记录数据;4. 绘制pH-V滴定曲线:以滴定体积为横坐标,pH值为纵坐标,绘制滴定曲线;5. 确定化学计量点:根据滴定曲线确定化学计量点,即pH值突跃点;6. 计算磷酸浓度:根据化学计量点的体积和NaOH标准溶液的浓度,按中和化学反应方程式计算磷酸的浓度。

1 实验目的1.1 进一步了解电位滴定法的原理和测定方法。
1.2 用电位滴定法测定能生成难溶化合物的离子浓度。
2 实验原理以银电极为指示电极,217型双盐桥饱和甘汞电极为参比电极,与被测卤离子溶液组成电池,用pH/mV计测定滴加AgNO3标准溶液时电池的电动势。
以电动势对滴加的AgNO3溶液的体积作图得电位滴定曲线,由电位滴定突跃确定化学计量点。
滴定过程中发生以下化学反应:Ag++X- AgX↓由于ψAg+/Ag=ψθAg+/Ag+0.059log a Ag+又a Ag+=γ[Ag+]=ψAg+/Agψ甘电池电动势E池=ψθAg+/Agψ甘+0.059logγAg+ +0.059log [Ag+]及γAg+均为定值,所以在一定的实验条件下,ψθAg+/Ag、ψ甘E池=常数+0.059log[Ag+]E池与溶液中log[Ag+]呈线性关系。
滴定卤离子混合溶液时,由于K sp(AgI)《K sp(AgBr)<K sp(AgCl)故先生成AgI沉淀,再生成AgBr沉淀,最后生成AgCl沉淀,[Ag+]由小变大,产生三次电位突跃,可分别确定三个化学计量点。
在滴定过程中,沉淀对卤离子的吸附很严重,加入凝聚剂NH4NO3可减少共沉淀,从而提高滴定分析的准确度。
用指示剂法确定上述卤离子混合液滴定的化学计量点是困难的。
其原因有:没有合适的指示剂,AgBr和AgCl的Ksp相差不大,滴定突跃较小,难以准确确定化学计量点。
3 仪器和试剂NaCl(优级纯),NH4NO3,0.1mol·L-1AgNO3溶液(溶解8.5g AgNO3于500mL二次水中,贮存于棕色试剂瓶中);pHS-2型(或其它型号)的pH/mV计,配以银电极和217型双盐桥饱和甘汞电极,电磁搅拌器及搅拌磁子;10mL滴定管、10mL移液管各一支。
4 实验步骤4.1 按pH/mV计的使用说明书调节好仪器,选择一mV档,预热0.5h后使用。

磷酸的电位滴定实验报告实验目的,通过电位滴定法测定磷酸盐的含量。
实验原理,电位滴定法是利用电位计测定反应物质的滴定终点的一种分析方法。
在本实验中,我们将利用电位滴定法来测定磷酸盐的含量。
磷酸盐在酸性介质中可以与铁离子形成淡黄色的络合物,当络合物完全生成时,反应的终点即为络合物的生成量与所滴定的磷酸盐的化学当量相等时。
通过测定滴定过程中的电位变化,可以确定滴定终点,从而计算出磷酸盐的含量。
实验步骤:1. 将待测磷酸盐样品溶解于适量的水中,加入适量的盐酸使其呈酸性溶液。
2. 将铁离子指示剂溶解于适量的水中,得到铁离子指示剂溶液。
3. 将磷酸盐溶液滴加入滴定瓶中,加入适量的铁离子指示剂溶液,开始电位滴定。
4. 在滴定过程中,记录电位随滴定液加入量的变化,当电位出现明显的跳跃或变化时,即为滴定终点。
5. 根据滴定终点时的电位值,计算出磷酸盐的含量。
实验结果:经过实验测定,得到磷酸盐的含量为x%,相对误差为x%。
实验结论:本实验利用电位滴定法成功测定了磷酸盐的含量,结果准确可靠。
通过本实验的实践,不仅加深了我们对电位滴定法的理解,也提高了我们的实验操作能力。
同时,实验结果也验证了电位滴定法在测定磷酸盐含量方面的可行性和准确性。
实验注意事项:1. 实验过程中需注意操作规范,避免溶液飞溅和溅出。
2. 滴定过程中需小心操作,注意滴定液的加入速度和滴定终点的判断。
3. 实验结束后,要及时清洗实验仪器,保持实验环境整洁。
通过本次实验,我们不仅学习了电位滴定法的基本原理和操作技巧,也掌握了测定磷酸盐含量的方法和步骤。
这将对我们今后的实验操作和科研工作有着重要的指导意义。

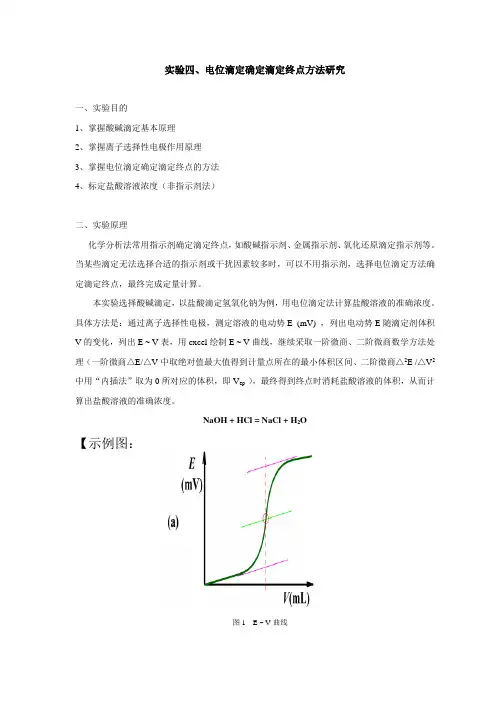
实验四、电位滴定确定滴定终点方法研究一、实验目的1、掌握酸碱滴定基本原理2、掌握离子选择性电极作用原理3、掌握电位滴定确定滴定终点的方法4、标定盐酸溶液浓度(非指示剂法)二、实验原理化学分析法常用指示剂确定滴定终点,如酸碱指示剂、金属指示剂、氧化还原滴定指示剂等。
当某些滴定无法选择合适的指示剂或干扰因素较多时,可以不用指示剂,选择电位滴定方法确定滴定终点,最终完成定量计算。
本实验选择酸碱滴定,以盐酸滴定氢氧化钠为例,用电位滴定法计算盐酸溶液的准确浓度。
具体方法是:通过离子选择性电极,测定溶液的电动势E (mV) ,列出电动势E随滴定剂体积V的变化,列出E ~ V表,用cxcel绘制E ~ V曲线,继续采取一阶微商、二阶微商数学方法处理(一阶微商△E/△V中取绝对值最大值得到计量点所在的最小体积区间、二阶微商△2E /△V2中用“内插法”取为0所对应的体积,即V ep ),最终得到终点时消耗盐酸溶液的体积,从而计算出盐酸溶液的准确浓度。
NaOH + HCl = NaCl + H2O【示例图:图1 E ~ V曲线“内插法”计算示例:】图2 △E/△V ~ V 曲线图3 △2E /△V 2 ~ V 曲线滴入的AgNO 3 体积(mL) 测量电位E (V) ΔE ΔV Δ2EΔV 224.10 0.183 0.1124.200.194 2.8 0.39 24.30 0.233 4.40.83 24.40 0.316 -5.9 0.2424.50 0.340 -1.30.1124.60 0.351 -0.4 0.0724.70 0.358mL3424954444302440243024....)..(.=+⨯-+=终点V三、实验仪器、药品仪器:+++++++型号磁力搅拌器(++++++公司)、+++++++型号酸度计(++++++公司)、托盘天平、复合电极、50mL酸式滴定管、250mL烧杯、100mL烧杯、玻璃棒、500mL试剂瓶(橡皮塞)、牛角匙、称量纸等。

电位滴定法实验报告
电位滴定法是一种常用的化学分析方法,基于电化学原理。
在电位滴定中,使用电极检测反应溶液中的电位变化,以确定反应的终点。
在实验中,我们使用了硝酸银溶液作为滴定试剂,对氯化钠溶液进行滴定。
在氯化钠溶液中,氯离子和银离子反应生成沉淀,反应式为Ag+ + Cl- → AgCl。
当滴入的硝酸银溶液与氯化钠溶液中的氯离子全部反应完毕时,电极检测到的电位会发生明显变化,此时滴定终点已到达。
实验步骤:
1. 准备滴定设备和试剂。
2. 用去离子水稀释氯化钠溶液,得到一定浓度的氯化钠溶液。
3. 将氯化钠溶液放入滴定瓶中。
4. 用滴定管将硝酸银溶液滴入氯化钠溶液中,同时使用电极检测反应溶液的电位变化。
5. 持续滴定,直到电位发生明显变化,滴定终点已到达。
6. 计算滴定所需的试剂体积和样品中氯离子的含量。
实验数据:
1. 滴定前氯化钠溶液体积:50 mL
2. 滴定前氯化钠溶液浓度:0.1 mol/L
3. 滴定过程中所用硝酸银溶液体积:10.5 mL
实验结果:
根据滴定数据计算得到,氯化钠溶液中氯离子的含量为
0.00525 mol。
实验结论:
通过本次实验,我们学习了电位滴定法的基本原理和操作技能。
通过对氯化钠溶液的滴定,我们成功地确定了样品中氯离子的含量。
此外,我们也了解了电位滴定法在化学分析中的广泛应用。
电位滴定法实验报告
本实验通过电位滴定法测定了硝酸钠溶液的浓度,并对实验结果进行了分析和讨论。
实验结果表明,电位滴定法是一种简便、快速、准确的测定方法,能够广泛应用于化学分析实验中。
实验原理:
电位滴定法是一种基于电化学原理的分析方法,它通过测量电位变化来确定溶液的浓度。
在本实验中,我们使用了一台自动滴定仪来测定硝酸钠溶液的浓度。
具体操作如下:
1. 将硝酸钠溶液样品放入滴定瓶中。
2. 加入适量的指示剂,例如亚甲基蓝。
3. 在自动滴定仪的控制下,以标准酸溶液滴定硝酸钠溶液。
4. 当溶液中的酸量大于等于硝酸钠的量时,指示剂的颜色发生变化。
5. 停止滴定,记录滴定过程中酸的体积。
实验结果:
我们测定了两组硝酸钠溶液样品的浓度,结果如下:
样品1:浓度为0.100 mol/L。
样品2:浓度为0.200 mol/L。
讨论:
通过本实验,我们发现电位滴定法是一种快速、准确的测量方法。
与其他常规的滴定法相比,电位滴定法的优点在于能够精确测量低浓度的溶液,并且不需要观察颜色变化等复杂的操作,因此可以在实验
室中得到广泛的应用。
然而,电位滴定法也存在一些缺点。
首先,这种方法对设备要求较高,需要操作自动滴定仪等专业设备;其次,电位滴定法的实验过程比较繁琐,需要进行多次滴定才能得到准确的结果。
结论:
本实验通过电位滴定法测定了硝酸钠溶液的浓度,并对实验结果进行了分析和讨论。
实验结果表明,电位滴定法是一种简便、快速、准确的测定方法,能够广泛应用于化学分析实验中。
磷酸的电位滴定一、实验目的1.了解酸碱电位滴定的原理及实验方法;了解电位滴定测定磷酸的pKa1和pKa2的方法。
2.熟悉绘制电位滴定曲线并由电位滴定曲线确定终点。
二、实验原理用0.10mo1/L 的NaOH 电位滴定0.050mo1/L 的磷酸可得到有两个pH 突跃的pH-V 曲线, 用三切线法或一阶、二阶微商法可得到终点Vep1和Vep2, 再由NaOH 溶液的准确浓度可算出酸的浓度。
当磷酸被中和至第一计量点时, 溶液由NaH2PO4组成。
在sp1之前溶液由H3PO4-H2PO4-组成。
当滴定至1/2Vsp1时, 由于c H3PO4=c H2PO4-,最好采用下列近似式计算pKa1:][][lg42431+++--=-H c H c pK pH PO H PO H a (1)式中c H3PO4.c H2PO4-分别是滴定至1/2Vsp1时H3PO4和H2PO4-的浓度。
同理, 计算pKa2可采用下列近似式:][][lg24422++-+-=--H c H c pK pH HPO PO H a (2)式中c H2PO4-、c HPO42-、分别是滴定至[V sp1+1/2(V sp2-V sp1)]时H 2PO 4-和HPO 42-的浓度。
测定pKa1和pKa2时, 以Vep1和V ep2分别代替Vsp1和Vsp2, 式(1)和(2)各组分的浓度要准确, NaOH 溶液要预先标定且不应含CO32-,盛装磷酸的烧杯要干燥, 磷酸的初始体积要准确, 滴定中不能随意加水。
电位滴定法测定磷酸的pKa1过程是: 由滴定曲线确定Vep1并计算磷酸的初始浓度, 在曲线上找到1/2 Vep1所对应的pH, 计算此时的c H3PO4.c H2PO4-, 然后代入(1)计算pKa1。
测定磷酸的pKa2可按同样的步骤进行。
表中VV E V E V E ∆⎪⎭⎫ ⎝⎛∆∆-⎪⎭⎫ ⎝⎛∆∆=∆∆1222 在接近滴定终点时, 加入△V 为等体积。
实验: K2Cr2O7电位滴定法测亚铁一、目的要求1.学会用K2Cr2O7电位滴定法测亚铁的原理及技术;2.进一步熟练掌握离子计的使用;3.掌握二阶微商法计算滴定终点的方法。
二、实验原理用K2Cr2O7溶液滴定Fe2+的反应为:Cr 2O27+ 6Fe 2++14H +=2Cr 3++ 6Fe 3++7H 2O用铂电极作指示电极, 饱和甘汞电极作参比电极组成原电池。
在滴定过程中, 由于滴定剂(Cr2O2-7)的加入, 待测离子氧化态(Fe3+)和还原态(Fe2+)的活度(或浓度)比值发生变化, 铂电极的电位亦发生变化, 在等量点附近产生电位突跃, 用二阶微商法确定终点。
三、试剂与仪器1.c(K2Cr2O7)= 0.0168mol/L 的K2Cr2O7标准溶液2、H2SO4—H3PO4混酸:150mL 浓H2SO4加放700mL 水中, 充分搅拌, 冷却后再加150mL H3PO4, 混匀即可。
3.硫酸亚铁铵待测溶液4.酸度计(或离子计、电极电位仪)5.电磁搅拌器6.铂电极 7、饱和甘汞电极 8、50mL 酸式滴定管 9、25mL 移液管 四、实验步骤1.准确移取15.00mL 硫酸亚铁铵待测溶液于250mL 烧杯中, 加入H2SO4—H3PO4混酸15mL , 并用蒸馏水稀释至约100mL 。
2.用预处理了的铂电极与饱和甘汞电极及待测液构成电池, 同时开始搅拌, 以离子计测定其电动热并记录。
预滴定一次, 确定大致的终点体积。
3.再另取同样两份试样, 进行正式滴定。
加入适量体积K2Cr2O7标准溶液(0.0168mol/L), 测电动势、记录;再加K2Cr2O7标准溶液, 测电动势、记录。
如此连续操作。
4、当电动势变化较大时, 改为每加0.1mL K2Cr2O7标准溶液读一次电位值。
5、用二阶微分计算法求出V e.p, 计算待测液中Fe的浓度(g/ L)。
五、实验数据记录及处理标准溶液名称及浓度取样体积仪器型号参比电极指示电极终点体积计算(mL): 1. 2.结果计算公式:结果计算(g/L): 1. 2.结果计算平均值: ;相对平均偏差:。
电位滴定法实验报告
电位滴定法是利用电位计测定滴定过程中电势变化的方法,从而确定反应滴定终点的一种分析方法。
在本实验中,首先将硫酸铜溶液中的 Cu2+ 与 EDTA 配合物进行滴定,当所有的 Cu2+ 与 EDTA 配合物反应完毕后,多余的 EDTA 配合物会与 Zn2+ 反应,此时电位会发生剧烈变化,即为滴定终点。
实验步骤:
1. 准备好所需试剂,包括硫酸铜溶液、EDTA 四钠盐溶液、氨水、氢氧化钠溶液、硝酸铅溶液等。
2. 取一定量的硫酸铜溶液置于滴定瓶中,加入适量的氨水和氢氧化钠溶液,调节 pH 值至 9.5 左右。
3. 进行电位滴定,将 EDTA 四钠盐溶液滴入硫酸铜溶液中,并用电位计记录电位变化,待电位发生剧烈变化时,滴定结束。
4. 记录滴定过程中所使用的 EDTA 四钠盐溶液的体积,计算出硫酸铜溶液中 Cu2+ 的摩尔浓度。
5. 进行平行实验,重复以上步骤,取平均值。
实验结果:
第一次实验滴定体积为 24.6 mL,第二次实验滴定体积为 24.8 mL,两次实验的平均值为 24.7 mL。
根据计算可得,硫酸铜溶液中Cu2+ 的摩尔浓度为 0.0494 mol/L。
结论:
本实验通过电位滴定法测定硫酸铜溶液中的 Cu2+ 含量,得出
硫酸铜溶液中 Cu2+ 的摩尔浓度为 0.0494 mol/L。
该实验结果具有一定的准确性和可靠性。
一、实验目的1. 了解电位滴定的基本原理和操作技术;2. 学习运用电位滴定法测定醋酸的含量;3. 掌握电位滴定曲线的绘制和分析方法。
二、实验原理电位滴定法是一种基于电位变化确定滴定终点的滴定方法。
在滴定过程中,滴定剂的加入会导致溶液中离子浓度的变化,进而引起电位的变化。
当滴定剂与被测物质恰好完全反应时,电位变化达到最大值,此时的电位即为滴定终点。
醋酸(CH3COOH)是一种弱酸,其与氢氧化钠(NaOH)反应的化学方程式为:CH3COOH + NaOH → CH3COONa + H2O在滴定过程中,当醋酸与氢氧化钠恰好完全反应时,溶液中的氢离子浓度(H+)和氢氧根离子浓度(OH-)达到平衡,电位达到最大值。
通过测量电位变化,可以确定滴定终点。
三、实验器材与试剂1. 器材:电位滴定仪、烧杯、移液管、滴定管、电极、玻璃棒、洗耳球、滴定架等。
2. 试剂:醋酸溶液(待测)、氢氧化钠溶液(标准溶液)、酚酞指示剂、去离子水等。
四、实验步骤1. 配制醋酸溶液:用移液管准确量取一定体积的醋酸溶液,转移至烧杯中,用去离子水稀释至一定体积,备用。
2. 标定氢氧化钠溶液:用移液管准确量取一定体积的氢氧化钠溶液,转移至锥形瓶中,加入适量的酚酞指示剂,用去离子水稀释至一定体积。
将滴定管充满氢氧化钠溶液,将滴定管尖端插入锥形瓶中,缓慢滴定至溶液颜色发生突变,记录消耗的氢氧化钠溶液体积。
3. 进行电位滴定:用移液管准确量取一定体积的醋酸溶液,转移至烧杯中,加入适量的酚酞指示剂,用去离子水稀释至一定体积。
将电极插入溶液中,打开电位滴定仪,记录初始电位。
缓慢滴定氢氧化钠溶液,观察电位变化,记录电位最大值时的氢氧化钠溶液体积。
4. 绘制电位滴定曲线:以氢氧化钠溶液体积为横坐标,电位为纵坐标,绘制电位滴定曲线。
五、实验结果与分析1. 氢氧化钠溶液的标定结果:根据标定结果,计算氢氧化钠溶液的浓度为:C(NaOH) = (m 1000) / (M V(NaOH))其中,m为称取的氢氧化钠质量,M为氢氧化钠的摩尔质量,V(NaOH)为消耗的氢氧化钠溶液体积。