第7章电化学基础.
- 格式:ppt
- 大小:1.42 MB
- 文档页数:61







第7章氧化还原反应电化学基础一、单选题1. 下列电对中,Eθ值最小的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C: 1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防止配制的SnCl2 溶液中Sn2+被完全氧化,最好的方法是:A: 加入Sn 粒B:. 加Fe 屑C: 通入H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发生氧化还原反应。

电化学基础第7章习题答案电化学是研究电与化学之间相互关系的学科,涉及到电解、电极反应、电解质溶液、电池等内容。
在电化学的学习过程中,习题的解答是巩固知识和提高能力的重要方法。
本文将针对电化学基础第7章的习题进行解答,帮助读者更好地理解电化学的相关概念和原理。
1. 电解质溶液的电导率与浓度的关系是什么?电解质溶液的电导率与浓度呈正相关关系。
当溶液中电解质浓度增加时,溶液中的离子数目增多,离子间的碰撞频率增加,导致电流的传导能力增强,电导率也随之增加。
2. 什么是电导率极限?电导率极限是指在无限稀释条件下,电解质溶液的电导率达到的最大值。
当溶液中电解质的浓度趋近于无限稀释时,离子间的相互作用减弱,离子迁移速率趋于极限值,因此电导率也趋于极限值。
3. 什么是电解质溶液的离子迁移率?电解质溶液的离子迁移率是指离子在电场作用下迁移的速率。
离子迁移率与离子的电荷量、电场强度以及溶液中的粘度等因素有关。
一般来说,阳离子的迁移率大于阴离子的迁移率。
4. 什么是电解质溶液的电导率测量方法?电解质溶液的电导率可以通过电导仪进行测量。
电导仪是一种测量电解质溶液电导率的仪器,通过测量电解质溶液中的电流和电压,计算得到电导率的数值。
电导仪的原理是根据欧姆定律,通过测量电流和电压的比值来确定电解质溶液的电导率。
5. 什么是电解质溶液的电解过程?电解质溶液的电解过程是指在外加电压的作用下,电解质溶液中的阳离子和阴离子被迁移到电极上,发生氧化还原反应的过程。
在电解过程中,阳离子会向阴极迁移,发生还原反应;阴离子则向阳极迁移,发生氧化反应。
电解质溶液的电解过程是电池和电解质溶液的基础。
6. 什么是电解质溶液的电解电位?电解质溶液的电解电位是指在电解质溶液中发生氧化还原反应时,电极上的电位差。
电解电位可以通过测量电解质溶液中的电流和电压,计算得到。
电解电位的大小决定了电解过程的方向和速率。
7. 什么是电解质溶液的离子迁移数?电解质溶液的离子迁移数是指单位时间内离子的迁移量。


§7.1 氧化还原反应的基本概念•氧化还原反应由氧化反应和还原反应两个半反应组成一、氧化态•定义:氧化态(氧化数)是元素一个原子的形式电荷,这种形式电荷是由假设两个键中的电子指定给电负性更大的原子而求得(以化合价为基础)•氧化态是按一定规则(人为规定)指定的形式电荷的数值(可以是负数、正数、零or分数)。
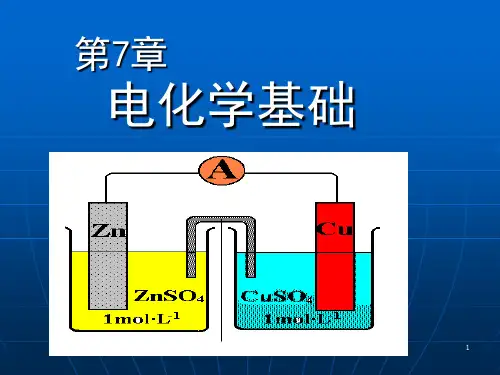
二、确定氧化态的规则1. 离子型化合物中,元素的氧化数等于该离子所带的电荷数2. 共价型化合物中,共用电子对偏向于电负性大的原子,两原子的形式电荷数即为它们的氧化数3. 单质中,元素的氧化数为零;离子Xn-氧化数为n-4. 中性分子中,各元素原子的氧化数的代数和为零,复杂离子的电荷等于各元素氧化数的代数和5. 氢的氧化数一般为+1,在金属氢化物中为-1,如NaH6. 氧的氧化数一般为(-II),例外有-I、+I、+II等,在过氧化物中为-1,如Na2O2 ,在超氧化物中为-0.5,如KO2 ,在氧的氟化物中为+1或+2,如O2F2 和OF2中7. 氧化数可以是分数Fe3O4(Fe2O3·FeO),Fe的氧化数为8/3,可见是平均氧化数•氧化数、化合价、化学键数的区分§7.2电化学电池一、原电池•借助于氧化还原反应将化学能直接转变成电能的装置。
理论上,任何氧化还原反应都可以设计为原电池。
•要求:(1) 自发氧化还原反应(2)装置,氧化过程和还原过程分别在不同的电极上进行,电极之间要通过导线和盐桥连接。
•盐桥:饱和的电解质溶液。
如KCl 溶液。
•目的:保持溶液电中性——由于K+和Cl-的定向移动,使两池中过剩的正负电荷得到平衡,恢复电中性。
于是两个半电池反应乃至电池反应得以继续,电流得以维持。
•原电池装置可用简单的符号表示,称为电池图示。
例:Daniell电池的电池图示——(-) Zn | Zn2+(c1) ||Cu2+(c2) | Cu (+)•原电池符号的要求:(1) 负极在左,正极在右(2) 按顺序排列各物质,两相之间的界面用“ | ”隔开(3) 盐桥用“||”表示(4) 溶液需标出浓度,气体需标出压力§7.3电极电势一、原电池的电动势原电池的电动势E MF等于正极的电极电势E(+)减去负极的电极电势E(-) 。