2007年全国高中化学竞赛甘肃预赛试题
- 格式:doc
- 大小:283.50 KB
- 文档页数:8

2007年全国化学竞赛初赛模拟试卷(01)(时间:3小时 满分:100分)第题(2分)右图是同学们经常使用的某品牌修正液包装标签。
请仔细阅读,结合第题(5分)羟胺(NH 2OH )熔点33.05℃,沸点56.5℃,是有机合成上最常用的还原剂,工业上可电解硝酸制得,羟胺盐酸盐在工业上用途非常广泛。
第题(8分)磺酸型离子交换树脂是最常见的阳离子交换树脂。
1.某磺酸型离子交换树脂X (网型)由常见单体烃A 和交联剂烃B 通过加聚、磺化反应而得树脂。
已知X 中C 、H 原子个数比是1︰1。
写出满足条件的A 、B 的结构简式;CH 3N OH3.除阳离子交换树脂外还有阴离子交换树脂,阴离子交换树脂的结构上有什么特点?4.如何用阴、阳离子交换树脂制备去离子水,简要说明。
第题(7分)某离子化合物钾盐X具有超导性,超导临界温度为18K。
它的晶体结构经测定阴离子作立方面心密堆积,K+填充在全部八面体和四面体空隙中,晶胞参数a=1424pm,晶体密度1.928g/cm3。
.计算该晶体的摩尔质量;.确定该晶体的化学式;K+的投影,◎表示2个K +的重叠投影)。
第题(10分)杂多化合物是一类含有氧桥的多核配合物,由于具有独特的分子结构及分子易于设计和组装的特点,现已广泛用作新型高效催化剂、药物、磁性材料、高质子导体……1.右图所示为1︰6系列的平面型杂多阴离子的典型代表,配离子Mo(Ⅵ)与氧形成八面体配位,杂原子I(Ⅶ)。
2.右图所示为1︰12系列的四面体型杂多阴离子的典型代表,配离子Mo(Ⅵ)与氧形成八面体配位,杂原子P(Ⅴ)。
,具体说明理由(假设MoO6八面体都等价)。
第题(8分)HPE 是合成苯氧基及杂环氧基苯氧基丙酸类除草剂的重要中间体,其结构简式如右图所示:第题(9分)为确定晶体X 的化学式,某学生取该晶体1.252g ,以水溶解,配成100.0mL 溶液(以下称X 液),经下列测定步骤:(1)取X 液3.00mL ,用硝酸及氢氧化钠调至pH =7,以铬酸钾作指示剂,用0.0200mol ·L -1硝酸银滴至砖红色铬酸银沉淀出现,消耗硝酸银溶液15.00mL ;(2)取X 液3.00mL ,用硝酸调至pH =1,加入25.00mL 0.0300mol ·L -1硝酸银溶液,振荡后,再加入硝基苯,用0.0200mol ·L -1硫氰化钾溶液滴至终点,消耗硫氰化钾溶液15.00mL ;(3)取X 液10.0mL ,加入10.0mL 2.00mol ·L -1氢氧化钠溶液,加热蒸馏,馏出物用50.00mL 0.100mol ·L -1盐酸吸收,蒸馏半小时后,用0.100mol ·L -1氢氧化钠溶液滴定盐酸吸收液至甲基红变黄,消耗氢氧化钠溶液25.00mL ;(4)取X 液5.00mL ,用硝酸调至pH =5~6,加入10mL 、pH =5.5的缓冲溶液,以二甲酚橙作指示剂,用0.0100mol ·L -1EDTA 溶液滴至终点,消耗EDTA 溶液25.00mL 。

2004年全国高中学生化学奥林匹克竞赛甘肃省预赛试题答案第一题:按要求选择出适当答案,每题3分,共60分第二题简答和填空题(本题包括10小题,共60分)21.(4分)87.5g22.(9分)c (CO32-)> c (OH-)(4分)已知K1=c (H+)•c (HCO3-)/c (H2CO3) (1)K2 = c (H+)•c (CO32-)/c (HCO3-) (2)在NaHCO3溶液中存在如下平衡:电荷守恒:c (Na+)+c (H+)=c (HCO3-)+2c (CO32-)+c (OH-) (3)(1分)物料守恒:c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) (4)(1分)(3)、(4)两式相减得质子守恒:c (H+)+c (H2CO3)=c (CO32-)+c (OH-) (5)(1分)将(1)、(2)两式代入(5)式得:c (H+)+c (H+) c (HCO3-)/K1 = K w/c (H+)+ K2 c (HCO3-)/c (H+);(1分)由于c (HCO3-)≈0.1mol.L-1则:cK2 » Kw;c »K1 整理得:c (H+)≈(K1K2)1/2 = 4.91×10-9mol.L-1 c (OH-)= 2.04×10-6mol.L-1将c (H+)和c (HCO3-)代入(2)得:c (CO32-)= 1.14×10-3mol.L-1 > c (OH-)(1分)评分说明:只有观点,无证明过程不得分,观点正确,过程不完整的酌情给分。
23.(6分)(1)因为勒沙特列定律只适合于一个物理量变化的情况,而对于两个或多个物理量同时变化的情况不一定适宜,本题就属于两个物理量(浓度和压强)同时变化的情况。
(2)平衡应向逆反应方向移动。
可将本过程解析为两个阶段:首先保持压强不变,再加入1molPCl5,体积增大一倍,浓度不变,平衡不移动;然后增大压强,缩小体积,平衡向逆向移动。

中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷(2012年9月2日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
允许使用非编程计算器以及直尺等文具第1题(7分)1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。
简述实验现象并写出两步主要反应的离子方程式。
无色溶液产生白色沉淀,后逐渐溶解(1分,如只写白色沉淀溶解不扣分,未表明白色,扣0.5分)(1)Zn2++2NH3+2H2O=Zn(OH)2↓+2NH4+(1分)写成如下形式均给分:Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+[Zn(H2O)6]2++2NH3·H2O=Zn(OH)2↓+2NH4+ +6H2O[Zn(H2O)6]2++2NH3=Zn(OH)2↓+2NH4+ +2H2O(2)Zn(OH)2 + 2NH4+ +2NH3 = [Zn(NH3)4]2+ +2H2O如写成Zn(OH)2 +4NH3 = [Zn(NH3)4]2+ +2OH—也对,如产物写成[Zn(NH3)6]2+扣0.5分,因主要产物是[Zn(NH3)4]2+1-2 化合物[Cu(Pydc)(amp)] ·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。
第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。
Pydc和amp是含有芳环的有机配体。
通过计算回答:(1)第一步失重失去的组分。

2007年全国化学竞赛初赛模拟试卷(09)(时间:3小时满分:100分)第题(5分)X的单质是一种软的、白色的、较活泼的金属;该元素的克拉克值低、分布分散、绝大部分伴生在有色金属、煤和铁矿中;X元素的世界储量不大,而我国的资源储量居世界前茅。
其化合物XP、XAs y P1-y是人们熟悉的半导体材料。
X在高价化合物中比在其低价化合物中稳定。
目前,具有层状结构的特殊性能物质(该金属的非整比化合物)Cd0.5Ga2XS5和Hg0.8Ga1.6X1.2S5正在深入研究。
第题(5分)第题(5分)Mn3O4的用途很广,在电子工业上,它是生产软磁铁氧体的原料,而软磁铁氧体则广泛地用作磁记录材料;在化学工业上,它可用作多种反应的催化剂。
可以高锰酸钾与乙醇(1g︰80mL)为反应物在较低的温度下制备出Mn3O4纳米粉体。
4的反应就基本完全;而对于无水乙醇,反应到相同程度则需要24h以上。
解释反应速率加快的第题(5分)以烯丙基溴和硫脲为原料,在相转移催化剂四丁基溴化铵的作用下,以水作溶剂,分三步反应合成了烯丙硫醇。
已知这三步反应在不同的pH条件下进行(酸性、中性、碱性,未按顺第题(8分)在乙醇溶液中,电解钛片4h,然后电解铅片2h,每隔30min加入0.1mL乙酰丙酮,制得中间体A,然后在一定条件下水解得到纳米材料B。
A是不定组成型物质,红外光谱显示A中存在C=C、C=O等官能团。
第题(10分)光合作用是绿色植物和其他自养型生物利用光能由简单化合物合成高能复杂分子的过程。
光合作用中叶绿素分子与特殊的酶分子受体(MS )相结合,发生一系列氧化还原反应。
科学家们发现光合作用还存在许多变化形式,如有些细菌可用H 2S 代替H 2O 进行光合作用生成结构与性质完全相似的产物。
我国科学家早在1946年就发现铀吸收中子后可发生核裂变分裂成较小的碎片。
如以一个漫中子轰击23592U 发生核裂变时,能产生两种核素72X 、16062Sm 和若干快中子。

3 3 中国化学会第 21 届(2007 年)全国高中学生化学竞赛(省级赛区)试题答案及评分标准H1.008相对原子质量He 4.003Li BeB C N O F Ne 6.941 9.01210.81 12.01 14.01 16.00 19.00 20.18 Na MgAl Si P S Cl Ar 22.99 24.3126.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb TeI Xe 85.47 87.62 88.91 91.22 92.91 95.94 98.91 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 La -Lu 178.5 180.9 183.9 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr Ra[223] [226] A c-Lr Rf Db Sg Bh Hs Mt Ds Rg第 1 题(12 分)通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成 Si(OH)4。
1-1 已知反应分两步进行,试用化学方程式表示上述溶解过程。
(2 分)Si + 4OH = SiO 44+ 2 H 2 (1 分) SiO 44+ 4H 2O = Si(OH)4 + 4OH (1 分)若写成 Si + 2OH+ H 2O = SiO 2+ 2 H 2SiO 2+ 3H 2O = Si(OH)4 + 2OH,也得同样的分。
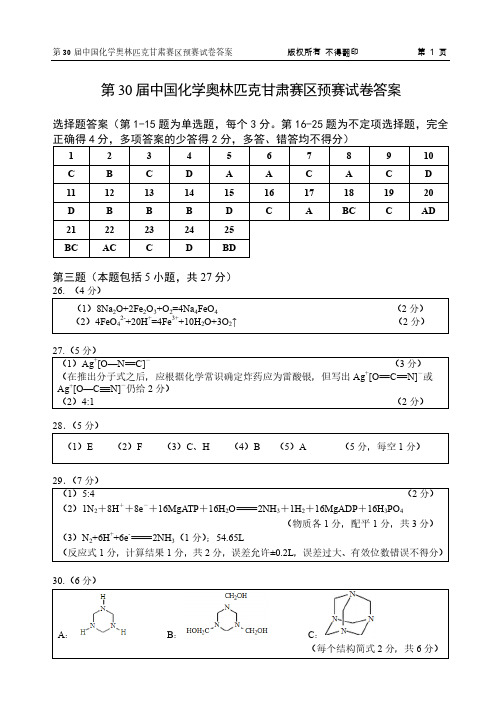
1、下列关于原子结构的说法中,正确的是:A. 原子由原子核和核外电子构成,核外电子带正电B. 原子核位于原子的中心,集中了原子的全部正电荷及几乎全部的质量C. 原子核内的质子数与中子数一定相等D. 不同元素的原子,其核外电子排布方式一定相同(解析)原子由原子核和绕核运动的电子构成,电子带负电,A错误;原子核位于原子中心,集中了原子的几乎全部质量和全部正电荷,B正确;原子核内的质子数决定了元素的种类,但质子数与中子数不一定相等,如氢原子中无中子,C错误;不同元素的原子,其核外电子排布方式一般不同,这是元素性质差异的基础,D错误。
(答案)B2、下列关于化学键的叙述中,错误的是:A. 离子键是阴、阳离子通过静电作用所形成的化学键B. 共价键是原子之间通过共用电子对所形成的化学键C. 非极性共价键只存在于同种非金属元素原子之间D. 离子化合物中一定含有离子键,但也可能含有共价键(解析)离子键是阴、阳离子间通过静电引力形成的,A正确;共价键是原子间通过共享电子对达到稳定结构的方式,B正确;非极性共价键不仅存在于同种非金属元素原子之间,如氧气分子中的O=O键,也存在于某些不同种非金属元素原子之间,如碳原子与氧原子在过氧化氢分子中形成的C-O键即为非极性键,C错误;离子化合物由离子构成,必然含有离子键,但其中的阴离子或阳离子团内部可能含有共价键,如氢氧化钠,D正确。
(答案)C3、下列关于元素周期律的叙述中,正确的是:A. 随着原子序数的递增,元素的原子半径逐渐增大B. 元素的非金属性越强,其气态氢化物越稳定C. 同周期元素从左到右,金属性逐渐增强D. 同主族元素从上到下,其单质的氧化性逐渐增强(解析)元素周期律表明,随着原子序数的递增,同周期元素原子半径逐渐减小,同主族元素原子半径逐渐增大,A错误;元素的非金属性越强,其与氢元素形成的共价键越稳定,因此其气态氢化物越稳定,B正确;同周期元素从左到右,金属性逐渐减弱,非金属性逐渐增强,C错误;同主族元素从上到下,金属性逐渐增强,非金属性逐渐减弱,因此其单质的还原性增强,氧化性减弱,D错误。
我爱奥赛网2007年第四届“我爱奥赛杯”高中化学竞赛试题(考试时间:2007年8月26日 9:00 - 12:00)题号 1 2 3 4 5 6 7 8 9 10 11 12 总分满分 5 4 6 11 6 8 12 11 9 11 8 9 100 得分 评卷人● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 姓名、考号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 请将答案写在指定的位置。
●允许使用非编程计算器以及直尺等文具。
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLiBeB C N O F Na M g Al Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se BrRb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量RfDbSgBhHsMt第1题(5分)最近美国科学家利用世界上最大的绿湾射电天文望远镜(Robert C. Byrd Green Bank Telescope ,简称GBT)所得到的太空数据,发现了宇宙空间中迄今为止最大的负离子(anion)C 8H —。
中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷(2012年9月2日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
允许使用非编程计算器以及直尺等文具第1题(7分)1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。
简述实验现象并写出两步主要反应的离子方程式。
无色溶液产生白色沉淀,后逐渐溶解(1分,如只写白色沉淀溶解不扣分,未表明白色,扣0.5分)(1)Zn2++2NH3+2H2O=Zn(OH)2↓+2NH4+(1分)写成如下形式均给分:Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+[Zn(H2O)6]2++2NH3·H2O=Zn(OH)2↓+2NH4+ +6H2O[Zn(H2O)6]2++2NH3=Zn(OH)2↓+2NH4+ +2H2O(2)Zn(OH)2 + 2NH4+ +2NH3 = [Zn(NH3)4]2+ +2H2O如写成Zn(OH)2 +4NH3 = [Zn(NH3)4]2+ +2OH—也对,如产物写成[Zn(NH3)6]2+扣0.5分,因主要产物是[Zn(NH3)4]2+1-2 化合物[Cu(Pydc)(amp)] ·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。
第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。
Pydc和amp是含有芳环的有机配体。
通过计算回答:(1)第一步失重失去的组分。
2005年全国⾼中学⽣化学奥林匹克竞赛⽢肃省预赛试题答案2005年全国⾼中学⽣化学奥林匹克竞赛⽢肃省预赛试题答案(2005年5⽉29⽇9︰00-12︰00 共计3⼩时)第⼀题选择题(各题中只有⼀个选项符合题⽬要求,每题3分,共60分)第⼆题选择题(每⼩题有1~2个选项符合题意。
若有两个正确选项,只选⼀个且正确的给2分,多选、错选都给0分,每题3分,共30分)第三题填空或回答(本题包括5⼩题,共25分)31.(3分)H2O2分⼦间存在氢键(1分),在液态或固态中存在缔合现象,所以熔、沸点⾼(1分);与⽔分⼦可形成氢键,所以溶解度⼤(1分)。
32.(3分)氟碳化合物溶解氧⽓的能⼒较强,使得氟碳化合物溶液中有⾜够的氧⽓供⽼⿏呼吸。
33.(4分)Vm=acsinβ·bN A=487.53(cm3)(1分)1mol晶胞的质量总数m=487.53×1.66=809.29(g)(1分)M=167+36.5n,显然只能含4个分⼦(1分)4×(167+36.5n)=809.29 n=0.97≈1(1分)34.(6分)1.在酰胺中,N上的未共⽤电⼦占碳氢双键共轭⽽离城,使N上的电⼦云密度降低,故没有胺那样的碱性。
邻苯⼆甲酸亚胺仲盐的负离⼦有很⼤的共振稳定性,因⽽使其共轭酸酸性⼤⼤增强。
(3分)2.质⼦化发⽣在氧上⽐在氮上的结构稳定。
(1分)因为得到共振⽽稳定如在质⼦化的氮上,则⽆以上的共振稳定作⽤。
(2分)35.(9分)(1)HCl(1分)Fe3O4(1分)FeCl3(1分)(2)催化(1分)氧化(1分)(3)KClO3(1分)H2O2(1分)(4)MnO2+4HCl(浓)MnCl2+C12↑+2H2O(2分)第四题综合题(本题包括5⼩题,共35分)36.(6分)1.BBr3+PBr3+3H2=BP+6HBr(1分)2.BBr3:平⾯正三⾓形,PBr3:三⾓锥形。
(2分)3.每个晶胞中有4个BP(1分)4.晶胞体积V=1.092×10-22cm3ρ=4M/N A V=2.554g/cm3(2分)37.(4分)从臭氧分解最后产物可推断出烯烃的结构:⽽从题中可知此烯是季铵碱的Hofmann消除得到的。
2007年全国高中学生化学竞赛甘肃省预赛试题1.化学概念在逻辑上存在如下关系:包含关系 并列关系 交叉关系 对下列概念的说法正确的是A .纯净物与混合物属于包含关系B .化合物与碱性氧化物属于包含关系C .单质与化合物属于交叉关系D .氧化还原反应与分解反应属于并列关系 2.世界上许多科学家都强烈反对发展超音速运输飞机(SST ),其主要原因是 A .燃料燃烧时,尾气中的氮氧化物易发生爆炸B .燃料燃烧时,尾气中的氮氧化物易腐蚀飞机发动机C .燃料燃烧时,尾气中的氮氧化物会严重破坏臭氧层D .燃料燃烧时,尾气中的氮氧化物导致光化学烟雾3.在含有氯化铁、氯化亚铁、氯化铝、氯化钠的混合溶液中加入足量的过氧化钠固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是 A .Na + B .Al 3+ C .Fe 3+ D .Fe 2+4、2007年诺贝尔化学奖授予德国化学家Gerhard Ertl ,以表彰他在表面化学领域研究所取得的开拓性成就。
某反应在Pt/Al 2O 3/Ba 催化剂表面吸附与解吸作用的机理如下图所示(图中HC 表示碳氢化合物,nitrate 指硝酸盐),该机理研究是指A .汽车尾气催化转化处理B .钢铁生锈机理C .合成氨工业催化氧化机理D .氢氧燃烧电池电极反应机理5.我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等。
月球的矿产资源极为丰富,仅月球表面5cm 厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi 2O 6]、斜长石[KAlSi 3O 8]和橄榄石[(MgFe)2SiO 4]等,下列说法或分析不正确的是 A .辉石、斜长石及橄榄石均属于硅酸盐矿B .斜长石的氧化物形式可表示为:K 2O ·Al 2O 3·6SiO 2C .橄榄石中铁为+2价A BCO 2D .月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱6.右图为电解饱和食盐水的简易装置,下列有关说法正确的是A .电解一段时间后往蛋壳中溶液滴加几滴酚酞,呈红色B .蛋壳表面缠绕铁丝发生氧化反应C .铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝D .蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触7.对于以下反应:A (s )+3B (g ) 2C (g )+D (g ),在一定温 度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时 就可确定一定达到平衡状态的是 A .容器的体积不再发生变化B .B 的生成速率和D 的反应反应速率为3∶1C .混合气体的密度不随时间变化D .B 、C 、D 的分子数之比为3∶2∶18.能在溶液中大量共存、且加入(NH 4)2Fe(SO 4)2·6H 2O 晶体后仍能大量存在的离子组是 A .Na +、H +、Cl -、NO 3- B .K +、Ba 2+、OH -、I - C .Na +、Mg 2+、Cl -、SO 42- D .Cu 2+、S 2-、Br -、ClO -9.X 、Y 、Z 、W 四种主族元素,若X 的阳离子与Y 的阴离子具有相同的电子层结构;W 的阳离子的氧化性强于等电荷数的X 阳离子的氧化性;Z 阴离子半径大于等电荷数的Y 的阴离子半径,则四种元素的原子序数由大到小的顺序是 A .ZXYW B .WXYZ C .XYZW D .ZYXW 10、在一定体积pH =12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO 4溶液,当溶液中的Ba 2+恰好完全沉淀时,溶液pH =11。
若反应后溶液的体积等于Ba(OH)2溶液与NaHSO 4溶液的体积之和,则Ba(OH)2溶液与NaHSO 4溶液的体积比是 A .1∶1 B .1∶2 C .1∶3 D .1∶4二、选择题(本题共8小题,每小题4分,共32分。
每小题有1或2个选项符合题意,若有2个正确选项,只选1个且正确给2分,多选、错选都给0分。
) 11.下列离子方程式正确的是A .含有等物质的量的氢氧化钡、明矾两种溶液混合:3Ba 2++6OH -+2Al 3++3SO 42-=3BaSO 4↓+2Al(OH)3↓B .纯碱溶液与胆矾溶液混合生成正盐、酸式盐、碱式盐: 3CO 32-+2Cu 2++2H 2O=2HCO 3-+Cu2(OH)2CO 3↓C .H 218O 中投入Na 2O 2固体:2H 218O +2O 22-=4OH -+18O 2D .0.1mol/L CuCl 2溶液中加入0.1mol/L NaHS 溶液:Cu 2++2HS -+2H 2O=Cu(OH)2↓+2H 2S ↑12.液态锂离子电池是指Li +嵌入化合物为正负电池的二次电池。
正极采用锂化合物LiCoO 2,负极采用碳电极,充电后成为锂-碳层间化合物Li x C 6(0<x ≤1),电解质为溶解有锂盐LiPF 6、LiAsF 6等的有机溶液。
下列有关说法不正确的是A .将LiCoO 2改写成为氧化物的形式为Li 2O ·Co 2O 3B .该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性C .Li 是3号元素,是最轻的金属之一,这类电池质能比高D .在电池充放电时,Li +在两个电极之间往返嵌入和脱嵌。
该电池的充放电反应方程式为:LiCoO 2+6C充电 放电Li 1-x CoO 2+Li x C 613.经X 射线研究证明,固态PCl 5由空间构型分别是正四面体和正八面体的两种离子构成。
下列关于PCl 5的说法正确的是A .固态的PCl 5中存在离子键,可看作是离子晶体B .固态的PCl 5全部是共价键,可看作是原子晶体C .固态的PCl 5是由[PCl 4]+和[PCl 6]-构成,且离子数目之比为1∶1D .固态的PCl 5具有良好的导电性14.右图是一种形状酷似罗马两面神Janus 的有机物结构简式,化学家建议将该分子叫做“Janusene ”,有关Janusene 的说法正确的是 A .Janusene 的分子式为C 30H 22 B .Janusene 属于苯的同系物C .Janusene 苯环上的一氯代物有6种D .Janusene 既可发生氧化反应,有可发生还原反应15.稗草烯:α-(2,2,2-三氯乙基)苯乙烯,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草。
温度和湿度对药效影响较大,温度高、湿度大时药效发挥快。
在同一剂量下,15℃以下只能起到抑制作用,25℃以上3-5天杂草就枯死。
一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害。
已知:同一碳原子上连两个羟基不稳定(→ C OH )。
下列说法不正确的是 A .该物质能使溴水褪色B .该物质能在碱性条件下可水解生成有机酸钠盐C .可用在光照条件下与Cl 2通过取代反应制得纯度较高的稗草烯D .稗草烯在一定条件下可发生加聚反应16.用坩锅钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。
下列关于上述实验现象的解释正确的是 A .火焰温度太低不能使铝燃烧 B .铝在空气种能很快形成氧化膜 C .氧化铝的熔点比铝的熔点高 D .用酸处理时未能将氧化铝溶解17.在25mL 0.1mol/L NaOH 溶液中逐滴加入0.2mol/L CH 3COOH 溶液,曲线如下图所示,有关粒子浓度关系正确的是A .在A 、B 间任一点,溶液中一定都有c(Na +)>c(CH 3COO -)>c(OH -)>c(H +)B .在B 点,a >12.5,且有c(Na +)=c(CH 3COO -)=c(OH -)=c(H +)C .在C 点:c(CH 3COO -)>c(Na +)>c(H +)>c(OH -)D .在D 点:c(CH 3COO -)+c(CH 3COOH)=2c(Na +) 18.主链为n 个碳原子的烷烃(已知n ≥4),用二个甲基去取代主链碳上的氢原子,规定二个甲基不能取代同一个碳原子上的氢原子,这样所形成的主链仍为n 个碳原子的同分异构体数目可能为 A .(2n-1)2B .(n-1)2C .41(n -3)(n -2) D .41(n -3)(n -1) 三、本题包括2小题,共20分C OHOHCH2CH 2CCl 3C CH 2CH 2CH 3)/mL19.(11分)有机物X 是某农药合成过程中的一种中间体,其分子结构可用下式表示:OOCl HO(1)下列有关X 发生化学反应的叙述中正确的是 ; A .在氢氧化钠醇溶液中共热能发生消去反应B .在铜作催化剂时加热,可被氧气氧化生成能发生银镜反应的物质C .在浓硫酸存在时加热可发生消去反应D .在铁作催化剂时,可跟液溴发生取代反应(2)写出X 跟足量氢氧化钠稀溶液共热时所发生反应的化学方程式: ; (3)X 有多种同分异构体,符合下列条件的同分异构体共有 种, ①苯环上只有分处在对位的两个取代基②遇氯化铁溶液不变色,但遇pH 试纸显红色③跟氢氧化钠稀溶液共热时除生成两种含碳元素的盐外(其中一种是碳酸钠),没有生成其它含碳元素的产物。
用一个结构简式表示符合上述条件的各种同分异构体 。
20.(9分)由C 、H 、O 三种元素组成的化合物A ,其蒸气密度是相同状态下H 2密度的30倍。
将30g A 充分燃烧,产物被足量烧碱溶液吸收,烧碱溶液增重44g 。
已知A 能与NaHCO 3反应生成CO 2。
回答下列问题:(1)有机物B 与A 相对分子质量相同,A 与B 之间能发生酯化反应,生成有机物C ;B烃基上的一氯取代产物有3种。
C 的结构简式是 ;(2)有机物B 在铜做催化剂的条件下与O 2反应生成D ,化学方程式是:;(3)有机物E 是D 的氧化产物,F 是E 的一种同分异构体,F 有下图所示的转化关系:①写出F 的结构简式;②X 生成Y 反应类型;③Z 在一定条件下可以聚合,写出化学方程式 ;④写出Q 发生氨解反应的化学方程式。
四、本题包括2小题,共27分21.(14分)茶是我国人民喜爱的饮品。
某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
【部分氢氧化物完全沉淀的pH :Ca(OH)2:pH ≥13;Al(OH)3:pH ≥5.5;Fe(OH)3:pH ≥4.1】H +(由六个原子构成的环状化合物)(1)上述实验方案中,检出钙元素的实验步骤是,检出钙元素的实验步骤是,检出钙元素的实验步骤是;(都填实验步骤编号) (2)步骤②中加入6mol/L HCl 的作用是 ;步骤④用浓氨水调节pH 后,加热至沸30min 的作用是;步骤⑨作用是; (3)写出步骤⑨中发生反应的离子方程式。