化学反应四种基本类型ppt课件
- 格式:ppt
- 大小:440.50 KB
- 文档页数:17



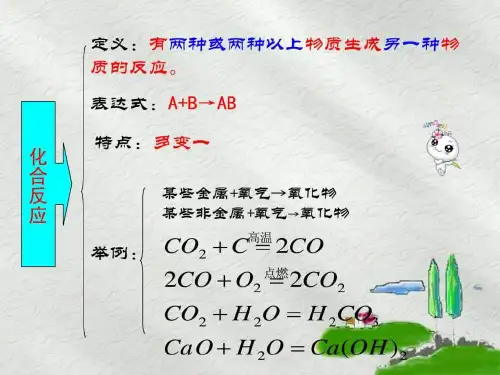
化学反应的类型第二讲/化学反应的类型知识梳理◤考点一◢化学反应类型的划分1.四种基本反应类型(1)化合反应:①概念:由两种或两种以上物质生成另一种物质的反应。
②表达式:A + B →A B③化合价:可能改变(1)分解反应①概念:由一种物质生成两种或两种以上其他物质的反应。
②表达式:A B →A + B③化合价:可能改变(2)置换反应①概念:由一种单质跟一种化合物反应,生成另一种单质跟一种化合物的反应。
②表达式:A + BC →B + AC ③化合价:一定改变(3)复分解反应①概念:由两种化合物相互交换成分生成另外两种化合物的反应。
②表达式:AB + CD →AD + BC③化合价:一定不变2.从得氧和失氧角度划分物质得到氧的反应叫反应,物质失去氧的反应叫反应。
3.从能量角度划分吸热反应:吸收热量的反应。
如:。
放热反应:放出热量的反应。
如:,锌和稀硫酸的反应等。
4.不属于四大基本反应类型的几种特殊反应:(1)天然气燃烧:。
酒精燃烧:。
(2)用一氧化碳还原金属氧化物的反应:①一氧化碳还原氧化铜:。
②一氧化碳还原氧化铁:。
③一氧化碳还原四氧化三铁:。
(3)碱的溶液(Ca(OH)2、NaOH)与二氧化碳、二氧化硫的反应:;。
;。
◤◢反应发生的条件1.置换反应(1)金属+ 酸→+反应条件:①酸指盐酸或稀硫酸②在金属活动性顺序中,排在氢前面的金属才能置换出酸中的氢,生成氢气。
(2)金属+ 盐→+反应条件:①盐一定溶于水②在金属活动性顺序中,排在前面的金属才能把排在后面的金属从溶液中置换出来。
(Ka、Ca、Na除外)2.复分解反应(1)包括①酸 + 某些金属氧化物→ + ②酸+ 碱→+③酸+ 盐→+④碱+ 盐→+⑤盐+ 盐→+(2)反应条件①生成物种有、、生成。
②碱与盐、盐与盐发生复分解反应时,必须在溶液中进行,即反应物都必须。
③把有关物质间的化学反应规律,熟记常见酸、碱、盐的溶解性。
碱中常见的沉淀有:Cu(OH)2、Fe(OH)3、Mg(OH)2 ;盐酸盐(氯化物)中常见的沉淀有:AgCl、BaCl2; 硫酸盐中常见的沉淀有:BaSO4;碳酸盐中常见的沉淀有:BaCO3、CaCO3。





一、四种基本反应类型与放热反应和吸热反应的关系(一)、化合反应中的放热反应和吸热反应绝大多数的化合反应是放热反应,少数化合反应是吸热反应。
1、化合反应中常见的放热反应:(1)氢化物的生成反应是放热反应的实例①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3(2)氧化物的生成是放热反应的实例①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3(3)含氧酸的生成反应是放热的实例①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4(4)强碱的生成反应是放热反应的实例①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2(5)活泼金属的含氧酸盐的生成是放热反应的实例①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO(二)、分解反应中的放热反应和吸热反应分解反应少数是放热反应,大多数是放热反应。