蛋白质空间结构
- 格式:doc
- 大小:54.50 KB
- 文档页数:3



不同的.构成DNA分子的基本单位是脱氧核苷酸,许许多多脱氧核苷酸通过一定的化学键连接起来形成脱氧核苷酸链,每个DNA分子是由两条脱氧核苷酸链组成.DNA分子结构的特点是:①DNA分子的基本骨架是磷酸和脱氧核糖交替排列的两条主链;②两条主链是平行但反向,盘旋成的规则的双螺旋结构,一般是右手螺旋,排列于DNA分子的外侧;③两条链之间是通过碱基配对连接在一起,碱基与碱基间是通过氢键配对在一起的蛋白质的结构:(氨基酸-多肽-肽链-蛋白质)一级结构:构成蛋白质的单元氨基酸通过肽键连接形成的线性序列,为多肽链.氨基酸在蛋白质分子中的连接方式1.肽键蛋白质分子中的氨基酸之间是通过肽键相连的,—个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合,即形成肽键(酰胺键,图2-1-2).2.肽与多肽链图2-1-2 肽与肽键氨基酸通过肽键(-CO-NH-)相连而形成的化合物称为肽(peptide).由两个氨基酸缩合成的肽称为二肽,三个氨基酸缩合成三肽,以此类推.一般由十个以下的氨基酸缩合成的肽统称为寡肽,由十个以上氨基酸形成的肽被称为多肽(polypeptide)或多肽链.氨基酸在形成肽链后,氨基酸的部分基团已参加肽键的形成,已经不是完整的氨基酸,称为氨基酸残基.肽键连接各氨基酸残基形成肽链的长链骨架,即…Cα-CO-NH-Cα…结构称为多肽主链.各氨基酸侧链基团称为多肽侧链.每个肽分子都有一个游离的α-NH2末端(称氨基末端或N端)和一个游离α-COOH末端(称羧基末端或C端).每条多肽链中氨基酸顺序编号从N端开始.书写某多肽的简式时,—般将N端书写在左侧端.(二)蛋白质分子的一级结构1.蛋白质分子的一级结构多肽链中氨基酸的排列顺序称为蛋白质的一级结构.氨基酸排列顺序是由遗传信息决定的,氨基酸的排列顺序是决定蛋白质空间结构的基础,而蛋白质的空间结构则是实现其生物学功能的基础.1953年,英国生物化学家Fred Sanger报道了胰岛素(insulin)的一级结构,这是世界上第一个被确定一级结构的蛋白质(图2-1-3).同年,Watson与Crick发现DNA的双螺旋结构.生物化学由此迈向了一个更高层次——分子生物学时代.图2-1-3 人胰岛索的一级结构(三)蛋白质分子的空间结构蛋白质分子井非如一级结构那样是完全展开的“线状”,而是处于更高级的水平.天然蛋白质可折叠、盘曲成—定的空间结构(三维结构).蛋白质的空间结构指蛋白质分子内各原子围绕某些共价键的旋转而形成的各种空间排布及相互关系,这种空间结构称为构象.按不同层次,蛋白质的高级结构可分为二,三和四级结构. 1.蛋白质的二级结构多肽链主链中各原子在各局部的空间排布,即多肽链主链构象称为蛋白质的二级结构.(1)形成二级结构的基础——肽键平面:20世纪30年代末,Pauling L和Corey R开始对肽进行x线结晶衍射图研究,以探索蛋白质的精细结构.他们测定了分子中各原子间的标准键长和键角,发现肽单元(主链的-CαCN-)呈刚性平面(rigid plane),即肽键平面(图2-1-4).图2-1-4 肽键平面和Cα“关节”示意图由于C-N键具有部分双键性质,因此C=O和C—N均不能自由旋转.所以整个肽链的主链原子(-CαCN-CαCN-)中只有N-Cα和Cα-N之间的单键可以旋转,N -Cα之间的旋转角为φ (phi),Cα-C之间的旋转角为ψ(psi).φ和ψ的大小就决定了Cα相邻两个肽键平面之间的相对位置关系,于是肽键平面就成为主链构象的结构基础.如每个氨基酸的ψ和φ已知,整个多肽链的主链构象就确定了.(2)蛋白质二级结构的基本形式:蛋白质的肽链局部盘曲、折叠的主要有α-螺旋、β-折叠、β-转角和不规则卷曲等几种形式.1) α-螺旋:肽链的某段局部盘曲成螺旋形结构,称为α-螺旋(图2-1-5).α-螺旋的特征是:①—般为右手螺旋;②每螺旋圈包含3.6个氨基酸残基,每个残基跨距为0.15nm,螺旋上升1圈的距离(螺距)为3.6×0.15=0.54nm; = 3 \* GB3 ③螺旋圈之间通过肽键上的>C=O和-NH-间形成氢键以保持螺旋结构的稳定;④影响α-螺旋形成的主要因素是氨基酸侧链的大小、形状及所带电荷等性质.图2-1-5 α-螺旋示意图2)β-折叠:为—种比较伸展、呈锯齿状的肽链结构.两段以上的β-折叠结构平行排布并以氢键相连所形成的结构称为β-片层或β-折叠层.β-片层可分顺向平行(肽链的走向相同,即N、C端的方向一致)和逆向平行(两肽段走向相反)结构(图2-1-6).图2-1-6 β—折叠结构示意图3) β-转角:此种结构指多肽链中出现的一种180°的转折.β-转角通常由4个氨基酸残基构成,由第1个残基的>C=O与第4个残基的-NH-形成氢键,以维持转折结构的稳定.4)不规则卷曲:此种结构为多肽链中除以上几种比较规则的构象外,多肽链中其余规则性不强的—些区段的构象.各种蛋白质依其一级结构特点在其多肽链的不同区段可形成不同的二级结构.如蜘蛛网丝蛋白中有很多α-螺旋及β-折叠层,也有β-转角和不规则卷曲(图2-1-7).图2-1-7 蜘蛛网丝蛋白2.蛋白质的三级结构多肽链中,各个二级结构的空间排布方式及有关侧链基团之间的相互作用关系,称为蛋白质的三级结构.换言之,蛋白质的三级结构系指每一条多肽链内所有原子的空间排布,即多肽链的三级结构=主链构象+侧链构象,三级结构是在二级结构的基础上由侧链相互作用形成的.多肽链的侧链(也就是氨基酸的侧链)分为亲水性的极性侧链和疏水性的非极性侧链(详见氨基酸分类).水介质中球状蛋白质的折叠总是倾向于把多肽链的疏水性侧链或疏水性基团埋藏在分子的内部.这一现象被称之为疏水作用或疏水效应(图2-1-8).疏水作用的本质是疏水基团或疏水侧链出自避开水的需要而被迫相互靠近,并不是疏水基团之间有什么吸引力的缘故,因此,将疏水作用称之为“疏水键”是不正确的.疏水作用是维系蛋白质三级结构最主要的动力.除疏水作用外,维系蛋白质的三级结构的动力还有氢键、盐键(离子键)、范德华力和二硫键等.图2-1-8 肌红蛋白三级结构蛋白质中的肽键称为主键,氢键、盐键、疏水作用、离子键、二硫键等是副键(次级键,图2-1-9),副键因外力作用(如热)容易断裂,导致蛋白质变性失活.图2-1-9 稳定和维系蛋白质三级结构的键三级结构对于蛋白质的分子形状及其功能活性部位的形成起重要作用,通过三级结构的形成,可将肽链中某些局部的几个二级结构汇成“口袋”或“洞穴”状,这种结构称为结构域(domain),它们的核心部分多为疏水氨基酸构成,结合蛋白质的辅基常镶嵌在其中,这种结构域多半是蛋白质的活性部位.有的蛋白质分子中只有一个特异的结构域,有的则有多个结构域.最近,在很多蛋白质分子中发现有两段β-折叠之间通过一段α-螺旋相连而形成的球状结构,以及多个α-螺旋形成的螺旋束,或三个二硫键将肽链连接成的三环状结构等结构域与功能活性有密切关系.3.蛋白质的四级结构有的蛋白质分子由两条以上具有独立三级结构的肽链通过非共价键相连聚合而成,其中每一条肽链称为一个亚基或亚单位(subunit).各亚基在蛋白质分子内的空间排布及相互接触称为蛋白质的四级结构.具有四级结构的蛋白质,其几个亚基的结构可以相同,也可以不同.如红细胞内的血红蛋白(hemoglobin,Hb,图2-1-10)是由4个亚基聚合而成的,4个亚基两两相同,即含两个α亚基和两个β亚基.在一定条件下,这种蛋白质分子可以解聚成单个亚基,亚基在聚合或解聚时对某些蛋白质具有调节活性的作用.有的蛋白质虽由两条以上肽链构成,但几条肽链之间是通过共价键(如二硫键)连接的,这种结构不属于四级结构,如前面提到过的胰岛素就是1例.二级结构:多肽链的某些部分氨基酸残基周期性的空间排列.三级结构:在二级结构基础上进一步折叠成紧密的三维形式.四级结构:由蛋白质亚基结构形成的多于一条多肽链的蛋白质分子的空间排列.。

蛋白质的空间构象
蛋白质的空间构象是指蛋白质在三维空间中的折叠方式和结构形态。
一般来说,蛋白质的空间构象包括原始结构、二级结构、三级结构和四级结构。
1. 原始结构:指的是蛋白质的氨基酸序列。
蛋白质的原始结构是由一系列氨基酸组成的多肽链,每个氨基酸通过肽键连接。
2. 二级结构:指的是蛋白质中氨基酸多肽链的局部折叠方式。
常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种具有螺
旋形状的结构,多肽链会紧密地缠绕在一起。
β-折叠是由平行
或反平行排列的β-片段组成的结构,多肽链以折叠方式相互
连接。
3. 三级结构:指的是蛋白质中氨基酸多肽链在整体上的三维空间折叠方式。
蛋白质的三级结构由二级结构区域的折叠和连接决定,决定了蛋白质的整体形状。
4. 四级结构:指的是蛋白质中多个氨基酸多肽链的相互组装和综合。
一些蛋白质由多个互相连接的氨基酸多肽链组成,这种组合形式称为四级结构。
蛋白质的空间构象决定了其功能和性质。
不同的空间构象决定了蛋白质的结构和功能多样性,成为生物体内各种生化反应和信号传导的关键分子。

蛋白质各级结构之间的区别
蛋白质的各级结构包括:一级结构、二级结构、三级结构和四级结构。
一级结构是蛋白质的线性序列,即由氨基酸组成的链。
它决定了蛋白质的基本构建块和氨基酸的种类、数量和顺序。
二级结构是蛋白质的局部空间结构,主要包括α螺旋、β折叠、β转角等形式。
它是由氢键相连的氨基酸残基所形成的规则、
稳定的空间构象。
三级结构是蛋白质的整体空间结构,由二级结构元素相互摺叠而成的形状。
三级结构决定了蛋白质的整体形状和功能。
四级结构是指由多个蛋白质链相互作用而形成的稳定形态。
多肽链的组合可以形成四级结构,例如血红蛋白由四个单体亚单位组成。
这些不同的蛋白质结构之间的区别在于其空间构象的不同。
一级结构决定了二级结构的可能性,二级结构的组合形成了三级结构,而多个蛋白质链的结合形成了四级结构。
这些结构之间的差异导致蛋白质在形状和功能上的差异。



蛋白质的结构及其功能蛋白质为生物高分子物质之一,具有三维空间结构,因而执行复杂的生物学功能。
蛋白质结构与功能之间的关系非常密切。
在研究中,一般将蛋白质分子的结构分为一级结构与空间结构两类。
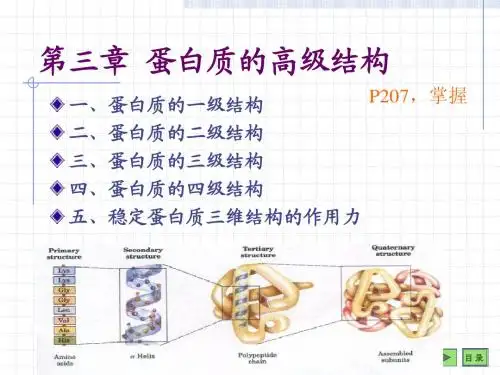
一、蛋白质的一级结构蛋白质的一级结构(primary structure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。
它是由基因上遗传密码的排列顺序所决定的。
各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。
迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。
蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物学活性,决定每一种蛋白质的生物学活性的结构特点,首先在于其肽链的氨基酸序列,由于组成蛋白质的20种氨基酸各具特殊的侧链,侧链基团的理化性质和空间排布各不相同,当它们按照不同的序列关系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子。
二、蛋白质的空间结构蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空间结构。
蛋白质的生物学活性和理化性质主要决定于空间结构的完整,因此仅仅测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生物学活性和理化性质。
例如球状蛋白质(多见于血浆中的白蛋白、球蛋白、血红蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等),前者溶于水,后者不溶于水,显而易见,此种性质不能仅用蛋白质的一级结构的氨基酸排列顺序来解释。
蛋白质的空间结构就是指蛋白质的二级、三级和四级结构。
(一)蛋白质的二级结构蛋白质的二级结构(secondary structure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
1.肽键平面(或称酰胺平面,amide plane)。
Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X 线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知:(1)中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。

高温破坏了蛋白质的空间结构高温破坏了蛋白质的空间结构引言:蛋白质是生命体中非常重要的有机化合物,对维持生命活动具有重要作用。
蛋白质通过其复杂的结构实现多种功能,这种结构是其生物活性的基础。
然而,高温环境对蛋白质的空间结构有广泛的影响,从而可能导致蛋白质功能的丧失或降低。
本文将深入探讨高温对蛋白质空间结构的破坏及其影响。
一、高温对蛋白质的热变性高温引起蛋白质的热变性是导致空间结构破坏的重要原因之一。
热变性是指蛋白质在高温下失去其特异性3D结构并发生结构性改变的现象。
这种改变导致蛋白质丧失其原有的功能。
蛋白质在正常生理条件下具有非常特定的空间折叠,这使得它们能够正确地与其他分子相互作用。
然而,高温破坏了这种折叠,导致蛋白质变得不稳定,易于发生变性。
研究表明,当蛋白质的环境温度超过其特定的生理温度范围时,其空间结构会发生破坏,导致蛋白质失去生物活性。
二、高温对蛋白质的氧化除了热变性,高温还可能引起蛋白质的氧化反应。
氧化是指蛋白质在存在氧分子的条件下发生化学反应,导致蛋白质分子中的氨基酸残基发生氧化或与氧发生反应。
这种氧化反应可以导致蛋白质的空间结构被破坏。
氧化反应通常会在高温下发生得更为剧烈,因为高温会增加反应的速率。
氧化破坏了蛋白质中的离子键和氢键,从而导致蛋白质的二级、三级结构发生改变。
此外,氧化还可能导致蛋白质形成交联产物,进一步破坏其结构。
三、高温对蛋白质的脱水高温还会引起蛋白质的脱水,从而导致其空间结构受到破坏。
当蛋白质暴露在高温下时,其周围的水分可能会蒸发。
这种脱水可能会导致蛋白质受到浓缩,使其变得更加稠密。
这种稠密可能导致蛋白质分子之间的相互作用增强,从而造成聚集或交联,最终导致蛋白质结构的破坏。
此外,脱水还可能引起蛋白质分子内部的氢键和离子键断裂,进一步导致蛋白质的空间结构变化。
四、高温对蛋白质功能的影响高温引起的蛋白质空间结构的破坏会直接影响其功能。
蛋白质功能通常依赖于其特定的结构,包括其折叠状态、活性位点以及与其他分子的相互作用等。

蛋白质的构型
蛋白质的构型指的是蛋白质分子在空间中的三维结构。
蛋白质由氨基酸链所组成,氨基酸之间通过肽键连接。
蛋白质的构型决定了其功能,因为许多功能依赖于其特定的空间结构。
蛋白质的构型主要由四个结构层次确定。
第一层次是氨基酸序列,即多肽链的线性排列。
第二层次是氢键的形成,将蛋白质的一部分从直线形成螺旋状或折叠成片状。
这个层次被称为二级结构。
第三层次是蛋白质的立体结构,即氢键和其他作用力所产生的三维形状。
这个层次被称为三级结构。
最后,第四层次是蛋白质与其他分子的相互作用,形成蛋白质复合物或聚合体。
分子生物学的研究表明,蛋白质的构型是非常关键的,因为它决定了蛋白质的活性、稳定性、抗原性等方面。
许多疾病,如肿瘤、脑退化性疾病和遗传疾病等,都与蛋白质构型的改变有关。
因此,对蛋白质构型的研究对疾病的预防和治疗有着重要的意义。
蛋白质的空间结构
蛋白质的空间结构又称为三维结构,它是由一条或多条蛋白质链,以及其中所包含的氨基酸残基之间的特定键类型和键形成的空间构型。
蛋白质的空间结构也可以描述为一个复杂而封闭的有序结构,由于蛋白质通常呈现出高度有序的构象,因此,它们的空间结构往往有助于它们具有独特的生物学功能。
蛋白质的空间结构是由氨基酸残基之间不同的键形和强度决定的,其中包括氢键、疏水性相互作用、疏水性静电相互作用等。
蛋白质的空间结构是由氨基酸残基的排列顺序决定的,可以有效地控制它们的生物学功能。
构成蛋白质空间结构的基本单位蛋白质,这个听起来高大上的词,实际上和我们生活息息相关。
你知道吗?它们可不只是存在于那些看似奢华的牛排或者豆腐里,甚至在我们身体的每一个细胞里,都是默默奉献的“小工蜂”。
今天,就让我们来聊聊构成这些蛋白质的基本单位,听起来是不是很神秘?别急,咱们一步步揭开这个迷雾。
1. 蛋白质的基本构成1.1 氨基酸的角色首先,得提到氨基酸。
嘿,别小看这几个字,它们可是蛋白质的“砖头”。
没错,蛋白质就像一座华丽的建筑,而氨基酸就是那一块一块的砖。
我们一共认识二十种不同的氨基酸,它们就像性格各异的朋友,有的爱开玩笑,有的比较内向。
它们通过肽键连接在一起,形成长长的链子,最后卷成复杂的三维结构,哎呀,真是个神奇的过程。
1.2 蛋白质的多样性更神奇的是,不同的氨基酸组合会形成不同的蛋白质,像是做菜一样,调料不一样,味道也会大相径庭。
有些蛋白质负责支撑和保护细胞,有些则在体内运输养分,就像快递小哥一样忙忙碌碌。
这种多样性可真让人惊叹,简直是生物界的一场大联欢。
2. 蛋白质的空间结构2.1 二级结构与折叠说到蛋白质的空间结构,就得提到二级结构。
蛋白质链子在折叠的过程中,会形成一些非常有趣的形状,比如α螺旋和β折叠。
想象一下,螺旋就像是旋转的滑梯,而折叠则像是折纸艺术,虽然过程复杂,但最后的结果却是美轮美奂。
就像我们常说的“众人拾柴火焰高”,这些结构的形成可不是一蹴而就的,而是经过长时间的努力和调整。
2.2 三级结构的魅力然后,我们再聊聊三级结构。
这时候,蛋白质就变得更为复杂,仿佛是个小精灵,千变万化。
它们的折叠和缠绕形成了一个独特的三维结构。
这个结构决定了蛋白质的功能,比如酶就是一种特殊的蛋白质,能够加速化学反应,简直是生物界的小超人!你要是能理解这些,绝对能在聚会中引起一番轰动,大家都会觉得你真是个知识渊博的“蛋白质专家”!3. 蛋白质的功能与应用3.1 生物功能说了这么多,咱们再看看蛋白质到底有啥用。
举例说明蛋白质一级结构、空间结构与功能之间的关系
蛋白质的结构与功能的关系
1.蛋白质一级结构与功能的关系(1)一级结构是空间构象的基础,蛋白质一级结构是空间构象和功能的基础。
(2)一级结构相似的蛋白质具有相似的高级结构与功能(3)氨基酸序列提供重要的生物进化信息
(4)重要蛋白质的氨基酸序列改变可引起疾病
若一级结构发生改变影响其功能,称分子病。
如血红蛋白β亚基的第6位氨基酸由谷氨酸转变成缬氨酸后,可导致镰刀形贫血。
但并非一级结构的每个氨基酸都很重要。
2.蛋白质高级结构与功能的关系
蛋白质空间构象与功能有密切关系。
生物体内蛋白质的合成、加工和成熟是一个复杂的过程,其中多肽链的正确折叠对其正确构象的形成和功能的发挥至关重要。
若蛋白质的折叠发生错误,尽管其一级结构不变,但蛋白质的构象发生改变,仍可影响其功能,严重时可导致疾病的发生,称为蛋白质构象疾病医学教育|网搜集整理。
成年人红细胞中的血红蛋白主要由两条α肽链和两条β肽链组成(α2β2),α链含141个氨基酸残基,β链含146个氨基酸残基。
胎儿期主要为α2γ2,胚胎期主要为α2ε2.血红蛋白的4条肽链组成4个亚基,各亚基构象变化可影响亚基与氧的结合。
疯牛病是由朊病毒蛋白(prp)引起的一组人和动物神经的退行性病变,具有传染性、遗传性或散在发病的特点。
其致病的生化机制是生物体内正常α螺旋形式的prpc转变成了异常的β-折叠形式的prpsc.。
蛋白质结构与功能的关系
――――蛋白质的一级结构
一、蛋白质的空间结构决定了其生物学功能。
下面以肌红蛋白和血红蛋白为例,说明蛋白质空间结构和功能关系。
(一)蛋白质的一级结构决定其高级结构
如核糖核酸酶含124个氨基酸残基,含4对二硫键,在尿素和还原剂β-巯基乙醇存在下松解为非折叠状态。
但去除尿素和β—巯基乙醇后,该有正确一级结构的肽链,可自动形成4对二硫键,盘曲成天然三级结构构象并恢复生物学功能。
(二)一级结构与功能的关系
已有大量的实验结果证明,如果多肽或蛋白质一级结构相似,其折叠后的空间构象以及功能也相似。
几种氨基酸序列明显相似的蛋白质,彼此称为同源蛋白质。
可认为同源蛋白质来自同一祖先,它们的基因编码序列及蛋白质氨基酸组成有较大的保守性,构成蛋白质家族。
在进化过程中祖先蛋白的基因发生突变,蛋白质结构逐渐发生变异,同源蛋白质序列的相似性大小反映蛋白质之间的进化关系的近远。
比较广泛存在各种生物的某种蛋白质,如细胞色素C的一级结构,通过分析不同物种的细胞色素C一级结构间相似程度,可反映出该物种在进化中的位置。
二、蛋白质的空间结构与功能的关系
蛋白质的空间结构决定了其生物学功能。
下面以肌红蛋白和血红蛋白为例,说明蛋白质空间结构和功能关系。
(一)肌红蛋白(Mb)和血红蛋白(Hb)的结构的相似性决定了功能的相似性
肌红蛋白与血红蛋白都都能与氧结合,因为它们以血红素为辅基,并且在血红素周围以疏水性氨基酸残基为主,形成空穴,为铁原子与氧结合创造了结构环境。
(二)肌红蛋白(Mb)和血红蛋白(Hb)的结构的差异性决定了功能的不同
肌红蛋白为单肽链蛋白质,而血红蛋白是由四个亚基组成的寡聚蛋白,这样的空间结构差异决定了它们之间的功能的各自特性。
肌红蛋白的主要功能是储存氧。
其三级结构折叠方式使辅基血红素对环境中O2的浓度改变非常敏感,当环境中的O2分压高时,Mb与O2结合能力极高,起到对O2的储存功能;当环境中的O2分压低时,Mb与O2结合能力大大降低,对外释放O2,为环境提供O2供机体所需。
血红蛋白的主要功用是在循环中转运氧。
Hb由4个亚基组成四级结构,每个亚基可结合1个血红素并携带1分子氧,共结合4分子氧。
Hb各亚基的三级结构与Mb极为相似,也有可逆结合氧分子的能力,但Hb各亚基与氧的结合存在着正协同效应。
(三)血红蛋白的构象变化与运氧功能
变构效应(allosteric effect):当血红蛋白的一个α亚基与氧分子结合以后,可引起其他亚基的构象发生改变,对氧的亲和力增加,从而导致整个分子的氧结合力迅速增高,使血红蛋白的氧饱和曲线呈“S”形(图2-11 )。
这种由于蛋白质分子构象改变而导致蛋白质分子功能发生改变的现象称为变构效应。
引起变构效应的小分子称变构效应剂。
变构效应在细胞蛋白与酶功能调节中有普遍意义。
协同效应(cooperativity):一个亚基与其配体(Hb中的配体为O2)结合后,能影响此寡聚体中另一亚基与配体的结合能力,称为协同效应。
如果是促进作用则称为正协同效应(positive cooperativity);反之则为负协同效应(negative cooperativity)。
当Hb中第一个亚基与O2结合后,引起其它盐键断裂促进第二、三、四亚基更易与
O2结合,完成Hb的带O2过程,发生了亚基之间相互作用的正协同效应。
带O2的Hb亚基结构松弛,呈松弛态(relaxed state,R态)。
这时小分子(O2)与大分子(Hb)亚基结合,导致分子构象改变及生物功能变化的过程,发生了变构效应。
血红蛋白特定空间构象及亚基间的正协同效应,则有利于Hb在氧分压高的肺部迅速充分的地与O2结合;而在氧分压低的组织发生相反过程,又迅速的最大限度的释出转运的
O2,完成Hb的生理功能。
三、蛋白质结构与功能研究与医学的关系:
蛋白质一级结构中起关键作用的氨基酸残基缺失或被替代,可能通过影响蛋白质的空间构象而影响其生理功能。
例如正常人血红蛋白β—亚基的第6位氨基酸是谷氨酸,如突变为
缬氨酸,仅一个氨基酸改变,就会使红细胞中水溶性的血红蛋白易于聚集粘着,红细胞变形成镰刀状且极易破碎,带氧功能降低,产生贫血。
这种血红蛋白分子变异引起的遗传性疾病称镰刀型红细胞贫血。
当蛋白质由于折叠错误而相互聚集,常形成抗蛋白水解酶的淀粉样纤维沉淀。
可导致人类纹状体脊髓变形病、老年痴呆、亨丁顿舞蹈病(Huntington disease)、疯牛病……
疯牛病是阮病毒蛋白(prion protein, PrP)引起的人和动物神经退行性病变。
这类疾病具有传染性、遗传性或散在发病的特点。
PrPc 为基因正常编码产物,PrPsc 为致病蛋白,PrPc与PrPsc 一级结构完全相同。
正常蛋白PrPc和可致疯牛病的蛋白PrPsc一级结构相同,只存在空间构象的差异。