镍酶介绍
- 格式:pptx
- 大小:6.31 MB
- 文档页数:72

天然金属酶-概述说明以及解释1.引言1.1 概述天然金属酶是生物体内一类具有催化功能的蛋白酶,其催化活性依赖于金属离子作为辅助因子。
金属酶广泛存在于各个生物体中,包括细菌、真菌、植物和动物等。
与其他酶相比,天然金属酶具有独特的结构和催化机制,因此在生物体的代谢和生物转化过程中起着重要的作用。
天然金属酶可以利用金属离子的活化性质,高效地催化各种生物化学反应,例如氧化还原反应、水解反应、水合反应等。
金属酶通常包含一个或多个金属离子,这些离子通过与酶的氨基酸残基相互作用,形成稳定的配体配位结构。
金属离子与酶的蛋白质结构相互配合,实现对底物的选择性识别和催化反应的高度特异性。
天然金属酶的分类和功能非常多样化。
根据金属离子的种类和数量,可将天然金属酶分为单金属酶和多金属酶两大类。
单金属酶中仅含有一种金属离子,如铁、铜、锌等;而多金属酶则同时含有多种金属离子,如铜锌超氧化物歧化酶和镍铁氢酶等。
这些金属酶在生物体的代谢过程中扮演着不可替代的角色,参与了很多重要的生物学功能,如呼吸过程、DNA 修复、光合作用等。
天然金属酶的研究对于理解生物体的催化过程、药物开发和环境保护等方面具有重要意义。
在未来的研究中,需要进一步探索和解析金属酶的催化机制、结构和功能关系,以及其在疾病治疗和生物工业生产中的应用潜力。
对于开发新的金属酶模型和催化剂,有助于设计和优化具有高效催化能力的人工酶,推动生物催化领域的发展。
1.2文章结构文章结构可以帮助读者更好地理解文章的内容和逻辑结构。
文章的结构一般由引言、正文和结论三部分组成。
在本文中,文章结构如下所示:1. 引言1.1 概述1.2 文章结构1.3 目的2. 正文2.1 金属酶的定义和特点2.2 天然金属酶的分类和功能3. 结论3.1 天然金属酶的重要性3.2 未来研究方向在引言部分后面,正文是本文的主要部分。
其中,2.1节将介绍金属酶的定义和特点,包括它们的基本概念和独特的特性。

镍对人体有什么好处和害处
病情分析:
镍具有刺激血液生长的作用,能促进红细胞再生。
在人体内缺铜时,镍的生理活性会充分发挥,又不影响人体内铜的生理活性。
补充适量的镍可使红细胞、白细胞及血红蛋白的生成增多。
患有各种贫血及肝硬化的病人血中镍均降低,镍有刺激生血功能的作用。
治疗贫血有的曾用过硫酸镍和溴化镍。
镍可以激活肽酶,镍还可能是胰岛素分子中的一种成分,相当于胰岛素的辅酶,动物实验证明,添加小量镍的胰岛素,有增强胰岛素降低血糖的作用。
过量的镍会对人体造成危害.镍可引起炎症、癌症、神经衰弱症、系统紊乱、降低生育能力、致畸和致突变等方面概述镍对人体健康的危害效应,并从镍能影响遗传物质的合成、影响多种酶和内分泌腺的作用、引起基因点突变、基因丢失、基因扩增、产生'镍指'、形成Ni2+-肽复合物、诱导产生活性氧及其影响电解质中的离子含量。


超氧化物歧化酶的研究进展学生:杨青青生命科学院10级研究生摘要:超氧化物歧化酶是一种广泛存在于生物体内各个组织中的重要金属酶,是一种能够特异性清除机体代谢过程中产生的自由基的抗氧化酶,近年来成为化学、生物学、医学、日用化工、食品科学和畜牧兽医学等多个学科领域研究的热点。
深入研究SOD及其与机体内铜、锌、铁、锰等元素代谢的关系,不仅有着重要的理论意义,而且具有重要的实用价值。
本文将从其来源、种类和分布、结构和理化特性、作用机理及生理功能、SOD基因的克隆和表达、分离纯化、制备开发应用等方面进行综述,并探讨和分析了目前存在的问题及应用前景,旨在为超氧化物歧化酶的研究、开发、应用提供参考。
关键词:超氧化物歧化酶;基因克隆;蛋白表达;分离;纯化;应用Research Advances in Superoxide DismutaseStudent: Yang Qing-Qing10 graduate student, School of life science, Shanghai University Abstract:Superoxide dismutase is an importance metal enzyme of widely various tissues in vivo, which is an antioxidant enzymes can specifically remove free radicals produced during metabolism and has been an inquiring hot spots in many fields such as chemistry, biology, medicine, daily chemical industry, food science and animal husbandry and veterinary science and so on in recent years. It not only has an important theoretical significance but is of an important practical value to study the relationship between SOD and the elementary metabolism of cup rum (Cu), zine (Zn), ferrum (Fe) and manganese (Mn). This article will not only summarize from its source, type and distribution, structure and physicochemical properties, function mechanisms and physiology functions, SOD gene cloning and expression, purification development applications but also analyze and discuss the problems and prospects of the future aiming at providing reference for the research, development and application of SOD.Key words: Superoxide dismutase; Gene cloning; Protein expression; Isolation; Purification; Application前言氧的某些代谢产物及其衍生的含氧物质都是直接或间接由氧转化而成的。
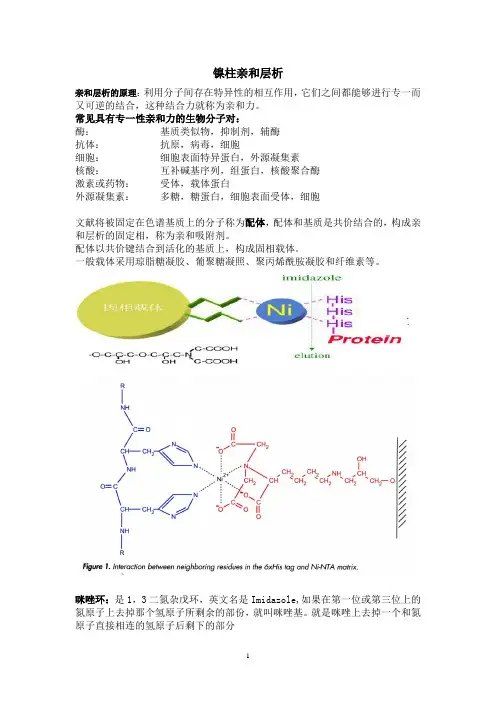
镍柱亲和层析亲和层析的原理:利用分子间存在特异性的相互作用,它们之间都能够进行专一而又可逆的结合,这种结合力就称为亲和力。
常见具有专一性亲和力的生物分子对:酶:基质类似物,抑制剂,辅酶抗体:抗原,病毒,细胞细胞:细胞表面特异蛋白,外源凝集素核酸:互补碱基序列,组蛋白,核酸聚合酶激素或药物:受体,载体蛋白外源凝集素:多糖,糖蛋白,细胞表面受体,细胞文献将被固定在色谱基质上的分子称为配体,配体和基质是共价结合的,构成亲和层析的固定相,称为亲和吸附剂。
配体以共价键结合到活化的基质上,构成固相载体。
一般载体采用琼脂糖凝胶、葡聚糖凝照、聚丙烯酰胺凝胶和纤维素等。
咪唑环:是1,3二氮杂戊环,英文名是Imidazole,如果在第一位或第三位上的氮原子上去掉那个氢原子所剩余的部份,就叫咪唑基。
就是咪唑上去掉一个和氮原子直接相连的氢原子后剩下的部分组氨酸的性质:具有弱疏水性、咪唑环为弱电性。
金属离子:Cu2+、Ni2+、Zn2+、Co2+等过渡金属离子可与N、S和O等供电原子产生配位键,因此可与蛋白质表面的组氨酸(His)的咪唑基、半胱氨酸(Cys)的巯基和色氨酸(Trp)的吲哚基发生亲和结合作用,其中以His的咪唑基的结合作用最强。
过渡金属离子与咪唑基的结合强弱顺序是Cu2+>Ni2+>Zn2+≥Co2+ 。
镍离子:有六个螯合价位,通常将镍柱分为了Ni-NTA和Ni-IDA。
Ni-NTA螯合了四价,剩余两价;而Ni-IDA螯合三价,剩余三价。
因此Ni-IDA Agarose结合作用力要比Ni-NTA Agarose强,在同样条件下Ni-IDA Agarose的载量要比Ni-NTA 高,而且洗脱杂质和目标蛋白所用的缓冲液中咪唑浓度更高;但Ni-NTA 更稳定,耐受更强的还原剂,镍离子更不易脱落。
因此需要根据不同的纯化条件选择纯化所需的镍柱,以达到纯化的最佳效果。
基质:①不溶性的多孔网状结构,渗透性好;②物理和化学稳定性高,有较高的机械强度,使用寿命长;③抗微生物和酶的侵蚀;④最好为粒径均一的球形粒子;⑤具有亲水性,无非特异性吸附;⑥含有可活化的反应基团,利于亲和配体的固定化。

第四章生物催化剂—酶生命的底子特征是新陈代谢,生物体在新陈代谢过程中,几乎所有的化学反响都是在生物催化剂——酶(enzyme)的催化下进行的。
但是20世纪80年代发现还有一类生物催化剂,称为核酶〔ribozyme〕,它主要作用于RNA的剪接。
本章主要介绍酶的有关内容,因为生物体的一切生命活动都是在酶的催化下平衡协调地进行,临床上许多疾病都与酶的异常密切相关,许多临床常用药物亦是通过影响酶的作用来达到治疗。
第一节酶是生物催化剂一、生物催化剂〔一〕酶酶是由活细胞发生的具有催化功能的蛋白质,它是最主要的生物催化剂。
酶所催化的化学反响称为酶促反响。
在酶促反响中被酶催化的物质叫底物〔substrate,S〕;经酶催化所发生的物质叫产品〔product,P〕;酶所具有的催化能力称为酶的“活性〞,如果酶丧掉催化能力称为酶掉活。
1926年Sumner初次从刀豆中提取脲酶结晶并率先提出酶的化学本质是蛋白质。
到目前为止,纯化和结晶的酶已超过2000余种。
按照酶的化学组成成分不同,可将其分为纯真酶〔simple enzyme〕和结合酶〔conjugated enzyme〕两类。
1.纯真酶这类酶的底子组成单元仅为氨基酸,通常只有一条多肽链。
它的催化活性仅仅决定于它的蛋白质布局。
如淀粉酶、脂肪酶、蛋白酶等均属于纯真酶。
2.结合酶这类酶由蛋白质局部和非蛋白质局部组成,前者称为酶蛋白〔apoenzyme〕,后者称为辅助因子〔cofactor〕。
酶蛋白与辅助因子结合形成的复合物称为全酶〔holoenzyme〕。
只有全酶才有催化作用。
酶蛋白在酶促反响中起着决定反响特异性的作用,辅助因子那么决定反响的类型,参与电子、原子、基团的传递。
辅助因子的化学本质是金属离子或小分子有机化合物,按其与酶蛋白结合的紧密程度不同可分为辅酶〔coenzyme〕与辅基〔prosthetic group〕。
辅酶与酶蛋白结合疏松,可用透析或超滤的方法除去。

生物教学中怎么讲解与DNA有关的6类酶1 DNA酶DNA酶,也称脱氧核糖核酸酶,是水解DNA中磷酸二酯键,生成低级多核苷酸或单核苷酸的磷酸二酯酶。
其中能够水解DNA分子内磷酸二酯键的酶又称为DNA内切酶,如DNA酶I(DNase I),DNA 酶II(DNase II)等;而从DNA链的一端逐个水解下核苷酸的酶称为DNA外切酶,如牛脾磷酸二酯酶和蛇毒磷酸二酯酶等非专一性核酸酶(底物也可为RNA)。
在DNase I的作用下,DNA被水解成3′端为游离羟基,5′端为磷酸基团的寡聚脱氧核苷酸,其平均长度为4个脱氧核苷酸残基。
在DNase II的作下,DNA被水解成5′端为游离羟基,3′端为磷酸基团的寡聚脱氧核苷酸,平均长度约6个核苷酸残基。
牛脾磷酸二酯酶可从DNA的5′羟基端开始逐个切割磷酸二酯键,蛇毒磷酸二酯酶可从DNA的3′羟基端开始逐个切割磷酸二酯键。
人教版高中生物必修2教材中,艾弗里等“证明DNA是遗传物质” 的经典实验就用到了DNA 酶。
在该酶作用下,载有S型肺炎双球菌荚膜遗传信息的DNA被分解破坏,无法将R型菌转化成S型,从而进一步证明了DNA是转化因子。
2 解旋酶DNA分子的许多生物学功能都需要解开双链才能执行,而解旋酶就能通过水解ATP获得能量来解开双链DNA。
解旋酶每解开一对碱基,需要水解2分子ATP。
分解ATP的活性依赖于单链DNA的存在。
如果双链DNA中有单链末端或缺口,则解旋酶可以首先结合在这一部分,然后逐步向双链方向移动。
解开的两条单链随机被单链结合蛋白所覆盖,以防止重新结合成双链或被核酸酶降解。
高中生物教材明确提到了DNA复制需要解旋酶,但转录是否需要解旋酶?教材并未明确指出,不少中学教师对此也是模糊不清。
事实上,在转录过程中,原核生物通过RNA聚合酶的特定亚基使DNA双链解开,也就是说,RNA聚合酶自身具有解旋的功能;而真核生物转录时,是某些蛋白转录因(如RNA聚合酶Ⅱ的TFⅡ-F 和TFⅡ-H)协助RNA聚合酶形成复合物解开DNA双链,起到解旋酶的作用。

酶详细资料大全酶(enzyme)是由活细胞产生的、对其底物具有高度特异性和高度催化效能的蛋白质或RNA。
酶的催化作用有赖于酶分子的一级结构及空间结构的完整。
若酶分子变性或亚基解聚均可导致酶活性丧失。
酶属生物大分子,分子质量至少在1万以上,大的可达百万。
酶是一类极为重要的生物催化剂(biocatalyst)。
由于酶的作用,生物体内的化学反应在极为温和的条件下也能高效和特异地进行。
随着人们对酶分子的结构与功能、酶促反应动力学等研究的深入和发展,逐步形成酶学(enzymology)这一学科。
酶的化学本质是蛋白质(protein)或RNA(Ribonucleic Acid),因此它也具有一级、二级、三级,乃至四级结构。
按其分子组成的不同,可分为单纯酶和结合酶。
仅含有蛋白质的称为单纯酶;结合酶则由酶蛋白和辅助因子组成。
例如,大多数水解酶单纯由蛋白质组成;黄素单核苷酸酶则由酶蛋白和辅助因子组成。
结合酶中的酶蛋白为蛋白质部分,辅助因子为非蛋白质部分,只有两者结合成全酶才具有催化活性。
基本介绍•中文名:酶•英文名:enzyme•化学式:无确切化学式•分子量:无固定分子量•套用:医学生产•含有元素:碳(C)、氢(H)、氧(O)、氮(N)•功能:催化•特点:高效特异可调节不稳定研究历史,理化性质,组成,空间结构,命名方法,习惯命名,系统命名,分类方式,按反应性质,按化学组成,按存在形式,功能作用,催化,套用,影响,反应特点,活性指标,学科运用,生物学,动力学,热力学,研究历史1773年,义大利科学家斯帕兰扎尼(L.Spallanzani,1729—1799)设计了一个巧妙的实验:将肉块放入小巧的金属笼中,然后让鹰吞下去。
过一段时间他将小笼取出,发现肉块消失了。
于是,他推断胃液中一定含有消化肉块的物质。
但是什么,他不清楚。
1833年,法国的佩恩(Payen)和帕索兹(Persoz)从麦芽的水解物中用酒精沉淀得到一种可使淀粉水解生成糖的物质,并将其命名为diastase,也就是现在所谓的淀粉酶。

酶(enzyme)中学生物理百科知识苏霍姆林斯基说:让学生变得聪明的办法,不是补课,不是增加作业量,而是阅读、阅读、再阅读。
学生知识的获取、能力的提高、思想的启迪、情感的熏陶、品质的铸就很大程度上来源于阅读。
我们应该重视它,欢迎阅读酶(enzyme)中学生物理百科知识。
酶(enzyme)
酶(enzyme)
是细胞产生的、大都具有催化生化反应功能的蛋白质:单纯蛋白质或结合蛋白质(其中非蛋白部分成为辅基或辅酶)。
1982~1983年,Cech、Atman和Pace三个实验室证实某些RNA具有催化活性。
目前已鉴定出2021种以上的酶,可分为:氧化还原酶、转移酶、水解酶、裂合酶、异构酶和连接酶六大类。
目前引起关注的研究有别构酶、诱导酶和固相酶。
酶促反应的特点是酶降低反应活化能可促使反应在常温下加
快进行,它具有易变性、失活高效率和专一性。
其结构基础是酶活性中心,它有结合和催化两种功能,该功能基于酶蛋白分子的构象。
Michaelis和Menten杰出的贡献就是得出了酶化反应动力学基本规律及其米氏方程。
酶作用机制有三种假说:诱导契合假说、锁钥假说及变形(或张力)假说,目前多数人采用诱导契合假说。
酶促反应受温度、pH、激活剂和抑制剂的影响。
感谢阅读酶(enzyme)中学生物理百科知识,希望大家从中得到启发。

镍催化剂论文题目:镍催化剂班级:学号:姓名:实验日期:2011.11.19.一、镍的基本知识:镍基催化剂一般是指雷尼镍又译兰尼镍,是一种由带有多孔结构的镍铝合金的细小晶粒组成的固态异相催化剂,它最早由美国工程师莫里·雷尼在植物油的氢化过程中,作为催化剂而使用。
其制备过程是把镍铝合金用浓氢氧化钠溶液处理,在这一过程中,大部分的铝会和氢氧化钠反应而溶解掉,留下了很干燥的活化后的雷尼镍.多大小不一的微孔。
这样雷尼镍表面上是细小的灰色粉末,但从微观角度上,粉末中的每个微小颗粒都是一个立体多孔结构,这种多孔结构使得它的表面积大大增加,极大的表面积带来的是很高的催化活性,这就使得雷尼镍作为一种异相催化剂被广泛用于有机合成和工业生产的氢化反应中。
我们所说的骨架镍,原料是镍铝合金,用氢氧化钠处理该合金2Ni-Al+2NaOH+2H2O=2Ni+2NaAlO2+3H2雷尼镍主要用于不饱和化合物,如烯烃,炔烃,腈,二烯烃,芳香烃,含羰基的物质,乃至具有不饱和键的高分子的氢化反应。
使用雷尼镍进行氢化有时甚至不需要特意加入氢化,仅凭活化后的雷尼镍中吸附的大量氢气即可完成反应。
反应后得到的是顺位氢化产物。
另外,雷尼镍也可以用于杂原子-杂原子键的还原。
除了作为催化剂加氢,雷尼镍还将充当试剂参与有机含硫化合物如硫缩酮的脱硫生成烃类的反应。
镍催化剂呈现出很高的加氢活性,由于其催化活性好,机械强度高,对毒物不敏感,导热性好等优点,不仅应用于各种不饱和烃的加氢,而且也是脱氢、氧化脱卤、脱硫等某些转化过程中的良好催化剂,使用于石油、化工、制药、油脂、香料、双氧水、合成纤维,特别是在山梨醇、木糖醇、麦芽糖醇等工业上得到了广泛应用。
二、镍催化剂的发展现状近几年年以来,LME镍价就在30000美元/吨以下波动,3月初受到停产消息刺激,镍价短暂回升到30000美元/吨以上,此后在关键点位连连失守,二季度末主要不锈钢企业开始减产压库,又给镍价回升蒙上了阴影,此后人们一直希望寄予下半年不锈钢市场能够恢复上,拖垮了整个商品期货价格,尽管各种类别的大综商品有不同的供求体系,但信贷市场的整体紧缩和实体经济运行的不确定性带来的悲观消费预期,导致投资者纷纷撤出商品市场。

超氧化物歧化酶的研究进展学生:杨青青生命科学院10级研究生摘要:超氧化物歧化酶是一种广泛存在于生物体内各个组织中的重要金属酶,是一种能够特异性清除机体代谢过程中产生的自由基的抗氧化酶,近年来成为化学、生物学、医学、日用化工、食品科学和畜牧兽医学等多个学科领域研究的热点。
深入研究SOD及其与机体内铜、锌、铁、锰等元素代谢的关系,不仅有着重要的理论意义,而且具有重要的实用价值。
本文将从其来源、种类和分布、结构和理化特性、作用机理及生理功能、SOD基因的克隆和表达、分离纯化、制备开发应用等方面进行综述,并探讨和分析了目前存在的问题及应用前景,旨在为超氧化物歧化酶的研究、开发、应用提供参考。
关键词:超氧化物歧化酶;基因克隆;蛋白表达;分离;纯化;应用Research Advances in Superoxide DismutaseStudent: Yang Qing-Qing10 graduate student, School of life science, Shanghai University Abstract:Superoxide dismutase is an importance metal enzyme of widely various tissues in vivo, which is an antioxidant enzymes can specifically remove free radicals produced during metabolism and has been an inquiring hot spots in many fields such as chemistry, biology, medicine, daily chemical industry, food science and animal husbandry and veterinary science and so on in recent years. It not only has an important theoretical significance but is of an important practical value to study the relationship between SOD and the elementary metabolism of cup rum (Cu), zine (Zn), ferrum (Fe) and manganese (Mn). This article will not only summarize from its source, type and distribution, structure and physicochemical properties, function mechanisms and physiology functions, SOD gene cloning and expression, purification development applications but also analyze and discuss the problems and prospects of the future aiming at providing reference for the research, development and application of SOD.Key words: Superoxide dismutase; Gene cloning; Protein expression; Isolation; Purification; Application前言氧的某些代谢产物及其衍生的含氧物质都是直接或间接由氧转化而成的。
关键词:超氧化物歧化酶;生理功能;特性;应用摘要:超氧化物歧化酶是生物体内清除超氧阴离子自由基的一种重要酶,具有重要的生理功能,在医药、食品、化妆品中有广泛的应用前景。
现从分类、分布、结构、性质、催化机理、制备、应用等方面探讨了超氧化物歧化酶的基础研究进展。
关键词:超氧化物歧化酶;生理功能;特性;应用Advanceincurrentresearchofsuperoxidedismutase.Abstract:SuperoxideDismutase(SOD)isanimportantenzymeinorganism,whichcanremovesuperoxidefreeradical.Itiswide-lyusedinclinicaltreatment,food,andcosmeticindustryforitsimportantphysiologicfunction.Thisreviewpresentsabasicre seachoutlineofSOD,includingclassification,distribution,structure,property,thecatalysemechanism,preparationandapplication. Keywords:Superoxidedismutase;Physiologicfunction;Property;Application 1938年Mann和Keilin[1]首次从牛红细胞中分离出一种蓝色的含铜蛋白质(Hemocuprein),1969年Mccord及Fridovich[2]发现该蛋白有催化O2,发生歧化反应的功能,故将此酶命名为超氧化物歧化酶(SuperoxideDismutase,SOD,EC1.15.1.1)。
该酶是体内一种重要的氧自由基清除剂,能够平衡机体的氧自由基,从而避免当体内超氧阴离子自由基浓度过高时引起的不良反应,同时SOD是一种很有用途的药用酶。
人中性转化酶(NI)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T70U/L -3000U/L使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中硝酸还原酶(NR)的活性。
实验原理本试剂盒应用双抗体夹心法测定标本中人中性转化酶(NI)水平。
用纯化的人中性转化酶(NI)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入中性转化酶(NI),再与HRP标记的中性转化酶(NI)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的中性转化酶(NI)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中人中性转化酶(NI)活性浓度。
标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色10分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
镍脲酶在植物体内的作用镍脲酶在植物体内的作用一、植物体内镍的含量大多数植物体的营养器官中镍的含量一般在0.05—10mg·kg-1范围内,平均1.10mg·kg-1。
不同植物种类之间镍的含量差异很大,常见栽培作物的含镍量列于表表部分栽培作物的含镍量作物种类含镍量/ mg·kg-1 作物种类含镍量/ mg·kg-1食荚菜豆1.7~3.7 莴苣 1.0~1.8菜豆1.1 番茄0.43~0.48洋葱0.59~0.84 马铃薯0.29~1.0大白菜0.62~0.99 黄瓜1.3~2.0胡萝卜0.26~0.98 甜玉米0.22~0.34燕麦子粒0.3~2.8 苹果0.06小麦子粒0.2~0.6 柑橘0.39某些植物具有累积镍的特点,根据其累积程度不同,可分为两类。
第一类为镍超累积植物,主要是野生植物,它们体内镍的含量超过1 000mg·kg-1,例如庭荠属(Alyssum)中大约有45种、车前属(Rinorea)中也有两种属于此种类型。
第二类为镍累积型,其中包括野生的和栽培的植物,主要有紫草科、十字花科、桃金娘科、豆科和石竹科的某些种类。
这些植物大多生长在蛇纹岩发育的土壤或酸性铁铝土壤,某些水生植物也有镍富集现象,其体内镍的浓度可以高达水中镍浓度的200倍左右。
镍累积植物往往也是累积钴的植物。
二、镍的营养功能(一)有利于种子发芽和幼苗生长低浓度的镍能刺激许多植物的种子发芽和幼苗生长,例如小麦、豌豆、蓖麻、白羽扇豆、大豆、水稻等。
试验证明,用100mg·L-1的镍处理小麦种子,能促进根系与地上部的生长。
如图5-4所示,当种子中镍的含量在100ng·g-1以下时,随着镍、含量增加,种子萌发率增加;当镍含量大于100ng·g-1干重时种子萌发率不变,也没有表现出明显的抑制作用。
在种子萌发时。
尿囊素是氮的代谢产物,因而需要镍参与这些代谢活动,促进种子萌发,且这种作用会影响后代。
紫外可见光谱在生物无机化学中的应用摘要综述了紫外可见光谱在生物无机化学各方面应用中的最新进展和独特之处,探讨了紫外可见光谱研究金属离子与生物分子相互作用的基本原理及所得主要信息。
关键词紫外可见光谱生物无机化学生物无机化学是近几十年来发展起来的一门新兴的边缘学科,它是无机化学(特别是配位化学) 、生物化学、医学临床化学、营养化学、环境科学等学科相互渗透、相互融合的产物,是近年来自然科学中十分活跃的一个领域,是在分子水平上研究生物金属与生物配体之间的相互作用,研究分析测定这些生物化合物结构和性能以及它们在活体中作用的一门学科。
生物无机化学发展迅速。
除了在金属蛋白和金属酶方面由铁、铜、锌⋯8943 .等扩大到诸如镍酶、钒酶、锰酶、钼酶、钨酶⋯8943 .以外,还从金属蛋白扩大到以非金属元素为活性元素的蛋白。
研究各种金属与生物配体相互作用的方法有电子吸收光谱、圆二色谱、红外光谱、核磁共振谱、X 射线衍射光谱、荧光光谱等。
在生物分子结构的研究中,很重要的目的是了解金属蛋白和金属酶。
金属蛋白和金属酶中仅含少量的金属离子,但它们起至关重要的作用,即它们及其配位环境往往就是生物分子的活性中心,因而测定金属离子及其微环境的结构是很有意义的。
金属蛋白和金属酶中金属离子的基态及最低激发态往往与它们所处的环境有直接的联系。
因此,金属蛋白和金属酶的电子吸收光谱研究是表征金属离子所处环境的主要手段。
本文对紫外可见光谱(电子吸收光谱) 在生物无机化学中的应用研究最新进展作了综述。
1 紫外可见光谱的基本原理所有的光谱都是由于粒子(原子、离子、自由基、分子、晶体等) 与电磁波以某种类型的相互作用产生的。
电子吸收光谱是由电子在一系列能级上跃迁产生的。
当电磁波的能量接近△E电子的能量时,可引起电子在各能级之间的跃迁并伴随分子的振动能级和转动能级的变化而产生的吸收光谱。
由于是电子跃迁所需的能量通常落在光谱的紫外、可见区,因而又称作紫外可见吸收光谱。