光谱分析实验讲义
- 格式:doc
- 大小:289.00 KB
- 文档页数:16

第一章光谱分析的原理一、光谱和光谱分析1、光的本质光有粒子性,又有波动性,它的本质是粒子性的,波动性只是它的某些表现。
研究表明,光、电、磁现象密不可分,光、电、磁现象都是粒子运动时,受自然力作用影响,温度发生变化产生的不同效应。
它们都是我们可以观察到的物质结构间通过粒子运动传递能量现象,有着明显的共同性原理。
这三种现象是粒子流温度差异造成的,其中光效应是温度相对较高的粒子流,电效应次之,磁效应是温度相对较低的粒子流。
根据以上分析,光的本质又可称为是电磁波,根据电磁波波长范围不同,可分为通讯波、红外线、可见光、紫外线、X射线、γ射线和宇宙线等。
图1-1 电磁波的波长范围2、光速、频率和波长光速:是光在真空中的传播速度;C=3×105 m/s,C=λ·f,其中:λ为光的波长,f为光的频率。
光在真空中的传播速度是固定不变的。
3、光的色散光的颜色是由光波波长所决定的,一定波长的光线射到眼里就生成一定色的感觉。
可见光的波范围是:380—780nm。
白光是是由许多种波长的光按一定比例混合而成的,透过三棱镜可以呈现出红、橙、黄、绿、青、蓝、紫七种颜色组成的光谱。
其波长范围为:红640—780nm橙640—610nm黄610—530nm绿505—525nm蓝505—470nm紫470—380nm其中红光波长最长,紫光波长最短,中间各种色光由红到紫递减。
单色光:只有一种波长,不能再行分解的光叫做单色光;复色光:含有若干种波长成份的混合光就叫做复色光。
光的色散:复色光分解成单色光的现象,叫做光的色散。
光谱:由色散形成的光按一定次序排列的光带叫做“光谱”。
4、光谱的分类光谱又分为发射光谱、吸收光谱和荧光光谱。
发射光谱:因物质的原子、离子或分子由较高能态向较低能态或基态跃迁而产生的光谱,称为发射光谱。
由发光体所发出的光直接得到的光谱都是发射光谱。
吸收光谱:物质的原子、离子或分子将吸收与其内能变化相对应的频率而由低能态或基态过渡到较高的能态,这种因物质对辐射的选择性吸收而得到的原子或分子光谱,称为吸收光谱。

有机化合物的光谱解析实验教案有机化合物的光谱解析实验教案一、实验目的:1.学习并掌握光谱解析的基本原理和方法。
2.通过实验,观察有机化合物的红外光谱、核磁共振氢谱和质谱,解析其结构特征。
3.培养学生对有机化合物光谱解析的实际操作能力和结构推断能力。
二、实验原理:光谱解析是利用物质吸收光、发射光或散射光的波长与强度,来确定物质的结构和组成的一种方法。
在有机化合物光谱解析中,常用的光谱技术包括红外光谱(IR)、核磁共振氢谱(1H-NMR)和质谱(MS)。
1.红外光谱(IR):利用不同化学键或基团在红外区域的吸收特性,研究有机化合物的分子结构。
不同类型的化学键或基团在红外光谱中表现出独特的吸收峰。
2.核磁共振氢谱(1H-NMR):利用核磁共振原理,研究有机化合物中氢原子(或其他原子)的化学环境。
不同类型的氢原子在核磁共振谱中表现出不同的化学位移。
3.质谱(MS):通过离子化样品并测量其质量-电荷比,研究有机化合物的分子量、分子式和分子结构。
在质谱中,不同的分子结构会产生不同的碎片离子,这些离子可用于推断分子结构。
三、实验步骤:1.准备试剂与仪器:准备好待测有机化合物、红外光谱仪、核磁共振谱仪、质谱仪等实验器材和试剂。
2.样品处理:将待测有机化合物进行适当处理,以便进行光谱分析。
例如,对于固体样品,可能需要使用KBr压片或溶解在适当溶剂中。
3.红外光谱分析:将处理后的样品放入红外光谱仪中,采集红外光谱数据。
记录各个吸收峰的位置与强度。
4.核磁共振氢谱分析:将处理后的样品放入核磁共振谱仪中,采集1H-NMR数据。
记录各个峰的化学位移与相对强度。
5.质谱分析:将处理后的样品放入质谱仪中,采集质谱数据。
解析各个碎片离子的质量与电荷比,结合其他光谱数据推断分子结构。
6.数据处理与结构推断:根据采集到的光谱数据,结合已知的化合物信息,推断化合物的可能结构。
对比已知数据,验证推断结构的准确性。
7.撰写实验报告:记录实验过程、数据和结论,撰写实验报告。



实验荧光光谱分析一、实验目的与要求:1. 了解荧光分光光度计的构造和各组成部分的作用;2. 掌握荧光分光光度计的工作原理;3. 掌握激发光谱、发射光谱及余辉衰减曲线的测试方法。
二、基本概念1. 发射光谱是指发光的能量按波长或频率的分布。
通常实验测量的是发光的相对能量。
发射光谱中,横坐标为波长(或频率),纵坐标为发光相对强度。
发射光谱常分为带谱和线谱,有时也会出现既有带谱、又有线谱的情况。
2. 激发光谱是指发光的某一谱线或谱带的强度随激发光波长(或频率)变化的曲线。
横坐标为激发光波长,纵坐标为发光相对强度。
激发光谱反映不同波长的光激发材料产生发光的效果。
即表示发光的某一谱线或谱带可以被什么波长的光激发、激发的本领是高还是低;也表示用不同波长的光激发材料时,使材料发出某一波长光的效率。
3. 余辉衰减曲线是指激发停止后发光强度随时间变化的曲线。
横坐标为时间,纵坐标为发光强度(或相对发光强度)。
三、测试仪器激发光谱、发射光谱及余辉衰减曲线的测试采用日本岛津RF-5301PC型荧光分光光度计。
从150W氙灯光源发出的紫外和可见光经过激发单色器分光后,再经分束器照到样品表面,样品受到该激发光照射后发出的荧光经发射单色器分光,再经荧光端光电倍增管倍增后由探测器接收。
另有一个光电倍增管位于监测端,用以倍增激发单色器分出的经分束后的激发光。
光源发出的紫外-可见光或者红外光经过激发单色器分光后,照到荧光池中的被测样品上,样品受到该激发光照射后发出的荧光经发射单色器分光,由光电倍增管转换成相应电信号,再经放大器放大反馈进入A/D转换单元,将模拟电信号转换成相应数字信号,并通过显示器或打印机显示和记录被测样品谱图。
四、样品制备液体试样液体试样应放入专用的液体样品槽中,固定到样品座中。
五、测试过程(一)RF-5301PC荧光分光光度计测试发射、激发光谱及余辉衰减曲线步骤先开机:打开Xe灯开关和主机开关。
开电脑。
双击电脑桌面的“RFPC”程序快捷键进入测试程序,会出现初始化界面,仪器依次检测ROM、RAM、EEPROM 激发狭缝、发射狭缝、激发单色器、发射单色器和基线,初始化完成后,进入到测试界面。



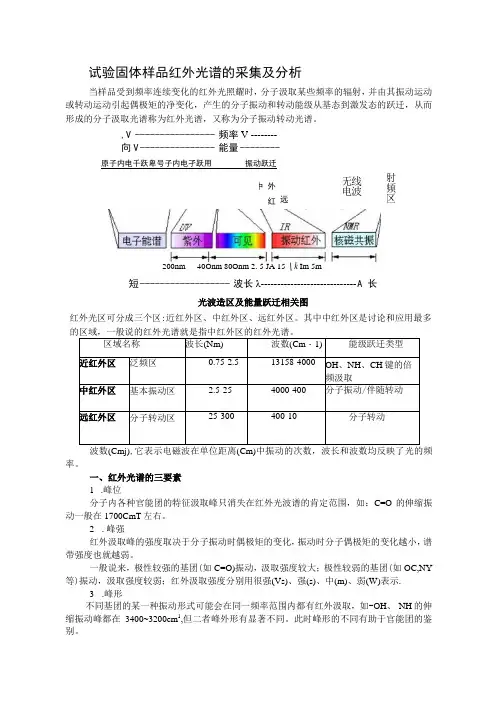
试验固体样品红外光谱的采集及分析当样品受到频率连续变化的红外光照耀时,分子汲取某些频率的辐射,并由其振动运动或转动运动引起偶极矩的净变化,产生的分子振动和转动能级从基态到激发态的跃迁,从而形成的分子汲取光谱称为红外光谱,又称为分子振动转动光谱。
,V ---------------- 频率V --------向V --------------- 能量 -------- 原子内电千跃卑号子内电孑跃用 振动跃迁红外光区可分成三个区:近红外区、中红外区、远红外区。
其中中红外区是讨论和应用最多的区域,一般说的红外光谱就是指中红外区的红外光谱。
区域名称 波长(Nm) 波数(Cm ・1) 能级跃迁类型近红外区 泛频区0.75-2.5 13158-4000 OH 、NH 、CH 键的倍频汲取 中红外区 基本振动区2.5-25 4000-400 分子振动/伴随转动 远红外区 分子转动区 25-300 400-10 分子转动波数(Cmj),它表示电磁波在单位距离(Cm)中振动的次数,波长和波数均反映了光的频率。
一、红外光谱的三要素1 .峰位分子内各种官能团的特征汲取峰只消失在红外光波谱的肯定范围,如:C=O 的伸缩振动一般在1700CmT 左右。
2 .峰强红外汲取峰的强度取决于分子振动时偶极矩的变化,振动时分子偶极矩的变化越小,谱带强度也就越弱。
一般说来,极性较强的基团(如C=O)振动,汲取强度较大;极性较弱的基团(如OC,NY 等)振动,汲取强度较弱;红外汲取强度分别用很强(Vs)、强(s)、中(m)、弱(W)表示.3 .峰形不同基团的某一种振动形式可能会在同一频率范围内都有红外汲取,如-OH 、-NH 的伸缩振动峰都在3400~3200cm 1,但二者峰外形有显著不同。
此时峰形的不同有助于官能团的鉴别。
远 外红中线波 无电 射频区200nm 40Onm 80Onm 2. 5 JA 15 ∖k Im 5m短 ------------------ 波长λ----------------------------- A 长光波造区及能量跃迁相关图常见官能团红外汲取特征频率表可见附录二、红外光谱仪的作用一是分析某化合物中是否含有某些官能团。

实验名称:光谱分析一实验目的1、学习光谱分析的基本原理,光谱图的基本特征;2、掌握利用光谱进行定性分析的基本方法和鉴定程序。
二实验仪器红外光谱仪,计算机三实验原理利用红外光谱对物质分子进行的分析和鉴定。
将一束不同波长的红外射线照射到物质的分子上,某些特定波长的红外射线被吸收,形成这一分子的红外吸收光谱。
每种分子都有由其组成和结构决定的独有的红外吸收光谱,据此可以对分子进行结构分析和鉴定。
红外吸收光谱是由分子不停地作振动和转动运动而产生的,分子振动是指分子中各原子在平衡位置附近作相对运动,多原子分子可组成多种振动图形。
当分子中各原子以同一频率、同一相位在平衡位置附近作简谐振动时,这种振动方式称简正振动(例如伸缩振动和变角振动)。
分子振动的能量与红外射线的光量子能量正好对应,因此当分子的振动状态改变时,就可以发射红外光谱,也可以因红外辐射激发分子而振动而产生红外吸收光谱。
分子的振动和转动的能量不是连续而是量子化的。
但由于在分子的振动跃迁过程中也常常伴随转动跃迁,使振动光谱呈带状。
所以分子的红外光谱属带状光谱。
分子越大,红外谱带也越多。
红外光谱仪的种类有:①棱镜和光栅光谱仪。
属于色散型,它的单色器为棱镜或光栅,属单通道测量。
②傅里叶变换红外光谱仪。
它是非色散型的,其核心部分是一台双光束干涉仪。
当仪器中的动镜移动时,经过干涉仪的两束相干光间的光程差就改变,探测器所测得的光强也随之变化,从而得到干涉图。
经过傅里叶变换的数学运算后,就可得到入射光的光谱。
这种仪器的优点:①多通道测量,使信噪比提高。
②光通量高,提高了仪器的灵敏度。
③波数值的精确度可达0.01厘米-1。
④增加动镜移动距离,可使分辨本领提高。
⑤工作波段可从可见区延伸到毫米区,可以实现远红外光谱的测定。
红外光谱分析可用于研究分子的结构和化学键,也可以作为表征和鉴别化学物种的方法。
红外光谱具有高度特征性,可以采用与标准化合物的红外光谱对比的方法来做分析鉴定。

实验七:红外光谱法推测化合物结构一、目的要求1.通过推测化合物C7H6O2的结构,掌握用红外光谱推测化合物结构的原理和方法。
2.了解红外分光光度计的使用。
二、方法原理当已知化合物的分子式时,可以计算其不饱和度u,从而可推测化合物的类型。
然后根据红外图谱解析的程序,有的放矢地对测得的红外光谱图进行解析。
通过解析图谱中的主要吸收峰,可知道组成化合物的各基团及它们相互间的连接情况,就可推测可能的结构式。
最后与红外标准图谱对照以确定结构。
三、实验步骤本实验的制样方式是采用溴化钾压片法。
1.取0.5~2mg样品,于玛瑙研钵中研细。
2.于研钵中加入100~200mg事先研细至2μm左右,于110~150℃烘箱充分烘干(约需48小时)的KBr粉末,把样品与KBr粉末充分研磨均匀。
3.把上述均匀的混合物置于一定的模具中,在真空下加压成直径为5mm或13mm的半透明片子。
4.把此半透明片子放于红外分光光度计的样品窗口,在参比窗口放上空白的KBr片子,进行测谱。
5.取下测好的红外光谱图,进行图谱解析工作。
四、图谱解析化合物C7H6O2的不饱和度u=1+7+1/2(0-6)=5。
可能含有苯环。
测得的红外光谱图的各谱峰及其归属见下表功能团区的3077,3012 c m -1及1600,1582,1495,1451 c m -1以及指纹区的751,690cm -1等处的峰表示含有单取代苯环(对不饱和度贡献为4),而1684cm -1表示分子中含有羰基(对不饱和度贡献为1)。
此羰基出现在较低波数表示羰基与苯环共轭,同时根据3000~2500cm -1一系列的多重峰和特征的935cm -1(羰基上OH 的面外弯曲振动),可断定此羰基是属于羧基的。
因此可推测该化合物为苯甲酸。
C OOH根据分子式C 7H 6O 2,查SADTLER 标准图谱分子式索引,查得苯甲酸的红外标准图谱号码为779。
将实验测得的红外光谱图与标准图谱779号对照,完全一致。
光谱分析实验教案引言:光谱分析是一种重要的实验方法,它通过研究物质在不同波长的光下的吸收、发射或散射特性,来获取物质的结构、组成和性质等信息。
在化学、物理、天文学等领域都有广泛的应用。
本文将介绍一份光谱分析实验教案,旨在帮助学生理解光谱分析的原理和应用,培养他们的实验技能和科学思维能力。
实验目的:通过本实验,学生将学会使用分光光度计进行吸收光谱测量,并掌握光谱分析的基本原理和应用方法。
实验材料:1. 分光光度计2. 可见光源(如白炽灯)3. 吸光物质溶液(如染料溶液)4. 试管或石英比色皿5. 光谱图纸实验步骤:1. 准备工作:将分光光度计调至可见光区,打开可见光源,调整光强适中。
2. 校准仪器:使用空白试剂(如纯水)进行校准,调整零点。
3. 测量吸光度:将吸光物质溶液倒入试管或石英比色皿中,放入分光光度计中,选择适当的波长进行测量,记录吸光度数值。
4. 绘制吸收光谱:根据测量结果,绘制吸收光谱曲线,标明吸光度和波长的关系。
5. 分析结果:根据吸收光谱曲线,分析吸光峰的位置、强度和形状,推测物质的结构和组成等信息。
6. 总结实验:总结实验结果,讨论实验中可能存在的误差和改进方法。
实验原理:光谱分析基于物质对不同波长光的吸收和发射特性。
当物质受到光的照射时,其分子内部的电子会发生跃迁,从低能级跃迁到高能级或从高能级跃迁到低能级,吸收或发射特定波长的光。
吸收光谱是物质在不同波长光下吸收光的强度与波长的关系曲线。
通过分析吸收光谱曲线,可以推测物质的结构和组成等信息。
实验应用:光谱分析在许多领域都有广泛的应用。
在化学领域,可以通过吸收光谱来测定物质的浓度、反应动力学等。
在生物医学领域,可以通过红外光谱来研究生物分子的结构和功能。
在天文学领域,可以通过光谱分析来研究恒星的组成和演化等。
实验注意事项:1. 实验过程中要注意安全,避免接触有毒物质。
2. 保持仪器的清洁和正常运行,避免误差的产生。
3. 实验前要对仪器进行校准,确保测量结果的准确性。
实验一火焰原子发射光谱法测定水样中的钠一、实验目的1. 了解火焰原子发射光谱仪的使用方法。
2. 学习利用火焰原子发射光谱测定水样中Na+含量的方法。
二、基本原理原子发射光谱分析(atomic emission spectrosmetry, AES),是根据处于激发态的待测元素原子回到基态时发射的特征谱线对待测元素进行分析的方法。
当试样在等离子体光源中被激发,待测元素会发射出特征波长的辐射,经过分光,并按波长顺序记录下来,根据特征波长谱线的存在情况可以进行定性分析,测量其强度可以进行定量分析。
原子吸收分光光度法测定的是占原子总数99%以上的基态原子,而原子发射光谱测定的是占原子总数不到1%的激发态原子,所以前者的灵敏度和准确度比后者高的多。
但原子吸收光谱法适合分析微量、痕量元素,因此,火焰原子发射光谱法可以分析浓度高的样品。
三、仪器与试剂1. GGX-9型原子吸收分光光度计(使用发射光谱检测功能)。
2. 空气压缩机(应备有除水、除油、除尘装置)。
3. 乙炔钢瓶。
燃气流量:0.9~1.2 l/min4. 容量瓶(50 mL,100 mL,l000 mL),移液管(5 mL),烧杯(100 mL,250 mL)。
5. 氯化钠(光谱纯)。
6. 浓硝酸(分析纯)。
四、实验步骤1. 钠的标准溶液配制(1)标准储备液配制钠标准贮备液:称取光谱纯氯化钠11.7000 g (准确到0.0001 g),用60 mL硝酸溶液溶解,用去离子水准确稀释至1000 mL,摇匀。
此溶液浓度为2 mg/mL(以Na计)。
(2)标准溶液配制取Na标准贮备液(2 mg/mL)20 mL,移入100 mL容量瓶中,用去离子水稀释至刻度,摇匀备用,此溶液Na含量为400 µg/mL。
2. 工作曲线的绘制分别移取钠的标准溶液0.00 mL,1.00 mL,3.00 mL,4.00 mL,5.00 mL于50 mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
以零号溶液为空白,乙炔压力为20 kPa的贫燃火焰,在589.0 nm的波长位置分别测量以上标准溶液的吸光度值。
将测得的发射光强度值对纳溶液的质量浓度作图,绘出工作曲线。
3. 未知样的分析水样采集后尽快通过0.45 µm滤膜过滤,取50mL在电炉上加热蒸至近干,然后立即加1 mL浓硝酸消解,消解澄清后,继续加热将酸蒸至近干。
用制作工作曲线的相同测量条件测定其吸光度值,然后由工作曲线查出未知溶液中钠的质量浓度(µg/mL)。
在测定样品的同时,用去离子水代替试样做空白实验。
五、结果处理1. 根据实验步骤2,以发射光强度为纵坐标,标准钠溶液的质量浓度为横坐标作图,绘制工作曲线。
2. 根据实验步骤3,由测得的未知样的发射光信号强度,在工作曲线查出未知溶液中Na的质量浓度(µg/mL),并计算出水样中Na的含量(µg/mL)。
六、思考题1.火焰原子发射法测Na会存在哪些干扰,应如何消除?实验二 原子吸收分光光度法测定湖水中铁的含量一、实验目的1. 了解GGX-9型原子吸收分光光度计的基本结构和使用方法。
2. 观察了解空心阴极灯电流、火焰高度、火焰状态等因素对吸光度的影响。
3. 掌握原子吸收分光光度法进行定量测定的方法。
二、实验原理1. 原子吸收分光光度法定量原理原子吸收分光光度法基于由基态跃迁至激发态时对辐射光吸收的测量。
通过选择一定波长的辐射光源,使之满足某种原子由基态跃迁到激发态能级的能量要求,则辐射后基态的原子数减少,辐射吸收值与基态原子的数量有关,也即由吸收前后辐射光强度的变化可确定待测元素的浓度。
因此从光源发出的待测元素的特征辐射通过样品蒸气时,被待测元素基态原子所吸收,从而由辐射的减弱程度求得样品中被测元素的含量。
在锐线光源条件下,光源的发射线通过一定厚度的原子蒸气,并被基态原子所吸收,吸光度与原子蒸气中待测元素的基态原子数间的关系遵循朗伯-比尔定律:lN I I κ==)lg(A 0式中:A 为吸光度;I 0为入射光强度;I 为经过原子蒸气吸收后的透射光强度;κ为摩尔吸收系数;l 为光波所经过的原子蒸气的光程长度;N 为基态原子浓度。
在火焰温度低于3000 K 的条件下,可以认为原子蒸气中基态原子的数目实际上接近于原子总数。
在特定的实验条件下,原子总数与样品浓度门的比例是恒定的,所以,上式又可以写成:B c A 'κ=这就是原子吸收分光光度法的定量基础。
常用的定量方法为标准曲线法和标准加入法等。
2. 原子吸收分光光度仪原子吸收分光光度计的主要组成部分包括:光源、原子化器、分光系统和检测系统。
其光路如图1-11所示。
图1-11 原子吸收分光光度计光路图(1)光源:光源的功能是发射被测元素的特征共振辐射。
对光源的基本要求是:发射的共振辐射的半宽度要明显小于吸收线的半宽度;辐射强度大、背景低,低于特征共振辐射强度的1%;稳定性好,30分钟之内漂移不超过1%;噪声小于0.1%;使用寿命长于5安培小时。
空心阴极放电灯是能满足上述各项要求的理想的锐线光源,应用最广。
其一端由石英或玻璃制成光学窗口,两根钨棒封入管内,一根钨棒连有由钛、锆、钽等有吸气性能的金属制成的阳极,另一根上镶有一个圆筒形的空心阴极。
筒内衬上或熔入被测元素,管内充有几百帕低压载气,常用氖或氦气。
当在阴阳两极间加上电压时,气体发生电离,带正电荷的气体离子在电场作用下轰击阴极,使阴极表面的金属原子溅射出来,金属原子与电子、惰性气体的原子及离子碰撞激发而发出辐射。
最后,金属原子又扩散回阴极表面而重新沉积下来。
通常,改变空心阴极灯的电流可以改变灯的发射强度,在忽略自吸收的前提下,其经验公式为I=ai n。
其中:a,n均为常数;i为电流。
n与阴极材料、灯内所充气体及谱线的性质有关。
对于Ne、Ar等气体,n值为2~3,由此可见,灯的发射强度受灯电流的影响较大,影响吸光度。
(2)原子化器:将试样中的被测元素转化为基态原子的过程称为原子化过程,能完成这个转化的装置称原子化器,目前,使用较普遍的原子化器有两类,一类是火焰原子化器,另一类是由石墨炉原子化器。
待测元素的原子化是整个原子吸收分析中最困难和最关键的环节,原子化效率的高低直接影响到测定的灵敏度,原子化效率的稳定性则直接决定了测定的精密度。
火焰原子化法中,常用的预混合型原子化器,这种原子化器由雾化器、混合室和燃烧器组成。
雾化器是关键部件,其作用是将试液雾化,使之形成直径为微米级的气溶胶,作为一个性能良好的原子化装置要求其调节方便,单位时间内吸入的试液尽可能多地产生微细雾粒,并使雾珠尽可能地到达火焰进行原子化;混合室的作用是使较大的气溶胶在室内凝聚为大的溶珠沿室壁流入泄液管排走,使进入火焰的气溶胶在混合室内充分混合均匀以减少它们进入火焰时对火焰的扰动,并让气溶胶在室内部分蒸发脱溶;燃烧器最常用的是单缝燃烧器,其作用是产生火焰,使进入火焰的气溶胶蒸发和原子化。
因此,原子吸收分析的火焰应有足够高的温度,能有效地蒸发和分解试样,并使被测元素原子化。
此外,火焰应该稳定、背景发射和噪声低、燃烧安全。
原子吸收测定中最常用的火焰是乙炔-空气火焰。
原子吸收测定中最常用的火焰是乙炔-空气火焰,此外,应用较多的是氢-空气火焰和乙炔-氧化亚氮高温火焰。
乙炔-空气火焰燃烧稳定,重现性好,噪声低,燃烧速度不是很大,温度足够高(约2300℃),对大多数元素有足够的灵敏度。
氢-空气火焰是氧化性火焰,燃烧速度较乙炔-空气火焰高,但温度较低(约2050℃),优点是背景发射较弱,透射性能好。
乙炔-氧化亚氮火焰的特点是火焰温度高(约2955℃),而燃烧速度并不快,是目前应用较广泛的一种高温火焰,用它可测定70多种元素。
(3)分光器:分光器由入射和出射狭缝、反射镜和色散元件组成,其作用是将所需要的共振吸收线分离出来。
分光器的关键部件是色散元件,现在商品仪器都是使用光栅。
原子吸收光谱仪对分光器的分辨率要求不高,曾以能分辨开镍三线Ni230.003、Ni231.603、Ni231.096nm为标准,后采用Mn279.5和279.8nm代替Ni三线来检定分辨率。
光栅放置在原子化器之后,以阻止来自原子化器内的所有不需要的辐射进入检测器。
(4)检测系统:原子吸收光谱仪中广泛使用的检测器是光电倍增管,最近一些仪器也采用CCD(电荷耦合检测器)作为检测器。
三、仪器与试剂1. GGX-9型原子吸收分光光度计,铁空心阴极灯一只。
2. 空气压缩机(应备有除水、除油、除尘装置)。
3. 乙炔钢瓶。
4. 容量瓶(50 mL,100 mL,l000 mL),移液管(5 mL),烧杯(100 mL,250 mL)。
5. 金属铁(光谱纯)。
6. 浓盐酸(分析纯)。
7. 浓硝酸(分析纯)。
四、实验步骤1. 铁的标准溶液配制(1)标准储备液配制铁标准贮备液:称取光谱纯金属铁1.0000 g (准确到0.0001 g),用60 mL盐酸溶液溶解,用去离子水准确稀释至1000 mL,摇匀。
此溶液浓度为1 mg/mL(以Fe计)。
(2)标准溶液配制取Fe标准贮备液(1000 µg/mL)5mL,移入100mL容量瓶中,用去离子水稀释至刻度,摇匀备用,此溶液Fe含量为50 µg/mL。
2. 工作曲线的绘制分别移取铁的标准溶液0.00 mL,1.00 mL,3.00 mL,4.00 mL,5.00 mL于50 mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
以零号溶液为空白,选择灯电流为2~5mA,乙炔压力为20 kPa的贫燃火焰,在248.3 nm的波长位置分别测量以上标准溶液的吸光度值。
将测得的吸光度值对铁溶液的质量浓度作图,绘出工作曲线。
3. 未知样的分析水样采集后尽快通过0.45 µm滤膜过滤,并立即加硝酸(1.42g/mL)酸化滤液,使pH为1~2。
用制作工作曲线的相同测量条件测定其吸光度值,然后由工作曲线查出未知溶液中铁的质量浓度(µg/mL)。
在测定样品的同时,用去离子水代替试样做空白实验。
五、结果处理1. 根据实验步骤2,以吸光度值为纵坐标,标准铁溶液的质量浓度为横坐标作图,绘制工作曲线。
2. 根据实验步骤3,由测得的未知样的吸光度值,在工作曲线查出未知溶液中铁的质量浓度(µg/mL),并计算出水样中铁的含量(µg/mL)。
六、思考题1. 在原子吸收光谱法中,为什么单色器位于样品室(火焰)之后,而不像紫外-可见分光光度计位于样品室之前?2. 为保证分析的准确度和精密度,实验中应该注意哪些问题?3. 何谓锐线光源?在原子吸收光谱分析中为什么要用锐线光源?4. 谱线变宽的原因有哪些?有何特点?参考文献1 穆华荣. 仪器分析实验,第二版. 北京: 化学工业出版社. 2004, 63-662 徐家宁. 基础化学实验(下册,物理化学和仪器分析实验),北京:高等教育出版社. 2006, 223-224实验三火焰原子吸收光谱法测定土壤中的铜(标准加入法)一、实验目的1. 掌握标准加入法测定元素含量的操作方法。