(推荐)高一化学必修二有机物知识点总结
- 格式:doc
- 大小:362.00 KB
- 文档页数:4

高一必修2有机化学知识点有机化学是化学学科的重要分支之一,主要研究碳元素及其化合物的性质、结构、合成和变化规律。
作为高中化学的必修课程之一,高一必修2有机化学知识点是学生们需要掌握的基础知识。
下面将从有机物的命名、结构和性质等方面,介绍高一必修2有机化学的主要知识点。
一、有机物的命名有机物的命名是有机化学中非常重要的一部分,通过命名可以准确地表示出有机物的结构和性质。
有机物的命名一般遵循一定的规则和规范,下面是有机物的命名方法的几个主要原则:1. 给有机物选择主链。
主链是由最长的碳链组成的,在主链上的每个碳原子上都可以进行取代。
2. 用取代基命名。
取代基是连接在主链上的其他原子或原团,用各种不同的前缀或后缀表示。
3. 编写完整的有机物名。
根据取代基和主链的位置以及它们的性质,确定有机物的完整名字。
二、有机物的结构有机物的结构包括分子结构和宏观结构。
分子结构是指有机物分子中各个原子之间的相对位置和结构关系。
宏观结构是指有机物物质的形态、性质和状态。
1. 分子结构有机物的分子结构决定了它的物理和化学性质。
在有机物分子中,碳原子可以形成单键、双键或三键,并与其他原子(如氢、氧、氮等)形成共价键。
2. 宏观结构有机物的宏观结构与其分子结构密切相关。
有机物可以存在于固体、液体和气体三种不同的聚集态,且会因为宏观结构的变化而表现出不同的性质。
三、有机物的性质有机物的性质与它的分子结构和宏观结构密切相关,下面是几个常见的有机物性质:1. 燃烧性大部分有机化合物可以燃烧,释放出大量的热能。
燃烧产物主要是二氧化碳和水。
2. 溶解性有机物的溶解性主要与分子结构中的极性基团有关。
极性有机物一般可以溶解于水等极性溶剂,而非极性有机物则溶解于非极性溶剂。
3. 反应性有机物的反应性很高,可以发生多种化学反应,如加成反应、消除反应、取代反应等。
这些反应对有机合成具有重要的意义。
四、有机化学的应用有机化学的应用非常广泛,几乎与人们的日常生活密切相关。

2024年高一化学必修二有机物知识点总结有机物是指由碳元素组成的化合物,是生命存在和发展的基础。
有机物的研究内容涉及到有机物的结构、性质及其与其他物质之间的相互作用等方面。
下面是2024年高一化学必修二有机物的知识点总结:一、有机化合物的命名1. 碳骨架的命名:直链、分支链和环状结构的命名方法;2. 取代基的命名:直链和分支链上的取代基的命名方法。
(例如,甲烷、乙烷、乙烯、氯乙烷、甲基氯、氯甲烷等)二、有机物的结构与性质1. 碳骨架的特点;2. 取代基的影响:取代基对有机物的物理性质和化学性质的影响;3. 功能团的特点:醇、酚、醚、醛、酮、羧酸、酯、胺、脂肪酸等的结构和性质。
三、烃类1. 烷烃:顺序碳烷、环状烷烃的结构和性质(例如:甲烷、乙烷、环戊烷等);2. 烯烃:顺序碳烯、环状烯烃的结构和性质(例如:乙烯、丙烯、环戊二烯等);3. 炔烃:顺序碳炔和环状炔烃的结构和性质(例如:乙炔、环戊二炔等)。
四、有机物的重要反应1. 酸碱中和反应:醇的酸碱中和反应、酸对有机物结构和性质的影响;2. 酯的酸碱中和反应和水解反应;3. 羧酸的酸碱中和反应、酸酐的形成和水解反应;4. 脂肪酸的结构和性质;5. 醇的氧化反应和酰氯的生成;6. 羟肟法合成醇;7. 氧化反应:醇的氧化制醛、醛的氧化制酸、醛的氧化制羧酸的反应、脂肪酸的氧化反应。
8. 加成反应:烯烃的加成反应、炔烃的加成反应。
五、官能团的化学变化1. 醇的氧化反应;2. 酸的酯化反应;3. 胺与酸的酰胺化反应。
六、有机物的合成1. 醇的合成:醇的加成、脱水缩合反应、酸阻断(酸催化)和还原反应;2. 酮的合成:醛的氧化、酮和酸酐的酰胺化反应;3. 羧酸的合成:主要是醇和醛的氧化反应及醮的水解反应。
七、高分子化合物1. 高分子化合物的特点和分类;2. 聚合反应:自由基聚合反应、离子聚合反应和缩聚反应等。
八、天然有机化合物与应用1. 生长素及应用;2. 阿司匹林及应用;3. 天然橡胶及应用。

高一必修二有机化学知识点高一必修二有机化学知识点(一)1、各类有机物的通式、及主要化学性质烷烃cnh2n+2 仅含c—c键与卤素等发生取代反应、热分解、不与高锰酸钾、溴水、强酸强碱反应烯烃cnh2n 含c==c键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应、加聚反应炔烃cnh2n-2 含c≡c键与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应苯(芳香烃)cnh2n-6与卤素等发生取代反应、与氢气等发生加成反应(甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应)卤代烃:cnh2n+1x醇:cnh2n+1oh或cnh2n+2o 有机化合物的性质,主要抓官能团的特性,比如,醇类中,醇羟基的性质:1.可以与金属钠等反应产生氢气,2.可以发生消去反应,注意,羟基邻位碳原子上必须要有氢原子,3.可以被氧气催化氧化,连有羟基的碳原子上必要有氢原子。
4.与羧酸发生酯化反应。
5.可以与氢卤素酸发生取代反应。
6.醇分子之间可以发生取代反应生成醚。
苯酚:遇到fecl3溶液显紫色醛:cnh2no 羧酸:cnh2no2 酯:cnh2no22、取代反应包括:卤代、硝化、卤代烃水解、酯的水解、酯化反应等;3、最简式相同的有机物,不论以何种比例混合,只要混和物总质量一定,完全燃烧生成的co2、h2o及耗o2的量是不变的。
恒等于单一成分该质量时产生的co2、h2o和耗o2量。
4、可使溴水褪色的物质如下,但褪色的原因各自不同:烯、炔等不饱和烃(加成褪色)、苯酚(取代褪色)、醛(发生氧化褪色)、有机溶剂[ccl4、氯仿、溴苯(密度大于水),烃、苯、苯的同系物、酯(密度小于水)]发生了萃取而褪色。
较强的无机还原剂(如so2、ki、feso4等)(氧化还原反应)5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物(2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物(4)具有还原性的无机物(如so2、feso4、ki、hcl、h2o26.能与na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物7、能与naoh溶液发生反应的有机物:(1)酚: (2)羧酸: (3)卤代烃(水溶液:水解;醇溶液:消去) (4)酯:(水解,不加热反应慢,加热反应快) (5)蛋白质(水解)8.能发生水解反应的物质有:卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐9、能发生银镜反应的有:醛、甲酸、甲酸某酯、葡萄糖、麦芽糖(也可同cu(oh)2反应)。
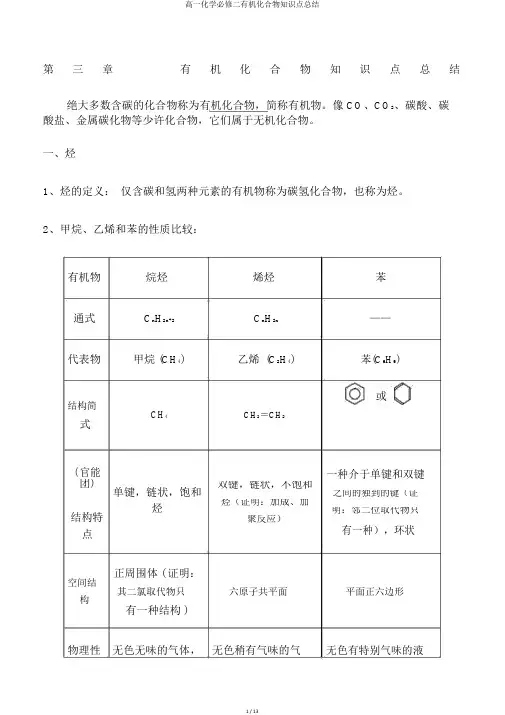
第三章有机化合物知识点总结绝大多数含碳的化合物称为有机化合物,简称有机物。
像 CO、CO2、碳酸、碳酸盐、金属碳化物等少许化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:有机物烷烃烯烃苯通式C n H2n+2C n H2n——代表物甲烷 (CH4)乙烯(C2H4)苯(C6H6)或结构简CH4CH2=CH2式( 官能一种介于单键和双键团)单键,链状,饱和双键,链状,不饱和之间的独到的键(证烃烃(证明:加成、加结构特明:邻二位取代物只聚反应)点有一种),环状正周围体 ( 证明:空间结其二氯取代物只六原子共平面平面正六边形构有一种结构 )物理性无色无味的气体,无色稍有气味的气无色有特别气味的液质比空气轻,难溶于水体,比空气略轻,难溶于水体,密度比水小,难溶于水用途优异燃料,化工原料石化工业原料,植物生长调治剂,催熟剂有机溶剂,化工原料3、烃类有机物化学性质有机物主要化学性质1、甲烷不能够使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应,性质比较牢固。
2、氧化反应(燃烧)注:可燃性气体点燃从前必然要验纯CH4+2O点燃CO2+2HO(淡蓝色火焰)3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有 5 种)甲烷CH4+Cl2 光CH3Cl+HCl CH 3 Cl +Cl 2 光CH2Cl 2+HClCHCl +Cl2 光CHCl+HClCHCl +Cl2光CCl +HCl2 23 3 4注意事项:①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐渐被氯原子取代;②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl 气体产量最多;③取代关系:1H~~Cl 2;④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。

高一化学必修二知识点有机有机化学是化学中的一个重要分支,研究有机物的结构、性质和合成方法。
高一化学必修二中也包含了一些有机化学的知识点,下面将介绍其中几个重要的知识点。
一、碳的四价有机化合物的特点之一是碳元素的存在。
碳原子的电子排布为1s2 2s2 2p2,其中2s层有两个电子,2p层有两个未成对电子。
这使得碳原子能够与其他原子形成多种化合物。
碳原子通过共价键形成化学键,每个碳原子能形成四个共价键。
这也是有机物中碳原子的四价的原因。
二、有机化合物的分类有机化合物根据它们所含有的特定基团可进行分类。
例如,烃是由碳和氢原子组成的有机化合物。
根据碳原子之间的连接方式,烃又可以分为饱和烃和不饱和烃。
饱和烃中的碳原子之间只含有单键,而不饱和烃中的碳原子之间存在双键或者三键。
另外,还有含有其他元素的有机化合物,如卤代烃、醇、醚、酮、酸等。
三、烃的同系物与异构体同系物是指化合物分子中所含的原子种类相同,但分子结构和物理性质略有不同的一类化合物。
烃的同系物是指分子中所含的碳原子数相同,而氢原子数不同的一系列化合物。
例子有甲烷、乙烷、丙烷等。
同系物具有相似的物理性质和化学行为。
异构体是指分子式相同,结构不同的化合物。
例如,丙烷和异丙烷即为一种异构体。
由于碳原子有四个配位空位,所以它们可以形成不同的空间构型,从而导致分子结构和性质的不同。
四、烃的命名方法有机化合物的命名方法有机理性和非名义两种。
有机理性命名是根据化合物的结构特征来命名的,而非名义命名则是根据化合物的来源或者性质来命名的。
在有机化学中,IUPAC命名法被广泛应用。
IUPAC命名法基于一定的规则,通过对化合物分子结构的分析,从而给化合物一个准确的名称。
其中,主链确定、取碳原子编号、标记官能团、命名前缀和后缀是IUPAC命名法的重要步骤。
通过这些知识点的学习,我们可以更加了解有机化学的基础知识和分类方法。
有机化学是化学领域的重要分支,它不仅在生物学、医药学等领域中有广泛应用,还对其他领域的发展起到关键作用。

⾼⼀化学必修2-有机化学知识点归纳⾼⼀化学必修2 有机化学知识点归纳(⼆)⼀、有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原⼦、原⼦团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:⽆;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键⾓为109°28′,空间正四⾯体分⼦。
烷烃分⼦中的每个C 原⼦的四个价键也都如此。
C) 化学性质:①取代反应(与卤素单质、在光照条件下),,……。
②燃烧③热裂解 (2)烯烃:A) 官能团:;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2B) 结构特点:键⾓为120°。
双键碳原⼦与其所连接的四个原⼦共平⾯。
C) 化学性质:①加成反应(与X 2、H 2、HX 、H 2O 等)②加聚反应(与⾃⾝、其他烯烃)③燃烧 (3)炔烃:A) 官能团:—C≡C— ;通式:C n H 2n —2(n ≥2);代表物:HC≡CHB) 结构特点:碳碳叁键与单键间的键⾓为180°。
两个叁键碳原⼦与其所连接的两个原⼦在同⼀条直线上。
CH 4 + Cl 2CH 3Cl + HCl 光CH 3Cl + Cl 2CH 2Cl 2 + HCl 光CH 4 + 2O 2CO 2 + 2H 2O点燃CH 4C + 2H 2⾼温隔绝空⽓C=C CH 2=CH 2 + HXCH 3CH 2X催化剂CH 2=CH 2 + 3O 22CO 2 + 2H 2O点燃n CH 2=CH 2CH 2—CH 2n催化剂CH 2=CH 2 + H 2OCH 3CH 2OH催化剂加热、加压CH 2=CH 2 + Br 2BrCH 2CH 2BrCCl 4原⼦:—X原⼦团(基):—OH 、—CHO (醛基)、—COOH (羧基)、C 6H 5— 等化学键:、—C ≡C — C=C 官能团C) 化学性质:(略) (4)苯及苯的同系物:A) 通式:C n H 2n —6(n ≥6);代表物:B)结构特点:苯分⼦中键⾓为120°,平⾯正六边形结构,6个C 原⼦和6个H 原⼦共平⾯。

2024年高一化学必修二有机物知识点总结一、有机物的基本概念和特点1. 有机物是由碳、氢和其他元素构成的化合物。
2. 有机物具有较低的沸点和融点,不导电,不溶于水,溶于非极性的溶剂,易于燃烧等特点。
3. 有机物的化学性质主要是由其分子中的官能团决定的。
二、有机物的官能团1. 烷基:由碳和氢构成的碳链。
2. 单键:以碳-碳键和碳-氢键为主。
3. 烷烃:只含有碳-碳单键的有机化合物。
4. 饱和烃:只含有碳-碳单键的烷烃。
5. 不饱和烃:含有碳-碳双键或三键的烯烃和炔烃。
6. 烷基化合物:由烷基与其他官能团组成的化合物。
7. 羟基:-OH官能团,羟基在分子中位置不同会影响化合物的性质。
8. 醇:含有羟基的有机化合物。
9. 醚:含有氧原子连接两个烃基的有机化合物。
10. 酮:含有羰基(C=O)的有机化合物,羰基在分子中位置不同会影响化合物的性质。
11. 羰基化合物:含有羰基的有机化合物,包括酮、醛和酸。
三、有机物的命名与结构1. 烷烃的命名:根据分子中碳原子的数量,在前缀中加上相应的词缀。
2. 烷基的命名:根据烷基与主链碳原子的骨架进行命名。
3. 醇的命名:根据羟基所连接的碳原子数进行命名,在相应的前缀前加上羟基的位置和数量。
4. 醚的命名:根据连接两个烃基的氧原子所连接的碳原子数进行命名。
5. 酮的命名:根据羰基所连接的碳原子数进行命名,遵循主链最长原则。
四、有机反应与有机官能团转化1. 配对反应:有机物的断键与形成键的过程。
2. 加成反应:在相邻的碳原子上添加一个官能团。
3. 消除反应:分子中的两个官能团结合而成一个官能团,并且脱掉一个小分子。
4. 氧化反应:有机物与氧气或氧化剂在反应中失去电子,增加氧原子数。
5. 还原反应:有机物与还原剂反应中获得电子,减少氧原子数。
五、有机化合物的性质和应用1. 烃的性质:易燃、不溶于水、轻于水、沸点和融点较低。
2. 醇的性质:可溶于水、具有氢键、沸点和融点较高。

必修二有机化学知识总结一、化石燃料化石燃料:煤、石油、天然气天然气的主要成分: CH 4石油的构成元素主假如碳和氢, 同时还含有 S 、O 、N 等。
主要成分各样液态的碳氢化合物,还溶有气态和固态的碳氢化合物煤是有机化合物和无机化合物所构成的复杂的混淆物。
煤的含量是 C 其次 H 、O 二、构造1、甲烷:分子式: CH 4构造式:电子式正四周体构造天然气三存在:沼气、坑气、天然气 2、化学性质一般状况下,性质稳固,跟强酸、强碱或强氧化剂不反 应( 1)、氧化性点燃CH 4+2O 2CO 2+2H 2O ;△ H<0CH 4 不可以使酸性高锰酸甲退色( 2)、代替反响代替反响:有机化合物分子的某种原子(或原子团)被另一种原子(原子团)所代替的反响CH 4+Cl 2光照CH 3Cl+HClCH Cl+Cl光照Cl + HCl2CH322CH 2Cl 2+Cl 2 光照CHCl 3+ HClCHCl +Cl光照+ HCl2CCl34( 3)主要用途:化工原料、化工产品、天然气、沼气应用三、乙烯石油炼制:石油分馏、催化裂化、裂解催化裂化:相对分子量较小、沸点教小的烃裂解:乙烯、丙烯老等气态短链烃石油的裂解已成为生产乙烯的主要方法 1、乙烯分子式: C H 4构造简式: CH ==CH2构造22式2、乙烯的工业制法和物理性质 6 个原子在同一平面上 工业制法:石油化工3、物理性质常温下为无色、无味气体,比空气略轻,难溶于水4、化学性质( 1)氧化性①可燃性现象:火焰光明,有黑烟原由:含碳量高②可使酸性高锰酸钾溶液退色 ( 2)加成反响有机物分子中双键(或叁键)两头的碳原子上与其余的原子或原子团直接联合生成新的化合物的反响现象:溴水退色催化剂CH 2=CH 2+H 2OCH 3CH 2OH(3) 加聚反响聚合反响:由相对分子量小的化合物相互联合成相对分子量很大的化合物。
这类由加成发生的聚合反响叫加聚反响乙烯聚乙烯用途: 1、石油化工基础原料2、植物生长调理剂催熟剂评论一个国家乙烯工业的发展水平已经成为权衡这个国家石油化学工业的重要标记之一四、煤的综合利用苯1、煤的气化、液化和干馏是煤综合利用的主要方法煤的气化:把煤转变为气体,作为燃料或化工原料气煤的液 --燃料油和化工原料干馏2、苯( 1)构造( 2)物理性质无色有特别气味的液体,熔点℃沸点℃,易挥发,不溶于水易溶于酒精等有机溶剂(3)化学性质①氧化性a.焚烧点燃2C6H 6+15O212CO 2+6H 2OB.不可以使酸性高锰酸钾溶液退色②代替反响硝化反响用途:基础化工原料、用于生产苯胺、苯酚、尼龙等第二单元食品中的有机化合物一、乙醇1、构造构造简式: CH3CH2OH 官能团 -OH 医疗消毒酒精是 75%2、氧化性①可燃性点燃CH 3CH 2OH+3O 22CO2+3H 2O②催化氧化催化剂2CH 3CH2OH+O 2 2 CH 3CHO+2H 2 O断1 、3键催化剂2 CH 3CHO+ O 2 2 CH 3COOH3、与钠反响2CH 3CH2OH+2Na2CH 3CH2ONa +H 2↑用途:燃料、溶剂、原料, 75%(体积分数)的酒精是消毒剂二、乙酸1、构造分子式: C2 H4O2,构造式:构造简式 CH3COOH 2 、酸性;CH 3COOHCH 3COO-+H+酸性 :CH 3COOH>H 2CO32CH COOH+Na2CO32CH3COONa+H O+CO2↑3 23、酯化反响醇和酸起作用生成脂和水的反响叫酯化反响催化剂CH CH OH+CH COOH CH COOCH CH +H23 2 3 3 2 3O反响种类:代替反响反响本质:酸脱羟基醇脱氢浓硫酸:催化剂和吸水剂饱和碳酸钠溶液的作用:( 1)中和挥发出来的乙酸(便于闻乙酸乙脂的气味)( 1)汲取挥发出来的乙醇( 3)降低乙酸乙脂的溶解度总结:三、酯油脂构造: RCOOR ′乙酸乙脂:水果、花卉芬芳气味油:植物油(液态)油脂脂:动物脂肪(固态)油脂在酸性和碱性条件下水解反响皂化反响:油脂在碱性条件下水解反响甘油应用:( 1)食用( 2)制肥皂、甘油、人造奶油、脂肪酸等四、糖类分子式通式 Cn (H 2O)m1、分类单糖:葡萄糖C6H 12O6糖类二糖:蔗糖: C12H 22O11多糖:淀粉、纤维素(C6H 10O5)n2、性质葡萄糖(1)氧化反响葡萄糖能发生银镜反响(光明的银镜)与新制Cu( OH )2反响(红色积淀)证明葡萄糖的存在查验病人的尿液中葡萄糖的含量能否偏高( 2)人体组织中的氧化反响供给生命活动所需要的能量C6H12O6( S)+6O2( g) ==6CO 2+6H 2O(l)△H=-12804KJ · mol -1C6H12O6 酒化酶2C2H 5OH+2CO2↑淀粉1、水解n五、蛋白质与氨基酸 3 聚氯乙烯 ---- 薄膜1、构成元素: C 、H 、O、 N 等,有的有 S、 P2、性质( 1)蛋白质是高分子化合物,相对分子质量很大( 2)★盐析:蛋白质溶液中加入浓的无机盐溶液,使蛋有机高分子的合成为人类供给了大批的新资料,使我们白质的溶解度降低进而析出的生活变的更为丰富多彩( 3)★变性:蛋白质发生化学变化凝集成固态物质而析有机物的系统命名法出1、烷烃的系统命名法( 4)颜色反响:蛋白质跟很多试剂发生颜色反响⑴ 定主链:就长不就短。

高一化学必修二有机物知识点有机化合物主要由氧元素、氢元素、碳元素组成。
有机物是生命产生的物质基础。
其特点主要有:多数有机化合物主要含有碳、氢两种元素,此外也常含有氧、氮、硫、卤素、磷等。
部分有机物来自植物界,但绝大多数是以石油、天然气、煤等作为原料,通过人工合成的方法制得。
和无机物相比,有机物数目众多,可达几百万种。
有机化合物的碳原子的结合能力非常强,互相可以结合成碳链或碳环。
碳原子数量可以是1、2个,也可以是几千、几万个,许多有机高分子化合物甚至可以有几十万个碳原子。
此外,有机化合物中同分异构现象非常普遍,这也是造成有机化合物众多的原因之一。
有机化合物除少数以外,一般都能燃烧。
和无机物相比,它们的热稳定性比较差,电解质受热容易分解。
有机物的熔点较低,一般不超过400℃。
有机物的极性很弱,因此大多不溶于水。
有机物之间的反应,大多是分子间反应,往往需要一定的活化能,因此反应缓慢,往往需要催化剂等手段。
而且有机物的反应比较复杂,在同样条件下,一个化合物往往可以同时进行几个不同的反应,生成不同的产物。
食品中的有机化合物:1.人体所需的营养物质:水、糖类(淀粉)、脂肪、蛋白质、维生素、矿物质其中,淀粉、脂肪、蛋白质、维生素为有机物。
2.淀粉(糖类)主要存在于大米、面粉等面食中;油脂主要存在于食用油、冰激凌、牛奶等;维生素主要存在于蔬菜、水果等;蛋白质主要存在于鱼、肉、牛奶、蛋等;纤维素主要存在于青菜中,有利于胃的蠕动,防止便秘。
其中淀粉、脂肪、蛋白质、纤维素是有机高分子有机化合物。
分类:一.根据碳原子结合而成的基本骨架不同,有机化合物被分为三大类:1.链状化合物这类化合物分子中的碳原子相互连接成链状,因其最初是在脂肪中发现的,所以又叫脂肪族化合物。
2.碳环化合物这类化合物分子中含有由碳原子组成的环状结构[2],故称碳环化合物。
它又可分为两类:脂环族化合物:是一类性质和脂肪族化合物相似的碳环化合物。
芳香族化合物:是分子中含有苯环或稠苯体系的化合物。

高一必修二有机化合物知识点有机化学是化学的一个重要分支,研究有机物的结构、性质、制备和变化规律。
在高一年级的化学学习中,学生将接触到有机化合物的基础知识。
本文将介绍高一必修二有机化合物的一些重要知识点,帮助学生更好地理解和掌握这些内容。
一、有机化合物的基本概念有机化合物是由碳原子和氢原子组成的化合物。
它们通常存在于生物体内,也可以由人工合成。
与无机化合物相比,有机化合物的特点是碳原子具有四个共价键的能力,可以形成多种多样的化合物。
而无机化合物则以金属和非金属元素的化合物为主。
二、碳的价态和碳的杂化有机化合物中碳原子的价态为四,即一个碳原子可以形成四个共价键。
碳的杂化是指碳原子的电子重新配置,使得碳原子形成正四面体的空间构型,以便与其他原子形成共价键。
常见的碳的杂化有sp3、sp2和sp杂化。
sp3杂化的碳原子形成四个σ键,sp2杂化的碳原子形成三个σ键和一个π键,sp杂化的碳原子形成两个σ键和两个π键。
三、有机化合物的命名原则有机化合物的命名原则主要包括根据分子式确定骨架、命名主链和给官能团命名等。
根据分子式确定骨架是指确定有机分子中碳原子构成的连续框架,可以是直链、支链或环状。
命名主链是指确定含有最多碳原子的直链或环状骨架,作为主链,其他碳原子称为支链。
给官能团命名是指根据分子中的官能团(功能团)给予相应的名称,如醇、酮、酯等。
四、同分异构体同分异构体是指分子式相同,但结构不同的化合物。
有机化合物中同分异构体常见的有结构异构体和空间异构体。
结构异构体是指同一分子式的化合物通过原子的连接方式不同而形成的异构体,而空间异构体是指分子式相同的化合物,在空间构型上存在不同的异构体。
同分异构体的存在使得有机化合物的种类变得更加丰富。
五、有机反应基础有机反应是指有机化合物之间或有机化合物与无机物之间发生的化学反应。
常见的有机反应有取代反应、还原反应、氧化反应等。
取代反应是指一个或多个原子或基团从有机分子中被其他原子或基团取代的反应。

【导语】⾼⼀新⽣要根据⾃⼰的条件,以及⾼中阶段学科知识交叉多、综合性强,以及考查的知识和思维触点⼴的特点,找寻⼀套⾏之有效的学习⽅法。
今天⽆忧考为各位同学整理了《⾼⼀化学必修⼆有机知识点归纳》,希望对您的学习有所帮助!【篇⼀】⾼⼀化学必修⼆有机知识点归纳 ⼀、物质的分类 ⾦属:Na、Mg、Al 单质 ⾮⾦属:S、O、N 酸性氧化物:SO3、SO2、P2O5等 氧化物碱性氧化物:Na2O、CaO、Fe2O3 氧化物:Al2O3等 纯盐氧化物:CO、NO等 净含氧酸:HNO3、H2SO4等 物按酸根分 ⽆氧酸:HCl 强酸:HNO3、H2SO4、HCl 酸按强弱分 弱酸:H2CO3、HClO、CH3COOH 化⼀元酸:HCl、HNO3 合按电离出的H+数分⼆元酸:H2SO4、H2SO3 物多元酸:H3PO4 强碱:NaOH、Ba(OH)2 物按强弱分 质弱碱:NH3•H2O、Fe(OH)3 碱 ⼀元碱:NaOH、 按电离出的HO-数分⼆元碱:Ba(OH)2 多元碱:Fe(OH)3 正盐:Na2CO3 盐酸式盐:NaHCO3 碱式盐:Cu2(OH)2CO3 溶液:NaCl溶液、稀H2SO4等 混悬浊液:泥⽔混合物等 合乳浊液:油⽔混合物 物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有⾊玻璃等 ⼆、分散系相关概念 1.分散系:⼀种物质(或⼏种物质)以粒⼦形式分散到另⼀种物质⾥所形成的混合物,统称为分散系。
2.分散质:分散系中分散成粒⼦的物质。
3.分散剂:分散质分散在其中的物质。
4、分散系的分类:当分散剂是⽔或其他液体时,如果按照分散质粒⼦的⼤⼩来分类,可以把分散系分为:溶液、胶体和浊液。
分散质粒⼦直径⼩于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,⽽分散质粒⼦直径⼤于100nm的分散系叫做浊液。
下⾯⽐较⼏种分散系的不同: 分散系溶液胶体浊液 分散质的直径<1nm(粒⼦直径⼩于10-9m)1nm-100nm(粒⼦直径在10-9~10-7m)>100nm(粒⼦直径⼤于10-7m) 分散质粒⼦单个⼩分⼦或离⼦许多⼩分⼦集合体或⾼分⼦巨⼤数⽬的分⼦集合体 三、胶体 1、胶体的定义:分散质粒⼦直径⼤⼩在10-9~10-7m之间的分散系。
2024年高一化学必修二有机物知识点总结有机化合物是化学的一个重要分支,是由碳元素构成的化合物。
它们是生活中广泛存在的物质,包括石油、天然气、纤维素、糖类、脂肪类、蛋白质等。
有机化合物的研究内容非常广泛,涉及到有机化学的基本理论和基本方法。
1.碳的化学性质(1)碳原子具有四个价电子,可以与其他原子形成共价键。
(2)碳原子可以形成碳碳单键、碳碳双键和碳碳三键。
(3)碳原子可以形成不同的立体异构体,如手性异构体和立体异构体。
2.有机化合物的命名与表示(1)有机化合物的命名是有机化学的基础,可分为烷烃、烯烃、炔烃、醇、醛、酮、酸、醚、胺等多个类别。
(2)有机化合物可以通过结构式、分子式、简式、系统命名等方式表示。
3.有机化合物的物理性质(1)有机化合物通常是无色液体、固体或气体,具有比较低的沸点和熔点。
(2)有机化合物通常具有不同的溶解度,可溶于有机溶剂,不溶于水。
4.醇的性质和应用(1)醇是一类含有羟基(-OH)的有机化合物。
(2)醇可以参与酸碱反应和氧化反应。
(3)醇可以用作溶剂、消毒剂、防冻剂等。
5.醛和酮的性质和应用(1)醛和酮是两类含有羰基(C=O)的有机化合物。
(2)醛和酮可以进行核苷亲和性反应、取代反应和加成反应。
(3)醛和酮具有类似的化学性质,但醛具有还原性,而酮不具有还原性。
(4)醛和酮可以用作溶剂、防腐剂、香料等。
6.酸和酯的性质和应用(1)酸和酯是两类含有羧基(-COOH)的有机化合物。
(2)酸和酯可以进行酯化反应和水解反应。
(3)酸和酯具有类似的化学性质,但酸具有酸性,而酯不具有酸性。
(4)酸和酯可以用作食品添加剂、溶剂、合成材料等。
7.脂肪类和碳水化合物的性质和应用(1)脂肪类是一类主要由长链碳原子和氢原子组成的有机化合物。
(2)脂肪类可以分为脂肪酸、甘油和脂类等。
(3)脂肪类可以进行酯化反应和酰化反应。
(4)脂肪类是重要的能量来源,同时也可以用作肥皂、润滑剂、染料等。
(5)碳水化合物是生物体内最主要的有机化合物,包括单糖、双糖和多糖等。
高一必修2化学有机知识点高一必修2化学课程涉及了许多重要的有机化学知识点。
有机化学是研究有机化合物的结构、性质、合成和反应的学科。
在这篇文章中,我们将重点介绍高一必修2化学课程中的一些重要有机知识点。
一、有机物的基本特征有机物一般包含碳元素,并且大多数有机物都是化合物,它们的分子结构复杂多样。
有机物与无机物相比,其热稳定性一般较差,容易燃烧。
另外,有机物通常是非电解质,不溶于水,但可以溶于有机溶剂。
二、碳的共价键在有机化合物中,碳原子使用它的四个价电子与其他原子形成共价键。
碳原子可以与其他碳原子形成碳链,构成有机物的骨架。
碳原子还可以与氧、氮、硫等原子形成共价键,使有机物的结构更为多样。
三、烃类化合物烃是一类只包含碳和氢元素的有机化合物。
根据碳原子之间的连接方式,烃可以分为饱和烃和不饱和烃。
饱和烃中的碳原子之间均为单键,不饱和烃中则存在双键或三键。
常见的烃类化合物有烷烃、烯烃和炔烃。
四、功能基团功能基团是有机分子中具有特定性质和化学反应的基团,能够决定有机物的性质和反应类型。
常见的功能基团有羟基、羰基、羧基、酯基等。
通过改变有机物的功能基团,可以改变有机物的性质和用途。
五、醇与酚醇是一类含有羟基的有机物,通式为R-OH,其中R代表有机基团。
醇按照羟基的位置和数量可以分为一元醇、二元醇和三元醇。
酚是指含有苯环上一个或多个羟基的有机物。
六、醛与酮醛和酮是一类含有羰基的有机物。
醛的通式为R-CHO,酮的通式为R-CO-R',其中R和R'代表有机基团。
醛和酮的结构差别在于羰基的位置。
七、羧酸与酯羧酸是一类含有羧基的有机物,通式为R-COOH。
酯是由羧酸和醇缩合而成的有机物,通式为R-COO-R'。
羧酸和酯在有机合成和生物代谢中具有重要的地位。
八、胺及其导出物胺是一类含有氨基的有机物,通式为R-NH2,其中R代表有机基团。
根据氨基所连接的碳原子数目,胺可以分为一级、二级和三级胺。
胺的导出物包括盐类和胺盐。
高一化学必修二第三章--有机化合物知识点总结第三章:有机化合物知识点总结绝大多数含碳的化合物都被称为有机化合物,简称有机物。
少数化合物,如CO、CO2碳酸、碳酸盐、金属碳化物等,属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:有机物 | 通式 | 代表物 | 结构简式(官能团) | 结构特点 | 空间结构 | 物理性质 | 用途 |烷烃 | CnH2n+2 | 甲烷(CH4) | CH4 | 单键,链状,饱和烃 | 正四面体 | 无色稍有气味的气体,比空气略轻,难溶于水 | 石化工业原料,植物生长调节剂,催熟剂 |烯烃 | CnH2n | 乙烯(C2H4) | CH2=CH2 | 双键,链状,不饱和烃(证明:加成、加聚反应) | 六原子共平面 | 无色有特殊气味的液体,密度比水小,难溶于水 | 优良燃料,化工原料|芳香烃 | C6H6 | 苯(C6H6) | 一种介于单键和双键之间的独特的键(证明:邻二位取代物只有一种),环状平面正六边形| 无色无味的气体,比空气轻,难溶于水 | 有机溶剂,化工原料 |3、烃类有机物化学性质1、甲烷的性质比较稳定,不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应。
2、燃烧反应(氧化反应):CH42O2CO22H2O(淡蓝色火焰)。
3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种):①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代。
②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多。
③取代关系:1H~~Cl2④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。
4、高温分解:CH4XXX2够的Na反应生成2mol氢气,而1mol水只生成1mol氢气。
高一化学必修2有机物知识点许多与人类生活有密切相关的物质,均与有机化合物有着密切联系。
下面是由店铺带来的高一化学必修2有机物知识点,希望对你有所帮助。
高一化学必修2有机物知识点(一)1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃;2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃;3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚;4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮;5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯;6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚;如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚.7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物.8. 烷烃与卤素单质: 卤素单质蒸汽(如不能为溴水)。
条件:光照.9. 苯及苯的同系物与(1)卤素单质(不能为水溶液):条件-- Fe作催化剂(2)浓硝酸: 50℃-- 60℃水浴(3)浓硫酸: 70℃--80℃水浴10. 卤代烃的水解: NaOH的水溶液高一化学必修2有机物知识点(二)1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃;2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃;3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚;4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮;5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯;6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚;如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚.7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物.8、甲烷的性质:①氧化反应(燃烧)CH4+ 2O2――→CO2+2H2O(淡蓝色火焰,无黑烟)②取代反应 (注意光是反应发生的主要原因,产物有5种)CH4+Cl2―→CH3Cl+HCl CH3Cl +Cl2―→CH2Cl2+HCl[来源:Z_xx_]CH2Cl2+Cl2―→CHCl3+HCl CHCl3+Cl2―→CCl4+HCl在光照条件下甲烷还可以跟溴蒸气发生取代反应,甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
高一化学必修2有机化学反应知识点总结有机化学是化学中的重要分支,它研究碳和氢以及它们之间的化合物的性质、结构、合成及其反应。
以下是高一化学必修2有机化学反应的一些重要知识点总结:反应类型1. 代谢反应:有机物分解产生能量和新的有机物。
2. 燃烧反应:有机物与氧气在高温下反应,产生二氧化碳和水。
3. 加成反应:两个或多个化合物反应生成一个新的化合物。
4. 酯化反应:酸与醇反应生成酯和水。
5. 酰基化反应:酸酐与醇反应生成酯和水。
6. 酯水解反应:酯与水反应生成醇和酸。
7. 醚化反应:醇与醇反应生成醚和水。
8. 醚水解反应:醚与水反应生成醇和醇。
9. 锯齿反应:有机物中的碳骨架被分解成两个部分,然后重新连接成一个新的化合物。
10. 缩合反应:两个或多个分子结合成一个较大的分子。
常见有机化合物反应醇的氧化反应醇的氧化反应可以将醇氧化为酮或醛,具体反应条件取决于醇的结构。
常用的氧化剂包括酸性高锰酸钾(KMnO4)、酸性高铬酸钾(K2Cr2O7)等。
烷烃的卤代反应烷烃可以与卤素发生取代反应,生成卤代烃。
反应条件包括适当温度和光照。
酸酐与醇的酯化反应酸酐与醇反应生成酯和水,反应通常需要催化剂。
常见的催化剂有硫酸和盐酸等。
醇的缩合反应两个或多个醇分子可以发生缩合反应,生成较大的分子。
此类反应通常需要酸性条件和适当温度。
酮与醛的加成反应酮与醛可以发生加成反应,产生一个新的酮或醇。
常见的加成试剂包括氢氨基钠(NaBH3CN)等。
这些是高一化学必修2有机化学反应的一些重要知识点总结,希望对你有所帮助!。
2024年高一化学必修二有机物知识点总结范本一、有机化合物基本概念有机化合物是碳作为骨架原子,含有碳氢键,可以来源于生物体的化合物。
有机化合物可以分为饱和化合物和不饱和化合物。
饱和化合物的碳氢键都是单键,不饱和化合物中会有双键或者三键的存在。
二、有机化合物的结构与命名1. 有机化合物的结构有机化合物的结构由碳链、官能团和取代基组成。
碳链指的是碳原子按照一定的排列形成的链状结构。
官能团是指一类具有特征性质和反应特点的原子或者原子团。
取代基是指在碳链上取代一部分氢原子的基团。
2. 有机化合物的命名有机化合物的命名可以采用国际命名法和通用命名法。
国际命名法是根据化合物的结构,按照一定规则给化合物命名。
通用命名法是根据化合物的来源或者性质,给化合物起一个通用的名字。
三、有机化合物的性质与反应1. 碳氢键的性质碳氢键是有机化合物中最常见的键,具有一些特点:碳氢键的键能较小,碳氢键的键长适中,碳氢键的键能较稳定。
2. 高分子与低分子有机化合物高分子有机化合物是一类能够形成长链或者网状结构的有机化合物,通常具有较高的相对分子质量。
低分子有机化合物是一类分子量较低的有机化合物,通常具有较低的沸点和相对分子质量。
3. 反应类型有机化合物的反应类型包括取代反应、加成反应、消除反应和重排反应等。
其中,取代反应是指一个原子或者团取代一个化合物中的另一个原子或者团的反应;加成反应是指两个分子结合成为一个分子的反应;消除反应是指一个分子断裂并且形成两个或者更多的分子的反应;重排反应是指分子内或者分子间的原子重新组合的反应。
四、有机物的分类与性质1. 烃烃是一类只含有碳氢键的有机化合物,根据碳原子的连续性可以分为烷烃、烯烃、炔烃和芳香烃。
烷烃是只含有碳碳单键的烃,烯烃是含有至少一个碳碳双键的烃,炔烃是含有至少一个碳碳三键的烃,芳香烃是由苯环结构组成的烃。
2. 醇醇是一类含有羟基(-OH)的有机化合物,根据羟基所在的位置和羟基的数目可以分为一元醇、二元醇和多元醇。
必修二有机物
一、有机物的概念
1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的金属化合物等除外)
2、特性
①种类多
②大多难溶于水,易溶于有机溶剂
③易分解,易燃烧
④熔点低,难导电、大多是非电解质
⑤反应慢,有副反应(故反应方程式中用“→”代替“=”)
二、甲烷
烃—碳氢化合物:仅有碳和氢两种元素组成(甲烷是分子组成最简单的烃)1、物理性质:无色、无味的气体,极难溶于水,密度小于空气,俗名:沼气、坑气;
2、分子结构:CH4:以碳原子为中心,四个氢原子为顶点的正四面体(键角:109度28分);
3、化学性质:
(1)、氧化性
CH
4+2O
2
−
−→
−点燃CO
2
+2H
2
O;
CH
4
不能使酸性高锰酸甲褪色;
(2)、取代反应
取代反应:有机化合物分子的某种原子(或原子团)被另一种原子(原子团)所取代的反应;
CH
4+Cl
2
−
−→
−光照CH
3
Cl+HCl
CH
3Cl+Cl
2
−
−→
−光照CH
2
Cl
2
+ HCl
CH
2Cl
2
+Cl
2
−
−→
−光照 CHCl
3
+ HCl
CHCl
3+Cl
2
−
−→
−光照 CCl
4
+ HCl
4、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质(所有的烷烃都是同系物);
5、同分异构体:化合物具有相同的分子式,但具有不同结构式(结构不同导致性质不同);烷烃的溶沸点比较:碳原子数不同时,碳原子数越多,溶沸点越高;碳原子数相同时,支链数越多熔沸点越低;
三、乙烯
1、乙烯的制法
工业制法:石油的裂解气(乙烯的产量是一个国家石油化工发展水平的标志之一);
2、物理性质:无色、稍有气味的气体,比空气略轻,难溶于水;
3
、结构:不饱和烃,分子中含碳碳双键,6个原子共平面,键角为120°;
4、化学性质
(1)氧化性
①可燃性
现象:火焰明亮,有黑烟原因:含碳量高
②可使酸性高锰酸钾溶液褪色
(2)加成反应
有机物分子中双键(或叁键)两端的碳原子上与其他的原子或原子团直接结合生成新的化合物的反应;
现象:溴水褪色
CH
2=CH
2
+H
2
O−
−→
−催化剂CH
3
CH
2
OH
(3)加聚反应
聚合反应:由相对分子量小的化合物互相结合成相对分子量很大的化合物。
这种由加成发生的聚合反应叫加聚反应;
乙烯聚乙烯
四、苯
1、物理性质:无色有特殊气味的液体,密度比水小,有毒,不溶于水,易溶于有机溶剂,本身也是良好的有机溶剂;
2、苯的结构:C6H6(正六边形平面结构)苯分子里6个C原子之间的键完全相同,碳碳键键能大于碳碳单键键能小于碳碳单键键能的2倍,键长介于碳碳单键键长和双键键长之间;键角120°;
3、化学性质
(1)氧化反应 2C6H6+15O2 = 12CO2+6H2O (火焰明亮,冒浓烟);
不能使酸性高锰酸钾褪色;
(2)取代反应
①
铁粉的作用:与溴反应生成溴化铁做催化剂;溴苯无色密度比水大;
②苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、密度大于水、有毒的油状液体——硝基苯;
反应用水浴加热,控制温度在50—60℃,浓硫酸做催化剂和脱水剂;
(3)加成反应
用镍做催化剂,苯与氢发生加成反应,生成环己烷
五、乙醇
1、物理性质:无色有特殊香味的液体,密度比水小,与水以任意比互溶;
如何检验乙醇中是否含有水:加无水硫酸铜;如何得到无水乙醇:加生石灰,蒸馏;
2、结构: CH3CH2OH(含有官能团:羟基);
3、化学性质
(1)氧化性
①可燃性
CH
3CH
2
OH+3O
2
−
−→
−
点燃
2CO
2
+3H
2
O
②催化氧化
2CH
3CH
2
OH+O
2
−→
−
∆
催化剂
2 CH
3
CHO+2H
2
O
2 CH
3CHO+ O
2
−→
−
催化剂
2 CH
3
COOH
(2)与钠反应
2CH
3CH
2
OH+2Na−→
−2CH
3
CH
2
ONa +H
2
↑
六、乙酸(俗名:醋酸)
1、物理性质:常温下为无色有强烈刺激性气味的液体,易结成冰一样的晶体,所以纯净的乙酸又叫冰醋酸,与水、酒精以任意比互溶;
2、结构:CH3COOH(含羧基,可以看作由羰基和羟基组成);
3、乙酸的重要化学性质
(1)乙酸的酸性:弱酸性,但酸性比碳酸强,具有酸的通性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体;
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO3= 2CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2)乙酸的酯化反应
醇和酸起作用生成脂和水的反应叫酯化反应;
CH3CH2OH+CH3COOH=CH3COOCH2CH3+H2O
反应类型:取代反应反应实质:酸脱羟基醇脱氢
浓硫酸:催化剂和吸水剂
饱和碳酸钠溶液的作用:
(1)中和挥发出来的乙酸(便于闻乙酸乙脂的气味)
(2)吸收挥发出来的乙醇
(3)降低乙酸乙脂的溶解度
(注:文档可能无法思考全面,请浏览后下载,供参考。
可复制、编制,期待你的好评与关注!)。