2021高中化学学业水平专题溶液与胶体(基础)
- 格式:pdf
- 大小:224.03 KB
- 文档页数:3

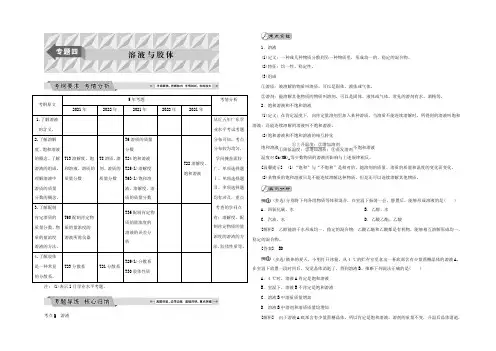
考纲原文5年考题考情分析2021年2022年2021年2022年2021年1.了解溶液的含义。
从近五年广东学业水平考试考题分布可知,考点分布较为均匀,学问掩盖面较广。
单项选择题Ⅰ、单项选择题Ⅱ、多项选择题均有涉及,重点考查的学问点有:溶解度、配制肯定物质的量浓度的溶液的方法、胶体性质等。
2.了解溶解度、饱和溶液的概念。
了解溶液的组成。
理解溶液中溶质的质量分数的概念。
T13溶解度、饱和溶液、溶质的质量分数T8溶质、溶剂、溶质的质量分数T6溶质的质量分数T24饱和溶液T25(1)溶解度T63(1)饱和溶液、溶解度、溶质的质量分数T22溶解度、饱和溶液3.了解配制肯定溶质的质量分数、物质的量浓度溶液的方法。
T60配制肯定物质的量浓度的溶液所需仪器T36配制肯定物质的量浓度的溶液的误差分析4.了解胶体是一种常见的分散系。
T23分散系T21分散系T29(1)分散系T30胶体性质注:(1)表示1月学业水平考题。
考点1溶液1.溶液(1)定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
(2)特征:均一性、稳定性。
(3)组成①溶质:被溶解的物质叫溶质。
可以是固体、液体或气体。
②溶剂:能溶解其他物质的物质叫溶剂。
可以是固体、液体或气体。
常见的溶剂有水、酒精等。
2.饱和溶液和不饱和溶液(1)定义:在肯定温度下,向肯定量溶剂里加入某种溶质,当溶质不能连续溶解时,所得到的溶液叫饱和溶液;还能连续溶解的溶液叫不饱和溶液。
(2)饱和溶液和不饱和溶液的相互转化饱和溶液①上升温度;②增加溶剂①降低温度;②增加溶质;③蒸发溶剂不饱和溶液温度对Ca(OH)2等少数物质的溶液的影响与上述规律相反。
[温馨提示] (1)“饱和”与“不饱和”是相对的,随溶剂的质量、溶质的质量和温度的变化而变化。
(2)某物质的饱和溶液只是不能连续溶解这种物质,但是还可以连续溶解其他物质。
(多选)分别将下列各组物质等体积混合,在室温下振荡一会,静置后,能够形成溶液的是( ) A.四氯化碳、水B.乙醇、水C.汽油、水D.乙酸乙酯、乙酸[解析] 乙醇能溶于水形成均一、稳定的混合物;乙酸乙酯和乙酸都是有机物,能够相互溶解形成均一、稳定的混合物。

高考化学二轮复习溶液和胶体知识专题总结溶液、饱和溶液、不饱和溶液1.溶液的概念:一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。
2.溶液的组成:溶液=溶质+熔剂溶质:被分散的物质。
如食盐水中的NaCl;氨水中的NH3;碘酒中的I2溶剂:溶质分散其中的物质。
如食盐水、氨水中的水;碘酒中的酒精3.溶解过程:溶质分散到溶剂里形成溶液的过程叫溶解。
物质溶解时,同时发生两个过程:溶解是一个物理、化学过程,并伴随着能量变化,溶解时溶液的温度是升高还是降低,取决于上述两个过程中放出和吸收热量的相对大小。
如:浓硫酸稀释溶液温度升高,NH4NO3溶于水溶液温度降低。
4.溶解平衡在一定条件下,溶解速率等于结晶速率的状态叫溶解平衡。
溶解平衡是动态平衡,溶解和结晶仍在进行。
达到溶解平衡的溶液是饱和溶液,它的浓度一定,未达到溶解平衡的溶液是不饱和溶液,通过加入溶质、蒸发溶剂、改变温度等方法可使不饱和溶液成为饱和溶液。
胶体及其性质1.胶体的本质特征:分散质粒子的直径大小在1nm~100nm之间2.胶体的分类3.胶体的重要性质①丁达尔现象:光通过胶体时所产生的光亮的通路的现象。
胶体的丁达尔现象是由于胶体微粒对光线的散射而形成的,溶液无此现象,故可用此法区别溶液和溶胶。
②布朗运动:胶体粒子所作的无规则的、杂乱无章的运动。
布朗运动是分子运动的体现。
③电泳现象:在外加电场的作用下,胶粒在分散剂里向阴极或阳极作定向移动的现象。
工业生产中可利用电泳现象来分离提纯物质。
例如:在电泳实验中,Fe(OH)3胶体微粒向阴极移动,使阴极附近颜色加深,呈深红褐色;而As2S3 胶体微粒向阳极移动,使阳极附近颜色加深,呈深金黄色。
④胶体的聚沉:一定条件下,使胶体粒子凝结而产生沉淀。
胶体聚沉的方法主要有三种:a.加入电解质 b.加入与胶粒带相反电荷的另一种胶体 c.加热。
如:制皂工业生产中的盐析,江河入海口三角洲的形成等等。
⑤渗析:依据分散系中分散质粒子的直径大小不同,利用半透膜把溶胶中的离子、分子与胶粒分离开来的方法。

一. 教学内容:胶体和溶液二、教学目标1、了解分散系的概念及其分类依据,制备、重要性质、分离和应用。
2、了解溶液的涵义、组成,明白得不饱和溶液、饱和溶液、溶质的质量分数、溶解度、结晶和结晶水合物等概念。
明白得温度等条件对溶解度的阻碍,了解溶解度曲线的涵义。
3、把握有关溶质的质量分数、溶解度的运算及其与物质的量浓度的相互换算。
把握一定质量分数溶液的配制方法及步骤。
三、教学重点、难点1、胶体的制备与性质2、溶液浓度的有关运算[教学过程]一、胶体:把一种或几种物质分散在另一种(或几种)物质中所得到的体系叫分散系,前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。
当分散剂是水或其他液体时,假如按照分散质粒子的大小来分类,能够把分散系分为:溶液、胶体和浊液。
分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于1 00nm的分散系叫做浊液。
说明:(1)胶体区别于其他分散系的本质特点是:分散质粒子直径在1nm-100nm之间;(2)胶体可通过滤纸而不能透过半透膜,证明滤纸上的小孔大于半透膜上的小孔,因此,可用过滤法分离胶体和浊液,用渗析法分离胶体和溶液。
(3)丁达尔效应是用来鉴别胶体和溶液的最有效、最简单的方法。
(4)胶体具有介稳性的缘故是由于同种胶粒吸附相同的离子,带有同种电荷,同种电荷相互排斥,因此胶粒之间不能相互集合在一起形成颗粒较大的粒子沉降下来。
但整个胶体是呈电中性的,不显电性。
(5)一样说来,金属氢氧化物、金属氧化物的胶粒吸附阳离子带部分正电荷,非金属氧化物、金属硫化物等胶粒吸附阴离子带部分负电荷,同种胶粒吸附相同的离子带同种电荷。
(6)胶体聚沉的缘故是由于破坏了胶粒所带电荷之间的相互排斥,从而使胶粒之间能够相互集合在一起形成颗粒较大的粒子沉降,加入电解质和带相反电荷的胶体,都能够破坏胶体内部的电荷平稳,使胶体聚沉,同时加热、加入酸碱等也能够使胶体聚沉。




【巩固练习】选择题:(每题只有1个选项符合题意)1.在物质分类中,前者包括后者的是A .氧化物、化合物B .溶液、胶体C .分散系、溶液D .酸性氧化物、化合物2.分类方法在化学学科的发展中起到重要的作用,下列分类标准合理的是A .根据纯净物的元素组成,将纯净物分为单质和化合物B .根据物质的元素组成,将物质分为纯净物和混合物C .根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体D .根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类3.下列现象与胶体知识无关..的是 A .日常生活中看到的云、烟、雾B .蒸发饱和食盐水析出氯化钠晶体C .向豆浆中加入盐卤做豆腐D .一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路4.关于NaOH 溶液和Fe(OH)3胶体描述正确的是A .NaOH 和Fe(OH)3都属于碱B .两者均为有色不透明的分散系C .两者分散质的直径都介于10-9~10-7m 之间D .一束光线分别通过时,两者都会出现明显的光带5.下列关于胶体的说法不.正确的是( ) A .制备Fe(OH)3胶体后可以用渗析的方法净化B .利用丁达尔效应可以区分溶液和胶体C .电泳现象可证明胶体都带电D .胶体是分散质粒子直径在1~100 nm 之间的分散系6.下列说法都正确的是( )①江河入海口三角洲的形成通常与胶体的性质有关 ②四川灾区重建使用了大量钢材,钢材是合金 ③“钡餐”中使用的硫酸钡是弱电解质 ④ 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 ⑤常用的自来水消毒剂有氯气和二氧化氮,两者都含有极性键 ⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物A .①②③④B .①②④⑥C .①②⑤⑥D .③④⑤⑥7.下列关于溶液和胶体的叙述,正确的是( )A .溶液是电中性的,胶体是带电的B .通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动C .溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动D .一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有8.某温度下,100 g 饱和氯化钠溶液中含有氯化钠26.5 g 。


高考总复习溶液和胶体【考纲要求】1.了解分散系的概念、分类2.了解胶体的概念、制备、性质、应用3.了解溶解度的概念及其影响,利用溶解度表或溶解度曲线获取相关物质溶解度信息4.理解溶液的组成和溶液中溶质质量分数、物质的量浓度等概念,并能进行相关计算【考点梳理】考点一:分散系及其分类1、分散系定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。
前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。
按照分散质或分散剂的状态。
要点诠释:分散系的分类【高清课堂:溶液和胶体】按照分散质或分散剂的聚集状态(气、固、液)来分,分散系可以有以下9种组合:2.溶液、胶体和浊液——三种分散系的比较不同的分散系,其外观、组成等不同,其根本原因是分散质粒子大小不同。
现将三种分要点诠释:当分散剂是水或其他液体时,按照分散质粒子的大小,可以把分散系分为溶液、胶体和浊液。
溶液中分散质粒子小于1nm,溶液中的分散质我们也称为溶质;浊液中的分散质粒子通常大于100nm;胶体中的胶体粒子大小在1nm~100nm之间。
因此,溶液和胶体的分散质都能通过滤纸,而悬浊液的分散质则不能通过滤纸。
这三类分散质中,溶液最稳定;浊液很不稳定,分散质在重力作用下会沉降下来;胶体在一定条件下能稳定存在,稳定性介于溶液和浊液之间,属于介稳体系。
考点二:胶体及其性质1、定义:分散质粒子大小在1nm~100nm之间的分散系称为胶体。
常见的胶体:Fe(OH)3胶体、淀粉溶胶、蛋白质溶液、肥皂水、有色玻璃、牛奶、豆浆、粥、江河之水、血液等。
2、胶体的分类:分散剂是液体——液溶胶。
如Al(OH)3胶体,蛋白质胶体(1)按分散剂的状态分分散剂是气体——气溶胶。
如雾、云、烟分散剂是固体——固溶胶。
如烟水晶、有色玻璃。
(2)按分散质的粒子分粒子胶体——胶粒是许多“分子”的集合体。
如Fe(OH)3胶体。
分子胶体——胶粒是高分子。

学习笔记学习笔记3.化合价升高——失去电子——被氧化/发生氧化反映/生成氧化产物——自身作还原剂/具备还原性;化合价减少——得到电子——被还原/发生还原反映/生成还原产物——自身作氧化剂/具备氧化性。
五、原子构造1.对一种原子来说:核电荷数=质子数=核外电子数 2.质量数(A )=质子数(Z )+中子数(N ) 3.普通用符号A Z X 表达一种质量数为A 、质子数为Z 原子。
4.具备一定数目质子和一定数目中子一种原子称为核素。
六、元素周期律1.元素周期律:元素性质随着原子序数递增而呈周期性变化,这个规律叫做元素周期律。
2.元素周期律是由门捷列夫发现。
3.原子、离子等粒子半径大小比较:电子层数越多,半径越大;若电子层数相等,核电荷数越大,半径越小。
5.在元素周期表中,行称为周期,列称为族。
6.最外层电子数=周期序数;电子层数=主族序数。
7.同周期从左向右,元素原子失电子能力逐渐削弱、得电子能力逐渐增强; 同主族从上到下,元素原子失电子能力逐渐增强、得电子能力逐渐削弱。
8.元素原子失电子能力越强,最高价氧化物水化物碱性越强;元素原子得电子能力越强,最高价氧化物水化物酸性越强,气态氢化物稳定性越强。
七、化学键1.定义:相邻原子间强互相作用称为化学键。
2.共价键:原子间通过共用电子形成化学键,叫做共价键。
3.离子键:阴、阳离子之间通过静电作用形成化学键,叫做离子键。
4.金属元素原子与非金属元素原子间形成离子键,非金属元素原子间形成共价键。
5.具有离子键化合物称为离子化合物;只具有共价键化合物称为共价化合物。
6.反映物 生成物 E 1>E 2 反映吸取能量;E 1<E 2反映释放能量。
7.常用放热反映有燃烧反映、中和反映、金属和酸反映;吸热反映有氢氧化钡晶体与氯化铵固体反映。
八、化学反映速率1.定义:化学反映速率指是单位时间里反映物浓度或生成物浓度变化:v = ΔcΔt。
2.决定化学反映速率大小因素:物质自身性质。
基本概念三――溶液和胶体 5. 溶液和胶体[考点扫描]1.溶液、悬浊液、乳浊液的涵义。
2.溶液的组成,溶液的形成过程,溶质溶解时的吸热和放热现象。
3. 溶解度的概念,温度对溶解度的影响及溶解度曲线。
4. 溶解度与溶液里溶质质量分数的换算。
5. 胶体的概念及其重要性质和应用。
[知识指津]1.三种分散系的区别2.溶液[范例点击]例1.氯化铁溶液与氢氧化铁胶体具有的共同性质是()A.分散质颗粒直径都在1nm一100nm之间B.能透过半透膜C.加热蒸干、灼烧后都有氧化铁生成D.呈红褐色解析:胶体粒子直径在1—100nm之间,溶液的分散质粒子直径小于1nm;半透膜只能使溶液中分子或离子透过而不能使胶粒透过,以此用渗析法分离胶体与溶液;黄色的氯化铁溶液加热蒸干过程中促进了氯化铁的水解,产生氢氧化铁,灼烧后转化为氧化铁;而红褐色氢氧化铁胶体在加热蒸干过程中先凝聚成氢氧化铁沉淀,灼烧后也转化为氧化铁。
故选C。
答案:C例2.下图是几种盐的溶解度曲线。
下列说法正确的是()A.40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体B.20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%C.60℃时,200克水中溶解80克硫酸铜达饱和。
当降温至30℃时,可析出30克硫酸铜晶体D.30℃时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是氯化钠解析:A中40℃时食盐的溶解度曲线的点所示的是大于35g/100g水;0℃时也是如此。
由此可知40℃时,制成的仅是不饱和的氯化钠水溶液。
降温至0℃时,仍未超过35.7g,不能析出晶体。
B中20℃硝酸钾的溶解度查曲线可知是31.6g,其质量分数必然小于此值。
所以B选项不正确。
C中析出的应为CuSO4·5H2O,得不到无水硫酸铜。
所以此题选D。
答案:D例3.将某温度下的KNO3溶液200g蒸发掉10g水,恢复到原温度,或向其中加入10g KNO3固体,均可使溶液达到饱和。
2021年全国卷高考化学专题突破—《溶液和胶体》【考纲要求】1.了解分散系的概念、分类2.了解胶体的概念、制备、性质、应用3.了解溶解度的概念及其影响,利用溶解度表或溶解度曲线获取相关物质溶解度信息4.理解溶液的组成和溶液中溶质质量分数、物质的量浓度等概念,并能进行相关计算【考点梳理】要点一、分散系及其分类1、分散系定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。
前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。
按照分散质或分散剂的状态。
要点诠释:分散系的分类按照分散质或分散剂的聚集状态(气、固、液)来分,分散系可以有以下9种组合:分散质分散剂实例气气空气液气云、雾固气烟、灰尘气液泡沫液液牛奶、酒精的水溶液固液硫酸铜溶液、油漆气固泡沫塑料液固珍珠(包藏着水的碳酸钙)固固有色玻璃、合金2.溶液、胶体和浊液——三种分散系的比较不同的分散系,其外观、组成等不同,其根本原因是分散质粒子大小不同。
现将三种分散系的比较列于下表中。
分散系溶液胶体浊液分散系粒子的直径<1 nm 1 nm~100 nm >100 nm分散质粒子分子或离子许多小分子集合体或单个高分子分子集合体或离子集合体性质外观均一、透明均一、透明不均一、不透明稳定性稳定介稳性不稳定能否透过滤纸能能不能能否透过半透膜能不能不能是否有丁达尔效应无有无实例食盐水、碘酒肥皂水、牛奶泥水要点诠释:当分散剂是水或其他液体时,按照分散质粒子的大小,可以把分散系分为溶液、胶体和浊液。
溶液中分散质粒子小于1nm,溶液中的分散质我们也称为溶质;浊液中的分散质粒子通常大于100nm;胶体中的胶体粒子大小在1nm~100nm之间。
因此,溶液和胶体的分散质都能通过滤纸,而悬浊液的分散质则不能通过滤纸。
这三类分散质中,溶液最稳定;浊液很不稳定,分散质在重力作用下会沉降下来;胶体在一定条件下能稳定存在,稳定性介于溶液和浊液之间,属于介稳体系。
2021年高考化学一轮复习辅导:溶液、胶体、
浊液巧分辨
下面是编辑老师整理的2021年高考化学一轮复习辅导:溶液、胶体、浊液巧分辨,希望对您高考复习有所帮助.
溶液、胶体、浊液巧分辨
高考中有关胶体知识的考查都比较简单,以选择题的形式考查的可能性较大,且常常与科技、生活和生产实际相结合。
要注意以下几点:
1.要准确理解胶体的概念:胶体、溶液、浊液的本质区别是分散质微粒直径(胶体分散质微粒直径介于1~100 nm之间)的大小不同。
2.对胶体性质的认识:丁达尔现象是胶体分散质微粒对可见光散射而造成的,可区别溶液与胶体;胶粒不能透过半透膜。
3.注意胶体知识与现代科技成果相结合,考查对胶体知识的运用情况。
溶液、胶体、浊液比较
分散系溶液胶体浊液外观均一、稳定、透明均一、较稳定不透明、不均一、不稳定分?散?质?微?粒组成单个分子或离子分子集合体或有机?高分子许多分子集合体直径小于1
nm1~100 nm之间大于100 nm能否透过?滤纸能能不能能否透过?半透膜能不能不能
注:抓住粒子直径在1 nm~100 nm之间,即与胶体粒子直径
大小相当,那么这种粒子与胶体粒子性质具有相似性,由此可以推断新情景纳米颗粒性质。
以上就是高考频道2021年高考化学一轮复习辅导:溶液、胶体、浊液巧分辨的全部内容,查字典化学网会在第一时间为大家提供,更多相关信息欢迎大家持续关注!。