叶绿体色素的提取
- 格式:doc
- 大小:778.50 KB
- 文档页数:5

绿叶中色素的提取和分离实验原理
绿叶中色素的提取和分离实验:
1、提取:绿叶中的色素——研磨法。
称取、剪碎5g叶片,放入研钵中。
加入少许二氧化硅、碳酸钙、5mL丙酮。
快速、充分研磨。
根据叶绿体中的色素在有机溶剂(乙醇、丙酮等)中溶解的特性,用丙酮可将色素从叶片中提取出来(若用95%的酒精作溶剂,则应向色素提取液中加入无水碳酸钠,除去色素提取液中的水分。
若用丙酮作溶剂,则用量不宜过多,以2~5mL为宜,过多会影响色素浓度,过少不易过滤),过滤后收集滤液,将滤液收集到小试管中,及时用棉塞将试管塞紧备用。
2、分离:制备滤纸条,将干燥过的定性滤纸剪成6cm×lcm的条,一端剪去两角,距该端lcm处用铅笔画一条极细的横线。
用毛细吸管吸取少量滤液,沿铅笔线均匀画一条细而直的滤液线,待干燥后再重复画2~3次(次数越多色素越多)。
实验原理:
1、色素提取原理:色素溶于有机溶剂而不溶于水,可用95%的乙醇、丙酮等有机溶剂来溶解色素,从而提取绿叶中的色素。
色素提取也可用水浴加热法,即把叶片剪碎后放在95%的乙醇中,进行隔水加热来提取。
一般地说,叶片加热到变成黄白色,叶片中的色素基本上被提取出来了。
2、色素分离原理:各种色素在层析液中溶解度不同,溶解度高的随层析液在滤纸上扩散速度比较快,反之则比较慢,从而使各种色素相互分离开来。

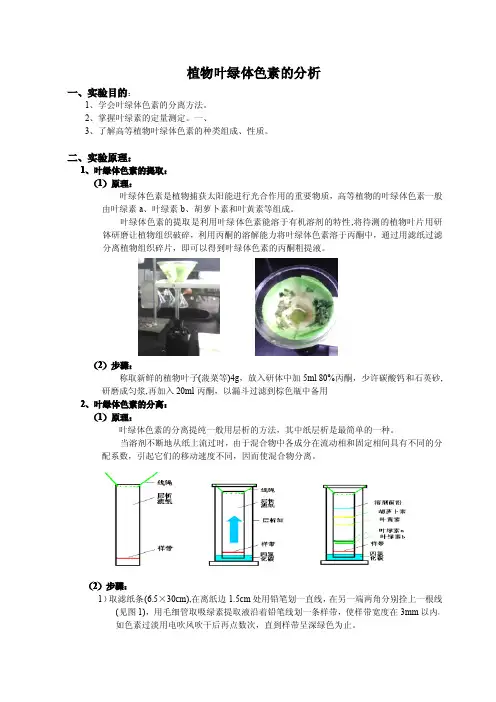
植物叶绿体色素的分析一、实验目的:1、学会叶绿体色素的分离方法。
2、掌握叶绿素的定量测定。
一、3、了解高等植物叶绿体色素的种类组成、性质。
二、实验原理:1、叶绿体色素的提取:(1)原理:叶绿体色素是植物捕获太阳能进行光合作用的重要物质,高等植物的叶绿体色素一般由叶绿素a、叶绿素b、胡萝卜素和叶黄素等组成。
叶绿体色素的提取是利用叶绿体色素能溶于有机溶剂的特性,将待测的植物叶片用研钵研磨让植物组织破碎,利用丙酮的溶解能力将叶绿体色素溶于丙酮中,通过用滤纸过滤分离植物组织碎片,即可以得到叶绿体色素的丙酮粗提液。
(2)步骤:称取新鲜的植物叶子(菠菜等)4g,放入研体中加5ml80%丙酮,少许碳酸钙和石英砂,研磨成匀浆,再加入20ml丙酮,以漏斗过滤到棕色瓶中备用2、叶绿体色素的分离:(1)原理:叶绿体色素的分离提纯一般用层析的方法,其中纸层析是最简单的一种。
当溶剂不断地从纸上流过时,由于混合物中各成分在流动相和固定相间具有不同的分配系数,引起它们的移动速度不同,因而使混合物分离。
(2)步骤:1)取滤纸条(6.5×30cm),在离纸边1.5cm处用铅笔划一直线,在另一端两角分别拴上一根线(见图1),用毛细管取吸绿素提取液沿着铅笔线划一条样带,使样带宽度在3mm以内,如色素过淡用电吹风吹干后再点数次,直到样带呈深绿色为止。
2)在层析缸中加入四氯化碳20ml及少许无水硫酸钠,然后将滤纸吊在层析缸中,使下端浸入溶剂中,色素点要略高于液面,滤纸条边缘不可碰到层析缸璧(如图2)用聚乙烯薄膜两层封住层析缸,直立于暗处层析。
3)0.5小时后,观察色素带分布(最上端是橙黄色的胡萝卡素,其次是黄色的叶黄素,然后是兰绿色的叶绿素a和黄绿色的叶绿素b),记录色谱图。
如图所示:3、叶绿体色素的性质(一)荧光现象:叶绿体色素在吸收光能以后可以从基态跃迁到激发态,当处于第一单线态(激发态)的电子再回到基态时其携带的能量将以光的形式放射出来产生荧光,叶绿素荧光的颜色是红色的。

浅谈叶绿体色素的提取,分离实验的基本原理叶绿体色素是植物共同的分子,是植物叶片绿色色素的主要成分,在植物的基因组中占有非常重要的地位。
叶绿体色素的提取和分离实验是植物生理学研究中常见实验,它们的研究对于深入解析植物叶片绿色色素的组成、形成机制以及植物的适应和演化有重要的意义。
本文简要介绍叶绿体色素提取、分离实验的基本原理以及实验步骤。
一、叶绿体色素的提取1.提取用植物组织植物细胞是由多种组织结构的嵌套形式组成的,而叶绿体这种特殊的细胞构造,它们除了在细胞质和细胞核里贮存着叶绿素外,还处于细胞子室内、细胞膜之间,因此叶绿体色素的提取,必须从整个植物细胞体内提取。
2.提取步骤a)取植物组织消化,加入蛋白酶消化液,消化温度保持在37℃,消化完成后,用离心机将悬浮液离心分离;b)将悬浮液和脉粗滤;c)用离心机将滤液离心,并将残留物清除;d)用硫酸钠缓冲液将离心液中的叶绿体色素进行沉淀分离;e)最后,用离心机将沉淀液离心,取得叶绿体色素提取液。
二、叶绿体色素分离实验叶绿体色素分离实验是以“四维定律”为基础的,四维定律指的是溶解物的溶解度与温度、酸度、配体浓度等四个维度的变化而发生变化。
以下是叶绿体色素分离实验的实验步骤:1.温度调节将叶绿体色素提取液加入50mL的萃取液中,将温度调节到10°C,保持温度稳定后,用离心机将其离心十分钟;2.酸度调整将离心液加入室温的硫酸铵溶液中,搅拌均匀,然后再次利用离心机离心,将叶绿体色素沉淀出来;3.配体浓度调整将离心液和硫酸铵溶液加入50mL的氯化钠溶液中搅拌均匀,然后将其再次离心,至此叶绿体色素被沉淀出来,即可获得叶绿体色素的分离液;最后,用离心机离心冷却至温度达到最低,来增强叶绿体色素的沉淀,以达到纯度高的目的。
综上所述,叶绿体色素的提取、分离实验步骤比较复杂,从植物组织的提取、细胞色素的悬浮液提取、细胞色素的滤液提取、通过改变温度、酸度、配体浓度的方法对叶绿体色素的分离实验,至此,叶绿体色素的提取和分离实验基本原理就介绍完了。


提取叶绿体色素的方法解析:提取叶绿体色素的方法一、准备工具大试管、台秤、研钵、剪刀、量筒、漏斗、分液漏斗、软术寒、烧杯、滤纸、小试管、分兆计、酒精灯、吸耳球、移液管、电吹风、毛细管95%乙醇、CaCO3、石英砂、汽油、苯、KOH、甲醇、乙酸铜、盐酸二、步骤1. 称取新鲜去大叶脉的菠菜叶片,或芹菜、油菜等其他植物的新鲜绿叶5 g,剪碎放人研钵中,加入乙醇5 ml、少许CaCO3,中和细胞中的酸防止Mg,从叶绿素中心释放,和石英砂,研磨成勻浆,再加入适量的乙醇20~25 ml,然后用漏斗过滤,即得叶绿体色素液。
2. 若用千拒肥排粉时,则称取1g 干粉放人小烧杯中,加95%乙醇20~30 ml 提取,并随时搅动。
待乙醇呈深绿英露色时,滤出浸提液备用。
取准备好的滤纸条(2cmX20cm),将其一端剪去两侧,中间留一个长约1.5cm,宽约0.5cm的窄条。
3. 用毛细管吸取叶绿体色素提取液点于滤纸的下端窄条的上方中央,注意一次所点溶液不可过多,如色素过淡,用电吹风吹千后再重复1~2次。
4. 在大试管中加入汽油5~10ml,或其他层析液,如石油醚:丙酮苯体积比为20 :2 :1的混合溶液,然后将滤纸条上端固定在软术塞上,插人试管内,使窄条进入溶液中,色素点要略高于液面,滤纸条边缘不可碰到试管壁,盖紧软木塞,直立于阴暗处,或试管外套一黑纸套。
5. 经0.5~1h后,观察分离后色素带的分布。
最上端橙黄色的是胡萝卜素,其次为叶黄素,再下面蓝绿色为Chl a,最后的黄绿色为Chl b。
6. 取叶绿体色素提取液少许于1支试管中,用反射光和透射光观察提取液的颜色有何不同,反射光下观察到的提取液颜色即为叶绿素产生的荧光颜色。
取叶绿体色素提取液少许,分装于两支试管,光对叶绿素的破坏作用中,一支放在黑暗处(或用黑纸套包裹),另一支放在强光下(阳光下),经过2~3h后,观察两支试管中溶液的颜狠敏色有何不同。




分离叶绿体色素的方法
1.离心法
叶绿体的密度较高,可利用这一特性通过离心来分离色素。
首先将植物细胞研磨并过滤,得到植物细胞的提取液。
将提取液放入离心管中,以逐渐增加转速的方式离心,使叶绿体向离心管的底部沉淀。
然后将上清液倒掉,用草酸铵溶液洗涤沉淀,最后用适量的液态透明质酸-乙醇溶液悬浮叶绿体,就可以得到纯净的叶绿体色素。
2.柱层析法
柱层析法常用于对叶绿体中的叶绿素a和叶绿素b进行分离。
首先将植物细胞研磨并过滤,得到植物细胞的提取液。
然后将提取液加入柱层析柱中,常用的柱层析材料包括硅胶和凝胶。
通过改变溶剂的流动速度和成分,使不同种类的叶绿素在柱层析柱上具有不同的流动速度,从而实现对叶绿素的分离和纯化。
3.电泳法
电泳法通过在电场中将叶绿体色素进行分离。
首先将植物细胞研磨并过滤,得到植物细胞的提取液。
然后将提取液加入凝胶电泳板中,通过施加电场,使带电的叶绿体色素在凝胶中移动。
由于不同种类的叶绿体色素在电场下具有不同的迁移速度,因此可以通过电泳法将叶绿体色素分离出来。
以上是常用的分离叶绿体色素的方法,每种方法都有其优缺点。
离心法简单快捷,但无法实现对不同种类叶绿体色素的有效分离;柱层析法可以分离不同种类的叶绿素,但操作较为繁琐;电泳法具有高分辨率和高灵
敏度,但对实验条件要求较高。
根据实际需要选择合适的方法进行操作,可以有效地分离叶绿体色素。
叶绿体色素的提取、分离、理化性质和含量测定实验一、叶绿体色素的提取、分离1.实验名称叶绿体色素的提取、分离实验2.实验原理叶绿体中色素与内囊体膜结合成为色素蛋白复合体。
这些色素不溶于水,而溶于有机溶剂,可用乙醇等有机溶剂提取。
提取液用薄层色谱法加以分离和鉴别。
本实验采用酒精提取。
层析法原理: K=Cs/Cm。
3.实验试剂与材料新鲜菠菜叶体积分数百分之九十五的乙醇,碳酸钙粉末,展开剂(石油醚:丙酮:苯=7:5:1)天平,研钵,漏斗,三角瓶,剪刀,点样毛细管,层析缸,硅胶预制板,滤纸4.实验步骤1.叶绿体色素的提取(1)取菠菜或其他植物新鲜叶片4~5片(2g左右),洗净,擦干,去掉中脉,剪碎,放入研钵中。
(2)研钵中加入少量石英砂及碳酸钙粉,加2~3ml 95%乙醇,研磨至糊状,再加10ml 95%乙醇,暗处放置3~5min,上清液过滤于三角瓶中,残渣用10ml 95%乙醇冲洗,一同过滤于三角瓶中。
2.色素分离:取硅胶预制板一个,用毛细管吸取提取液,在板短边据下端1厘米处划一细线,待干后再次划线,重复3,4次。
在层析缸中加入层析液,高度0.5厘米,将预制板放入层析液中进行层析。
改好缸盖。
待色素较好分离后,取出硅胶预制板,迅速用铅笔标出展开剂前沿和各色素带的位置。
5.实验结果与分析滤纸条上出现4条色素带,从上到下依次是:橙黄色胡萝卜素(最快)黄色叶黄素蓝绿色叶绿素a(最多)黄绿色叶绿素b(最慢)二.理化性质1.实验目的验证叶绿素的理化性质。
2.实验原理叶绿素是一种二羧酸——叶绿酸与甲醇和叶绿醇形成的复杂酯,故可与碱起皂化反应而生成醇(甲醇和叶绿醇)和叶绿酸的盐,产生的盐能溶于水中,可用此法将叶绿素与类胡萝卜素分开;叶绿素与类胡萝卜素都具有光学活性,叶绿素吸收光量子而转变成激发态,激发态的叶绿素分子很不稳定,当它变回到基态时可发射出红光量子,因而产生荧光。
叶绿素中的镁可以被H+所取代而成褐色的去镁叶绿素,后者遇铜则成为绿色的铜代叶绿素,铜代叶绿素很稳定,在光下不易破坏,故常用此法制作绿色多汁植物的浸渍标本。
叶绿体色素的提取和分离
叶绿体色素是位于植物叶绿体中的一类有机化合物,包括叶绿素 a、叶绿素 b、类胡萝卜素等。
提取和分离叶绿体色素的方法如下:
1. 手工研磨法:将植物叶片取出后,加入适量的减水醇(如乙醇或甲醇),用研钵或机械研磨器搅拌研磨,使细胞破碎释放叶绿体色素。
然后通过离心将悬液离心分离出叶绿体色素。
2. 酒精沉淀法:将植物叶片切碎后加入适量的酒精溶液,用撇去悬浮物,然后再用滤纸滤除酒精中的杂质。
过滤后的溶液可以进行酒精沉淀,即加入适量的酒精悬浮叶绿体色素,并通过离心分离出沉淀。
3. 层析法:将植物叶片经过研磨和过滤后得到的色素溶液,可以通过色谱柱层析进行分离。
常用的色谱柱包括硅胶柱、纸层析柱和高效液相色谱柱等。
通过向色谱柱中加入适当的溶剂系统,可以将叶绿体色素按照其亲水性和亲油性进行分离。
4. 液-液萃取法:将植物叶片研磨并与适量的有机溶剂(如二氯甲烷、苯或正己烷)混合,通过摇晃、振荡或搅拌等方法,使叶绿体色素在有机相和水相之间分配。
随后,分离有机相并蒸干,即可得到叶绿体色素。
这些方法可以根据实验需求和设备条件选择使用,提取和分离叶绿体色素可以用于进一步的分析和研究。
叶绿体色素的提取叶绿体色素的提取是一项实验技术,涉及从植物叶片中提取叶绿体色素的过程。
下面是关于该实验的详细步骤和注意事项。
一、实验目的本实验旨在学习叶绿体色素的提取方法,了解叶绿体色素的种类和性质,掌握叶绿体色素的提取和纯化技术。
二、实验原理叶绿体色素是植物叶片中的一类重要色素,包括叶绿素、类胡萝卜素和黄酮类化合物等。
这些色素在光合作用中起着重要的作用,可以帮助植物吸收光能并转化为化学能。
叶绿体色素的提取通常使用有机溶剂(如丙酮、乙醇等)作为提取剂,通过研磨、过滤和分离等步骤将色素从叶片中提取出来。
三、实验步骤1.准备实验材料:新鲜的植物叶片(如菠菜、甘蓝等)、称量纸、研钵、玻璃棒、漏斗、滤纸、丙酮、无水乙醇等。
2.称量植物叶片:选择新鲜的植物叶片,用称量纸称取5g左右,记录重量。
3.研磨:将称好的植物叶片放入研钵中,加入少量丙酮和无水乙醇混合液(比例为1:1),用玻璃棒充分研磨至匀浆状。
4.过滤:将研磨后的匀浆通过漏斗倒入滤纸中,用玻璃棒轻轻压榨,使滤纸上的液体完全流尽。
5.分离:将滤纸上的色素用玻璃棒刮下,用丙酮和无水乙醇混合液洗涤滤纸上的色素,洗液收集到棕色瓶中。
6.纯化:将收集到的洗液通过旋转蒸发仪进行浓缩,得到纯化的叶绿体色素。
7.分析:通过光谱分析、色谱分析等方法对提取到的叶绿体色素进行分析鉴定。
四、注意事项1.实验过程中要使用新鲜的植物叶片,以保证色素的含量和活性。
2.研磨时要充分破碎细胞,以便色素的提取。
3.过滤时要注意滤纸的选择和使用,避免滤纸上的杂质对色素纯度的影响。
4.分离时要小心操作,避免色素的损失。
5.纯化时要注意控制温度和时间,避免高温导致色素分解。
6.分析时要选择合适的分析方法,以便准确鉴定叶绿体色素的种类和性质。
7.注意安全操作,避免溶剂溅到皮肤或眼中。
8.实验结束后要及时清理实验现场,将废液和废弃物妥善处理。
9.本实验中使用的丙酮和无水乙醇等有机溶剂应妥善保管和使用,避免对环境和健康造成影响。
叶绿体中色素的提取用的物质
叶绿体中色素提取的物质有:
1. EDTA:乙二胺四乙酸,也叫芐酸,是一种维持叶绿体的必需条件,能够调节pH和离子平衡,起到配合体特殊性复制叶绿体的作用。
2. 普鲁兰液:由80%甘油、20%乙二醇组成,用于辅助新陈代谢,同时也能调节叶绿体膜结构,保持叶绿体的正常功能。
3. 尿囊素:它是一种非常重要的膜质脂质,可以稳定叶绿体的水溶性物质,同时还可以抑制高温环境下的膜脂质挥发,可以防止叶绿体的膜结构改变。
4. 果糖:提取叶绿体的过程中果糖可作为能量的供给,可以为叶绿体提供热能使其反应充分活跃,同时果糖可以避免某些离子参与抵抗膜上脂质分布,保证叶绿体膜结构的稳定。
5. 甲醇:用于溶解叶绿体,能够使其保持混合态,但不会影响构型,可以在中性或弱酸碱条件下保持叶绿体膜结构不变。
6. 矿物质:种类繁多,包括钠、钙、镁、铁、钾等元素。
它们可以调
节叶绿体的电解质平衡,维持其正常的结构及功能,为充分发挥叶绿体提供必要的条件。
提取叶绿体色素的方法
叶绿体色素是一种非常重要的生物分子,可以在植物中找到。
它们起着重要的作用,可以参与光合作用,吸收太阳能以供有机物质的合成。
因此,叶绿体色素的提取显得尤为重要。
提取叶绿体色素的方法有几种,其中最常用的是离心法和沉淀法。
(1)离心法:首先,要将样品分离出叶绿体,可以用离心法。
在离心容器中加入植物细胞悬液,先用慢速离心运转1分钟,再用中速离心运转5分钟,最后再用高速离心运转5分钟,使叶绿体聚集在容器的离心池的底部,然后可以得到细胞浆液,再进行叶绿体的提取。
(2)沉淀法:检测混合物中的叶绿体,可以用沉淀法。
在混合
物中加入氯化钠或氯化钙溶液,使叶绿体发生沉淀,然后用离心法分离叶绿体,最后滤过,就可以得到叶绿体色素溶胶了。
提取叶绿体色素需要准备一些特定的试剂,比如:Tris-HCl缓
冲溶液、NaCl 、EDTA 、Triton X-100 、B-mercaptoethanol 、Glycerol 、蛋白酶K 、蛋白酶R 以及植物细胞悬液。
- 1 -。
叶绿体色素的提取酒精的作用
在叶绿体色素的提取实验中,酒精的作用是作为溶剂来提取叶绿体中的色素。
叶绿体中的色素能够溶解在酒精或丙酮等有机溶剂中,因此,通过加入无水酒精(或丙酮)可以有效地将叶绿体中的色素分离出来。
具体步骤和作用如下:
1.研磨:首先将叶绿体与适量的无水酒精混合,在研磨过程中,叶绿体被破坏释放出色素。
2.过滤:将研磨后的混合物进行过滤,分离出叶绿体碎片和色素溶液。
3.收集色素:收集滤液,其中含有溶解的叶绿体色素。
酒精在这个过程中的作用是溶解叶绿体中的色素,使得它们从固态的叶绿体中释放出来,并形成可以被收集的溶液。
此外,使用无水酒精可以减少水分的影响,避免色素的降解,从而提高色素的提取效率和纯度。
需要注意的是,在使用酒精作为溶剂时,应当确保实验操作在通风良好的条件下进行,因为酒精蒸气具有一定的毒性,长时间暴露可能对健康造成影响。
同时,实验结束后,应当妥善处理酒精,避免火灾和安全事故。
叶绿体色素的提取、分离、理化性质和含量测定
Ⅰ提取与分离
实验日期:2011.10.22
实验者:XXX
同组姓名:XXX
一、实验目的:
1.学习应用薄层色谱法分离叶绿体色素的实验方法。
2.了解叶绿素的组成、性质和测定叶绿素有助于理解光合作用的本质。
二、实验原理:
叶绿体是进行光合作用的细胞器。
叶绿体中的叶绿素a,叶绿素b,胡萝卜素和叶黄素与类囊体膜结合成为色素蛋白复合体。
这些色素都不溶于水而溶于有机溶剂,故可用乙醇等有机溶剂提取。
提取液可用薄层色谱法加以分离和鉴别。
植物活性成分的分离常用薄层层析法和柱层析法,其中柱层析适用于大量制备。
本实验采用薄层层析色谱法,其中固定相用硅胶预制板。
三、实验材料与试剂:
1.新鲜的菠菜叶片。
2.体积分数为95%的乙醇,碳酸钙粉末,展开剂。
3.研钵,漏斗,滤纸,三角瓶,剪刀,点样毛细管,层析缸,硅胶预制板。
四、实验步骤:
(一)色素提取液的制备
1.取新鲜叶片4~5片,洗净,擦干叶表面,去除中脉剪碎(越碎越好),放
入研钵中。
2.向研钵中加入少量CaCO3,加2~3ml体积分数为95%的乙醇,研磨至糊状,
再加10~15ml体积分数为95%的乙醇,上清液用漏斗过滤出,残渣再用10ml
体积分数为95%的乙醇冲洗一次,一同过滤于三角瓶中,即制成叶绿体色
素提取液。
提取液应尽量避光保存。
因提取量较大,可用于其他相关实验
(即用于后面的理化性质的验证)。
(二)叶绿体色素的分离
1.取硅胶预制板一个,用点样毛细管吸取上述提取液,平行于硅胶板的短边,
距下边缘1cm处用毛细管划线,自然风干后划第二次,重复操作3~4次,
确保划的滤液细线颜色足够深,使分离结果更加明显。
2.取已经加入适量展开剂的层析缸,把硅胶预制板带有色素的一端放入,使
其下端浸入展开剂中,但注意液面不可超出滤液细线。
迅速改好层析缸盖
减少展开剂的挥发对人体产生的不良影响。
注意观察展开剂的扩散过程,
当各种色素得到较好分离,且展开剂前沿接近硅胶预制板上端边缘处时,
取出硅胶预制板迅速用铅笔标出展开剂前沿和各色素带的位置。
注意要迅
速,否则展开剂前沿很快会挥发消失,且前沿和各个色素带的位置均会有
微小变动。
3.测量出前沿和各个色素带距离原点的距离并记录。
五、实验结果与分析(以图辅助以文字展示):
.
自上而下分别为:胡萝卜素,叶绿素a,叶绿素b,叶黄素。
各自到原点的距离:
展开剂前沿:8.50cm
胡萝卜素:8.10cm ,Rf=0.95
叶绿素a:6.70cm ,Rf=0.79
叶绿素b:6.30cm ,Rf=0.74
叶黄素:5.90cm ,Rf=0.69
事实上实验中不止看到了这四种色素带,在它们下面还有一些分离出来的色素带,但是不在本实验的讨论范围中,故不予考虑。
Ⅱ理化性质
一、实验目的:
验证叶绿体素的理化性质。
二、实验原理:
1.叶绿素可与碱起皂化反应产生的盐能溶于水中,因此可用此法分离叶绿素和类胡萝
卜素。
2.叶绿素吸收光子而转变成激发态,激发态的叶绿素分子很不稳定,当它变回基态时
可发射出红光量子因而产生荧光。
3.叶绿素的化学性质很不稳定,易受强光的破坏,特别是当叶绿素与蛋白质分离后,
而类胡萝卜素则较稳定。
4.叶绿素中的镁可以被H+取代而成褐色的去镁叶绿素。
去镁叶绿素遇铜成为铜代叶
绿素,铜代叶绿素很稳定,在光下不易被破坏,故常用此法制作绿色多汁植物的
浸渍标本。
三、实验材料与试剂:
1.新鲜菠菜叶片。
2.叶绿素提取与分离实验中剩余的叶绿素提取液。
3.小试管,试管架,水浴锅(60℃和90℃各一个),10ml移液管,洗耳球,三角瓶。
4.体积分数为95%的乙醇,笨,醋酸铜粉末,质量分数为5%的稀盐酸,醋酸-醋酸铜
溶液,氢氧化钾-甲醇溶液。
四、实验步骤:
(一)光对叶绿素的破坏作用
取2支小试管,各加入2.5ml叶绿体色素乙醇提取液,并用乙醇稀释一倍。
其中一支放在直射阳光下,另一只用锡纸包严,40min后对比观察颜色有
何变化。
(二)皂化作用(绿色素与黄色素的分离)
1.取1支小试管加入3ml浓的叶绿素乙醇提取液,加入1ml氢氧化钾-甲醇溶液,充分摇匀。
2.片刻后,加入3ml苯,摇匀,再沿试管壁慢慢加入1ml左右蒸馏水,轻轻混匀(勿激烈摇荡),然后置于试管架上静置分层。
若溶液不分层,则用
滴管吸取蒸馏水,沿管壁滴加,边滴加边摇动,直到溶液开始分层时静置。
(三)H+和Cu2+对叶绿素分子中Mg2+的取代作用
1.取2支试管,第一支加叶绿体色素提取液5ml,作为对照。
第二支试管加叶绿体色素提取液5ml后,再加入质量分数为5%的稀盐酸数滴,摇匀,
观察溶液颜色变化情况。
当溶液变褐后,再加入少量醋酸铜粉末,60℃水
浴加热,观察溶液颜色变化情况,并与对照试管相比较。
2.取新鲜菠菜叶片两小片(能塞进小试管即可),放入试管中,加醋酸-醋酸铜溶液,使之没过叶片,90℃水浴加热,随时观察叶片颜色的变化,直至
颜色不再变化为止。
(四)荧光现象的观察实验前
取一支小试管加入3ml浓的叶绿体色素乙醇提取液,在直射光下照射,比
较溶液的透射光与反射光颜色有何不同。
五、实验结果与分析(以图辅助以文字展示):
(一)光对叶绿素的破坏作用
(二)皂化作用(绿色素与黄色素的分离)
有明显的分层现象,上层显黄色,下层显绿色。
(三)H+和Cu2+对叶绿素分子中Mg2+的取代作用
绿色→→→→黄色→→→→绿色
(四)荧光现象的观察
实验前(左边光
照)
利用另外一支试管取未用锡箔纸包的
叶绿素溶液进行对比如图,右边为光照
后的叶绿素溶液
实验后(由于实验过程中包锡箔纸
的试管不慎打翻导致现在这样)
反射光明显是红色的
明显透射光是绿色的。