GMP-第四章-厂房与设施(1)
- 格式:ppt
- 大小:1.57 MB
- 文档页数:56





新版GMP各章节重点问题解读-—第四章:厂房与设施(上)硬件是否符合GMP,直接影响药品质量.硬件的优劣在一定程度上取决于设计质量和施工质量。
厂房和设施是制药企业实施GMP的基础,是一个先决条件,是硬件中的关键部分。
硬件包括厂区建筑物实体及附属配套的公用设施(如空调净化系统、制药用水、电、气系统等)。
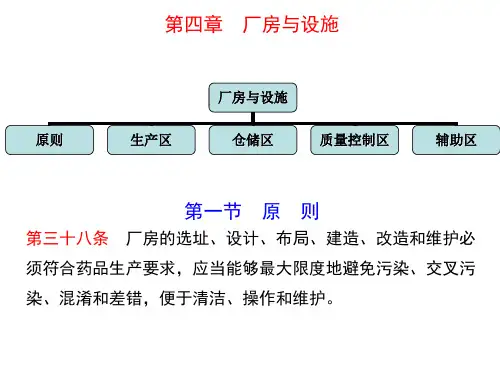
本章就厂房与设施必须遵从“防止污染和交叉污染、防止差错和混淆”的GMP原则,以及对生产区、仓储区、质量控制区、辅助区等具体要求进行了阐述。
GMP中“厂房与设施”的“防止污染”即通过合理的厂房与设施来防止在生产、取样、包装和贮存等操作过程中,物料、中间产品和成品受到化学或微生物特性的杂质或异物的不利影响。
“厂房与设施”的“防止交叉污染”即通过合理的厂房与设施来防止通过人流、工器具传送、物料传递、空气流动等途径,造成不同品种物料或药品成分互相干扰、污染,或是因人、工器具、物料、空气等不恰当的流向,让洁净级别低的生产区域的污染物传入洁净级别高的生产区域而造成污染。
计划于2015年3月1日实施的EU(欧盟)GMP修订版本第三章“厂房与设备"在3.6节中增加了防止交叉污染的措施应与其风险级别相适应的内容,同时规定了当药品存在特定风险时,需要使用专用设施的要求。
“防止混淆和差错"就厂房设施而言,主要是提供足够的空间及完善的设施确保物料和产品不会相互混杂,避免操作出现差错的可能。
原则新版GMP细化了对“厂房与设施"总的原则要求(见新版GMP第三十八条),提出了药厂选址要“根据厂房及生产防护措施综合考虑”,厂房所处的环境应能够“最大限度地降低物料或产品遭受污染的风险” (见新版GMP第三十九条)。
强调了总体布局的合理性,即“不应对药品生产造成污染,人流物流互不干扰” (见新版GMP第四十条).在“确保不影响药品的质量”前提下,还应对厂房要按企业制定的GMP文件要求进行清洁或必要的消毒(见新版GMP第四十一条).为确保生产和贮存的产品质量以及相关设备性能不会受到影响,厂房须配置必要的“照明、温度、湿度和通风"等设施(见新版GMP第四十二条)和“防止昆虫或其它动物进入”措施(见新版GMP第四十三条),避免杀虫剂等用品对设备、物料、产品造成污染。


GMP之四--厂房和设施概述GMP之四--厂房和设施概述厂房和设施是制药企业生产过程中不可或缺的一部分,它们对于产品质量的保证起着至关重要的作用。
遵循GMP(Good Manufacturing Practice,良好生产规范)的要求,对厂房和设施进行合理的规划、建设和管理,能够最大程度地确保制药企业的生产过程符合质量标准,并保证生产线的安全和可靠性。
一、厂房厂房是制药企业生产过程中的核心部分,它需要满足一系列的要求,包括但不限于:空气洁净度、温湿度控制、照明要求、消防安全等。
首先,厂房内的空气洁净度对于制药企业的生产过程至关重要。
药品生产过程中的微生物和颗粒污染可能会对产品质量产生不利影响,因此必须采取措施来控制厂房内空气中的微生物和颗粒数目。
通风系统、空气过滤设备、定期的清洁和消毒是保证空气洁净度的重要手段。
其次,温湿度控制也是厂房设计和管理的重要方面之一。
药品生产过程中对温湿度的要求可能各不相同,但必须在一定的范围内保持恒定。
过高或过低的温湿度会影响药品的稳定性和质量,因此必须通过合适的空调和湿度控制设备来实现恒定的温湿度。
此外,良好的照明也是厂房的重要要求之一。
适宜的照明可以提高生产环境的舒适度和操作人员的工作效率,同时也可以减少错误操作和事故发生的可能性。
因此,厂房需要安装足够的照明设施,并定期对其进行清洁和维护。
最后,消防安全是厂房设计和管理的重要考虑因素之一。
厂房内需要设置合适的消防设备,包括消防器材和灭火系统,以应对突发火灾事件。
此外,厂房内的电气设备和线路也需要进行定期的维护和检查,以防止电气故障引发火灾。
二、设施除了厂房之外,设施也是制药企业生产过程中不可或缺的一部分。
设施包括但不限于供应水、动力系统、处理设备、储存设备等。
首先,供应水是制药生产过程中不可或缺的资源之一。
水是许多药品生产过程中的原料、溶媒和清洗剂,因此必须确保供应水的质量符合要求。
对供应水进行适当的处理和消毒,以去除有害物质和微生物污染,是保证产品质量和安全的关键步骤之一。



第四章厂房与设施学习笔记《药品生产质量管理规范(2010)》版与《药品生产质量管理规范(1998修订)》版厂房与设施相关章节相比的主要变化有:1、增加厂房与设施的总的设计原则最大限度地避免污染、交叉污染、混淆和差错的发生2、根据不同区域需求规定基本要求(1)生产厂房的共用厂房、设施、设备的评估(2)明确药品与非药用产品的生产厂房公用限制要求3、关键的洁净设施的设计原则的变化(1)洁净等级的变化,采用ISO 14644标准;(2)强调具体的洁净区域温湿度的数值的要求;(3)不同洁净等级直接的压差为10Pa;(4)非无菌药品暴露操作区净化级别参照“D”级设置;(5)增加捕尘控制的系统要求第一节原则第三十八条厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。
新增条款厂房设施的设计和建造都必须由具备相应资质和经验的单位进行,以保证设计和建造质量,除满足药品生产的要求外,还应满足安全、消防方面的法规要求。
提出厂房设施的设计建造总的设计原则:最大限度地避免污染、交叉污染、混淆和差错的发生第三十九条应当根据厂房及生产防护措施综合考虑选址,厂房所处的环境应当能够最大限度地降低物料或产品遭受污染的风险。
新增条款增加对厂房选址时需要控制的原则性要求,进行风险防范。
需注意:1、企业总平面图,是否标明周边情况,周围是否有污染源。
2、厂房选址是否能避免其周围环境的影响,第四十条企业应当有整洁的生产环境;厂区的地面、路面及运输等不应当对药品的生产造成污染;生产、行政、生活和辅助区的总体布局应当合理,不得互相妨碍;厂区和厂房内的人、物流走向应当合理。
完善条款:在1998年修订规范第8条的基础上,提出厂区和厂房的人、物流走向应合理的要求。
对企业生产环境提出要求:应当降低由于厂区内尘土飞扬导致大气中的含尘量增加污染环境的危险。
对企业厂区布局提出要求:生产、行政、生活和辅助区的总体布局应合理,不得互相妨碍,厂房建设布局应考虑风向的影响,动物房、锅炉房、产尘车间等潜在污染源应位于下风向。