2018版高中物理 第十章 热力学定律章末总结
- 格式:ppt
- 大小:14.13 MB
- 文档页数:24







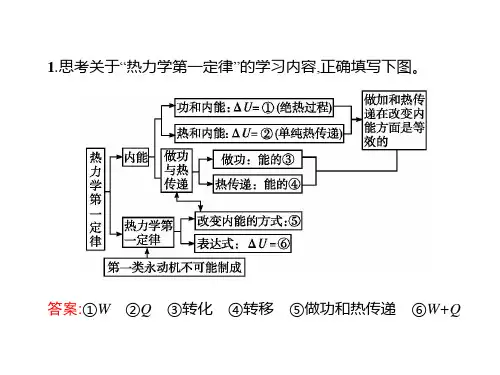
第十章知识总结
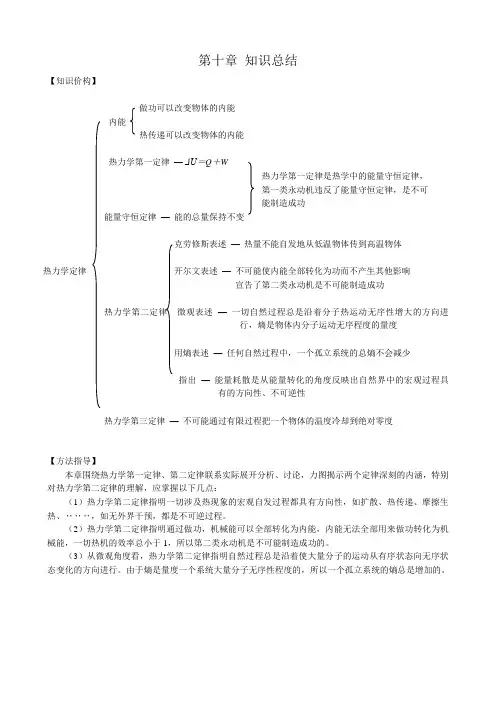
【知识价构】
做功可以改变物体的内能
内能
热传递可以改变物体的内能
热力学第一定律—ΔU=Q+W
热力学第一定律是热学中的能量守恒定律,
第一类永动机违反了能量守恒定律,是不可
能制造成功
能量守恒定律—能的总量保持不变
克劳修斯表述—热量不能自发地从低温物体传到高温物体
热力学定律开尔文表述—不可能使内能全部转化为功而不产生其他影响
宣告了第二类永动机是不可能制造成功
热力学第二定律微观表述—一切自然过程总是沿着分子热运动无序性增大的方向进
行,熵是物体内分子运动无序程度的量度
用熵表述—任何自然过程中,一个孤立系统的总熵不会减少
指出—能量耗散是从能量转化的角度反映出自然界中的宏观过程具
有的方向性、不可逆性
热力学第三定律—不可能通过有限过程把一个物体的温度冷却到绝对零度
【方法指导】
本章围绕热力学第一定律、第二定律联系实际展开分析、讨论,力图揭示两个定律深刻的内涵,特别对热力学第二定律的理解,应掌握以下几点:
(1)热力学第二定律指明一切涉及热现象的宏观自发过程都具有方向性,如扩散、热传递、摩擦生热、‥‥‥,如无外界干预,都是不可逆过程。
(2)热力学第二定律指明通过做功,机械能可以全部转化为内能,内能无法全部用来做功转化为机械能,一切热机的效率总小于1,所以第二类永动机是不可能制造成功的。
(3)从微观角度看,热力学第二定律指明自然过程总是沿着使大量分子的运动从有序状态向无序状态变化的方向进行。
由于熵是量度一个系统大量分子无序性程度的,所以一个孤立系统的熵总是增加的。

学案7 章末总结一、热力学第一定律的综合应用热力学第一定律揭示了内能的增量(ΔU )与外界对物体做功(W )和物体从外界吸收热量(Q )之间的关系,即ΔU =W +Q ,正确理解公式的意义及符号含义是解决本类问题的关键.(1)外界对物体做功,W >0;物体对外做功,W <0;(2)物体从外界吸热,Q >0;物体放出热量,Q <0;(3)ΔU >0,物体的内能增加;ΔU <0,物体的内能减少.分析题干,确定内能改变的方式(W 、Q )→判断W 、Q 的符号→代入公式ΔU =W +Q →得出结论⎩⎪⎨⎪⎧ ΔU >0,则内能增加ΔU ;ΔU <0,则内能减少|ΔU |.例1 如图1所示,一定质量的理想气体从状态A 经等压过程到状态B .此过程中,气体压强p =1.0×105 Pa 不变,吸收的热量Q =7.0×102J ,求此过程中气体内能的增量.图1解析 等压变化过程有V A T A =V B T B ,对外做的功W =p (V B -V A )根据热力学第一定律有ΔU =Q -W ,代入数据解得ΔU =5.0×102 J.答案 5.0×102 J针对训练1 如图2所示,p -V 图中,一定质量的理想气体由状态A 经过程Ⅰ变至状态B 时,从外界吸收热量420 J ,同时膨胀对外做功300 J .当气体从状态B 经过程Ⅱ回到状态A 时,外界压缩气体做功200 J ,判断此过程中气体是吸热还是放热,并求出热量变化的多少.图2答案 放热 320 J解析 一定质量的理想气体由状态A 经过程Ⅰ变至状态B 时,从外界吸收的热量Q 1大于气体膨胀对外做的功W 1,气体内能增加,由热力学第一定律可知,气体内能的增加量为 ΔU =Q 1-W 1=420 J -300 J =120 J气体由状态B 经过程Ⅱ回到状态A 时,气体内能将减少120 J ,而此过程中外界又压缩气体做了W 2=200 J 的功,因而气体必向外界放热,放出的热量为Q 2=ΔU ′-W 2=(-120 J)-200 J =-320 J即此过程中气体放出的热量是320 J.二、热力学第二定律1.热力学第二定律的两种表述(1)按照热传递的方向性表述为:热量不能自发地从低温物体传到高温物体,这是热力学第二定律的克劳修斯表述.(2)按照机械能与内能转化的方向性表述为:不可能从单一热库吸收热量,使之完全变成功,而不产生其他影响.这是热力学第二定律的开尔文表述.2.热力学第二定律的微观意义(1)一切自发过程总是沿着分子热运动的无序性增大的方向进行.(2)用熵来表示热力学第二定律:在任何自然过程中,一个孤立系统的总熵不会减小.3.分析此类问题的方法掌握热力学第二定律时,要注意理解其本质,即热力学第二定律是对宏观自然过程进行方向性的说明.凡是对这种宏观自然过程进行方向性的说明,都可以作为热力学第二定律的表述.本章对热力学第二定律的表述很多,这些不同形式的表述都是等价的.例2下列有关热力学第二定律的说法正确的是( )A.气体自发地扩散运动总是向着更为无序的方向进行,是可逆过程B.第二类永动机虽然不违反能量守恒定律,但它是制造不出来的C.空调既能制冷又能制热,说明热传递不具有方向性D.一定质量的理想气体向真空自由膨胀时,体积增大,熵减小答案 B解析与温度有关的一切热现象的宏观过程都是不可逆的,A项错误;热量不能自发地由高温物体传到低温物体,空调机里的压缩机工作,消耗了电能,产生了其他影响,C项错误;一定质量的理想气体向真空自由膨胀时,体积增大,熵增大,D项错误.只有B项正确.针对训练2 热力学第二定律指出:内能与机械能的转化具有方向性.请结合熵的变化加以解释.答案见解析解析机械运动是宏观情况下物体在空间位置上的变化,物体运动状态的变化完全遵循牛顿运动定律,这是一种有序的运动.热运动是大量分子的无序运动,机械运动向热运动的转化,属于从有序向无序的转化,熵增加,符合热力学规律,因此机械能可以全部转化为内能.反过程是熵减小,不符合熵增加原理,因此内能不能全部转化为机械能,而不引起其他变化.1.(热力学第一定律)在大气中,空气团竖直运动经过各气层的时间很短,因此,运动过程中空气团与周围空气热量交换极少,可看作绝热过程.潮湿空气团在山的迎风坡上升时,水汽凝结成云,到山顶后变得干燥,然后沿着背风坡下降时升温,气象上称这股干热的气流为焚风.空气团在山的迎风坡上升时温度降低,原因是空气团________(选填“对外放热”或“对外做功”);设空气团的内能U与温度T满足U=CT(C为一常数),空气团沿着背风坡下降过程中,外界对空气团做的功为W,则此过程中空气团升高的温度ΔT=________.答案对外做功W C解析空气团在山的迎风坡上升时温度降低,空气团内能减小,又绝热,根据热力学第一定律可知空气团对外做功;根据U=CT得:ΔU=CΔT①由根据热力学第一定律得:ΔU=CΔT②Q=0③①②③联立解得:ΔT =W C2.(热力学第一定律)一定质量的理想气体从状态a 开始,经历三个过程ab 、bc 、ca 回到原状态,其p -T 图象如图4所示,下列判断正确的是( )图4A .过程ab 中气体一定吸热B .过程bc 中气体既不吸热也不放热C .过程ca 中外界对气体所做的功等于气体所放的热D .a 、b 和c 三个状态中,状态a 分子的平均动能最小E .b 和c 两个状态中,容器壁单位面积单位时间内受到气体分子撞击的次数不同 答案 ADE解析 由p -T 图象可知过程ab 是等容变化,温度升高,内能增加,体积不变,由热力学第一定律可知过程ab 一定吸热,选项A 正确;过程bc 温度不变,即内能不变,由于过程bc 体积增大,所以气体对外做功,由热力学第一定律可知,气体一定吸收热量,选项B 错误;过程ca 压强不变,温度降低,内能减少,体积减小,外界对气体做功,由热力学第一定律可知,放出的热量一定大于外界对气体做的功,选项C 错误;温度是分子平均动能的标志,由p -T 图象可知,a 状态气体温度最低,则平均动能最小,选项D 正确;b 、c 两状态温度相等,分子平均动能相等,由于压强不相等,所以单位面积单位时间内受到气体分子撞击的次数不同,选项E 正确.3.(热力学定律的应用)以下说法正确的是( )A .电冰箱内的食品温度比室内温度低,说明在一定条件下热量也可以由低温物体传到高温物体B .内能可以转化为机械能C .能量的耗散否定了能量守恒定律D .能量的耗散说明自然界的宏观过程有方向性答案 ABD解析 在一定条件下,热量可以由低温物体传到高温物体,A 正确;由能量守恒定律可知,各种形式的能量之间可以相互转化,并且总能量守恒,所以B 正确;能量的耗散并没有否定能量守恒定律,而是说明自然界的宏观过程有方向性,C 错误,D 正确.4.(热力学定律的应用)下列说法不正确...的是( ) A .在任何自然过程中,一切参与者的总能量和总熵保持不变B.熵无处不在,是系统无序程度的量度C.一切不可逆过程在熵增加的同时,总是伴随着能量退降D.由热力学第二定律可知,自然界的能量品质正在退化,可利用的能量越来越少E.热力学第二定律的微观实质是熵增加答案 A解析系统的总能量守恒,但总熵可能不变或增加.。
章末总结一、热力学第一定律的综合应用热力学第一定律揭示了内能的增量(ΔU )与外界对物体做功(W )与物体从外界吸收热量(Q )之间的关系,即ΔU =W +Q ,正确理解公式的意义及符号含义是解决本类问题的保证. (1)外界对物体做功,W >0;物体对外做功,W <0; (2)物体从外界吸热,Q >0;物体放出热量,Q <0; (3)ΔU >0,物体的内能增加;ΔU <0,物体的内能减少.分析题干,确定内能改变的方式(W 、Q )→判断W 、Q 的符号→代入公式ΔU =W +Q →得出结论 ⎩⎪⎨⎪⎧ΔU >0,则内能增加ΔU ;ΔU <0,则内能减少|ΔU |. 例1 如图1所示,一定质量的理想气体从状态A 经等压过程到状态B .此过程中,气体压强p =1.0×105 Pa 不变,吸收的热量Q =7.0×102 J ,求此过程中气体内能的增量.图1解析 等压变化过程有V A T A =V BT B,对外做的功W =p (V B -V A ) 根据热力学第一定律有ΔU =Q -W , 代入数据解得ΔU =5.0×102 J.答案 5.0×102 J针对训练图2如图2所示,p-V图中,一定质量的理想气体由状态A经过程Ⅰ变至状态B时,从外界吸收热量420 J,同时膨胀对外做功300 J.当气体从状态B经过程Ⅱ回到状态A时,外界压缩气体做功200 J,判断此过程中气体是吸热还是放热,并求出热量变化的多少.答案放热320 J解析一定质量的理想气体由状态A经过程Ⅰ变至状态B时,从外界吸收的热量Q1大于气体膨胀对外做,气体内能增加,由热力学第一定律可知,气体内能的增加量为的功W1ΔU=Q1-W1=420 J-300 J=120 J气体由状态B经过程Ⅱ回到状态A时,气体内能将减少120 J,而此过程中外界又压缩气体做了W=2002J的功,因而气体必向外界放热,放出的热量为Q2=ΔU′-W2=(-120 J)-200 J=-320 J即此过程中气体放出的热量是320 J.二、热力学第二定律1.热力学第二定律的两种表述(1)按照热传递的方向性表述为:热量不能自发地从低温物体传到高温物体,这是热力学第二定律的克劳修斯表述.(2)按照机械能与内能转化的方向性表述为:不可能从单一热库吸收热量,使之完全变成功,而不产生其他影响.这是热力学第二定律的开尔文表述.2.热力学第二定律的微观意义(1)一切自发过程总是沿着分子热运动的无序性增大的方向进行.(2)用熵来表示热力学第二定律:在任何自然过程中,一个孤立系统的总熵不会减小.3.分析此类问题的方法掌握热力学第二定律时,要注意理解其本质,即热力学第二定律是对宏观自然过程进行方向的说明.凡是对这种宏观自然过程进行方向的说明,都可以作为热力学第二定律的表述.本章对热力学第二定律的表述很多,这些不同形式的表述都是等价的.例2关于热力学定律,下列说法正确的是__________.(填入正确选项前的字母)A.为了增加物体的内能,必须对物体做功或向它传递热量B.对某物体做功,必定会使该物体的内能增加C.可以从单一热源吸收热量,使之完全变为功D.不可能使热量从低温物体传向高温物体E.功转变为热的实际宏观过程是不可逆过程解析由热力学第一定律ΔU=W+Q,可知A正确,B错误;由热力学第二定律知,C、D这些过程在借助于外界帮助的情况下是可以实现的,所以C正确,D错误;由于自然界中一切与热现象有关的过程都是不可逆的,所以E正确,故正确答案为A、C、E.答案ACE1.(热力学第一定律)如图3所示,A、B是两个完全相同的球,分别浸没在水和水银的同一深度内,A、B两球用同一种材料制成,当温度稍微升高时,球的体积会明显变大,如果开始水和水银的温度相同,且两液体温度同时缓慢升高同一值,两球膨胀后,体积相等,则()图3A.A球吸收的热量较多B.B球吸收的热量较多C.两球吸收的热量一样多D.无法确定答案 B解析两球初、末态温度分别相同,初、末态体积也相同,所以内能增量相同,但水银中的B球膨胀时对外做功多,所以吸热较多,故选B.2.(热力学第一定律的综合应用)对于一定质量的理想气体,下列说法正确的是()A.若气体的压强和体积都不变,其内能也一定不变B.若气体的温度不断升高,其压强也一定不断增大C.若气体温度升高1 K,其等容过程所吸收的热量一定大于等压过程所吸收的热量D.在完全失重状态下,气体的压强为零答案 A解析一定质量的理想气体的内能与温度有关,若气体的压强和体积都不变,则温度不变,其内能也一=C知,气体的温度不断升高,压强不一定增大,B错误;根据热力学第一定律定不变,A正确;由pVT有ΔU=Q+W,气体温度升高1 K,ΔU相同,等容过程W=0,等压过程,体积增大,则W<0,故等容过程所吸收的热量一定小于等压过程所吸收的热量,C错误;气体的压强是由于分子频繁撞击器壁而产生的,与是否失重无关,D错误.3.(热力学定律的应用)以下说法正确的是()A.电冰箱内的食品温度比室内温度低,说明在一定条件下热量也可以由低温物体传到高温物体B.内能可以转化为机械能C.能量的耗散否定了能量守恒定律D.能量的耗散说明自然界的宏观过程有方向性答案ABD解析在一定条件下,热量可以由低温物体传到高温物体,A正确;由能量守恒定律可知,各种形式的能量之间可以相互转化,并且总能量守恒,所以B正确;能量的耗散并没有否定能量守恒定律,其说明自然界的宏观过程有方向性,C错误,D正确.章末检测卷(十)(时间:90分钟满分:100分)一、选择题(本题共10小题,每小题4分,共40分)1.在下列现象中不是通过做功使物体内能改变的是()A.用打气筒给自行车打气时,筒壁温度升高B.在阳光照射下,水的温度升高C.铁锤打铁块,使铁块温度升高D.夏天在室内放几块冰,室内会变凉一些答案BD解析活塞与筒壁发生摩擦,摩擦力做功使筒壁温度升高;在阳光照射下,水温升高是靠太阳的热辐射来升温的;铁锤打铁块是做功过程;室内放上冰块是通过热传递的方式来改变室内温度的.2.柴油机使柴油燃料在它的汽缸中燃烧,产生高温高压的气体,燃料的化学能转化为气体的内能,高温高压的气体推动活塞做功,气体的内能又转化为柴油机的机械能.燃烧相同的燃料,输出的机械能越多,表明柴油机越节能.是否节能,是衡量机器性能好坏的重要指标,有经验的柴油机维修师傅,不用任何仪器,只是将手伸到柴油机排气管附近,去感知一下尾气的温度,就能够判断出这台柴油机是否节能,关于尾气的温度跟柴油机是否节能之间的关系,你认为正确的是()A.尾气的温度越高,柴油机越节能B.尾气的温度越低,柴油机越节能C.尾气的温度高低与柴油机是否节能无关D.以上说法均不正确答案 B解析气体的内能不可能完全转化为柴油机的机械能,柴油机使柴油燃料在它的汽缸中燃烧,产生高温高压的气体,是一个高温热源;而柴油机排气管排出的尾气是一个低温热源.根据能量守恒,这两个热源之间的能量差就是转换的机械能,燃烧相同的燃料,要想输出的机械能越多,尾气的温度就要越低.3.景颇族的祖先发明的点火器如图1所示,用牛角做套筒,木质推杆前端粘着艾绒,猛推推杆,艾绒即可点燃.对筒内封闭的气体,在此压缩过程中()图1A.气体温度升高,压强不变B.气体温度升高,压强变大C.气体对外界做正功,气体内能增加D.外界对气体做正功,气体内能减少答案 B解析外界对气体做正功,其内能增加,温度升高,分子热运动加剧、体积变小,单位体积内分子的密集程度增加,故其压强变大.正确选项为B.4.关于热力学定律和分子动理论,下列说法正确的是()A.一定质量的气体吸收热量,其内能一定增大B.不可能使热量由低温物体传递到高温物体C.若两分子间距离增大,分子势能一定增大D.若两分子间距离减小,分子间引力和斥力都增大答案 D解析由热力学第一定律ΔU=W+Q知,一定质量的气体吸收热量内能不一定增大,例如气体对外做功,且W>Q,那么内能将会减少,故A项错误;不可能使热量由低温物体传递到高温物体,而不引起其他变化,关键是理解“而不引起其他变化”,如果“引起其他变化”,完全可以实现将热量从低温物体时,分子力表现为斥力,当分子间距增大时,分子势能减小,故传递到高温物体,故B项错误;当r<rC项错误;根据分子引力、斥力随分子间距的变化规律知,D项正确.图25.固定的水平汽缸内由活塞B封闭着一定质量的理想气体,气体分子之间的相互作用力可以忽略.假设汽缸壁的导热性能很好,外界环境的温度保持不变.若用外力F将活塞B缓慢地向右拉动,如图2所示,则在拉动活塞的过程中,关于汽缸内气体的下列结论,正确的是()A.气体对外做功,气体内能减小B.气体对外做功,气体内能不变C.外界对气体做功,气体内能不变D.气体向外界放热,气体内能不变答案 B解析用力F缓慢拉活塞时,气体膨胀,对外做功,但由于汽缸的导热性很好,环境温度又不变,气体会从外界吸收热量而保持与环境温度相同,因而气体的内能不变,故B选项正确.6.一木块沿斜面向下滑,下列说法正确的是()A.不管斜面是否光滑,下滑过程中重力对木块做了功,它的内能将增大B.若斜面光滑且不计空气阻力,木块滑到斜面底部时,速度增大,内能也将增大C.若斜面粗糙,木块在重力作用下虽速度增大,但它的内能并不改变D.若斜面粗糙,木块的机械能减小,而它的内能将增大答案 D解析斜面光滑且不计空气阻力时,木块下滑过程中机械能守恒,内能不变;斜面粗糙,木块下滑时要克服摩擦力做功,故木块的机械能减小,由能量守恒定律知它的内能将增大,故D正确.图37.已知理想气体的内能与温度成正比,如图3所示的实线为汽缸内一定质量的理想气体由状态1到状态2的变化曲线,则在整个过程中汽缸内气体的内能()A.先增大后减小B.先减小后增大C.单调变化D.保持不变答案 B解析题图中虚线是等温线,由理想气体状态方程pVT=C知,气体由状态1到状态2时温度先减小后增大,即理想气体的内能先减小后增大,B正确.图48.如图4所示,水平放置的密封汽缸内的气体被一竖直隔板分隔为左右两部分,隔板可在汽缸内无摩擦滑动,右侧气体内有一电热丝.汽缸壁和隔板均绝热.初始时隔板静止,左、右两边气体温度相等.现给电热丝提供一较弱电流,通电一段时间后切断电源.当缸内气体再次达到平衡时,与初始状态相比()A.右边气体温度升高,左边气体温度不变B.左、右两边气体温度都升高C.左边气体压强增大D.右边气体内能的增加量等于电热丝放出的热量答案BC解析当电热丝通电后,右边气体温度升高气体膨胀,将隔板向左推,对左边的气体做功,根据热力学第一定律,左边气体内能增加,气体的温度升高,压强增大,选项B、C正确,选项A错误.右边气体内能的增加量为电热丝产生的热量减去对左边的气体所做的功,选项D错误.图59.如图5所示,密闭绝热容器内有一绝热的具有一定质量的活塞,活塞的上部封闭着气体,下部为真空,活塞与器壁的摩擦忽略不计,置于真空中的轻弹簧的一端固定于容器的底部,另一端固定在活塞上,弹簧被压缩后用绳扎紧(绳未画出),此时弹簧的弹性势能为E p(弹簧处在自然长度时的弹性势能为零),现绳突然断开,弹簧推动活塞向上运动,经过多次往复运动后活塞静止,气体达到平衡状态.经过此过程()A.E p全部转换为气体的内能B.E p一部分转换成活塞的重力势能,其余部分仍为弹簧的弹性势能C.E p全部转换成活塞的重力势能和气体的内能D.E p一部分转换成活塞的重力势能,一部分转换为气体的内能,其余部分仍为弹簧的弹性势能答案 D解析弹簧静止后仍有弹性势能,最后活塞重心升高,重力势能增加,由于气体的体积变小,活塞对气体做了功,气体内能增加.故正确答案为D.图610.我国神九航天员的漫步太空已成为现实.神九航天员漫步太空,此举震撼世界,意义重大无比.其中,飞船在航天员出舱前先要“减压”,在航天员从太空返回进入航天器后要“升压”,因此飞船将此设施专门做成了一个舱,叫“气闸舱”,其原理如图6所示,两个相通的舱A、B间装有阀门K,指令舱A中充满气体,气闸舱B内为真空,整个系统与外界没有热交换.打开阀门K后,A中的气体进入B中,最终达到平衡,则()A.气体体积膨胀,对外做功B.气体分子势能减少,内能增加C.体积变大,温度降低D.B中气体不可能自发地全部退回到A中答案 D解析当阀门K被打开时,A中的气体进入B中,由于B中为真空,所以A中的气体不会做功,则A错误;又因为系统与外界无热交换,所以气体内能不变,则气体的温度也不变,则B、C错误;由热力学第二定律知,真空中气体膨胀具有方向性,在无外界作用时,B中气体不能自发地全部退回到A中.故D正确.二、填空题(本题共2小题,共14分)11.(6分)在将空气压缩装入气瓶的过程中,温度保持不变,外界做了24 kJ的功.现潜水员背着该气瓶缓慢地潜入海底,若在此过程中,瓶中空气的质量保持不变,且放出了 5 kJ的热量.在上述两个过程中,空气的内能共减小________kJ,空气__________(填“吸收”或“放出”)的总热量为________kJ.答案5放出29解析理想气体的内能仅与温度有关,故将空气压缩装入气瓶的过程中并不改变空气的内能,只有潜入海底过程才改变内能,所以两个过程中,空气的内能共减小5 kJ,由热力学第一定律ΔU=W+Q,知Q =-29 kJ,故空气放出的总热量为29 kJ.12.(8分)一定质量的理想气体,状态从A→B→C→D→A的变化过程可用如图7所示的p-V图描述,图中p1、p2、V1、V2和V3为已知量.图7(1)气体状态从A到B是________(填“等容”“等压”或“等温”)过程;(2)气体状态从B到C的变化过程中,气体的温度________(填“升高”“不变”或“降低”);(3)气体状态从C到D的变化过程中,气体________(填“吸热”或“放热”)(4)气体状态从A→B→C→D的变化过程中,气体对外界所做的总功为________________________.答案(1)等压(2)降低(3)放热(4)p2(V3-V1)-p1(V3-V2)解析(1)从A到B压强不变,所以是等压过程.(2)从B到C为等容过程,由查理定律p1T1=p2T2可知温度降低.(3)从C到D为等压压缩过程,体积减小,温度降低,因此外界对气体做功,内能减小.由热力学第一定律ΔU=W+Q可知,气体放出热量.(4)从A到B过程体积增大,气体对外界做功W1=p2(V3-V1).从B到C过程体积不变,不做功.从C到D,外界对气体做功W2=p1(V3-V2),所以从A→B→C→D过程中,气体对外界所做的总功W=W1-W2=p2(V3-V1)-p1(V3-V2).三、计算题(本题共4小题,共46分)13.(8分)一质量为M=2 kg的木块,放在高h=0.8 m的光滑桌面上,被一个水平方向飞来的子弹打落在地面上(子弹留在木块中).设子弹的初速度为804 m/s,落地点与桌边的水平距离s=1.6 m,子弹的质量m=10 g.若子弹射入木块时产生的热量的90%被子弹吸收,则子弹的温度升高多少?[设子弹的比热容为3.78×102 J/(kg·℃),取g=10 m/s2,空气阻力不计]答案766 ℃解析由平抛运动的规律可知h=12gt2,s=v1t联立解得:v1=4 m/s碰撞过程中损失的机械能转化为内能即[12m v 2-12(M+m)v21]×90%=c·mΔt代入数据,解得:Δt≈766 ℃图814. (12分)如图8所示,为一汽缸内封闭的一定质量的气体的p-V图线,当该系统从状态a沿过程a→c→b到达状态b时,有335 J热量传入系统,系统对外界做功126 J.求:(1)若沿a→d→b过程,系统对外做功42 J,则有多少热量传入系统?(2)若系统由状态b沿曲线过程返回状态a的过程中,外界对系统做功84 J,则系统是吸热还是放热?传递的热量是多少?答案(1)251 J(2)放热293 J解析(1)由热力学第一定律可得a→c→b过程系统增加的内能ΔU=W+Q=(-126+335) J=209 J,由a→d→b过程有ΔU=W′+Q′得Q′=ΔU-W′=[209-(-42)] J=251 J,为正,即有251 J的热量传入系统.(2)由题意知系统由b→a过程内能的增量ΔU ′=-ΔU =-209 J根据热力学第一定律有Q ″=ΔU ′-W ″=(-209-84) J =-293 J负号说明系统放出热量,热量传递为293 J.图915. (12分)如图9所示,一导热汽缸放在水平面上,其内封闭一定质量的某种理想气体.活塞通过滑轮组与一重物连接,并保持平衡.已知汽缸高度为h ,开始活塞在汽缸中央,初始温度为t 摄氏度,活塞面积为S ,大气压强为p 0,物体重力为G ,活塞质量及一切摩擦不计.缓慢升高环境温度,使活塞上升Δx ,封闭气体吸收了Q 的热量.(活塞、汽缸底的厚度不计,且汽缸始终未离开地面)求:(1)环境温度升高了多少度?(2)气体的内能如何变化?变化了多少?答案 (1)2Δx h(273.15+t ) (2)气体内能增加 Q -(p 0S -G )Δx解析 (1)活塞缓慢移动,任意时刻都处于平衡状态,故气体做等压变化,由盖—吕萨克定律可知: V T =ΔV ΔT ,得ΔT =2Δx h(273.15+t ). (2)设汽缸内气体压强为p ,由平衡条件得:pS =p 0S -G ,封闭气体对外做功W =pS Δx =(p 0S -G )Δx ,由热力学第一定律得:ΔU =Q +(-W )=Q -(p 0S -G )Δx .由于气体的温度升高,其内能增加.16.(14分)某压力锅结构如图10所示.盖好密封锅盖,将压力阀套在出气孔上,给压力锅加热,当锅内气体压强达到一定值时,气体就把压力阀顶起.假定在压力阀被顶起时,停止加热.图10(1)假定在一次放气过程中,锅内气体对压力阀及外界做功1 J ,并向外界释放了2 J 的热量.锅内原有气体的内能如何变化?变化了多少?(2)已知大气压强p随海拔高度H的变化满足p=p0(1-αH),其中常数α>0.结合气体实验定律定性分析在不同的海拔高度使用压力锅,当压力阀被顶起时锅内气体的温度有何不同.答案(1)减少 3 J(2)温度随着海拔高度的增加而降低.解析(1)根据热力学第一定律:ΔU=W+Q,气体对外做功,功为负,W=-1 J;向外放热,热量为负,Q=-2 J.则有:ΔU=W+Q=-3 J,负号表示内能减少.锅内气体内能减少,减少了3 J.(2)由p=p0(1-αH)(其中α>0),随着海拔高度的增加,大气压强减小;由p1=p+mgS=p(1-αH)+mgS,随着海拔高度的增加,阀门被顶起时锅内气体压强减小;根据查理定律p1T1=p2T2可知,阀门被顶起时锅内气体温度随着海拔高度的增加而降低.。
高二物理第十章 热力学定律 第2~4节人教实验版【本讲教育信息】一. 教学内容:第十章 热力学定律 第2~4节二. 知识要点:1. 了解热传递及其三种方式,掌握热和内能的关系,区分做功和热传递本质上的不同。
2. 理解外界对系统做功和热传递过程W 、Q 、△U 的物理含义,理解热力学第一定律,掌握能量守恒定律。
3. 知道热传递的方向性及热力学第二定律的两种不同表述,知道什么是第二类永动机。
三. 重点、难点解析:(一)热传递(1)定义:相互接触的两个物体,温度不同时,会自发地将热量从高温物体传到低温物体,这种过程叫热传递.(2)热传递的条件:两物体温度不同.只要存在温度差,热传递过程就会进行,与原来物体内能的多少大小无关.热传递过程能量可以由内能大的物体传到内能小的物体上,也可以由内能小的物体传到内能大的物体上.(3)热传递的三种方式:热传导、热对流、热辐射热传递的三种方式各有特点.传导的特点在于沿着物体但不伴之以物质的迁移,所以多发生于固体上;对流则是靠物质的流动来传递热,所以对流是液体和气体特有的传热方式;辐射则无需物质作为媒介,而是以直线方式向外传递的.(4)热传递过程实质是能量转移的过程.例1 下列所述现象中属于利用热传导的方式来传热的是A. 冬天,用手去拿室外的铁块,手感到冷B. 夏天,开空调后一段时间整个房间内温度降低C. 在地面上晒小麦D. 冬天,用暖水袋暖手【解析】冬天,室外的铁块温度低,手温度高,用手拿铁块时,手上的热量直接通过热传导的方式传到铁块上.用暖水袋暖手,道理同上.开空调后整个房间内降温,是空气通过对流的方式使热空气降温.晒小麦是依靠太阳热辐射来吸收热量的.所以正确答案为A 、D 答案:AD【特别提示】明确热传递的三种方式及各自的特点.(二)热和内能(1)热传递和物体内能改变的关系热传递也可以改变物体的内能.物体吸收了热量,分子热运动变得剧烈,分子平均动能就增加,物体的内能就增大,反之物体内能就减少.在单纯热传递的情况下,系统由状态1到达状态2,内能增量为12U U U -=∆,吸收的热量为Q 即Q U =∆,也就是说:物体吸收热量,内能增加,物体放出热量,内能减少,内能改变的多少用热量来量度.(2)做功和热传递在改变物体的内能上是等效的.(3)做功和热传递在本质上是不同的.做功使物体的内能改变,是其他形式的能量和内能之间的转化(不同形式能量间的转化).热传递使物体的内能改变,是物体间内能的转移(同种形式能量的转移).例2下列关于做功和热传递的说法中正确的是A. 做功和热传递的实质是相同的B. 做功和热传递在改变物体内能上是等效的C. 做功和热传递是对同一过程中的两种说法D. 做功和热传递是不可能同时发生的【解析】做功和热传递在改变物体内能上是等效的,但本质不同,做功是将其他形式的能量转化为内能或将内能转化为其他形式的能量;热传递是将一个物体的内能传递给另一个物体,且做功和热传递可以同时进行.故正确选项为B.答案:B【特别提示】做功和热传递本质不同,但在改变物体内能上是等效的,注意它们的区别和联系.要注意区分的几个概念(1)热量和内能内能是由系统的状态决定的,状态确定,系统的内能也随之确定,要使系统的内能发生变化.可以通过热传递或做功两种过程来完成.而热量是热传递过程中的特征物理量,和功一样,热量只是反映物体在状态变化过程中所迁移的能量,是用来衡量物体内能变化的。
章末总结一、热力学第一定律的理解热力学第一定律揭示了内能的增量(ΔU )与外界对物体做功(W )和物体从外界吸收热量(Q )之间的关系,即ΔU =W +Q ,正确理解公式的意义及符号含义是解决本类问题的关键. (1)外界对物体做功,W >0;物体对外做功,W <0; (2)物体从外界吸热,Q >0;物体放出热量,Q <0; (3)ΔU >0,物体的内能增加;ΔU <0,物体的内能减少.分析题干,确定内能改变的方式(W 、Q )→判断W 、Q 的符号→代入公式ΔU =W +Q →得出结论⎩⎪⎨⎪⎧ΔU >0,则内能增加ΔU ;ΔU <0,则内能减少|ΔU |. 例1 如图1所示,在斯特林循环中的p -V 图象中,一定质量的理想气体从状态A 依次经过状态B 、C 和D 后再回到状态A ,整个过程由两个等温和两个等容过程组成,下列说法正确的是( )图1A.状态A的温度高于状态C的温度B.B→C过程中,单位体积的分子数目减小C.C→D过程中,气体分子每次与容器壁碰撞的平均冲力的平均值变小了D.一个循环过程中,气体要从外界吸收一定的热量答案 D解析因CD和AB都是等温线,且CD等温线的温度高于AB等温线的温度,故状态A的温度低于状态C的温度,选项A错误;B→C过程中,气体的体积不变,故单位体积的分子数目不变,选项B错误;C→D过程中,气体的温度不变,分子平均动能不变,平均速率不变,故气体分子每次与容器壁碰撞的平均冲力的平均值不变,选项C错误;一个循环过程中,从状态A依次经过状态B、C和D后再回到状态A,气体对外做功,温度不变,根据热力学第一定律可知,气体要从外界吸收一定的热量,选项D正确,故选D.二、热力学第一定律与气体实验定律的结合例2要使一定质量的理想气体由某一状态经过一系列状态变化,最后回到初始状态.下列各过程可能实现这一要求的是()A.先等容放热,再等压升温,最后再等温放热B.先等温膨胀,再等压升温,最后再等容吸热C.先等容吸热,再等温膨胀,最后再等压降温D.先等压升温,再等容吸热,最后再等温放热答案AC解析根据热力学第一定律ΔU=W+Q知等容放热时W=0,内能减小,温度降低,压强减小;再等压升温,体积增大,等温放热时,内能不变,由ΔU=W+Q知外界对气体做功,体积减小,压强增大,所以气体的状态可能回到初始状态,故A正确;等温膨胀时,体积增大,再等压升温时,温度升高,体积增大;最后再等容吸热时,W=0,内能增大,温度升高,压强增大,所以体积不能回到初始状态,故B错误;等容吸热时,W=0,内能增大,温度升高,压强增大,再等温膨胀时,温度不变,体积增大,压强减小,再等压降温时,体积减小,所以气体的状态可能回到初始状态,故C正确;等压升温时温度升高,体积增大;再等容吸热时,W=0,内能增大,温度升高,压强增大,最后再等温放热时,内能不变,外界对气体做功,体积减小,压强增大,所以压强不能回到初始状态,故D错误.例3如图2所示,一定质量的理想气体从状态A经等压过程变化到状态B,已知气体压强p=2.0×105 Pa,此过程中气体吸收的热量Q=2.8×102 J,求:图2(1)该气体在状态A 时的体积; (2)A 到B 过程气体对外做的功;(3)该气体从状态A 到状态B 过程中内能的增量. 答案 (1)8×10-4 m 3 (2)80 J (3)2×102 J解析 (1)由V A T A =V B T B 得V A =V B T A T B =8×10-4 m 3(2)对外做功W =p (V B -V A )=80 J (3)由热力学第一定律 ΔU =Q -W代入数据解得ΔU =2×102 J.针对训练 如图3所示,p -V 图中,一定质量的理想气体由状态A 经过程Ⅰ变至状态B 时,从外界吸收热量420 J ,同时膨胀对外做功300 J .当气体从状态B 经过程Ⅱ回到状态A 时,外界压缩气体做功200 J ,求此过程气体吸收或放出的热量是多少?图3答案 放出的热量是320 J解析 气体由状态A 经过程Ⅰ变至状态B 时,从外界吸收的热量Q 1大于气体膨胀对外做的功W 1,气体内能增加,由热力学第一定律可知,气体内能的增加量为 ΔU =Q 1-W 1=420 J -300 J =120 J气体由状态B 经过程Ⅱ回到状态A 时,气体内能将减少120 J ,而此过程中外界又压缩气体做了W 2=200 J 的功,因而气体必向外界放热,放出的热量为 Q 2=W 2-ΔU ′=200 J -(-120 J)=320 J.例4 把一定质量的理想气体用活塞封闭在可导热的汽缸内,活塞相对于底部的高度为h ,可沿汽缸无摩擦地滑动,汽缸整体放在冰水混合物中.取一小盒沙子缓慢地倒在活塞的上表面上.沙子倒完时,活塞下降了h4.再取相同质量的一小盒沙子缓慢地倒在活塞的上表面上.外界的压强和温度始终保持不变,求第二次沙子倒完时活塞距汽缸底部的高度.在第二次倒沙子的过程中外界对气体做功145 J ,封闭气体吸热还是放热,热量是多少? 答案 0.6h 放热 145 J解析 设大气和活塞对气体的总压强为p 0,加一小盒沙子对气体产生的压强为p ,由玻意耳定律得p 0h =(p 0+p )⎝⎛⎭⎫h -h 4①由①式得p =13p 0②再加一小盒沙子后,气体的压强变为p 0+2p . 设第二次加沙子后,活塞距汽缸底部的高度为h ′, 由玻意耳定律得p 0h =(p 0+2p )h ′③联立②③式解得h ′=0.6h气体等温压缩,内能不变,即ΔU =0,外界对气体做功,故气体一定放出热量;根据热力学第一定律ΔU =W +Q ,得Q =-W =-145 J.1.(热力学第一定律的理解)带有活塞的汽缸中封有一定质量的理想气体,缸内气体从状态A 变化到状态B ,如图4所示.此过程中,汽缸单位面积上所受气体分子撞击的作用力________(选填“变大”“不变”或“减小”),缸内气体________(选填“吸收”或“放出”)热量.图4答案 不变 吸收解析 缸内气体从状态A 变化到状态B ,为等压变化,故汽缸单位面积上所受气体分子撞击的作用力不变,理想气体对外做功的同时,分子的平均动能增大,即内能增大,根据热力学第一定律ΔU =W +Q 可知:ΔU >0,W <0,所以Q >0,即气体吸收热量 .2.(热力学第一定律的综合应用)在空气中,空气团竖直运动经过各气层的时间很短,因此,运动过程中空气团与周围空气热量交换极少,可看作绝热过程.潮湿空气团在山的迎风坡上升时,水汽凝结成云雨,到山顶后变得干燥,然后沿着背风坡下降时升温,气象上称这股干热的气流为焚风.空气团在山的迎风坡上升时温度降低,原因是空气团________(选填“对外放热”或“对外做功”);设空气团的内能U 与温度T 满足U =CT (C 为一常数),空气团沿着背风坡下降过程中,外界对空气团做的功为W ,则此过程中空气团升高的温度ΔT =________. 答案 对外做功W C解析 空气团在山的迎风坡上升时温度降低,空气团内能减小,又绝热,根据热力学第一定律可知空气团对外做功;根据U =CT 得:ΔU =C ΔT ① 根据热力学第一定律得:ΔU =W +Q ② Q =0③联立①②③解得ΔT =WC3.(热力学第一定律的综合应用)如图5所示,内壁光滑的导热汽缸水平放置,一定质量的理想气体被封闭在汽缸内,外界大气压强为p 0、温度为T 0.现对汽缸缓慢加热,体积由V 1增大为V 2,此过程气体吸收热量Q 1;然后固定活塞,停止加热,封闭气体的温度逐渐降低至与外界大气温度相同.求:图5(1)刚停止加热时封闭气体的温度T ; (2)停止加热后,封闭气体向外传递的热量Q 2. 答案 见解析解析 (1)由盖—吕萨克定律有V 1T 0=V 2T解得T =V 2V 1T 0(2)设加热过程封闭气体增加的内能为ΔU ,则有 ΔU =Q 1-p 0(V 2-V 1) ΔU =Q 2解得:Q 2=Q 1-p 0(V 2-V 1)4. (热力学第一定律的综合应用)一定质量的理想气体从状态A 变化到状态B 再变化到状态C ,其状态变化过程的p -V 图象如图6所示.已知该气体在状态A 时的温度为27 ℃,求:图6(1)该气体在状态B 、C 时的温度;(2)该气体从状态A 到状态C 的过程中与外界交换的热量. 答案 (1)-173 ℃ 27 ℃ (2)200 J解析 (1)对于理想气体,A →B 是等容变化,由查理定律得p A T A =p B T B ,即T B =p Bp A T A =100 K ,所以t B =T B -273 ℃=-173 ℃,B →C 是等压过程,由盖—吕萨克定律V B T B =V C T C 得T C =V CV B T B=300 K ,所以t C =27 ℃.(2)状态A 、C 温度相等,ΔU =0,A →C 的过程中,由热力学第一定律ΔU =Q +W 得Q =-W ,在整个过程中,气体在B 到C 过程对外做功,所以W =-p ΔV =-1×105×2×10-3 J=-200 J ,故Q =200 J ,即气体从外界吸热200 J.。