【中学思维导图】图解苏教版高中化学选修4化学反应原理
- 格式:pdf
- 大小:1.04 MB
- 文档页数:7

第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2018·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )A.增加压强B.降低温度 C.增大CO的浓度 D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2018·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )[:A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2018山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1∆H < 0 (I)2NO(g)+Cl2(g)2ClNO(g) K2∆H < 0 (II)(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入 NO和 Cl2,10min时反应(II)达到平衡。



第二章化学反应速率和化学平衡第四节化学反应进行的方向【思维导图】【微试题】1.(2010·杭州第一次质量检测)下列说法中正确的是( )A.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应C.熵增加且放热的反应一定是自发反应D.非自发反应在任何条件下都不能发生【答案】C2.对于反应:4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=- kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对该反应的方向起决定作用的是( ) A.焓变 B.温度 C.压强 D.熵变【答案】A3.高温下,某反应达平衡,平衡常数K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)],恒容时,温度升高,H2浓度减小,下列说法正确的是( )A.该反应的焓变为正值B.恒温恒容下,增大压强,H2浓度一定减小C.升高温度,逆反应速率减小D.该反应的化学方程式为CO+H2OCO2+H2【答案】A4.(2012·海南高考·15) 已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:回答下列问题:(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和的B,如反应初始6s内A的平均反应速率υ(A)= mol·L-1·s-1。
,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):a.压强不随时间改变 b.气体的密度不随时间改变c. c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为。

化学选修四化学反应原理第一章第一节化学反应与能量的变化一、焓变反应热焓(ΔH),单位:kJ/mol当ΔH>0时,为吸热反应;当ΔH<0时,为放热反应ΔH=断键时吸收的总能-生成物成键时放出的总能二、热化学方程式:表示参加反应物质的量和反应热的关系的化学方程式第二节燃烧热能源燃烧热:101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量单位:kJ/mol第三节化学反应热的计算盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关第二章第一节、学反应速率:单位时间内反应物或生成物的浓度(常用物质的量的浓度)变化来表示这个反应的速率第二节、影响化学反应速率的因素一、浓度对反应速率的影响:反应物浓度增大,反应速率增大(只适用于气体或液体的反应)二、压强对反应速率的影响(气体):增大压强,反应速率加快三、温度对反应速率的影响:升高温度反应速率增大第三节、化学平衡一、逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
二、化学平衡状态:可逆反应的正、逆两个方向的反应速率相等。
(逆、等、定、动、变、同)三、勒夏特列原理:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。
四、化学平衡常数(K):生成物浓度幂之积与反应物浓度幂之积的比值。
(只受温度影响)五、自发反应:在一定条件下,不需外界帮助就能自动进行的反应第三章第一节、弱电解质的电离:加水、升温促进电离,多元弱酸分布电离第二节、的电离和溶液的酸碱性一、的离子积常数(K w):室温下为1.0×10-14二、基橙变色范围:3.1~4.4石蕊变色范围:5.0~8.0酚酞变色范围:8.2~10.0第三节、盐类的水解:有弱就水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。
第四章第一节、原电池(条件:两个电极活泼性不同,有电解质溶液并形成回路)原电池的总反应相当于电解质溶液与负极的反应第二节、化学电源一、一次电池:锌锰干电池、锌银电池、锂电池二、二次电池:铅蓄电池三、燃料电池第三节、电解池一、当离子到达电极时,就失去或获得电子,发生氧化还原反应,这个过程叫做放电。

普通高中化学
(山东科学技术出版社)
化学反应原理(第1章化学反应与能量转化)
思维导图
史学强
2014年10月18日
你是否发现笔记记得越多,思维也越混乱?你是否经常为琐事缠身而苦无分身之术?你是否总是感叹一天的时间太少?思维导图来了!它可以“解救”你!
思维导图是一种终极思维工具,由英国“记忆之父”东尼·博赞发明,并在全球得到广泛推广,已成为21世纪风靡全球思维工具,到目前已被世界上2.5亿人所使用。
思维导图注重开发人的左、右脑,运用线条、符号、词汇和图像,把一长串枯燥的信息变成彩色的、容易记忆的、有高度组织性的图,它绘制起来非常简单,而且十分有趣!它可以帮助人们改善思维,提高记忆力和办事效率。
关键词:高中化学化学反应原理电解池盖斯定律反应热原电池史学强
本资料利用思维导图整理高中化学《化学反应原理》第一章章中每一节基础知识,可以帮助大家增强记忆、改善思维、提高化学学习效率!
化学反应与能量转化
1-1化学反应的热效应
1-2电能转化为化学能——电解
1-3化学能转化为电能——电池。

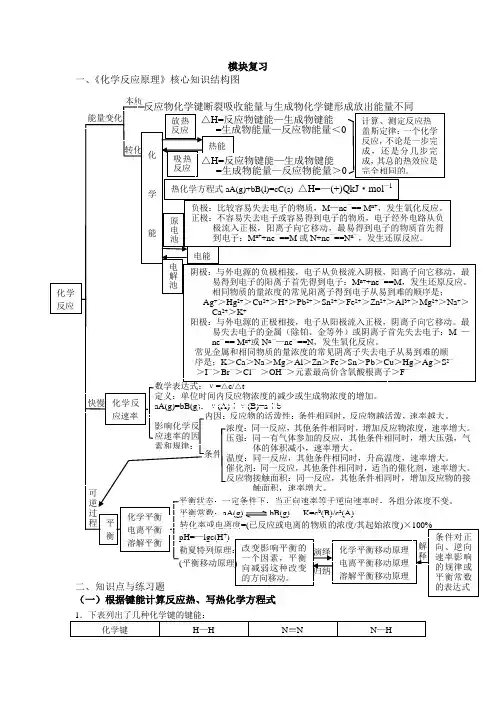
模块复习一、《化学反应原理》核心知识结构图键能/kJ·mol—1436 946 393 298K时氮气跟氢气反应的热化学方程式正确的是A.N2(g)+3H2(g)===2NH3(g) △H=—104kJ·mol—1B.N2+3H2===2NH3△H=—104kJ·mol—1C.N2(g)+H2(g)===NH3(g) △H=+989kJ·mol—1D.N2(g)+3H2(g)===2NH3(g) △H=+989kJ·mol—1(二)盖斯定律的应用2.100g C不完全燃烧所得产物中,CO所占体积为1/3,CO2为2/3,且:C(s)+ 12O2(g)═ CO(g)△H = -110.35 k J·mol-1CO(g)+ 12O2(g)═ CO2(g)△H = -282.57 k J·mol-1与这些碳完全燃烧相比,损失的热量为A.39.292 kJ B.3274.3 kJ C.784.92 kJ D.2489.44 kJ(三)原电池的工作原理,书写化学电源的电极反应式,金属的电化学腐蚀3.关于原电池的叙述中,错误的是A.构成原电池正极和负极的必须是两种不同的金属B.原电池是将化学能转化为电能的装置C.在原电池中,电子流出的一极是负极,发生氧化反应D.原电池放电时,电流的方向是从负极到正极4.右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2 =2CO2 +4H2O 。
下列说法正确的是:A.左电极为电池的负极,a处通入的物质是甲醇B.右电极为电池的负极,b处通入的物质是空气C.负极反应式为:CH3OH +H2O-6e—=CO2 +6H+D.正极反应式为:O2 +2H2O +4e—=4OH―5.以下现象与电化腐蚀无关的是A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎为纯铁)容易生锈C.铁质器件附有铜质配件,在接触处易生铁锈D.银质奖牌长期放置后在其奖牌的表面变暗(四)电解原理及电极反应式的书写6.用铂作电极电解一定浓度的下列物质的水溶液。