第4节-波尔理论
- 格式:ppt
- 大小:441.50 KB
- 文档页数:16



氢原子光谱(Hydrogen spectral series)卢瑟福的行星模型的困难根据卢瑟福的原子模型,电子像太阳系的行星围绕太阳转一样围绕着原子核旋转。
但是根据经典电磁理论,这样的电子会发射出电磁辐射,损失能量,以至瞬间坍缩到原子核里。
这与实际情况不符,卢瑟福无法解释这个矛盾。
卢瑟福模型遇到的困难实际上是利用经典力学和经典电磁学描述原子的困难,这时候就要利用一种新的方法——量子力学来研究原子。
量子论的提出1900年德国物理学家普朗克(M.Planck)在研究黑体辐射时,为解释辐射能量密度与辐射频率的关系,冲破经典力学的束缚,提出能量量子化的概念。
他认为辐射物体其辐射能的放出式吸收不是连续的,而是一份一份地放出或吸收,每一份辐射能——量子——所代表的能量取决于辐射物体中原子的振荡频率ν即E=hν 。
式中h为普朗克常数,等于6.6262 ×10-34J.S。
1905年德国物理学家爱因斯坦(A.Einstein)为解释光电效应而推广了普朗克的量子概念,认为不仅振荡的原子能量是量子化,而辐射能本身也是量子化的,辐射能也是由一份一份的量子组成的,辐射能和量子也称为光子,提出了光子学说。
建立了量子理论。
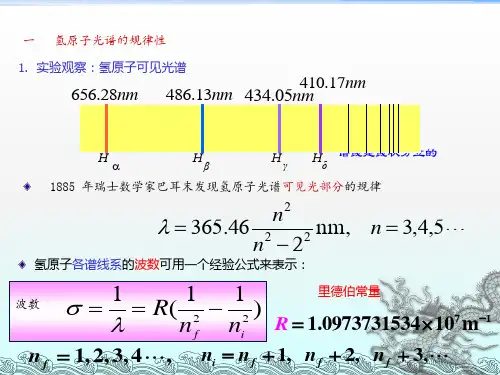
氢原子光谱(Hydrogen spectral series)光和电磁辐射1865年麦可斯韦(J.C.Maxwell)指出光是电磁波,即是电磁辐射的一种形式。
电磁辐射包括无线电波、TV波、微波、红外、可见光、紫外X射线、γ射线和宇宙射线。
可见光仅是电磁辐射的一小部分,波长范围是400nm(紫光)至700nm(红光)。
(如右图)太阳光或白炽灯发出的白光,通过玻璃三棱镜时,所含不同波长的光可折射成红、橙、黄、绿、青、蓝、紫等没有明显分界线的光谱,这类光谱称为连续光谱。
当气体原子被激发得到的是分立的、有明显分界的谱线,这类光谱称为不连续光谱或线状光谱。

2020-2021学年高二物理人教版选修3-5课后作业:第十八章第4节玻尔的原子模型含解析A组:合格性水平训练1.(玻尔原子理论)(多选)下列说法中正确的是()A.氢原子处于基态时,能级最低,状态最稳定B.氢原子由高能级向低能级跃迁后,动能和电势能都减小C.玻尔理论成功解释了氢原子光谱的分立特征D.光子的能量大于氢原子基态能量绝对值时,不能被氢原子吸收答案AC解析原子在不同状态中具有不同的能量,能量最低的状态叫基态。
所以基态能量最低、状态最稳定,A正确;氢原子由高能级向低能级跃迁后,动能增大,电势能减小,B错误;玻尔在普朗克关于黑体辐射的量子论和爱因斯坦关于光子的概念的启发下把微观世界中物理量取分立值的观点应用到原子系统,成功解释了氢原子光谱的分立特征,C正确;当光子能量大于氢原子基态电离能时,氢原子吸收后发生电离,D错误。
2.(氢原子能级跃迁)一群氢原子处于同一较高的激发态,它们向较低激发态或基态跃迁的过程中()A.可能吸收一系列频率不同的光子,形成光谱中的若干条暗线B.可能发出一系列频率不同的光子,形成光谱中的若干条亮线C.只吸收频率一定的光子,形成光谱中的一条暗线D.只发出频率一定的光子,形成光谱中的一条亮线答案B解析当原子由高能级向低能级跃迁时,原子将发出光子,由于不只是两个特定能级之间的跃迁,所以它可以发出一系列频率的光子,形成光谱中的若干条亮线,B正确,A、C、D错误.3.(综合)(多选)如图所示为氢原子的能级示意图,一群氢原子处于n=3的激发态,在自发跃迁中放出一些光子,用这些光子照射逸出功为2.25 eV的钾,下列说法正确的是()A.这群氢原子能发出三种不同频率的光B.这群氢原子发出的光子均能使金属钾发生光电效应C.金属钾表面逸出的光电子最大初动能一定小于12。
09 eV D.金属钾表面逸出的光电子最大初动能可能等于9。
84 eV E.氢原子发出光子后其核外电子动能变小答案ACD解析根据C错误!=3知,这群氢原子能辐射出三种不同频率的光子,从n=3能级向n=2能级、从n=2能级向n=1能级和从n =3能级向n=1能级跃迁发出不同频率的光,所以A正确。

玻尔的氢原⼦理论§4. 玻尔的氢原⼦理论⼀玻尔(1885-1962)丹麦物理学家尼尔斯·玻尔,⽣于丹麦哥本哈根的⼀个富裕知识分⼦家庭,⽗亲是哥本哈根⼤学⽣理学教授。
1903年进⼊哥本哈根⼤学数学和⾃然科学系,⼤学⼆年级时他热中于研究⽔的表⾯张⼒问题,并在丹麦皇家科学院的有奖征⽂中容获⾦质奖章,1909年获硕⼠学位,1911年以论⽂《⾦属电⼦论的研究》获博⼠学位。
1911年9⽉,他到英国剑桥卡⽂迪什实验室进修,据说他第⼀次与导师J.J.汤姆孙见⾯时,就把他论⽂中批评汤姆孙的段落当⾯指出,使导师很不⾼兴,因⽽给以冷遇。
1912年3⽉转到了曼彻斯特随卢瑟福⼯作,这成了他⼀⽣的重要转折点。
玻尔在卢瑟福实验室⼯作期间(约4个⽉),正值卢瑟福发表有核原⼦理论,并组织对这⼀理论进⾏检验。
玻尔参加了α粒⼦散射实验⼯作,因此清楚这⼀理论所⾯临的困难。
但玻尔坚信卢瑟福有核原⼦模型的正确性,认为“只有量⼦假说是摆脱困难的唯⼀出路”。
1913年提出著名的玻尔原⼦理论。
1916年任哥本哈根⼤学教授,1921年起⼀直领导着该校为他建⽴的理论物理研究所,直到去世。
玻尔于1916年、1927年分别提出对应原理和互补原理,1936年提出原⼦核的液滴核模型,1939年创⽴核裂变理论,预⾔铀的⾃⾝裂变。
曾参加第⼀颗原⼦弹的制造。
1922年因对原⼦结构和原⼦辐射的研究⽽获得诺贝尔物理学奖。
⼆玻尔的氢原⼦理论1.汉森的拜访1912年7⽉回到哥本哈根,1913年初,玻尔的好友、光谱学家汉森(H.M.Hansen)在拜访玻尔时问到原⼦结构和光谱学中的谱线有什么关系?并向玻尔详细介绍了巴尔末的发现,以及谁也⽆法对巴尔末公式作出解释。
2.斯塔克的启⽰1913年2⽉玻尔注意到德国物理学家斯塔克(J.Stark)在《原⼦动⼒学原理》⼀书中的⼀段话:“⼀个光谱的全部谱线是由单独⼀个电⼦造成的,是在这个电⼦从⼀个(⼏乎)完全分离的状态逐次向势能最⼩的状态跃迁过程中辐射出来的。


1第4节 氢原子光谱 玻尔理论一、 氢原子光谱,422-=n n B λ∞=,,5,4,3 nA =7.3645B αH βH γH ∞H ,∞→nB =∞λ巴耳末系,:线系极限∞H =:线系极限波长B =∞λA 7.3645波数:沿波线单位长度内波的个数 ν~cνλν==1~λ )121()121(441(1411~2222222nR n B n B n n B -=-=-=-==λν,5,4,3=n 里德伯公式:里德伯恒量1710096776.14-⨯==m BR 帕邢系:, )131(1~22n R -==λν,6,5,4=n 原子光谱实验规律:“原子光谱都是彼此分立的线状光谱,每一条光谱线的波数由 两个光谱项的差值决定” 里兹并合原理,, )()(~n T k T -=νN k n ∈,k n >、:光谱项)(k T )(n T 氢原子:,2)(k R k T =2)(nRn T =碱金属原子:,2)()(α+=k R k T 2)()(β+=n Rn T 、都给定,给出一条光谱线的波数k n 一定,所有的取值对应的谱线构成一个谱线系 k n 不同,给出不同的谱线系 k二、 玻尔理论1、 原子的有核模型1911,卢瑟夫,粒子散射实验α 有核模型 与经典理论矛盾 按照经典理论: 原子光谱应是连续的,原子是不稳定的2、 玻尔的氢原子理论c2(1) 定态假设:原子只能处在一系列具有不连续能量的 稳定状态:定态,不辐射电磁波 定态1, 定态2,,, , 1E 2E , 轨道1, 轨道2, ,(2) 跃迁假设:的定态的定态 n E →k E 光子频率 hE E nk -=ν <,吸收一个光子,>,放出一个光子n E k E n E k E (3)角动量量子化假设:电子绕核转动的角动量:, n hnL ==π2 ,3,2,1=n:量子数n :约化普朗克常数,SI :=π2h = π2h= Js 341005.1-⨯三、 氢原子结构和氢原子光谱 1、 轨道半径(1) 20224r e r V m πε= (2),n mVr L == ,3,2,1=n (,)V m r P r L⨯=⨯=θθsin sin rmV rP L == ,, 222023141 n r e mr πε=22204n me r ⋅= πε ,3,2,1=n , 1=nA ==529.042201mer πε ,2=n 2122⋅=r r ,3=n2133⋅=r r21n r r n ⋅=<<<321r r r :玻尔半径A =529.01r 结论:电子的轨道半径是量子化的 2、 定态能量,, r e mV E 022421πε-=20224r e r V m πε=r e mV 022821πε= ,210202188n r e re E ⋅-=-=πεπε ,3,2,1=nVm e3,,,1=n eV r e E 6.1381021-=-=πε2=n eV E E 4.32/212-== ,,3=n ,51.13/213eV E E -== 21/n E E n =<<<321E E E 的定态:基态,的定态,激发态 1=n 1>n 结论:氢原子的定态能量是量子化的 每一个定态能量称为一个能级∞=n4=n51.1-3=neV 4.3-2=neV 6.13-1=n3、 氢原子光谱氢原子 ,n E →k E k n >辐射光子频率==h E E k n -=ν)(12121k E n E h -)11(221nk h E -- 波数, ==c νν~11(221n k hc E --k n > 令,, hc E R 1-===λν1~)11(22n k R -k n >= hcER 1-=1710097373.1-⨯m 例:赖曼系中波长最短的谱线光子能量是多少? 答:eV 6.13例:巴耳末系中波长最短的谱线光子能量是多少? 答:eV 4.3例:写出氢原子光谱各谱线系的极限波数表达式解:,, ==λν1~11(22n k R -∞→n 2)(~k R =∞ν赖曼系 (), = 1=k R =∞)(~赖ν1710097.1-⨯m 巴耳末系(), 2=k 1710274.04)(~-⨯==∞m R 巴ν5=n 赖曼系4四、 玻尔理论的缺陷氢原子及 类氢离子光谱 , ,, H +He +2Li +3Be Z= 1, 2, 3, 4碱金属元素的原子光谱,光谱的精细结构 塞曼效应,谱线宽度、强度、偏振逻辑上,玻尔理论自相矛盾 认识原子结构的里程碑 “定态”、“能级”、“跃迁” 例:氢原子由量子数为的定态()的定态 n →1-n 求:(1)辐射光子频率1-→n n ν (2)很大时,n 1-→n n νn ν≈:电子在第轨道上的转动频率n νn 解:(1)= 1-→n n ν22121211)1(12])1([1n n n h E n E n E h h E E n n --⋅-=--=--= ()22102)1(128n n n h r e --⋅πε10218r e E πε-= (2)= () n νn n n n n r mV mV r V ππ222=20224nn n r e r V m πε== (,) 31020214214nh r e n r e n ⋅=⋅πεππε n r mV n n =21n r r n ⋅= 很大时,== n 1-→n n ν22102)1(128n n n h r e --⋅πε310214nh r e ⋅≈πεn ν对应原理:当量子数很大时,量子方程应过渡到经典方程 n 经典理论是量子理论在很大时的极限 n 例:氢原子某谱线系的极限波长为,其中一条谱线A 3647 波长为A 6565求:该谱线对应的氢原子初态和末态的能级能量 ()1710097.1-⨯=m R 解:,,, ==λν1~11(22n k R -∞→n 21k R =∞λ2==∞λR k ,,= =λ1)121(22n R -221211n R -=λR nλ14112-=R R λλ44-344=-=R Rn λλ 初态,3=n eV E E 51.13/213-==末态,2=n eV E E 4.32/212-==。

第四节、玻尔的原子模型【自主学习】一、经典理论的困难1、电子绕原子核做圆周运动辐射能量,最终栽入,原子寿命很短,但事实并非如此。
2、随着电子绕原子核运动的能量越来,转动也越来越,这个变化是,我们应该看到各种频率的的光,即原子的光谱应该是,而实际上原子光谱是。
二、玻尔理论的基本假设1、玻尔理论的基础及实验依据(1)在卢瑟福学说的基础上(2)普朗克关于黑体辐射和爱因斯坦关于的概念(3)光谱学,特别是氢光谱实验中测得的各种数据2、轨道假设与定态假设(1)玻尔认为,电子运行轨道的半径不是任意的,只有当半径的大小符合一定条件时这样的轨道才是可能的。
也就是说电子在这些轨道上绕核的转动是,不产生。
(2)当电子在不同的轨道上运动时原子处于不同的状态。
玻尔指出,原子在不同的状态中具有不同的能量,因此,,这些量子化的能量值叫做。
原子中这些具有确定能量的稳定状态称为。
能量最低的状态叫做。
其他的状态叫做。
(3)频率条件(跃迁假设)当电子从能量较高的定态轨道(其能量记为Em)跃迁到能量较低的定态轨道(能量记为En,m>n)时,会放出能量为hν的光子(h是普朗克常量),这个光子的能量由前后两个能级的能量差决定,即,这个式子被称为频率条件,又称。
反之,当电子光子时会从较低的能量态跃迁到较高的能量态,这个光子的能量同样由决定。
三、玻尔理论的成功—解释氢光谱的规律(1)氢光谱的规律:(2)解释:四、玻尔理论的局限简述(1). 局限性:(2).量子力学基础上的原子理论观点:【典型例题】例题 1、下面关于玻尔理论的解释中,不正确的说法是()A、原子只能处于一系列不连续的状态中,每个状态都对应一定的能量B、原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量C、原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子D、原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的例题2.对玻尔理论的评论和议论,正确的是[]A.玻尔理论的成功,说明经典电磁理论不适用于原子系统,也说明了电磁理论不适用于电子运动B.玻尔理论成功地解释了氢原子光谱的规律,为量子力学的建立奠定了基础C.玻尔理论的成功之处是引入量子观念D.玻尔理论的成功之处,是它保留了经典理论中的一些观点,如电子轨道的概念例题3.下列叙述中,哪些符合玻尔理论[]A.电子可能轨道的分布是不连续的B.电子从一条轨道跃迁到另一个轨道上时,原子将辐射或吸收一定的能量C.电子的可能轨道上绕核做加速运动,不向外辐射能量D.电子没有确定的轨道,只存在电子云【检测练习】1、对玻尔理论的下列说法中,正确的是()A、继承了卢瑟福的原子模型,但对原子能量和电子轨道引入了量子化假设B、对经典电磁理论中关于“做加速运动的电荷要辐射电磁波”的观点提出了异议C、用能量转化与守恒建立了原子发光频率与原子能量变化之间的定量关系D、玻尔的两个公式是在他的理论基础上利用经典电磁理论和牛顿力学计算出来的2、下面关于玻尔理论的解释中,不正确的说法是()A、原子只能处于一系列不连续的状态中,每个状态都对应一定的能量B、原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量C、原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子D、原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的3、根据玻尔理论,氢原子中量子数N越大下列说法正确的是:()A、电子轨道半径越大B、核外电子的速率越大C、氢原子能级的能量越大D、核外电子的电势能越大4、根据玻尔的原子理论,原子中电子绕核运动的半径()A、可以取任意值B、可以在某一范围内取任意值C、可以取一系列不连续的任意值D、是一系列不连续的特定值5、按照玻尔理论,一个氢原子中的电子从一半径为ra的圆轨道自发地直接跃迁到一半径为rb的圆轨道上,已知ra>rb,则在此过程中()A、原子要发出一系列频率的光子B、原子要吸收一系列频率的光子C、原子要发出某一频率的光子D、原子要吸收某一频率的光子6、.用光子能量为E的单色光照射容器中处于基态的氢原子。

谈谈玻尔理论(河北南宫中学 张朝欣)在物理学史上,玻尔(N.Bohr )的原子原子理论是具有开创性的.㈠ 原子的核式结构对原子能量的描述电子被发现后,卢瑟福(E.Rutherford)在1909至1911年间,通过α粒子散射实验,提出了原子的的核式结构模型:在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕核旋转.核外电子和核的关系与行星和太阳的关系类似,卢瑟福将自己的学说称为行星模型. 卢瑟福认为,核外电子在核对它的库仑力的作用下,绕核做匀速圆周运动 rvmre K 222=…………………①由此可得电子动能 reKmvE k 22122==原子的内部能量为电子动能与电势能之和 电势能为 reKE P 2-= (以无穷远为势能零点,中学不要求,可参阅有关书籍)所以原子的内部总能量为reKE E E p k 22-=+=卢瑟福原子的核式结构还是很不完善的,它并没有告诉我们电子在核外是如何分布的,也不能说明不同原子的物理、化学性质不同起源于什么,这是需要进一步探讨的问题.更严重的是,它和经典物理理论不可调和的矛盾.㈡ 原子的核式结构与经典物理理论的矛盾由原子内部能量reKE 22-=可知,r 越大,能量E 越大(绝对值越小).也就是说,只要能量是确定的,则电子轨道半径就是确定的,原子的核式结构就是一个稳定的系统.但是,根据经典的电磁理论来看,情况并非如此.由麦克斯韦的电磁场理论,我们知道,变化的电场产生磁场. 电子绕核做匀速圆周运动,会在空间产生震荡变化的电场,此电场会产生同频率的震荡变化的磁场,磁场再产生电场……互相激发而产生电磁波.也就是说,电子绕核做匀速圆周运动,要辐射电磁波,辐射电磁波的频率等于电子周期运动的频率.辐射电磁波的过程,也是辐射能量的过程.伴随着电磁波的辐射,系统能量也相应减少.由reKE 22-=来看,随着能量E 的减少,电子轨道半径r 变小,最终,电子要落到原子核上.也就是说,按照经典电磁理论,原子应当是不稳定的系统,然而实际上原子是非常稳定的! 另外,按照经典电磁理论,原子辐射电磁波的频率等于电子周期运动的频率.频率rv T⋅==πγ21 ,将①解出v 代入可得32mrK e πγ=由此式可知,随着电子轨道半径r 的减小,频率γ将增大.即随着电磁波的辐射,r 将伴随着能量E 的连续减少而连续地变小,因而辐射电磁波的频率γ将连续地变大.由此可以推断,原子发光光谱应是包含一切频率的连续光谱,然而实际上原子光谱是不连续的.由以上分析可知,将我们熟悉的力学和电磁理论应用于微观的原子系统,推出的结论是原子应该是不稳定的,原子光谱应连续光谱.然而实验事实恰好相反.原子是稳定的,原子光谱是不连续的. 经典理论面临着前所未有的困难!㈢玻尔的原子理论1913年,卢瑟福的学生玻尔在原子的核式结构基础上,在普朗克的能量量子化和爱因斯坦的光子理论启发下,从原子是稳定的,原子光谱是不连续的的实验结果出发,将能量量子化的观点引入原子结构中,提出了一些基本假设,解救了原子行星模型的困境,成功地建立了氢原子理论,并为其它元素的原子结构和性质的研究奠定了基础.玻尔原子理论提出的主要假设为:⑴ 轨道量子化 能量是量子化的,原子的能量状态也是量子化的,即原子只能处于一系列不连续的能量状态中.原子的不同能量状态对应电子的不同运行轨道,由于原子的能量状态也是量子化的,因此电子的可能轨道也是不连续的.电子不能在任意半径的轨道上运行.这种现象叫轨道量子化.玻尔指出,只有满足下列条件的轨道才是可能的:轨道半径r 与电子动量mv 的乘积等于π2h 的整数倍,即 π2h nmvr =,3,2,1=n …… 为正整数,叫量子数⑵ 定态 原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的.在这些稳定状态中运动的电子虽然具有加速度,但并不向外辐射能量.这些状态叫定态.一些能量的改变,(不管是由于吸收或辐射电磁波,或由于碰撞的结果)都只能从一个定态变为另一个定态的变化(跃迁)而产生,决不能任意连续地改变.⑶ 跃迁 原子从一个能量状态m E 的定态跃迁到另一个能量状态n E 的定态时,它辐射或吸收一定频率的光子,光子的能量由这两个定态的能级差决定:m n E E h -=γ这个关系叫频率条件。
玻尔理论玻尔理论,又称玻尔原子论,是量子力学最早的发展方向之一。
它由丹麦物理学家尼尔斯·玻尔在20世纪早期提出,是对经典力学中的行星运动的类比和推广,被广泛认为是现代物理学的基石之一。
本文将详细介绍玻尔理论的基本原理、发展历程以及物理意义等方面的内容。
一、玻尔理论的基本原理玻尔理论的基本原理是,原子中的电子绕着原子核旋转并在不同的轨道上运动,每个轨道都对应一种能量状态。
这些轨道由一些固定的量子数来描述,电子在该轨道上的运动只能以某些特定的能量量子(即能量量子化)的形式存在,不能连续地进行。
玻尔理论基于下面两个假设:1.电子在原子内的运动是旋转而非运动,而且只有在确定的轨道上才能旋转;2.在该轨道上,电子的角动量是规定的,不会发生变化,电子在轨道上的能量也是规定的,不会变化。
基于上述假设,玻尔使用了量子条件来推导原子的能级结构,结果表明,电子在原子中所能具有的能量是量子化的,而且能量的量子数只能是一个自然数。
玻尔利用牛顿力学和库仑定律建立了一个简单的数学模型,这个模型用来描述电子在不同轨道上的运动状态。
这一模型成为了现代量子力学的基础之一,而且为认识原子和分子性质在物理学发展中起了关键作用。
二、玻尔理论的发展过程在19世纪晚期和20世纪初期,物理学家们已经通过研究原子光谱、电离现象和化学反应等现象展开了对原子的探索。
而这个领域的发展正是玻尔理论面世的背景和契机。
1900年,德国物理学家马克斯·普朗克提出了能量量子化的概念,从而开启了量子物理学的大门。
此后,量子理论得到了迅速的进展,但是对原子结构的理解仍然很有限。
1913年,玻尔提出了他的原子理论,用来解释原子光谱线上的谱线。
这个理论基于经典力学的公式,假设了电子在轨道上运动并将其运动状态量子化,使能量是离散的而不是连续的。
和量子力学有所不同的是,玻尔理论基于轨道和能量的概念来描述电子的运动状态,而不是以波函数的形式来描述。
随着量子力学的广泛应用和科学发展的进步,玻尔理论的内在瑕疵也逐渐显现出来。
高中物理玻尔理论教案word ---
**教案**
**科目:** 物理
**主题:** 波尔理论
**年级:** 高中
**时长:** 1节课(45分钟)
**教学目标:**
1. 了解波尔理论的基本概念和假设
2. 掌握计算电子在氢原子轨道上的能级
3. 理解氢光谱的谱线产生机制
**教学步骤:**
1. 导入(5分钟)
- 通过提问引导学生回忆原子结构和光谱的基本知识
- 引出本节课要学习的内容
2. 讲解波尔理论(15分钟)
- 介绍波尔理论的提出者和重要思想
- 讲解波尔理论的假设和基本公式
- 示意图解释电子在氢原子中的运动轨道和能级
3. 计算电子能级(10分钟)
- 带领学生进行计算电子在氢原子轨道上的能级
- 指导学生理解计算方法和结果的物理意义
4. 分析氢光谱(10分钟)
- 解释氢光谱的谱线是如何产生的
- 引出氢光谱实验的结果与波尔理论的吻合程度
5. 总结和检测(5分钟)
- 针对波尔理论和氢光谱的内容进行总结
- 布置相关思考题目和作业
**教学资源:**
- 讲义
- 演示实验器材(如示波器等)
- 计算器
**扩展练习:**
1. 计算氢原子中电子在第n层的能级
2. 查阅相关资料,了解其他原子的波尔理论推广版本
**作业:**
1. 以500字左右写一篇文章,总结波尔理论的内容和意义
2. 计算氢原子电子在第4层的能级值和能级间的能级差
---
希望这个教案范例对您有所帮助。
如果需要进一步的帮助或其他教案范例,请随时告诉我。
祝您教学顺利!。
第4节玻尔的原子模型1.丹麦物理学家玻尔提出玻尔原子理论的基本假设。
(1)定态假设:原子只能处于一系列不连续的能量状态之中,这些状态中能量是稳定的。
(2)跃迁假设:原子从一个定态跃迁到另一个定态,辐射或吸收一定频率的光子。
hν=Em-En。
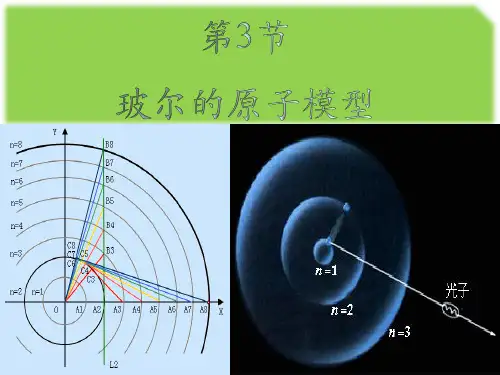
(3)轨道假设:原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应。
2.氢原子的轨道半径rn=n2r1,n=1,2,3,…氢原子的能量:En=1n2E1,n=1,2,3,…一、玻尔原子理论的基本假设1.玻尔原子模型(1)原子中的电子在库仑力的作用下,绕原子核做圆周运动。
(2)电子绕核运动的轨道是量子化的。
(3)电子在这些轨道上绕核的转动是稳定的,且不产生电磁辐射。
2.定态(1)当电子在不同轨道上运动时,原子处于不同的状态,原子在不同的状态中具有不同的能量,即原子的能量是量子化的,这些量子化的能量值叫作能级。
(2)原子中这些具有确定能量的稳定状态,称为定态。
能量最低的状态叫作基态,其他的状态叫作激发态。
3.跃迁(1)当电子从能量较高的定态轨道(其能量记为E m)跃迁到能量较低的定态轨道(能量记为E n,m>n)时,会放出能量为hν的光子,这个光子的能量由前、后两个能级的能量差决定,即hν=E m-E n,该式被称为频率条件,又称辐射条件。
(2)反之,当电子吸收光子时会从较低的能量态跃迁到较高的能量态,吸收的光子的能量同样由频率条件决定。
二、玻尔理论对氢光谱的解释1.解释巴耳末公式(1)按照玻尔理论,从高能级跃迁到低能级时辐射的光子的能量为hν=E m-E n。
(2)巴耳末公式中的正整数n和2正好代表能级跃迁之前和之后所处的定态轨道的量子数n和2。
并且理论上的计算和实验测量的里德伯常量符合得很好。
2.解释氢原子光谱的不连续性原子从较高能级向低能级跃迁时放出光子的能量等于前后两个能级差,由于原子的能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
第4节玻尔的原子模型1.丹麦物理学家玻尔提出玻尔理论的基本假设(1)定态假设:原子只能处于一系列不连续的能量状态之中,这些状态中能量是稳定的。
(2)跃迁假设:原子从一个定态跃迁到另一个定态,辐射或吸收一定频率的光子。
hν=E m-E n。
(3)轨道假设:原子的不同能量状态跟电子沿不同的圆形轨道绕核运动相对应。
2.氢原子的轨道半径r n=n2r1,n=1,2,3,…氢原子的能量:E n=1n2E1,n=1,2,3,…一、玻尔原子理论的基本假设1.玻尔原子模型(1)原子中的电子在库仑力的作用下,绕原子核做圆周运动。
(2)电子绕核运动的轨道是量子化的。
(3)电子在这些轨道上绕核的转动是稳定的,且不产生电磁辐射。
2.定态当电子在不同轨道上运动时,原子处于不同的状态,原子在不同的状态中具有不同的能量,即原子的能量是量子化的,这些量子化的能量值叫做能级,原子具有确定能量的稳定状态,称为定态。
能量最低的状态叫做基态,其他的能量状态叫做激发态。
3.跃迁当电子从能量较高的定态轨道(其能量记为E m)跃迁到能量较低的定态轨道(其能量记为E n,m>n)时,会放出能量为hν的光子,该光子的能量hν=E m-E n,这个式子被称为频率条件,又称辐射条件。
二、玻尔理论对氢光谱的解释1.解释巴耳末公式(1)按照玻尔理论,从高能级跃迁到低能级时辐射的光子的能量为hν=E m-E n。
(2)巴耳末公式中的正整数n和2正好代表能级跃迁之前和之后所处的定态轨道的量子数n和2。
并且理论上的计算和实验测量的里德伯常量符合得很好。
2.解释氢原子光谱的不连续性原子从较高能级向低能级跃迁时放出光子的能量等于前后两个能级差,由于原子的能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
三、玻尔理论的局限性1.成功之处玻尔理论第一次将量子观念引入原子领域,提出了定态和跃迁的概念,成功解释了氢原子光谱的实验规律。
4 玻尔的原子模型1.知道玻尔原子模型及能级、跃迁、激发态、基态等概念。
2.理解原子发射和吸收光子的频率与能级差的关系。
3.了解玻尔理论的成功之处和局限之处。
按照经典电磁理论的说法,只要给原子提供一定的能量,原子就会由低能量状态跃迁到高能量状态。
实际上对于某种元素的原子,只有吸收一些特定大小的能量原子才能从低能量状态向高能量状态跃迁,这是为什么呢?提示:原子只有吸收大小为两能级之差的能量才会发生跃迁。
1.玻尔原子理论的基本假设(1)轨道量子化:玻尔认为,电子绕原子核做圆周运动,服从经典力学的规律,但轨道不能是任意的,只有当半径的大小符合一定条件时,这样的轨道才是可能的。
也就是说,电子的轨道是________的。
电子在这些轨道上绕核的转动是稳定的,不产生______辐射。
(2)定态:电子在不同轨道上运动时能量是不同的,轨道的量子化势必对应着能量的量子化,这些量子化的能量值叫做______。
这些具有确定的能量稳定状态称为______,能量最低的状态叫做______。
也就是说,原子只能处在一系列________的能量状态中。
(3)频率条件:当电子从能量______的定态轨道跃迁到能量______的定态轨道时,会辐射出能量为hν的光子,这个光子的能量由前后两个能级的能量差决定,即hν=________。
反之会吸收光子。
思考:为什么原子光谱是线状谱?2.玻尔理论对氢原子光谱的解释(1)玻尔理论解释巴耳末公式:按照玻尔理论,从高能级跃迁到低能级时辐射的光子的能量为hν=E m-E n;巴耳末公式中的正整数n和2正好代表能级跃迁之前和之后的__________的量子数n和2。
并且理论上的计算和实验测量的______________符合得很好,同样,玻尔理论也很好地解释甚至预言了氢原子的其他谱线系。
(2)解释气体放电发光:气体放电管中的原子受到________________的撞击,有可能跃迁到激发态,激发态是不稳定的,会自发地向低能级跃迁,放出光子。