人教版必修一《3.2.1 钠的重要化合物》随堂练习及答案
- 格式:doc
- 大小:137.50 KB
- 文档页数:2
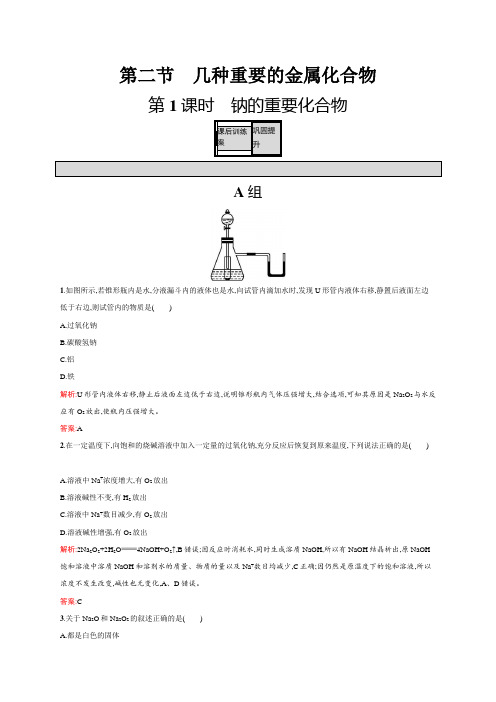
第二节几种重要的金属化合物第1课时钠的重要化合物A组1.如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向试管内滴加水时,发现U形管内液体右移,静置后液面左边低于右边,则试管内的物质是()A.过氧化钠B.碳酸氢钠C.铝D.铁解析:U形管内液体右移,静止后液面左边低于右边,说明锥形瓶内气体压强增大,结合选项,可知其原因是Na2O2与水反应有O2放出,使瓶内压强增大。
答案:A2.在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是()A.溶液中Na+浓度增大,有O2放出B.溶液碱性不变,有H2放出C.溶液中Na+数目减少,有O2放出D.溶液碱性增强,有O2放出解析:2Na2O2+2H2O4NaOH+O2↑,B错误;因反应时消耗水,同时生成溶质NaOH,所以有NaOH结晶析出,原NaOH 饱和溶液中溶质NaOH和溶剂水的质量、物质的量以及Na+数目均减少,C正确;因仍然是原温度下的饱和溶液,所以浓度不发生改变,碱性也无变化,A、D错误。
答案:C3.关于Na2O和Na2O2的叙述正确的是()A.都是白色的固体B.都是碱性氧化物C.都能和水反应形成强碱溶液D.都是强氧化剂解析:Na2O2为淡黄色固体,A错误;Na2O2不是碱性氧化物,B错误;Na2O没有强氧化性,D错误;二者均能与水反应生成NaOH,C正确。
答案:C4.做焰色反应实验时所用的铂丝,每次用完后都要()A.用水多洗几次B.先用稀盐酸洗,再用水洗C.用稀盐酸洗,再在火焰上灼烧到没有什么颜色为止D.放在火焰上灼烧,直到铂丝发红为止解析:做焰色反应实验所用的铂丝,用完后先用稀盐酸洗,因为蘸取盐酸后灼烧,可生成金属氯化物,金属氯化物在高温时可挥发,从而除去金属离子。
答案:C5.向装有Na2O2的试管中加入一定量水,再滴入2滴酚酞溶液,振荡,下列叙述正确的是()A.加水后,用燃着的木条放到试管口,燃着的木条熄灭B.滴入酚酞溶液先变红,振荡后褪色C.滴入酚酞溶液,溶液仍为无色D.因为Na2O2与酚酞发生氧化还原反应使溶液变为红色解析:Na2O2与水发生如下反应:2Na2O2+2H2O4NaOH+O2↑,O2能使木条复燃,NaOH与酚酞作用使无色的酚酞溶液变红色,在反应过程中Na2O2表现出强氧化性,它能将红色物质氧化而褪色,故滴入酚酞溶液先变红,振荡后褪色。

1.下列对于Na2O、Na2O2的比较正确的一项是()A.Na2O、Na2O2都是钠的氧化物,都是碱性氧化物B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体C.Na2O2在和CO2的反应中既是氧化剂又是还原剂D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子解析:A项:Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不是碱性氧化物;B项:Na2O2是淡黄色固体;C项:Na2O2与CO2反应时电子转移关系:,Na2O2中-1价O变成了-2价O和零价O;D项:Na2O2与H2O反应时,Na2O2中-1价O 变成了-2价O和零价O,故1 mol Na2O2转移1 mol电子。
答案:C2.下列叙述中正确的是()A.等物质的量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积不相同B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1 2C.NaHCO3能转化成Na2CO3,但Na2CO3不能转化成NaHCO3 D.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3结晶析出解析:A项,根据碳原子守恒,等物质的量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同;B项,发生反应:CO2-3+H+===HCO-3,不生成CO2;C项,能相互转化:NaHCO3+NaOH===Na2CO3+H2O,Na2CO3+CO2+H2O===2NaHCO3;D项,向饱和Na2CO3溶液中通入足量CO2时发生反应:Na2CO3+CO2+H2O===2NaHCO3↓,反应中消耗H2O,且生成的NaHCO3溶解度小、质量多,故NaHCO3会结晶析出。
答案:D3.某无色透明溶液加入Na2O2后,有无色无味气体产生,同时产生白色沉淀,原溶液中可能含有的离子是()A.Cu2+B.Mg2+C.Ba2+D.Fe3+解析:在溶液中Cu2+、Fe3+均有颜色,故可排除A、D两项。

课堂练习1.下列判断正确的是( )A.可用水来确定某Na2O粉末中是否含有Na2O2B.可用CO2来确定某Na2O粉末中是否含有Na2O2C.可利用在空气中加热的方法除去Na2O中的Na2O2D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色2.关于Na2CO3和NaHCO3性质的说法不正确的是( )A.热稳定性:NaHCO3<Na2CO3B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同3.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )A.溶液呈碱性B.与澄清石灰水反应产生白色沉淀C.与足量盐酸反应放出气体D.受热易分解4.(双选)有关钠的化合物的叙述正确的是( )A.在饱和碳酸钠溶液里通入二氧化碳会出现浑浊B.NaOH、Na2CO3、NaHCO3均呈碱性,所以可以共存C.在CaCl2溶液中滴入少量NaHCO3溶液无沉淀,再滴少量NaOH溶液出现沉淀D.36.0 g水中投入6.2 g Na2O所得溶液的溶质质量分数为14.7%5.下列关于焰色反应的叙述正确的是( )A.五颜六色的焰火是物质本身燃烧的颜色B.氢气、硫等在氧气中燃烧时有颜色,这也是焰色反应C.某无色溶液进行焰色反应,透过蓝色钴玻璃可观察到火焰呈紫色,则可证明溶液中的阳离子一定只含有K+D.焰色反应是某种金属元素灼烧时所具有的特殊颜色,是物理变化6.(双选)过氧化钠可作为氧气的。
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(N A表示阿伏加德罗常数)( )7.在溶液中加入足量22A.NH+4、Ba2+、Cl-、NO-3B.K+、Na+、Cl-、SO2-4C.Ca2+、Mg2+、NO-3、HCO-3D.Na+、Cl-、CO2-3、SO2-38.下列离子方程式正确的是( )A.过氧化钠投入水中:O2-2+2H2O===4OH-+O2↑B.CO2通入Na2CO3溶液中:CO2+CO2-3+H2O===2HCO-3C.澄清石灰水中通入足量的CO2:Ca2++2OH-+CO2===CaCO3↓+H2OD.小苏打溶液中加入过量的石灰水:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O9.右图表示A~E五种物质的转化关系。

此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合看比例,答案解析附后。
课时达标训练1.(2017·武汉高一检测)下列判断正确的是( )A.可用水来确定某Na2O粉末中是否含有Na2O2B.可用CO2来确定某Na2O粉末中是否含有Na2O2C.Na2O比Na2O2稳定D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色【解析】选A。
CO2、H2O与Na2O2、Na2O均能反应,且CO2、H2O 与Na2O2反应时能产生O2,因O2、CO2均是无色无味的气体,故Na2O2与CO2的反应无明显现象,而Na2O2与水反应会产生气泡,有明显的现象,所以A项正确,B项错误;Na2O在空气中加热时会转化为Na2O2,故Na2O2比Na2O稳定,C项错误;Na2O、Na2O2加到酚酞溶液中,二者均先与溶液中的水反应生成碱而使溶液变为红色,但Na2O2具有漂白性,又会将红色溶液漂白,D项错误。
2.下列金属化合物中最方便用于潜水艇舱内供氧的是( )A.KMnO4B.KClO3C.KNO3D.Na2O2【解析】选D。
题中KMnO4、KClO3(加入催化剂)只能在加热条件下分解生成氧气,而硝酸钾加热生成氧气的同时还生成二氧化氮气体,都不适合用于潜水艇舱内供氧,而过氧化钠常温下易与二氧化碳、水反应生成氧气,可用于潜水艇舱内供氧。
3.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )A.加热时有无气体放出B.滴加盐酸时有无气泡放出C.溶于水后,滴加稀的氯化钙溶液看有无白色沉淀生成D.溶于水后,滴加澄清石灰水,看有无白色沉淀生成【解析】选C。
碳酸氢钠加热易分解,而碳酸钠加热不分解,无法检验是否含有碳酸钠,A错误;二者都能与盐酸反应生成二氧化碳气体,无法检验是否含有碳酸钠,B错误;溶于水后,滴加稀的氯化钙溶液,只有碳酸钠与氯化钙反应生成沉淀,可鉴别,C正确;二者都能与澄清石灰水反应生成碳酸钙沉淀,无法检验是否含有碳酸钠,D错误。

2021年高中化学 3-2-1钠的重要化合物课堂练习新人教版必修1 1.下列判断正确的是( )A.可用水来确定某Na2O粉末中是否含有Na2O2B.可用CO2来确定某Na2O粉末中是否含有Na2O2C.可利用在空气中加热的方法除去Na2O中的Na2O2D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色2.关于Na2CO3和NaHCO3性质的说法不正确的是( )A.热稳定性:NaHCO3<Na2CO3B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同3.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )A.溶液呈碱性B.与澄清石灰水反应产生白色沉淀C.与足量盐酸反应放出气体D.受热易分解4.(双选)有关钠的化合物的叙述正确的是( )A.在饱和碳酸钠溶液里通入二氧化碳会出现浑浊B.NaOH、Na2CO3、NaHCO3均呈碱性,所以可以共存C.在CaCl2溶液中滴入少量NaHCO3溶液无沉淀,再滴少量NaOH溶液出现沉淀D.36.0 g水中投入6.2 g Na2O所得溶液的溶质质量分数为14.7%5.下列关于焰色反应的叙述正确的是( )A.五颜六色的焰火是物质本身燃烧的颜色B.氢气、硫等在氧气中燃烧时有颜色,这也是焰色反应C.某无色溶液进行焰色反应,透过蓝色钴玻璃可观察到火焰呈紫色,则可证明溶液中的阳离子一定只含有K+D.焰色反应是某种金属元素灼烧时所具有的特殊颜色,是物理变化6.(双选)过氧化钠可作为氧气的来源。
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(N A表示阿伏加德罗常数)( )二氧化碳碳酸钠转移的电子A 1 mol N AB 22.4 L 1 molC 106 g 1 molD 106 g 2N A7.22A.NH+4、Ba2+、Cl-、NO-3B.K+、Na+、Cl-、SO2-4C.Ca2+、Mg2+、NO-3、HCO-3D.Na+、Cl-、CO2-3、SO2-38.下列离子方程式正确的是( )A.过氧化钠投入水中:O2-2+2H2O===4OH-+O2↑B.CO2通入Na2CO3溶液中:CO2+CO2-3+H2O===2HCO-3C.澄清石灰水中通入足量的CO2:Ca2++2OH-+CO2===CaCO3↓+H2OD.小苏打溶液中加入过量的石灰水:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O9.右图表示A~E五种物质的转化关系。

2019年高中化学第三章第二节第1课时钠的重要化合物练习(含解析)新人教版必修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高中化学第三章第二节第1课时钠的重要化合物练习(含解析)新人教版必修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高中化学第三章第二节第1课时钠的重要化合物练习(含解析)新人教版必修1的全部内容。
1.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )A.最后溶液变蓝色B.溶液先变蓝色后褪色C.溶液仍为紫色D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生解析:Na2O2先与H2O反应生成NaOH和H2O2,H2O2再分解生成O2,NaOH使紫色石蕊溶液变蓝色;中间产物H2O2有强氧化性,会慢慢将蓝色的石蕊氧化为无色物质,所以最后溶液变为无色。
答案:B2.2。
6 mol过氧化钠与3。
0 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()A.Na2CO3B.Na2O2、Na2CO3C.NaOH、Na2CO3D.Na2O2、NaOH、Na2CO3答案:C3.为除去括号内的杂质,所选用的试剂或方法不正确的是()A.Na2CO3溶液(NaHCO3),加入适量的NaOH溶液B.NaHCO3溶液(Na2CO3),通入过量的CO2气体C.Na2O2粉末(Na2O),将混合物在氧气中加热D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤解析:Ba(OH)2+Na2SO4===BaSO4↓+2NaOH,虽除去了Na2SO4,但又增加了新的杂质NaOH,并且Na2CO3溶液也能与Ba(OH)2溶液反应.答案:D4.欲除去NaHCO3溶液中的少量Na2CO3,最好的方法是( )A.加适量澄清石灰水B.加适量NaOH溶液C.加适量的盐酸D.通入足量的CO2答案:D5.Na2CO3和NaHCO3是重要的化工原料,请回答:(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别为__________________,__________________。
3-2-1钠的重要化合物每课一练(人教版必修1)一、选择题(每小题3分,共39分。
每小题有1~2个正确选项)1. 下列叙述中正确的是()①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2③Na2O主要有氧化性,Na2O2主要有还原性④Na2O2可作供氧剂,而Na2O不能⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物A. 都正确B. ②③④⑤C. ②③⑤D. ④⑤解析:Na2O是NaOH的碱性氧化物,但Na2O2与水反应时还生成O2,不是碱性氧化物;Na2O2与CO2的反应不符合置换反应的特点;Na2O2有强氧化性,因其中-1价O易得电子变为其稳定价态-2价,而Na2O的氧化性、还原性都很弱。
答案:D2. 2.3 g纯净金属钠在干燥空气中被氧化后得到3.5 g固体,由此可判断其氧化产物是()A. 只有Na2OB. 只有Na2O2C. Na2O和Na2O2D. 无法确定解析:由Na―→Na2O和由Na―→Na2O2分别计算之。
2Na ~Na2O2×23 622.3 g3.1 g2Na ~Na2O22×23 782.3 g3.9 g因3.1 g<3.5 g<3.9 g ,故氧化产物二者皆有。
答案:C3.1 mol 过氧化钠与2 mol 碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )A .Na 2CO 3B .Na 2O 2 Na 2CO 3C .NaOH Na 2CO 3D .Na 2O 2 NaOH Na 2CO 3解析:由题意可知,首先发生反应:2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑,生成H 2O 和CO 2各1 mol ;然后H 2O 和CO 2与Na 2O 2反应:2Na 2O 2+2H 2O===4NaOH +O 2↑,2Na 2O 2+2CO 2===2Na 2CO 3+O 2,CO 2和H 2O 完全反应需消耗2 mol Na 2O 2,但题中只有1 mol Na 2O 2,应优先考虑与CO 2的反应:1 mol Na 2O 2先与1 mol CO 2反应,生成1 mol Na 2CO 3和0.5 mol O 2。
一、选择题(本题包括5小题,每小题4分,共20分)1.关于Na2O和Na2O2的叙述正确的是()A.都是白色的固体B.都是碱性氧化物C.都能和水反应形成强碱溶液D.都是强氧化剂解析:Na2O是白色固体,Na2O2是淡黄色固体;Na2O是碱性氧化物,Na2O2不是碱性氧化物;Na2O2是强氧化剂,Na2O不是。
C正确。
答案:C2.下列对于过氧化钠的叙述中,正确的是()A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物B.过氧化钠能与水反应,所以过氧化钠可以作很多气体的干燥剂C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂解析:A项:产物中还有O2生成,故不是碱性氧化物,B项,Na2O2与H2O反应产生O2,故不能作干燥剂,Na2O2与水、CO2的反应中,Na2O2既是氧化剂又是还原剂。
D项正确。
答案:D3.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是()A.只含Na+B.一定含Na+,可能含有K+C.既含有Na+,又含有K+D.可能含有Na+,可能还含有K+解析:钠的焰色是黄色,K的焰色是紫色,观察K的焰色时需要透过蓝色钴玻璃,以滤去黄色光的干扰,该实验中没有通过蓝色钴玻璃观察说明一定含Na+,不能确定是否含K+。
答案:B4.①纯净的碳酸钠a g;②碳酸钠与碳酸氢钠的混合物a g,两者相比下列各种情况的描述正确的是( )A .分别和盐酸完全反应时,混合物的耗酸量大B .分别和盐酸完全反应时,纯净的碳酸钠放出的CO 2多C .分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大D .分别配成等体积溶液,混合物溶液中的Na +的物质的量浓度大解析:同质量的Na 2CO 3比NaHCO 3耗酸量要多,但是产生的CO 2要少,故A 、B 项均错误;同质量的两组物质,混合物含的碳元素较多,故最终转化成CaCO 3沉淀的质量就大,C 项正确;同质量的Na 2CO 3比NaHCO 3所含Na +物质的量大,故配成等体积溶液后纯净的碳酸钠溶液中的Na +物质的量浓度大,故D 项错误。
第二节几种重要的金属化合物第1课时钠的重要化合物一、选择题(每题只有一个选项符合题意,请将正确答案填入括号内)1.下列说法不正确的是( )A. Na2O2可用于呼吸面具中氧气的来源B. Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应C. Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治疗胃酸过多,制造发酵粉等D. NaCl的性质稳定,可用作调味品2.把过氧化钠投入含有HCO-3、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是( )A. HCO-3B. Cl-C. Mg2+D. Na+3.将等物质的量的Na、Na2O、Na2O2、NaOH,分别投入等质量的足量水中,所得溶液质量分数最小的是( )A. NaB. Na2OC. Na2O2D. NaOH4.下列六种物质:①Na2O、②Na2O2、③NaCl、④Na2CO3溶液、⑤NaOH、⑥NaHCO3,其中不能与CO2反应的是( )A. ①④B. ②③C. ③⑥D. ⑤⑥5.除去Na2CO3固体中少量NaHCO3的最佳方法是( )A. 加入适量盐酸B. 加入NaOH溶液C. 加热D. 配成溶液后通入CO26. 下列关于焰色反应的叙述正确的是 ( )A.五颜六色的焰火是物质本身燃烧的颜色B.氢气、硫等在氧气中燃烧时有颜色,这也是焰色反应C.某无色溶液进行焰色反应,透过蓝色钴玻璃可观察到火焰呈紫色,则可证明溶液中的阳离子一定只含有K+D.焰色反应是某种金属元素灼烧时所具有的特殊颜色,是物理变化7.把一定量的NaHCO3和Na2O2的混合物放在密闭容器中加热,关于混合物加热前后消耗HCl的物质的量,下列判断正确的是 ( ) A.加热前消耗的多 B.加热后消耗的多C.加热前和加热后消耗的一样多D.不知NaHCO3和Na2O2的含量无法确定8. 将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na 2O 2固体,Na 2O 2固体增加的质量为( )A. aB. 3a 4 gC. 3a 2 gD. 4a3 g9. 在10 mL 0.01 mol·L -1纯碱溶液中,不断搅拌并逐滴加入1.2 mL 0.05 mol·L -1盐酸,完全反应后在标准状况下生成二氧化碳的体积为 ( )A. 1.344 mLB. 2.24 mLC. 0.672 mLD. 0 mL 10.有A 、B 两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na 2CO 3和0.84 g NaHCO 3,A 、B 中分别有10 mL 相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )A. B 装置的气球膨胀的体积大B. 最终两试管中NaCl 的物质的量一定相同C. 若最终两气球体积不同,则盐酸的浓度一定小于或等于 1 mol·L -1D. 若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol·L -1二、非选择题:11.钠的化合物在生产和生活中起到重要的作用。
课时作业15钠的重要化合物时间:45分钟满分:100分,)一、选择题(每小题4分,共44分)1.(双选)有关钠的化合物的叙述正确的是()A.在饱和碳酸钠溶液里通入二氧化碳会出现浑浊B.NaOH、Na2CO3、NaHCO3均呈碱性,所以可以共存C.在CaCl2溶液中滴入少量NaHCO3溶液无沉淀,再滴少量NaOH溶液出现沉淀D.36.0 g水投入6.2 g Na2O所得溶液的溶质质量分数为14.7% 解析:A项正确,因NaHCO3的溶解度小于Na2CO3,所以在饱和Na2CO3溶液里通入CO2发生反应:Na2CO3+CO2+H2O===2NaHCO3↓,因生成溶解度更小的小苏打而出现浑浊;B项不正确,NaOH不与NaHCO3共存,它们反应生成Na2CO3,本选项中只Na2CO3与NaHCO3或Na2CO3与NaOH共存;C项正确,CaCl2溶液中加入少量NaHCO3溶液,溶液中的较多离子为Ca+、HCO-3、Na+、Cl-,离子间不反应,但加入NaOH溶液后,发生反应:HCO-3+OH-===CO2-3+H2O,生成的CO2-3与Ca2+立即反应产生碳酸钙沉淀;D项不正确,Na2O与水反应生成NaOH,其质量为8.0 g,溶质质量分数为:w(NaOH)=8.0 g(36.0 g+6.2 g)×100%=18.96%≈19%。
答案:AC2.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g则该样品的纯度(质量分数)是()A. 84w2-53w131w1 B.84(w1-w2)31w1C. 73w2-42w131w1 D.115w2-84w131w1解析:设混合物中NaHCO3的质量为x。
2NaHCO3Na2CO3+CO2↑+H2OΔm(减少) 16810662x(w1-w2)g解得x=168(w1-w2)62g,则样品的纯度为w1-168(w1-w2)62w1=84w2-53w131w1。
2014高中化学 3.2.1 钠的重要化合物随堂练习 新人教版必修1
1.(对应考点一)[双选题]关于Na 2O 2与CO 2、H 2O 反应的叙述正确的是( )
A .Na 2O 2与CO 2反应中,Na 2O 2只作还原剂,CO 2作氧化剂
B .Na 2O 2与H 2O 反应中,Na 2O 2既作氧化剂又作还原剂
C .Na 2O 2与CO 2反应中,1 mol Na 2O 2转移2 mol 电子
D .Na 2O 2与水反应中,1 mol Na 2O 2转移1 mol 电子
解析:Na 2O 2与CO 2、H 2O 反应中,既作氧化剂又作还原剂,且1 mol Na 2O 2反应均转移1 mol 电子。
故选B 、D 。
答案:BD
2.(对应考点一)1 mol 过氧化钠与2 mol 碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A .Na 2CO 3
B .Na 2O 2 Na 2CO 3
C .NaOH Na 2CO 3
D .Na 2O 2 NaOH Na 2CO 3
解析:由题意可知,首先发生反应:2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑,生成H 2O 和
CO 2各1 mol ;然后H 2O 和CO 2与Na 2O 2反应:2Na 2O 2+2H 2O===4NaOH +O 2↑,2Na 2O 2+2CO 2===2Na 2CO 3+O 2,CO 2和H 2O 完全反应需消耗2 mol Na 2O 2,但题中只有1 mol Na 2O 2,应优先考虑与CO 2的反应:1 mol Na 2O 2先与1 mol CO 2反应,生成1 mol Na 2CO 3和0.5 mol O 2。
最后残留的固体是Na 2CO 3。
答案:A
3.(对应考点二)下列叙述中正确的是( )
A .向含有CaCO 3沉淀的水中通入CO 2至沉淀恰好溶解,再向溶液中加入NaHCO 3饱和溶液,又有CaCO 3沉淀生成
B .向Na 2CO 3溶液中逐滴加入等物质的量的稀盐酸,生成的CO 2与原Na 2CO 3的物质的量之比为1∶2
C .等质量的NaHCO 3和Na 2CO 3分别与足量盐酸反应,在同温同压下,生成的CO 2体积相同
D .向Na 2CO 3饱和溶液中通入CO 2,有NaHCO 3结晶析出
解析:A 项,CaCO 3+CO 2+H 2O===Ca(HCO 3)2,产物与NaHCO 3不反应。
B 项,发生反应:CO 2-3+H +===HCO -
3,不生成CO 2。
C 项,等质量的NaHCO 3和Na 2CO 3分别与足量盐酸反应时,NaHCO 3产生的CO 2多。
D 项,向饱和Na 2CO 3溶液中通入CO 2时发生反应:Na 2CO 3+CO 2+H 2O===2NaHCO 3↓,反应中消耗H 2O ,且生成的NaHCO 3溶解度小、质量多,故NaHCO 3会结晶析出。
答案:D
4.(对应考点二)[双选题]有两个无标签的试剂瓶,分别装有Na 2CO 3和NaHCO 3固体,有四位同学为鉴别它们采用以下不同方法,其中可行的是( )
A .分别将它们配制成溶液,再加入澄清石灰水
B .分别将它们配制成溶液,再加入NaOH 溶液
C .分别将它们配制成溶液,再加入CaCl 2溶液
D .分别加热,再用石灰水检验是否有CO 2产生
解析:A 项中发生的反应分别为:Na 2CO 3+Ca(OH)2===CaCO 3↓+2NaOH,2NaHCO 3+Ca(OH)2===CaCO 3↓+Na 2CO 3+2H 2O ,两者现象相同(产生白色沉淀);B 项中只发生反应:NaHCO 3+NaOH===Na 2CO 3+H 2O ,但无明显现象;C 项Na 2CO 3与CaCl 2发生反应:Na 2CO 3+CaCl 2===CaCO 3↓+2NaCl ,产生白色沉淀,NaHCO 3与CaCl 2不反应,可以鉴别;D 项将固
体物质分别加热后,只发生反应:2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑,产生的CO 2能使澄
清石灰水变浑浊。
答案:CD
5.(实验题)将少量稀盐酸滴加到盛有碳酸钙的U 形管中,可观察到
U 形管中的脱脂棉剧烈燃烧。
(1)稀盐酸与碳酸钙反应的离子方程式是___________________
______________________________________________________。
(2)从脱脂棉的燃烧可以推出Na 2O 2与CO 2反应的结论是a.________,
b.________。
(3)Na 2O 2与CO 2反应的化学方程式是_______________________________________ ________________________________________________________________________。
还原剂是________,氧化剂是________。
解析:盐酸与碳酸钙反应放出CO 2,CO 2遇Na 2O 2也发生反应:2Na 2O 2+2CO 2===2Na 2CO 3+O 2,该反应放热,使脱脂棉的温度很容易达到其着火点,在O 2充足的条件下剧烈燃烧起来。
在上述反应中只有Na 2O 2中的氧元素的化合价发生变化,故Na 2O 2既是氧化剂,又是还原剂。
答案:(1)2H ++CaCO 3===Ca 2+
+CO 2↑+H 2O (2)反应放出O 2 反应放热
(3)2Na 2O 2+2CO 2===2Na 2CO 3+O 2 Na 2O 2 Na 2O 2。