氯化氢和盐酸
- 格式:ppt
- 大小:153.50 KB
- 文档页数:11

盐酸是氢氯酸的俗称,是氯化氢(HCl)气体的水溶液,为无色透明的一元强酸。
盐酸具有极强的挥发性,因此打开盛有浓盐酸的容器后能在其上方看到白雾,实际为氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。
盐酸(Hydrochloric acid)分子式HCl,相对分子质量36.46。
盐酸为不同浓度的氯化氢水溶液,呈透明无色或黄色,有刺激性气味和强腐蚀性。
易溶于水、乙醇、乙醚和油等。
浓盐酸为含38%氯化氢的水溶液,相对密度1.19,熔点-112℃沸点-83.7℃。
3.6%的盐酸,pH值为0.1。
中文名盐酸外文名Hydrochloric Acid系统命名氢氯酸溶质分子式HCl分子量36.46CAS号7647-01-0管制类型盐酸(*)(腐蚀)(易制毒-3)应用家居清洁、食品添加剂、皮革加工世界年产量约2000万吨含量分析纯浓度约36%-38%pKa-7熔点(℃)-35 °C沸点(℃)57 °C相对密度1.20相对蒸气密度1.26饱和蒸气压30.66(21℃)目录1首次发现2物理性质3化学性质4毒理性质5制备方法▪实验室制法6使用注意▪安全性▪操作事项▪酸雾处理▪泄漏应急处理▪消防措施▪急救措施7应用领域▪生活用途▪工业用途8测定方法9储存条件▪注意事项▪废弃处置▪运输信息1首次发现在公元800年的一个信奉伊斯兰教,名为阿布·穆萨·贾比尔·伊本·哈扬的阿拉伯化学家/炼金师,将氯化钠和硫酸混合从而第一次制取了盐酸。
贾比尔发现过许多常见的化学品,并写下了21本书来记述他的理论。
[1]2物理性质盐酸是无色液体(工业用盐酸会因有杂质三价铁盐而略显黄色),有腐蚀性,为氯化氢的水溶液,具有刺激性气味,一般实验室使用的盐酸为0.1mol/L,pH=1。
高中化学把盐酸和硫酸、硝酸、氢溴酸、氢碘酸、高氯酸合称为六大无机强酸。
氯化氢与水混溶,浓盐酸溶于水有热量放出。
溶于碱液并与碱液发生中和反应。
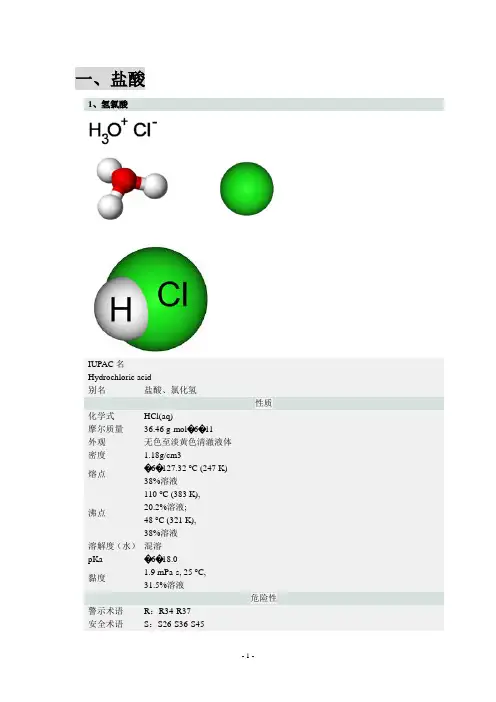
一、盐酸1、氢氯酸IUPAC名Hydrochloric acid别名盐酸、氯化氢性质化学式HCl(aq)摩尔质量36.46 g·mol�6�11外观无色至淡黄色清澈液体密度 1.18g/cm3熔点�6�127.32 °C (247 K) 38%溶液沸点110 °C (383 K), 20.2%溶液;48 °C (321 K), 38%溶液溶解度(水)混溶pKa �6�18.0黏度1.9 mPa·s, 25 °C,31.5%溶液危险性警示术语R:R34-R37安全术语S:S26-S36-S45主要危害 腐蚀性 闪点不可燃相关物质其他阴离子HF,HBr ,HI 相关酸氢溴酸,氢氟酸氢碘酸,硫酸若非注明,所有数据均出自一般条件(25 ℃,100 kPa )下。
盐酸,学名氢氯酸,是氯化氢(化学式:HCl )的水溶液,是一元酸。
盐酸是一种强酸,浓盐酸具有极强的挥发性,因此盛有浓盐酸的容器打开后能在上方看见酸雾,那是氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。
它有众多规模较小的应用,包括家居清洁,食品添加剂,除锈,皮革加工等。
世界盐酸年产量约20万吨。
盐酸是一种常见的化学品,在一般情况下,浓盐酸中氯化氢的质量分数在37%左右。
同时,胃酸的主要成分也是盐酸。
制取盐酸有许多方法: 2、实验室制取实验室中一般以浓硫酸和氯化钠反应生成氯化氢。
总反应式为:直接合成3、工业制取盐酸,很多使用两种物质直接合成盐酸。
使用这种方法制取盐酸,通常是电解饱和的氯化钠溶液,来制取氯气、氢氧化钠、氢气。
通过氯气和氢气反应可以制取氯化氢气体,溶于水后成为盐酸,反应式:这种方法可以获得较纯的盐酸。
4、有机物合成常用于卤化有机物,反应式:5、不同浓度的盐酸 浓度 (m/m)c : kg HCl/kg 浓度(m/V)c : kgHCl/m3 密度 ρ : kg/l 摩尔浓度MpH 值 黏性 η : mPa·s 比热容 s : kJ/(kg·K) 蒸汽压 PHCl : Pa 沸点b.p.熔点m.p. 10%104.801.0482.87-0.1.16 3.47 0.527 103-18M 5 ℃℃20% 219.60 1.098 6.02M-0.81.372.99 27.3108℃-59℃30% 344.70 1.149 9.45M-1.1.702.60 1,410 90℃-52℃32% 370.88 1.159 10.17M-1.1.802.55 3,130 84℃-43℃34% 397.46 1.169 10.90M-1.1.902.50 6,733 71℃-36℃36% 424.44 1.179 11.64M-1.11.992.46 14,100 61℃-30℃38% 451.82 1.189 12.39M-1.12.10 2.43 28,000 48℃-26℃6、化学反应盐酸是常用的实验室试剂。



各种酸的腐蚀和材质选型石家庄博特环保133****0665一、氯化氢和盐酸干燥氯化氢在200℃以下对碳钢实际上并不腐蚀,它的腐蚀速率不大于0.1mm/a,在250℃时上升为0.5 mm/a。
含水氯化氢气体的腐蚀,实际上就是盐酸的腐蚀,只要温度高于氯化氢的最高露点(80~200℃,随HCL含量及压力条件而不同)以上,最好在250~300℃,碳钢的腐蚀速率仍保持可容忍的范围内;盐酸是典型的非氧化性酸,铁在稀盐酸中生成氯化亚铁,在浓酸中生成三氯化铁,三氯化铁溶于水。
31%的工业盐酸由于含有三价铁的氯化物,呈深黄色,且腐蚀明显强于化学纯的发烟盐酸(浓度37~38%);在盐酸中,铸铁的腐蚀比碳钢严重;普通不锈钢即使在1%的盐酸中,也会发生孔蚀;在盐酸介质中,只有含钼不锈钢、钛(氯离子含量300ppM,温度90℃以下)、银、哈氏合金、锆和钽可供选择,特别是钽,这种金属即使在三氯化铁和氯的存在下,在任何浓度和温度(直至沸腾)的盐酸中,也不会腐蚀;在盐酸生产中,采用了大量的非金属材料,硬PVC的耐盐酸性能优于PP,可以在任何浓度范围内使用,只要不超过它的允许使用温度。
在稀酸场合,PP可在110℃以下长期使用。
PE在80℃以下具有优良的耐酸性。
乙烯基酯树脂的耐酸性能优于双酚A聚酯和环氧树脂,但比酚醛树脂的耐温性地20~30℃。
PTFE具有优良的耐酸性,使用温度在250℃以下。
天然橡胶在80℃以下的盐酸中具有优良的耐酸性能。
不透性浸渍石墨具有优良的耐腐蚀性能,在盐酸生产中得到广泛的应用。
二、硫酸硫酸是一种含氧酸,稀硫酸的氧化性很弱,属于非氧化性酸类,主要产生氢去极化腐蚀。
氢去极化腐蚀是指以作为去极化剂的腐蚀过程,反应的结果是金属不断地溶解、减薄。
浓硫酸具有很强的氧化性,属于氧化类酸,可使部分金属有自钝化的能力,在金属表面生成致密的钝化膜,这种膜不溶于浓硫酸,从而阻碍腐蚀继续发生。
在硫酸生产中,常用的金属材料有:铅、碳钢、铸铁、不锈钢、哈氏合金、锆和钽等。
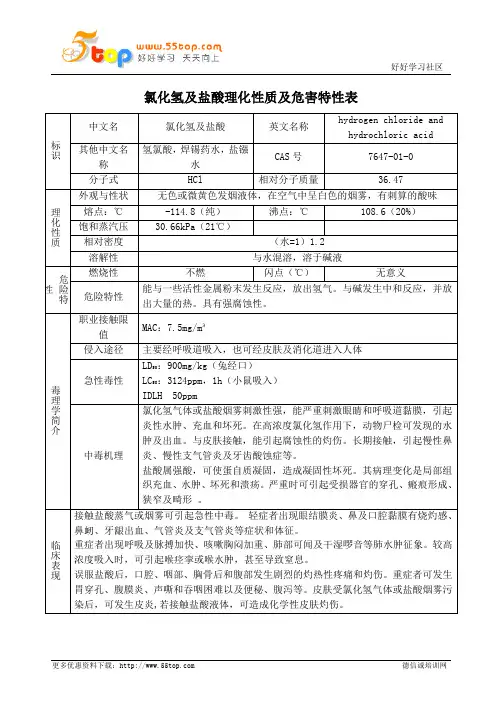
氯化氢及盐酸理化性质及危害特性表标识中文名氯化氢及盐酸 英文名称 hydrogen chloride and hydrochloric acid其他中文名称 氢氯酸,焊锡药水,盐镪水CAS 号 7647-01-0 分子式 HCl 相对分子质量 36.47 理化性质外观与性状无色或微黄色发烟液体,在空气中呈白色的烟雾,有刺算的酸味熔点:℃ -114.8(纯) 沸点:℃108.6(20%)饱和蒸汽压 30.66kPa (21℃)相对密度 (水=1)1.2 溶解性 与水混溶,溶于碱液危险特性燃烧性 不燃闪点(℃)无意义危险特性 能与一些活性金属粉末发生反应,放出氢气。
与碱发生中和反应,并放出大量的热。
具有强腐蚀性。
毒理学简介职业接触限值 MAC :7.5mg/m³侵入途径主要经呼吸道吸入,也可经皮肤及消化道进入人体 急性毒性LD 50:900mg/kg (兔经口)LC 50:3124ppm ,1h (小鼠吸入) IDLH 50ppm中毒机理氯化氢气体或盐酸烟雾刺激性强,能严重刺激眼睛和呼吸道黏膜,引起炎性水肿、充血和坏死。
在高浓度氯化氢作用下,动物尸检可发现的水肿及出血。
与皮肤接触,能引起腐蚀性的灼伤。
长期接触,引起慢性鼻炎、慢性支气管炎及牙齿酸蚀症等。
盐酸属强酸,可使蛋自质凝固,造成凝固性坏死。
其病理变化是局部组织充血、水肿、坏死和溃疡。
严重时可引起受损器官的穿孔、瘢痕形成、狭窄及畸形 。
临床表现接触盐酸蒸气或烟雾可引起急性中毒。
轻症者出现眼结膜炎、鼻及口腔黏膜有烧灼感、鼻衂、牙龈出血、气管炎及支气管炎等症状和体征。
重症者出现呼吸及脉搏加快、咳嗽胸闷加重、肺部可闻及干湿啰音等肺水肿征象。
较高浓度吸入时,可引起喉痉挛或喉水肿,甚至导致窒息。
误服盐酸后,口腔、咽部、胸骨后和腹部发生剧烈的灼热性疼痛和灼伤。
重症者可发生胃穿孔、腹膜炎、声嘶和吞咽困难以及便秘、腹泻等。
皮肤受氯化氢气体或盐酸烟雾污染后,可发生皮炎,若接触盐酸液体,可造成化学性皮肤灼伤。


制取盐酸的原理制取盐酸的原理是通过盐酸的制备反应,即盐酸酸化反应。
通常使用氯化氢气体和水反应制取盐酸。
氯化氢(HCl)是一种无色、刺激性气体。
它是一种强酸,具有极强的腐蚀性,容易溶解在水中形成盐酸(HCl(aq))。
制取盐酸的过程就是将氯化氢气体溶解在水中,生成盐酸溶液。
制取盐酸的反应式可以表示为:HCl(g) + H2O(l) →HCl(aq)具体的制备过程如下:1. 首先需要制备氯化氢气体。
氯化氢气体通常通过酸的金属盐与酸反应得到。
例如,可以通过硫酸(H2SO4)和氯化钠(NaCl)反应制备氯化氢气体。
反应式为:2H2SO4(aq) + 2NaCl(s) →2NaHSO4(aq) + 2HCl(g)2. 将制备好的氯化氢气体通入水中。
将含有氯化氢气体的气体通入到装有水的容器中,可以通过使用分液漏斗或气体导管实现。
通入气体的速率需要控制,以确保反应均匀进行。
3. 盐酸生成。
氯化氢气体与水反应后,生成盐酸溶液。
酸性溶液中的氯氢酸分子会与水中的水分子之间发生化学反应,结合生成盐酸的离子。
反应式为:HCl(g)+ H2O(l) →HCl(aq)4. 过程与控制。
在制备的过程中,需要注意以下几点:- 反应容器和设备应该具有一定的耐腐蚀性,以防止盐酸对其造成损害。
- 通入氯化氢气体的速率需要控制,以确保反应均匀进行,并避免过量的气体逸出。
- 制备过程通常在有足够通风的实验室环境下进行,以保证氯化氢气体的安全处理。
制取盐酸的原理可以通过酸碱理论进一步解释。
在水中,氯化氢气体会溶解产生氯氢酸分子(HCl)和氯化物离子(Cl-)。
氯氢酸是一种强酸,它能够与水分子中的氢键进行竞争性结合,从而形成离子状态的盐酸。
总结一下,制取盐酸的原理是通过盐酸的制备反应,即将氯化氢气体与水反应制备盐酸溶液。
氯化氢气体是一种强酸,其溶解在水中形成盐酸溶液。
制备盐酸的过程需要注意反应容器和设备的耐腐蚀性,控制气体的通入速率以及在有良好通风的实验室环境下进行。

氯化氢和盐酸不⼀样吗?盐酸和氯化氢有什么区别?氯化氢和盐酸不⼀样吗? 盐酸和氯化氢有什么区别,是同⼀种物质吗?我们经常会遇到这样的问题,下⾯和⼩编具体来看⼀下吧。
我们都知道⼀说氯化氢⽓体,可能⼤家都不知道,但是⼀说盐酸,想必⼤家都⾮常熟悉了,那么氯化氢⽓体究竟是什么样的⽓体呢。
我们从⽹上查阅资料知道氯化氢(HCl),⼀个氯化氢分⼦是由⼀个氯原⼦和⼀个氢原⼦构成的,是⽆⾊有刺激性⽓味的⽓体。
其⽔溶液俗称盐酸,学名氢氯酸。
相对分⼦质量为36.46。
氯化氢极易溶于⽔,在0时,1体积的⽔⼤约能溶解500体积的氯化氢。
所以说氯化氢是化合物,它有多种存在状态,可以是⽓体,可以是液体。
纯的氯化氢是分⼦化合物,通常条件下为⽓体,分⼦式为HCl。
盐酸是氯化氢的⽔溶液,分⼦式HCl。
盐酸是混合物,是氯化氢常溶解在⽔中形成,也就是氯化氢和⽔的混合物,不是化合物。
盐酸是氯化氢溶在⽔⾥后,离解成⽔合氢离⼦和氯离⼦的混合物,严格来说应该写为H3O+和Cl-,但作为反式来写,写为HCl即可。
“盐酸是混和物,是HCL(氯化氢)的⽔溶液氯化氢分⼦式是HCL,因此盐酸和氯化氢不是⼀种物质,可以这样说,盐酸是混合物,是氯化氢的⽔溶液,⽽氯化氢是纯净物,常温是⽓态的”。
⽽氯化氢主要⽤于制染料、⾹料、药物、各种氯化物及腐蚀抑制剂等⽅⾯。
盐酸是⼀种⽆机强酸,在⼯业加⼯中有着⼴泛的应⽤,例如⾦属的精炼。
盐酸往往能够决定产品的质量。
在⽇常⽣活中,利⽤盐酸可以与难溶性碱反应的性质,制取洁厕灵、除锈剂等⽇⽤品。
因此,氯化氢和盐酸不是同⼀种物质,千万可不要搞混了。
两者之前有着很⼤的区别,⼀定要根据实际情况来进⾏选择⽤哪种产品合适。
⼭东⾔赫化⼯有限公司作为地区⼀家⾼纯氯化氢⽓体、化学级氯化氢⽓体以及99%硫化氢⽓体产品代理供应机构,其代理的相关⼯业⽓体产品不仅种类多样,纯度不⼀,⽽且储量丰富,价格公道,完全能够满⾜⽣产以及实验室研究等各种需求,因⽽深受⼴⼤需求⼚家的好评,公司也才能成为地区最值得信赖的⽓体供应机构。

以食盐为原料的化工产品(二)知识梳理一、氯化氢和盐酸的性质1.氯化氢的性质(1)物理性质:氯化氢是____色___________气味的气体,密度约为相同条件下空气的 1.26 倍,氯化氢________溶于水,0℃时,1 体积的水大约能溶解_______体积的氯化氢气体。
(2)氯化氢可以使湿润的蓝色石蕊试纸变蓝,露置于空气中可以形成______,原因是_____________________________________________________________。
2.盐酸的性质(1)盐酸是______的水溶液,人体胃液里含有盐酸。
(2)盐酸是______色__________味的溶液;盐酸(“易”、“不易”)______挥发;浓盐酸敞口放置,瓶口会出现由__________(填“小液滴”、“固体小颗粒”)形成的____________。
(3)酸的通性盐酸_____使紫色石蕊试剂变红,_____(填“能”或“不能”)使酚酞试剂变色;盐酸可与活泼金属如______和_______等反应;盐酸可与金属氧化物如_______和_______等反应;盐酸可与碱如_________和_________等反应;盐酸还可与某些盐如________和________等反应。
【答案】无有刺激性极易500白雾氯化氢吸收空气中的水蒸气,形成盐酸小液滴,悬浮在空气中HCl 无色有刺激性易小液滴白雾能不能Zn、Fe Fe2O3、CuO NaOH、Ca(OH)2 CaCO3、Na2CO3二、喷泉实验在圆底烧瓶里充满氯化氢气体如图所示,用带有玻璃导管和滴管(滴管里预先吸入水)的双孔塞塞紧瓶口,倒置烧瓶,使玻璃管伸进盛有紫色石蕊溶液的烧杯里,挤压滴管的胶头,使水射入烧瓶中。
现象:_________________________________________________________________。
原理:因为 HCl 极易溶于水,烧瓶中的 HCl 溶于胶头滴管射入的少量水中,使得烧瓶压强减小,在大气压的作用下,将烧杯里的水从玻璃导管喷入烧瓶中;且 HCl 溶于水形成盐酸,显酸性。

高考氯化氢与盐酸的相关反应总结
整理了高考氯化氢与盐酸的相关反应,希望同学们自己消化吸收好。
(1)、浓盐酸被二氧化锰氧化(实验室制氯气)MnO2+4HCl(浓)==加热==MnCl2+Cl2↑+2 H2O
(2)、盐酸、氯化钠等分别与硝酸银溶液的反应(盐酸及氯化物溶液的检验;溴化物、碘化物的检验)
(3)、盐酸与碱反应HCl + NaOH ======= NaCl + H2O 2HCl + Mg(OH)2 ====== MgCl2 + 2H20 2HCl + Ba(OH)2 ====== BaCl2 + 2H20 2HCl + Ca(OH)2 ====== CaCl2 + 2H20 3H Cl + Al(OH)3 ====== AlCl3 + 3H2O
(4)、盐酸与碱性氧化物反应氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O;氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O
(5)、盐酸与锌等活泼金属反应Zn+2HCl=ZnCl2+H2↑
(6)、盐酸与弱酸盐如碳酸钠、硫化亚铁反应
(7)、盐酸与苯酚钠溶液反应:C6H5ONa + HCl ==> C6H5OH + NaCl
(8)、稀盐酸与漂白粉反应
(9)、氯化氢与乙烯加成反应
(10)、氯化氢与乙炔加成反应(制聚氯乙烯)
(11)、漂白粉与空气中的二氧化碳反应(说明碳酸酸性强于HClO)
(12)、HF、HCl、HBr、HI酸性的比较(HF为弱酸,HCl、HBr、HI为强酸,且酸性依次增强)
(13)、用于人工降雨的物质有哪些?(干冰、AgI)。
浓盐酸吸收氯化氢的原理浓盐酸吸收氯化氢是指使用浓盐酸(也就是浓硫酸)作为吸收剂来吸收氯化氢气体的一个过程。
这一吸收过程会发生化学反应,属于物理吸收和化学吸收的结合。
下面我从几个方面详细解释这个过程中的原理:一、反应原理浓盐酸吸收氯化氢时,会发生这样一个化学反应:HCl(g) + H2SO4(l) →H3SO4(l) + HCl(aq)即氯化氢气体被浓硫酸吸收,生成氯化氢和硫酸的溶液。
这里浓硫酸作为吸收剂,与氯化氢发生化学反应生成盐,属于化学吸收的一种。
二、吸收dynamics盐酸吸收氯化氢过程的动力学遵循气-液接触吸收的基本规律。
它包含气体分子从气体相向液相的传质过程:1. 气体分子在气液界面发生规律的molecular 碰撞;2. 分子通过液面进入液相,这一步决定了整个吸收速率;3. 气体分子在液体内部扩散和流动。
影响吸收动力学的主要因素还有气液接触方式、界面积大小、温度和压力等。
三、卤化氢溶解度卤化氢溶解度是影响盐酸吸收氯化氢效果的一个重要因素。
卤化氢如氯化氢、溴化氢在水中的溶解度较低,但在浓盐酸中溶解度会大大提高。
这是因为卤化氢和卤化氢钠生成复合离子,溶解度按照次序HCl > HBr > HI。
盐酸浓度越高,卤化氢溶解度越大。
四、热力学分析从热力学的Gibbs自由能变化来看,标准状态下吸收反应的ΔG小于0,说明反应可自发进行。
实际工业条件下,可以通过提高压力来增加反应的驱动力。
另外反应放热,具有良好的热动力学特征。
反应放热可以为后续的氯化氢回收提供热力条件。
五、工业应用案例工业上常用浓盐酸洗涤法来除去各种烃类气体中的痕量氯化氢、溴化氢等杂质。
例如在石油加工的裂化装置、催化重整装置中,都会用浓盐酸吸收法除去反应产生的氯化氢。
此外在一些有机合成过程中也会用到浓盐酸吸收氯化氢。
通过选择合适的操作条件,可以达到很高的去除率。
六、工艺优化方向为进一步提高浓盐酸吸收氯化氢的效果,可以从这些方面进行工艺优化:1. 增加气液接触面积,通常采用填料吸收塔来实现;2. 提高盐酸浓度,因为浓酸可以更好吸收氯化氢;3. 调节操作温度和压力,需要根据具体条件测试最佳参数;4. 回收吸收液中的氯化氢,降低酸液浓度的减少;5. 选择抗腐蚀材料,构建适合的反应设备。
氯化氢和盐酸的共同点
氯化氢(HCl)和盐酸是同一种物质的不同形态:
1.共同成分:两者都含有相同的化学成分,即氯原子和氢原子。
2.化学键性质:在纯净的氯化氢分子中,氯与氢之间通过共价键结合。
而当氯化氢溶解于水中形成盐酸时,虽然分子间原有的共价键结构被破坏,但形成的水合氢离子(H3O+)和氯离子(Cl-)中依然包含氢与氯的化学键合作用。
3.酸性表现:无论是气态的氯化氢还是其水溶液——盐酸,都表现出酸性。
在水中,氯化氢完全离解产生氢离子和氯离子,导致溶液显酸性。
4.化学反应活性:它们都能参与许多化学反应,特别是作为酸参与酸碱中和反应、金属氧化物或金属氢氧化物的反应等。
5.挥发性:浓盐酸具有挥发性,能挥发出氯化氢气体,这一点上二者也有关联。
总结起来,氯化氢和盐酸的核心共同点在于它们都源于氯化氢分子,并且在合适的条件下都表现出强烈的酸性特征。
高考化学知识点:氯化氢与盐酸
(1)、浓盐酸被二氧化锰氧化(实验室制氯气)
(2)、盐酸、氯化钠等分别与硝酸银溶液的反应(盐酸及氯化物溶液的检验;溴化物、碘化物的检验)
(3)、盐酸与碱反应
(4)、盐酸与碱性氧化物反应
(5)、盐酸与锌等活泼金属反应
(6)、盐酸与弱酸盐如碳酸钠、硫化亚铁反应
(7)、盐酸与苯酚钠溶液反应
(8)、稀盐酸与漂白粉反应
(9)、氯化氢与乙烯加成反应
(10)、氯化氢与乙炔加成反应(制聚氯乙烯)
(11)、漂白粉与空气中的二氧化碳反应(说明碳酸酸性强于HClO)
(12)、HF、HCl、HBr、HI酸性的比较(HF为弱酸,HCl、HBr、HI为强酸,且酸性依次增强)
(13)、用于人工降雨的物质有哪些?(干冰、AgI)
总结:高三是重要时期,希望大家好好学习,也希望小编为大家整理的高考化学知识点对大家有帮助,大家加油。
备战2014高考第一轮复习资料精汇
浏览了本文的读者也浏览了:
高中化学:书写方程式的问题
高中化学知识点:化学实验基本操作
更多精彩内容尽在:首页 gt; 高中 gt; 高三 gt; 高三化学 gt; 高三化学知识点。
盐酸生产工艺流程盐酸,化学式HCl,是一种重要的化工原料,广泛应用于化工、医药、冶金等领域。
盐酸的生产工艺流程是一个复杂的过程,需要经过多个步骤才能得到高纯度的盐酸产品。
本文将介绍盐酸生产的工艺流程及其各个步骤。
1. 原料准备盐酸的生产原料主要是氯化氢气体和水。
氯化氢气体通常是通过氯气和氢气在催化剂的作用下反应得到的。
水则是从自来水或其他水源中获取。
在生产过程中,需要确保原料的纯度和质量,以保证最终产品的质量。
2. 氯化氢气体的制备氯化氢气体是盐酸生产的关键原料之一。
氯化氢气体的制备通常是通过盐酸和硫酸的中和反应得到的。
中和反应的化学方程式为:HCl + H2SO4 → H2O + Cl2这个反应是一个放热反应,产生的氯化氢气体会被收集并储存起来,以备后续的使用。
3. 氯化氢气体的吸收生产中,氯化氢气体需要被吸收到水中,形成盐酸溶液。
这个过程通常是在吸收塔中进行的,氯化氢气体通过塔底喷嘴喷入,与塔内的水接触,被吸收到水中。
吸收后的盐酸溶液会被输送到下一个步骤进行处理。
4. 盐酸溶液的浓缩从吸收塔中得到的盐酸溶液通常是稀的,需要经过浓缩才能得到高浓度的盐酸产品。
浓缩通常是通过蒸发的方式进行的,将盐酸溶液加热,使水分蒸发,得到高浓度的盐酸溶液。
5. 盐酸的精制得到高浓度的盐酸溶液后,还需要进行精制处理,以去除其中的杂质。
通常采用蒸馏或结晶的方法进行精制,得到高纯度的盐酸产品。
6. 盐酸产品的储存和包装最后得到的高纯度盐酸产品会被储存在专用的储罐中,并进行包装,以便运输和使用。
以上就是盐酸生产的工艺流程及其各个步骤。
盐酸作为一种重要的化工原料,在生产过程中需要严格控制各个步骤,以确保产品的质量和安全。
希望本文能够对盐酸生产工艺有所帮助。
盐酸分子式
盐酸(Hydrochloricacid),又称氯化氢,是一种具有特殊性质
的有机化合物,它是指由氢原子和氯原子组成的化合物,其分子式为HCl,它是一种无色、有刺激性气味的液体。
对温度非常敏感,容易
被高温破坏,极易变质,氯化氢主要用于医药、冶金、农业、食品工业、还有污水处理等领域。
盐酸的结构
氯化氢分子主要由氢原子和氯原子组成。
其中,氢原子由一个质子和一个电子组成,而氯原子由一个质子和两个电子组成。
氢原子的电子以单核对价方式与氯原子的两个电子形成一个单元,构成一个由H+和Cl-两种离子组成的离子络合物,其分子式为HCl。
盐酸的特性
盐酸具有极强的溶解力,可以溶解几乎所有大部分的金属离子,而且也可以溶解一些非金属离子如氢离子。
由于它的强酸性,它可以用来控制环境的PH值以达到缓解酸雨影响的目的。
此外,由于其微
量元素中的氯原子对某些有机物具有较强的杀菌能力和抑菌能力,因此,盐酸也被广泛用于抑菌和杀菌的消毒工作。
盐酸的用途
盐酸在生活中有很多用途,最常见的用途当属清洗、消毒,由于其弱酸性和有效的抑菌效果,这使得盐酸在家居清洁时受到广泛应用。
此外,由于盐酸具有很强的溶解力,它也是一种常见的实验室试剂,常被用于医学鉴定、科研仪器实验、分析化学实验中。
此外,它也常
被用于水处理,以酸化处理水源中的氧化物、铁锈等有害物质。
盐酸的安全性
盐酸具有毒性,所以在使用时一定要注意安全措施,这样才能避免对周围环境和自己身体产生不良影响。
当使用盐酸时,最好采取防护措施,如戴口罩、穿耐酸衣、佩戴安全眼镜等,以防止氯化氢进入口腔和眼睛,并做好量的止损措施,以免出现大量的事故发生。