氯化氢和盐酸
- 格式:ppt
- 大小:1.35 MB
- 文档页数:7



各种酸的腐蚀和材质选型石家庄博特环保133****0665一、氯化氢和盐酸干燥氯化氢在200℃以下对碳钢实际上并不腐蚀,它的腐蚀速率不大于0.1mm/a,在250℃时上升为0.5 mm/a。
含水氯化氢气体的腐蚀,实际上就是盐酸的腐蚀,只要温度高于氯化氢的最高露点(80~200℃,随HCL含量及压力条件而不同)以上,最好在250~300℃,碳钢的腐蚀速率仍保持可容忍的范围内;盐酸是典型的非氧化性酸,铁在稀盐酸中生成氯化亚铁,在浓酸中生成三氯化铁,三氯化铁溶于水。
31%的工业盐酸由于含有三价铁的氯化物,呈深黄色,且腐蚀明显强于化学纯的发烟盐酸(浓度37~38%);在盐酸中,铸铁的腐蚀比碳钢严重;普通不锈钢即使在1%的盐酸中,也会发生孔蚀;在盐酸介质中,只有含钼不锈钢、钛(氯离子含量300ppM,温度90℃以下)、银、哈氏合金、锆和钽可供选择,特别是钽,这种金属即使在三氯化铁和氯的存在下,在任何浓度和温度(直至沸腾)的盐酸中,也不会腐蚀;在盐酸生产中,采用了大量的非金属材料,硬PVC的耐盐酸性能优于PP,可以在任何浓度范围内使用,只要不超过它的允许使用温度。
在稀酸场合,PP可在110℃以下长期使用。
PE在80℃以下具有优良的耐酸性。
乙烯基酯树脂的耐酸性能优于双酚A聚酯和环氧树脂,但比酚醛树脂的耐温性地20~30℃。
PTFE具有优良的耐酸性,使用温度在250℃以下。
天然橡胶在80℃以下的盐酸中具有优良的耐酸性能。
不透性浸渍石墨具有优良的耐腐蚀性能,在盐酸生产中得到广泛的应用。
二、硫酸硫酸是一种含氧酸,稀硫酸的氧化性很弱,属于非氧化性酸类,主要产生氢去极化腐蚀。
氢去极化腐蚀是指以作为去极化剂的腐蚀过程,反应的结果是金属不断地溶解、减薄。
浓硫酸具有很强的氧化性,属于氧化类酸,可使部分金属有自钝化的能力,在金属表面生成致密的钝化膜,这种膜不溶于浓硫酸,从而阻碍腐蚀继续发生。
在硫酸生产中,常用的金属材料有:铅、碳钢、铸铁、不锈钢、哈氏合金、锆和钽等。
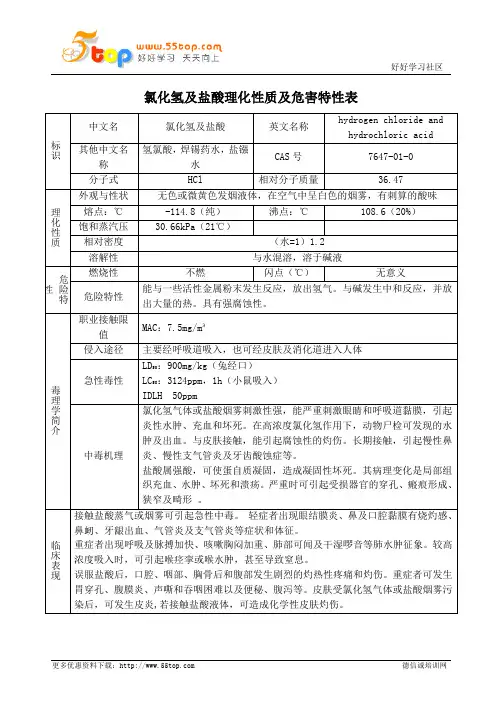
氯化氢及盐酸理化性质及危害特性表标识中文名氯化氢及盐酸 英文名称 hydrogen chloride and hydrochloric acid其他中文名称 氢氯酸,焊锡药水,盐镪水CAS 号 7647-01-0 分子式 HCl 相对分子质量 36.47 理化性质外观与性状无色或微黄色发烟液体,在空气中呈白色的烟雾,有刺算的酸味熔点:℃ -114.8(纯) 沸点:℃108.6(20%)饱和蒸汽压 30.66kPa (21℃)相对密度 (水=1)1.2 溶解性 与水混溶,溶于碱液危险特性燃烧性 不燃闪点(℃)无意义危险特性 能与一些活性金属粉末发生反应,放出氢气。
与碱发生中和反应,并放出大量的热。
具有强腐蚀性。
毒理学简介职业接触限值 MAC :7.5mg/m³侵入途径主要经呼吸道吸入,也可经皮肤及消化道进入人体 急性毒性LD 50:900mg/kg (兔经口)LC 50:3124ppm ,1h (小鼠吸入) IDLH 50ppm中毒机理氯化氢气体或盐酸烟雾刺激性强,能严重刺激眼睛和呼吸道黏膜,引起炎性水肿、充血和坏死。
在高浓度氯化氢作用下,动物尸检可发现的水肿及出血。
与皮肤接触,能引起腐蚀性的灼伤。
长期接触,引起慢性鼻炎、慢性支气管炎及牙齿酸蚀症等。
盐酸属强酸,可使蛋自质凝固,造成凝固性坏死。
其病理变化是局部组织充血、水肿、坏死和溃疡。
严重时可引起受损器官的穿孔、瘢痕形成、狭窄及畸形 。
临床表现接触盐酸蒸气或烟雾可引起急性中毒。
轻症者出现眼结膜炎、鼻及口腔黏膜有烧灼感、鼻衂、牙龈出血、气管炎及支气管炎等症状和体征。
重症者出现呼吸及脉搏加快、咳嗽胸闷加重、肺部可闻及干湿啰音等肺水肿征象。
较高浓度吸入时,可引起喉痉挛或喉水肿,甚至导致窒息。
误服盐酸后,口腔、咽部、胸骨后和腹部发生剧烈的灼热性疼痛和灼伤。
重症者可发生胃穿孔、腹膜炎、声嘶和吞咽困难以及便秘、腹泻等。
皮肤受氯化氢气体或盐酸烟雾污染后,可发生皮炎,若接触盐酸液体,可造成化学性皮肤灼伤。


制取盐酸的原理制取盐酸的原理是通过盐酸的制备反应,即盐酸酸化反应。
通常使用氯化氢气体和水反应制取盐酸。
氯化氢(HCl)是一种无色、刺激性气体。
它是一种强酸,具有极强的腐蚀性,容易溶解在水中形成盐酸(HCl(aq))。
制取盐酸的过程就是将氯化氢气体溶解在水中,生成盐酸溶液。
制取盐酸的反应式可以表示为:HCl(g) + H2O(l) →HCl(aq)具体的制备过程如下:1. 首先需要制备氯化氢气体。
氯化氢气体通常通过酸的金属盐与酸反应得到。
例如,可以通过硫酸(H2SO4)和氯化钠(NaCl)反应制备氯化氢气体。
反应式为:2H2SO4(aq) + 2NaCl(s) →2NaHSO4(aq) + 2HCl(g)2. 将制备好的氯化氢气体通入水中。
将含有氯化氢气体的气体通入到装有水的容器中,可以通过使用分液漏斗或气体导管实现。
通入气体的速率需要控制,以确保反应均匀进行。
3. 盐酸生成。
氯化氢气体与水反应后,生成盐酸溶液。
酸性溶液中的氯氢酸分子会与水中的水分子之间发生化学反应,结合生成盐酸的离子。
反应式为:HCl(g)+ H2O(l) →HCl(aq)4. 过程与控制。
在制备的过程中,需要注意以下几点:- 反应容器和设备应该具有一定的耐腐蚀性,以防止盐酸对其造成损害。
- 通入氯化氢气体的速率需要控制,以确保反应均匀进行,并避免过量的气体逸出。
- 制备过程通常在有足够通风的实验室环境下进行,以保证氯化氢气体的安全处理。
制取盐酸的原理可以通过酸碱理论进一步解释。
在水中,氯化氢气体会溶解产生氯氢酸分子(HCl)和氯化物离子(Cl-)。
氯氢酸是一种强酸,它能够与水分子中的氢键进行竞争性结合,从而形成离子状态的盐酸。
总结一下,制取盐酸的原理是通过盐酸的制备反应,即将氯化氢气体与水反应制备盐酸溶液。
氯化氢气体是一种强酸,其溶解在水中形成盐酸溶液。
制备盐酸的过程需要注意反应容器和设备的耐腐蚀性,控制气体的通入速率以及在有良好通风的实验室环境下进行。


氯化氢和盐酸不⼀样吗?盐酸和氯化氢有什么区别?氯化氢和盐酸不⼀样吗? 盐酸和氯化氢有什么区别,是同⼀种物质吗?我们经常会遇到这样的问题,下⾯和⼩编具体来看⼀下吧。
我们都知道⼀说氯化氢⽓体,可能⼤家都不知道,但是⼀说盐酸,想必⼤家都⾮常熟悉了,那么氯化氢⽓体究竟是什么样的⽓体呢。
我们从⽹上查阅资料知道氯化氢(HCl),⼀个氯化氢分⼦是由⼀个氯原⼦和⼀个氢原⼦构成的,是⽆⾊有刺激性⽓味的⽓体。
其⽔溶液俗称盐酸,学名氢氯酸。
相对分⼦质量为36.46。
氯化氢极易溶于⽔,在0时,1体积的⽔⼤约能溶解500体积的氯化氢。
所以说氯化氢是化合物,它有多种存在状态,可以是⽓体,可以是液体。
纯的氯化氢是分⼦化合物,通常条件下为⽓体,分⼦式为HCl。
盐酸是氯化氢的⽔溶液,分⼦式HCl。
盐酸是混合物,是氯化氢常溶解在⽔中形成,也就是氯化氢和⽔的混合物,不是化合物。
盐酸是氯化氢溶在⽔⾥后,离解成⽔合氢离⼦和氯离⼦的混合物,严格来说应该写为H3O+和Cl-,但作为反式来写,写为HCl即可。
“盐酸是混和物,是HCL(氯化氢)的⽔溶液氯化氢分⼦式是HCL,因此盐酸和氯化氢不是⼀种物质,可以这样说,盐酸是混合物,是氯化氢的⽔溶液,⽽氯化氢是纯净物,常温是⽓态的”。
⽽氯化氢主要⽤于制染料、⾹料、药物、各种氯化物及腐蚀抑制剂等⽅⾯。
盐酸是⼀种⽆机强酸,在⼯业加⼯中有着⼴泛的应⽤,例如⾦属的精炼。
盐酸往往能够决定产品的质量。
在⽇常⽣活中,利⽤盐酸可以与难溶性碱反应的性质,制取洁厕灵、除锈剂等⽇⽤品。
因此,氯化氢和盐酸不是同⼀种物质,千万可不要搞混了。
两者之前有着很⼤的区别,⼀定要根据实际情况来进⾏选择⽤哪种产品合适。
⼭东⾔赫化⼯有限公司作为地区⼀家⾼纯氯化氢⽓体、化学级氯化氢⽓体以及99%硫化氢⽓体产品代理供应机构,其代理的相关⼯业⽓体产品不仅种类多样,纯度不⼀,⽽且储量丰富,价格公道,完全能够满⾜⽣产以及实验室研究等各种需求,因⽽深受⼴⼤需求⼚家的好评,公司也才能成为地区最值得信赖的⽓体供应机构。

匠心文档,专属精品。
高考氯化氢与盐酸的相关反应总结
整理了高考氯化氢与盐酸的相关反应,希望同学们自己消化吸收好。
(1)、浓盐酸被二氧化锰氧化(实验室制氯气)MnO2+4HCl(浓)==加热==MnCl2+Cl2↑+2 H2O
(2)、盐酸、氯化钠等分别与硝酸银溶液的反应(盐酸及氯化物溶液的检验;溴化物、碘化物的检验)
(3)、盐酸与碱反应HCl + NaOH ======= NaCl + H2O 2HCl + Mg(OH)2 ====== MgCl2 + 2H20 2HCl + Ba(OH)2 ====== BaCl2 + 2H20 2HCl + Ca(OH)2 ====== CaCl2 + 2H20 3H Cl + Al(OH)3 ====== AlCl3 + 3H2O
(4)、盐酸与碱性氧化物反应氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O;氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O
(5)、盐酸与锌等活泼金属反应Zn+2HCl=ZnCl2+H2↑
(6)、盐酸与弱酸盐如碳酸钠、硫化亚铁反应
(7)、盐酸与苯酚钠溶液反应:C6H5ONa + HCl ==> C6H5OH + NaCl
(8)、稀盐酸与漂白粉反应
(9)、氯化氢与乙烯加成反应
(10)、氯化氢与乙炔加成反应(制聚氯乙烯)
(11)、漂白粉与空气中的二氧化碳反应(说明碳酸酸性强于HClO)
(12)、HF、HCl、HBr、HI酸性的比较(HF为弱酸,HCl、HBr、HI为强酸,且酸性依次增强)
(13)、用于人工降雨的物质有哪些?(干冰、AgI)
匠心教育文档系列 1。


浓盐酸吸收氯化氢的原理浓盐酸吸收氯化氢是指使用浓盐酸(也就是浓硫酸)作为吸收剂来吸收氯化氢气体的一个过程。
这一吸收过程会发生化学反应,属于物理吸收和化学吸收的结合。
下面我从几个方面详细解释这个过程中的原理:一、反应原理浓盐酸吸收氯化氢时,会发生这样一个化学反应:HCl(g) + H2SO4(l) →H3SO4(l) + HCl(aq)即氯化氢气体被浓硫酸吸收,生成氯化氢和硫酸的溶液。
这里浓硫酸作为吸收剂,与氯化氢发生化学反应生成盐,属于化学吸收的一种。
二、吸收dynamics盐酸吸收氯化氢过程的动力学遵循气-液接触吸收的基本规律。
它包含气体分子从气体相向液相的传质过程:1. 气体分子在气液界面发生规律的molecular 碰撞;2. 分子通过液面进入液相,这一步决定了整个吸收速率;3. 气体分子在液体内部扩散和流动。
影响吸收动力学的主要因素还有气液接触方式、界面积大小、温度和压力等。
三、卤化氢溶解度卤化氢溶解度是影响盐酸吸收氯化氢效果的一个重要因素。
卤化氢如氯化氢、溴化氢在水中的溶解度较低,但在浓盐酸中溶解度会大大提高。
这是因为卤化氢和卤化氢钠生成复合离子,溶解度按照次序HCl > HBr > HI。
盐酸浓度越高,卤化氢溶解度越大。
四、热力学分析从热力学的Gibbs自由能变化来看,标准状态下吸收反应的ΔG小于0,说明反应可自发进行。
实际工业条件下,可以通过提高压力来增加反应的驱动力。
另外反应放热,具有良好的热动力学特征。
反应放热可以为后续的氯化氢回收提供热力条件。
五、工业应用案例工业上常用浓盐酸洗涤法来除去各种烃类气体中的痕量氯化氢、溴化氢等杂质。
例如在石油加工的裂化装置、催化重整装置中,都会用浓盐酸吸收法除去反应产生的氯化氢。
此外在一些有机合成过程中也会用到浓盐酸吸收氯化氢。
通过选择合适的操作条件,可以达到很高的去除率。
六、工艺优化方向为进一步提高浓盐酸吸收氯化氢的效果,可以从这些方面进行工艺优化:1. 增加气液接触面积,通常采用填料吸收塔来实现;2. 提高盐酸浓度,因为浓酸可以更好吸收氯化氢;3. 调节操作温度和压力,需要根据具体条件测试最佳参数;4. 回收吸收液中的氯化氢,降低酸液浓度的减少;5. 选择抗腐蚀材料,构建适合的反应设备。
氯化氢和盐酸的共同点
氯化氢(HCl)和盐酸是同一种物质的不同形态:
1.共同成分:两者都含有相同的化学成分,即氯原子和氢原子。
2.化学键性质:在纯净的氯化氢分子中,氯与氢之间通过共价键结合。
而当氯化氢溶解于水中形成盐酸时,虽然分子间原有的共价键结构被破坏,但形成的水合氢离子(H3O+)和氯离子(Cl-)中依然包含氢与氯的化学键合作用。
3.酸性表现:无论是气态的氯化氢还是其水溶液——盐酸,都表现出酸性。
在水中,氯化氢完全离解产生氢离子和氯离子,导致溶液显酸性。
4.化学反应活性:它们都能参与许多化学反应,特别是作为酸参与酸碱中和反应、金属氧化物或金属氢氧化物的反应等。
5.挥发性:浓盐酸具有挥发性,能挥发出氯化氢气体,这一点上二者也有关联。
总结起来,氯化氢和盐酸的核心共同点在于它们都源于氯化氢分子,并且在合适的条件下都表现出强烈的酸性特征。
hcl化学名称
hcl的化学名称为氯化氢。
氯化氢,化学式为HCl,一个氯化氢分子是由一个氯原子和一个氢原子构成的,是无色有刺激性气味的气体。
其水溶液称为盐酸,又称氢氯酸。
氯化氢极易溶于水,在0℃时,1体积的水大约能溶解500体积的氯化氢。
化学性质
氯化氢,腐蚀性的不燃烧气体,与水不反应但易溶于水,空气中常以盐酸酸雾的形式存在。
易溶于乙醇和醚,也能溶于其它多种有机物;易溶于水,在25℃和1大气压下,1体积水可溶解503体积的氯化氢气体。
干燥氯化氢的化学性质很不活泼。
碱金属和碱土金属在氯化氢中可燃烧,钠燃烧时发出亮黄色的火焰。
氯化氢的水溶液为盐酸。
工业用盐酸常成微黄色,主要是因为三氯化铁的存在。
常用氨水来检验盐酸的存在,氨水会与氯化氢反应生成白色的氯化铵微粒。
氯化氢有强烈的偶极,与其他偶极产生氢键。
制取方法
实验室制取
一般是用固体氯化钠和浓硫酸起反应,不加热或稍微加热,分别生成硫酸氢钠和氯化氢。
NaCl+H2SO4=NaHSO4+HCl↑
然后在500℃到600℃的条件下,继续起反应而生成氯化氢和硫酸钠。
NaHSO4+NaCl=Na2SO4+HCl↑
总的化学方程式可以表示如下:
2NaCl+H2SO4=Na2SO4+2HCl↑(注:加热且缺水环境下HCl才加↑)。
盐酸的化学名称化学名称:氯化氢。
高中记叙文:氯化氢,一个看似平凡却有着神秘力量的元素。
初中记叙文:氯化氢,它是无色液体,看起来像水。
这些,都让我感觉很好奇。
初中记叙文:氯化氢,又叫做盐酸。
可能大家听到这个词会觉得不是什么好东西,但事实上也并非如此。
现在人们的生活条件都提高了,用的各种东西都要讲究,而氯化氢,则是用作清洗剂。
那是因为氯化氢具有腐蚀性,即使擦拭,不注意的话也会受伤,这也正是它的用途之一。
其次,它还能用于医疗方面,例如消毒、除臭、漂白等。
当然,化学方程式更是少不了它。
一道有关化学方程式的计算题,出现了一个数据与“ 1”,但该数值没有以“ 2”显示,所以我便在“ 2”后边加了一个“ 0”,没想到,这个数字居然等于我随便写的一个数,这可把我吓了一跳。
于是我立马去翻资料,原来“ 1”代表着过氧化氢,而“ 0”则代表着盐酸。
“ 1”和“ 0”合在一起就是盐酸。
真是“虚惊一场”啊!在生活中,类似的例子比比皆是。
也许有人会问,为什么“ 0”是“ 0”呢?在这里,我给你们举几个例子。
在冬天,将雪融化成冰时,常常需要向下浇水,而地上的积水,不久就结成了冰,变成了冰。
这是什么现象呢?没错,就是这个原因。
同时我又想到了“两岸猿声啼不住,轻舟已过万重山”这句诗,我觉得,可以改成“两岸猿声啼不住,一脚踏过万重山”。
我再举个例子,比如说眼镜是用来保护眼睛的,可我一戴上眼镜,坐在电脑旁,这样很容易造成近视,所以大家应该适当佩戴。
其实,盐酸和氯化氢的功效不止于此。
盐酸可以发光,俗话说:“无灯不成夜”,如果人们在黑暗处行走时,盐酸会反射出明亮的白光。
氯化氢也可以用来制备干冰。
你可能会问,盐酸为什么是白色的呢?因为盐酸溶于水形成了酸式盐,而碱式盐是蓝色的。
氯化氢和二氧化硫反应生成硫酸和盐酸,最后加入过量的氢氧化钠溶液反应生成碳酸钠和水。
这些都可以用在自己身上,还可以帮助别人呢!盐酸,虽然看起来只是普通的酸,但它却有着强大的作用,由小到大,从少到多,一点点展现在我们眼前,令人震撼。
盐酸分子式
盐酸(Hydrochloricacid),又称氯化氢,是一种具有特殊性质
的有机化合物,它是指由氢原子和氯原子组成的化合物,其分子式为HCl,它是一种无色、有刺激性气味的液体。
对温度非常敏感,容易
被高温破坏,极易变质,氯化氢主要用于医药、冶金、农业、食品工业、还有污水处理等领域。
盐酸的结构
氯化氢分子主要由氢原子和氯原子组成。
其中,氢原子由一个质子和一个电子组成,而氯原子由一个质子和两个电子组成。
氢原子的电子以单核对价方式与氯原子的两个电子形成一个单元,构成一个由H+和Cl-两种离子组成的离子络合物,其分子式为HCl。
盐酸的特性
盐酸具有极强的溶解力,可以溶解几乎所有大部分的金属离子,而且也可以溶解一些非金属离子如氢离子。
由于它的强酸性,它可以用来控制环境的PH值以达到缓解酸雨影响的目的。
此外,由于其微
量元素中的氯原子对某些有机物具有较强的杀菌能力和抑菌能力,因此,盐酸也被广泛用于抑菌和杀菌的消毒工作。
盐酸的用途
盐酸在生活中有很多用途,最常见的用途当属清洗、消毒,由于其弱酸性和有效的抑菌效果,这使得盐酸在家居清洁时受到广泛应用。
此外,由于盐酸具有很强的溶解力,它也是一种常见的实验室试剂,常被用于医学鉴定、科研仪器实验、分析化学实验中。
此外,它也常
被用于水处理,以酸化处理水源中的氧化物、铁锈等有害物质。
盐酸的安全性
盐酸具有毒性,所以在使用时一定要注意安全措施,这样才能避免对周围环境和自己身体产生不良影响。
当使用盐酸时,最好采取防护措施,如戴口罩、穿耐酸衣、佩戴安全眼镜等,以防止氯化氢进入口腔和眼睛,并做好量的止损措施,以免出现大量的事故发生。