2015年天津大学无机化学期中试卷
- 格式:doc
- 大小:227.50 KB
- 文档页数:15

第1章化学反应中的质量关系和能量关系习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g。
3.解:一瓶氧气可用天数4.解:= 318 K℃5.解:根据道尔顿分压定律p(N2) = 7.6104 Pap(O2) = 2.0104 Pap(Ar) =1103 Pa6.解:(1)0.114mol;(2)(3)7.解:(1)p(H2) =95.43 kPa(2)m(H2) == 0.194 g8.解:(1) = 5.0 mol(2) = 2.5 mol结论: 反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:U = Qp pV = 0.771 kJ10.解:(1)V1 = 38.310-3 m3= 38.3L(2) T2 == 320 K(3)W = (pV) = 502 J(4) U = Q + W = -758 J(5) H = Qp = -1260 J11.解:NH3(g) +O2(g)NO(g) +H2O(g)= 226.2 kJ·mol112.解:= Qp = 89.5 kJ=nRT= 96.9 kJ13.解:(1)C (s) + O2 (g) → CO2 (g)=(CO2, g) = 393.509 kJ·mol1CO2(g) +C(s) → CO(g)= 86.229 kJ·mol1CO(g) +Fe2O3(s) →Fe(s) + CO2(g)= 8.3 kJ·mol1各反应之和= 315.6 kJ·mol1。
(2)总反应方程式为C(s) + O2(g) +Fe2O3(s) →CO2(g) +Fe(s)= 315.5 kJ·mol1由上看出:(1)与(2)计算结果基本相等。
所以可得出如下结论:反应的热效应只与反应的始、终态有关,而与反应的途径无关。
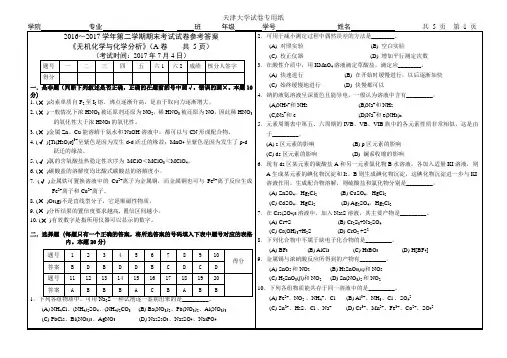
11.下列金属硫化物中,可溶于稀盐酸的是______。
(A) ZnS (B) PbS (C) CuS (D) Ag2S12. 下面三种物质热稳定性顺序正确的是______。
(A) NH4HCO3<Na2CO3<Ag2CO3 (B) NH4HCO3<Ag2CO3<Na2CO3(C) Na2CO3<NH4HCO3<Ag2CO3 (D)Ag2CO3<NH4HCO3<Na2CO313.下列关于硼酸结构的叙述错误的是_______.(A) 硼酸为白色片状晶体,其结构单元为平面三角形的B(OH)3(B) 硼原子通过sp3杂化轨道与三个OH基团成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系14.仅用一种试剂就可以将Ag+, Hg2+, Zn2+, Fe3+, Ni2+ 5种离子区分开,这种试剂可选用_________。
(A) NaCl(B) NaOH (C) K2SO4 (D)H2SO415. 下列有关碱金属过氧化物性质的描述不正确的是_________。
(A)过氧离子中的O-O键不如氧分子中的O-O键牢固(B)碱金属过氧化物具有氧化性(C)碱金属过氧化物具有还原性(D)碱金属过氧化物与冷水反应可生成H2O2, 所以H2O2可看作过氧离子的共轭酸16. 向下列溶液中加入AgNO3溶液,析出黑色沉淀的是_________。
(A)H3PO4(B) NaH2PO4(C) H3PO2(D) Na2H2P2O717. 下列说法不正确的是_________。
(A)还原性HClO4 > HClO3 > HClO(B)热稳定性NaClO > NaClO3 > NaClO4(C)氧化性NaClO >> NaClO3 > NaClO4(D)酸性HClO4 > HClO3 > HClO18. 有关HgCl2和Hg2Cl2的描述不正确的是_________。
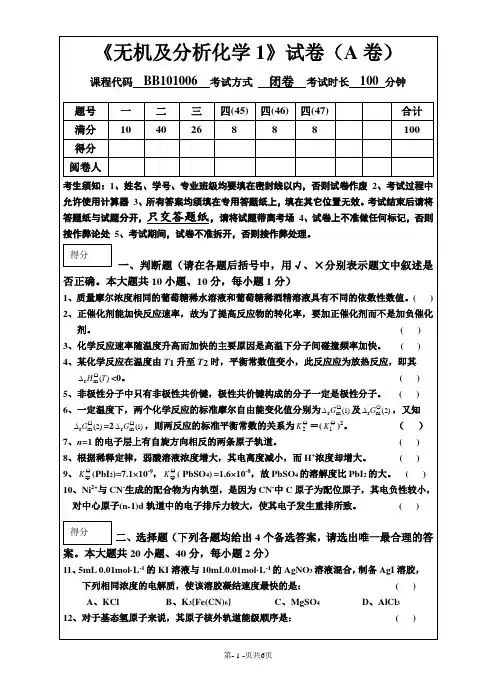

无机化学期中试卷2015.11.17班级 姓名 学号 分数 一、 选择题 ( 共10题 20分 )1. 2 分 (3778) 3778对于一个氧化还原反应,下列各组中所表示的m r G ∆, E 和K 的关系应是…………………………………………………………………………………………… ( )(A) m r G ∆>0; E <0;K <1 (B) m r G ∆>0; E >0;K >1 (C) m r G ∆<0; E <0;K >1 (D) m r G ∆<0; E >0;K <12. 2 分 (0438) 0438关于熵,下列叙述中正确的是…………………………………………………………( )(A) 298K 时,纯物质的 m S = 0 (B) 一切单质的 m S = 0(C) 对孤立体系而言, m r S ∆> 0的反应总是自发进行的 (D) 在一个反应过程中,随着生成物的增加,熵变增大3. 2 分 (3515) 351525℃,2NO 2(g)N 2O 4(g),K c 与K p ( K )的比值( p = 100 kPa )K c /K p 等于…( )(A)2980831.01⨯= 0.0404 (B) 8.31 ⨯ 25 = 207.8(C) 0.0831 ⨯ 298 = 24.8 (D) 0.0821 ⨯ 298 = 24.54. 2 分 (3871) 3871HI 的生成反应的焓变为负值,HI 的分解反应的焓变为正值,则HI 分解反应的活化能 E a ……………………………………………………………………………………………( ) (A) E a <ΔH 分解 (B) E a >ΔH 分解 (C) E a = 0 (D) E a =ΔH 分解5. 2 分 (6709) 6709常用的三种甘汞电极,即(1) 饱和甘汞电极 (2) 摩尔甘汞电极 (3) 0.1 mol ·dm -3甘汞电极其电极反应为:Hg 2Cl 2(s) + 2e - =2Hg(l) + 2Cl -(aq),在25℃ 时三种甘汞电极的 ϕ的大小次序为………………………………………………………………………………… ( )(A) 1ϕ> 2ϕ>3ϕ(B) 2ϕ> 1ϕ>3ϕ(C) 3ϕ> 2ϕ> 1ϕ (D) 1ϕ= 2ϕ=3ϕ6. 2 分 (0436) 0436下列反应中,m r S ∆值最大的是………………………………………………………( )(A) C(s) + O 2(g)−→−CO 2(g) (B) 2SO 2(g) + O 2(g)−→−2SO 3(g)(C) CaSO 4(s) + 2H 2O(l)−→−CaSO 4·2H 2O(s) (D) 3H 2(g) + N 2(g)−→−2NH 3(g)7. 2 分 (0715) 0715已知V 3+/ V 2+的 ϕ= -0.26 V ,O 2/H 2O 的 ϕ= 1.23 V ,V 2+离子在下述溶液中能放出氢的是………………………………………………………………………………………… ( ) (A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 (C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液8. 2 分 (3427) 3427已知25℃时 H 2O(g) H 2(g) O 2(g)m S / J ·mol -1·K -1 188.7 130.6 205.0在标准状态下,生成1 mol 气态水的 m r S ∆为……………………………………………( )(A) 205.0 J ·mol -1·K -1 (B) 188.7 J ·mol -1·K -1(C) 44.4 J ·mol -1·K -1 (D) -44.4 J ·mol -1·K -19. 2 分 (0616) 0616 0.1 mol/L 和0.05 mol/L 的H 2S 水溶液中:…………………………………………( )A. 两者的H +浓度近似相等 B. 两者的S 2-浓度近似相等 C. 前者的H + 浓度是后者的两倍D. 前者的S 2- 浓度是后者的两倍10. 2 分 (3481) 3481下列说法中正确的是…………………………………………………………………( ) (A) 稳定单质的标准生成焓、标准吉布斯生成自由能和标准熵都为零 (B) 放热反应总是可以自发进行的(C) H 2(g)的标准燃烧热等于H 2O(l)的标准生成焓(D) CO 2(g)的标准生成焓也就是CO(g)的标准燃烧热二、填空题 ( 共 7题 20分 ) 11. 5 分 (0770) 0770写出锌电极[ ϕ(Zn 2+/Zn) = -0.763V]与饱和甘汞电极( ϕ= 0.2415V)组成的原电池符号_____________________________________________________________________________; 正极反应______________________________________________________________ ; 负极反应______________________________________________________________ ; 电池反应______________________________________________________________ ; 平衡常数______________________________________________________________。

天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。

无机化学要求:一、独立完成,下面五组题目中,请任选其中一组题目作答,满分100分; 二、答题步骤:1. 使用A4纸打印学院指定答题纸(答题纸请详见附件);2. 在答题纸上使用黑色水笔....按题目要求手写..作答;答题纸上全部信息要求手写,包括学号、姓名等基本信息和答题内容,请写明题型、题号; 三、提交方式:请将作答完成后的整页答题纸以图片形式依次粘贴在一个.......Word .... 文档中...上传(只粘贴部分内容的图片不给分),图片请保持正向、清晰; 1. 上传文件命名为“中心-学号-姓名-科目.doc ” 2. 文件容量大小:不得超过20MB 。
提示:未按要求作答题目的作业及雷同作业,成绩以....................0.分记..!题目如下: 第一组:一、填空题(本题共10分)1. 用电对MnO 4-/Mn 2+,Cl 2/Cl -设计成原电池,其负极反应为 ,正极反应为 ,电池符号为 。
( E (MnO 4-/Mn 2+)=1.51V ; E (Cl 2/Cl -)=1.36V )2. 下列氧化剂:KClO 3、Br 2、FeCl 3、KMnO 4,当其溶液中H +浓度增大时,氧化能力增强的是 。
3. KCN ,NH 4F ,NH 4OAc ,NH 4NO 3,Na 2CO 3,各溶液浓度均为0.1 mol·L -1,按pH 值从小到大顺序排列 。
(已知: K (NH 3·H 2O) =1.8×10-5, K (HF)=6.6×10-4, K (HCN)=6.2×10-10,K (HOAc)=1.8×10-5, 1K (H 2CO 3)=4.4×10-7, 2K (H 2CO 3)=4.8×10-11)4. 2NH 3(g)N 2(g) + 3H 2(g),已知298 K 时, m H r ∆= 92.22 kJ·mol -1,m S r ∆ =198.53 J·mol -1·K -1,则标准状态下,NH 3(g)自发分解的温度是____ ___K 。
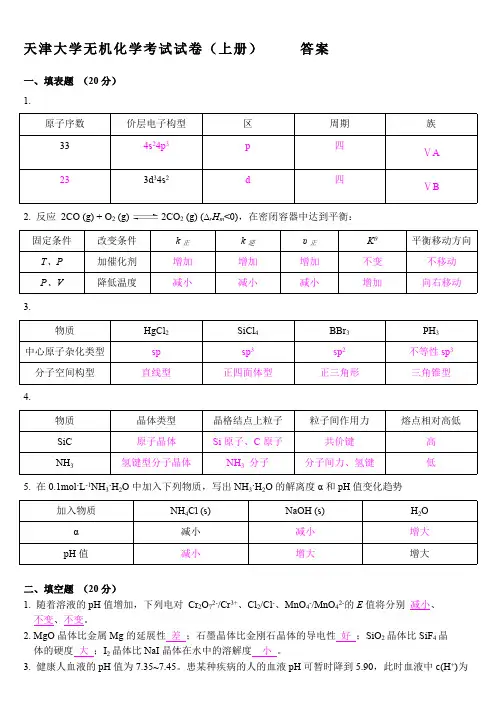
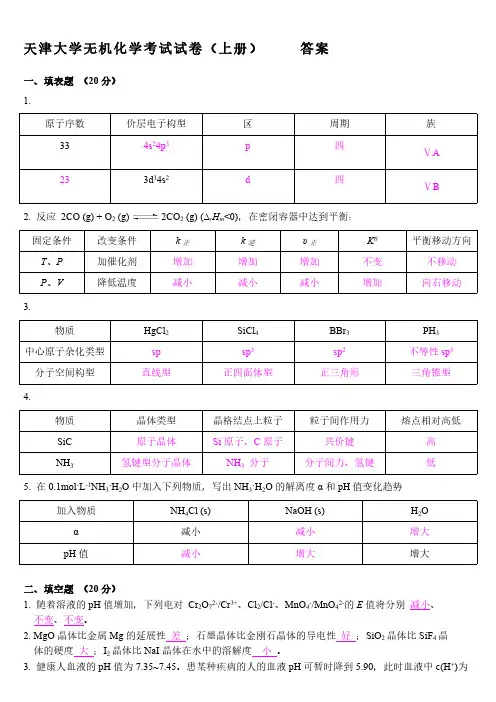
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期族334s24p3p四ⅤA233d34s2d四ⅤB2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P加催化剂增加增加增加不变不移动P、V降低温度减小减小减小增加向右移动3.物质HgCl2SiCl4BBr3PH3中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型4.物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si原子、C原子共价键高NH3氢键型分子晶体NH3分子分子间力、氢键低5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势加入物质NH4Cl (s)NaOH (s)H2O α减小减小增大pH值减小增大增大二、填空题(20分)1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。
患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为s o 正常状态的 28~35 倍。
4. 已知B 2轨道的能级顺序为σ1s σ*1s σ2s σ*2s π2py π2pz σ2px π*2py π*2pz σ*2px ,则B 2的分子轨道分布式为(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最强的是 PbO 2 ,还原性最强的是 Sn 2+ 。

(完整版)⽆机化学(天津⼤学版)第⼀章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)⽤于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想⽓体状态⽅程pV = nRT6.理想⽓体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表⽰化学反应进⾏程度的物理量,符号为ξ,单位为mol。
随着反应的进⾏,任⼀化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,⽽与状态变化的途径⽆关。
10.热和功体系和环境之间因温差⽽传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热⼒学能(U)体系内部所含的总能量。
12.能量守恒定律孤⽴体系中能量是不会⾃⽣⾃灭的,它可以变换形式,但总值不变。
13.热⼒学第⼀定律封闭体系热⼒学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下⽓体:纯⽓体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔⽣成焓()最稳定的单质─────—→单位物质的量的某物质=18.标准摩尔反应焓变()⼀般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(⽣成物) + Σνi(反应物)第⼆章化学反应的⽅向、速率和限度[学习指导]1.反应速率:单位体积内反应进⾏程度随时间的变化率,即:2.活化分⼦:具有等于或超过E c能量(分⼦发⽣有效碰撞所必须具备的最低能量)的分⼦。

1/8【育明教育】中国考研考博专业课辅导第一品牌官方网站: 12015年天津大学考研指导育明教育,创始于2006年,由北京大学、中国人民大学、中央财经大学、北京外国语大学的教授投资创办,并有北京大学、武汉大学、中国人民大学、北京师范大学复旦大学、中央财经大学、等知名高校的博士和硕士加盟,是一个最具权威的全国范围内的考研考博辅导机构。
更多详情可联系育明教育孙老师。
无机材料科学基础一、考试的总体要求要求考生从材料学学科领域的范畴,较系统地掌握各部分章节的基础理论和基本知识,了解与无机固体材料性能密切相关的物质结构特征,与过程相关的材料行为规律。
从微观、宏观、物质内部及表面、静态、动态等不同角度,认识无机非金属材料的基本特性。
具备综合运用所学知识进行分析和解决实际问题的能力。
为从事材料的设计与制造,新材料的研究与开发,以及继续进行专业学习奠定基础。
二、考试的内容及比例第1章结晶学基础(20~25分)①等同点及空间格子、布拉维法则和面角守恒定律;②晶体的宏观对称、宏观对称要素的组合、对称型(点群)、晶族、晶系及晶体常数特征;③晶体定向、结晶符号及其相互联系;④十四种空间格子、晶体的微观对称要素;⑤点群、空间群及其国际符号;⑥球体紧密堆积原理;⑦晶体化学基本原理:配位数和配位多面体、离子极化、电负性、鲍林规则及应用。
第2章晶体结构与晶体中的缺陷(20~30分)①无机非金属材料组成与晶体结构类型:金刚石结构、NaCl 结构、闪锌矿结构、萤石结构、钙钛矿结构;②层状和架状硅酸盐晶体结构;③缺陷化学反应表示法、热缺陷浓度计算;④位错的基本类型;⑤外表面、晶界与亚晶界;⑥固溶体特点、分类及其研究方法,置换型固溶体中“组分缺陷”反应表示,非化学计量化合物的各种缺陷反应。
第3章熔体和玻璃(10~15分)①无机熔体的结构理论和熔体性质;②玻璃的通性;③玻璃形成的基本条件;④玻璃的结构及结构参数。
第4章表面与界面(10~15分)①表面能和表面张力;②表面的驰豫、重构及双电层、固体的表面能;③弯曲表面效应;表面润湿,粘附、吸附和表面改性;④界面特性:晶界偏析、晶界迁移、晶界应力、晶界电荷与静电势;124第5章相平衡与相图(30~40分)①相与相平衡的基本概念;②单元和二元系统相图各种基本类型的阅读分析;③三元相图中的基本类型,运用相图的基本规则来确定相图中的点和线的性质以及相平衡和非平衡条件下的析晶路程。
天津大学无机化学考试试卷〔下册〕答案一、是非题〔推断以下表达是否正确,正确的在括号中画√,错误的画X〕(每题 1 分,共 10 分) 1、( X )在周期表中,处于对角线位置的元素性质相像,这称为对角线规章。
2、( X )SnS 溶于Na S 溶液中,生成硫代亚锡酸钠。
2 23、( X )磁矩大的协作物,其稳定性强。
4、( X )氧族元素氢化物的沸点凹凸次序为H O>H S>H Se>H Te。
2 2 2 35、(√)[HgCl ]2-的K= 10-16,当溶液中c(Cl-)=·L-1 时,c(Hg2+)/c([HgCl ]2-)的比值为10-12。
4 46、( √)假设某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X )硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO -可以被 OH-复原为 MnO 2-。
4 49、(√)协作物 Na [Ag(S O ) ]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
3 2 3 210、(X )Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题〔在以下各题中,选择出符合题意的答案,将其代号填入括号内〕 (每题 1 分,共20 分) 1、在以下各种酸中氧化性最强的是............... ( B )。
(A)HClO ;(B)HClO;(C)HClO ;(D)HCl。
3 42、以下浓酸中,可以用来和KI(s)反响制取较纯 HI(g)的是...............( C )。
(A)浓HCl;(B)浓H SO ;(C)浓H PO ;(D)浓HNO 。
2 434 33、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D )。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是由于钛镍合金. ............... ( C )。
育明教育中国考研专业课辅导第一品牌育明教育官方网站:1育明教育天津分校20152015年天津地区年天津地区年天津地区151515所高校考研辅导必备所高校考研辅导必备天津分校地址南京路新天地大厦天津分校地址南京路新天地大厦20072007专注考研专业课辅导专注考研专业课辅导88年天津地区专业课辅导第一品牌天津分校李老师与大家分享资料育明教育,创始于2006年,由北京大学、中国人民大学、中央财经大学、北京外国语大学的教授投资创办,并有北京大学、武汉大学、中国人民大学、北京师范大学复旦大学、中央财经大学、等知名高校的博士和硕士加盟,是一个最具权威的全国范围内的考研考博辅导机构。
更多详情可联系育明教育天津分校李老师。
2015年天津大学化学专业0703目录考试科目真题及内部资料理学院专业代码、名称及研究方向人数考试科目备注070300化学_0110070300①101思想政治理论②201英语一③718有机化学④839物理化学复试科目:无机化学育明教育中国考研专业课辅导第一品牌育明教育官方网站:2考研政治每年平均分在4,50分,不是很高,政治取得高分除了靠记忆力还要有一定的技巧,今天我就考研政治中的一些答题技巧,来和同学们分享一下。
选择题分值为50分。
其中单选题16道,满分16分;多选题17道,满分34分。
选择题由于考查范围广,涉及的知识点零散,这种题型很需要考生对教材和大纲有系统而熟练的掌握。
选择题中,多选题的难度较大,它是拉开政治分数的一个题型之一。
单项选择题政治单选是属于必得的高分题型。
而应对单选这种题型,考生在记忆相关概念时一定要明晰,不能模棱两可,尤其是容易混淆的概念,一定要注意区分。
而最能帮助考生区分的方法是适度的习题训练,通过练习来加强记忆和理解。
在得分方面,单选题总分值在16分,考生最好拿12分以上的分数。
解答单项选择题要掌握一定的技巧,掌握技巧的前提是形成正确的解题思路。
第一步是读懂题,审好题,准确把握题干的规定性。
第一章化学反应中得质量关系与能量关系[学习指导]1。
“物质得量”(n)用于计量指定得微观基本单元或其特定组合得物理量,其单位名称为摩[尔],单位符号为mol。
2、摩尔质量(M)M= m/n3、摩尔体积(V m)V m = V/n4、物质得量浓度(cB)c B = nB/V5、理想气体状态方程pV = nRT6、理想气体分压定律p= Σp B ;p B=(nB/n)p7、化学计量式与化学计量数O =ΣνB B ;νBﻫB8、反应进度(ξ)表示化学反应进行程度得物理量,符号为ξ,单位为mol。
随着反应得进行,任一化学反应各反应物及产物得改变量:ΔnB=νBξ9、状态函数状态函数得改变量只与体系得始、终态有关,而与状态变化得途径无关。
10、热与功体系与环境之间因温差而传递得热量称为热.除热以外,其它各种形式被传递得能量称为功.11、热力学能(U)体系内部所含得总能量。
12、能量守恒定律孤立体系中能量就是不会自生自灭得,它可以变换形式,但总值不变。
13、热力学第一定律封闭体系热力学能得变化:ΔU= Q+WﻫQ > 0,W> 0, ΔU > 0;Q〈 0, W〈0, ΔU < 0。
14、恒压反应热(Qp)与反应焓变(Δr Hm)H(焓)≡ U + pV,Q p = ΔrHm15、赫斯定律Q p= ∑Q B,Δr H m= ∑Δr Hm(B)ﻫBB16、标准状况: p= 101、325kPa, T= 273、15 K标准(状)态:pθ= 100kPa下ﻫ气体:纯气体物质液体、固体:最稳定得纯液体、纯固体物质。
ﻫ溶液中得溶质:摩尔浓度为1mol·L-1ﻫ标准态下17 ﻫ、标准摩尔生成焓() 最稳定得单质─────-→ 单位物质得量得某物质=18、标准摩尔反应焓变() 一般反应cC + dD = yY + zZ=[y(Y) + z(Z)]— [c(C)+d(D)]=Σνi(生成物) + Σνi(反应物)第二章化学反应得方向、速率与限度[学习指导]1、反应速率:单位体积内反应进行程度随时间得变化率,即:2、活化分子:具有等于或超过E c能量(分子发生有效碰撞所必须具备得最低能量)得分子。
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期334s24p3p四233d34s2d四2.反应 2CO (g) + O (g)2CO(g) (?H <0),在密闭容器中达到平衡:22r m固定条件改变条件k 正k 逆υ正KθT、P加催化剂增加增加增加不变P、V降低温度减小减小减小增加3.物质HgCl2SiCl4BBr 3中心原子杂化类型sp sp3sp2分子空间构型直线型正四面体型正三角形4.族ⅤAⅤB平衡移动方向不移动向右移动PH3不等性 sp3三角锥型物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si 原子、 C 原子共价键高NH 3氢键型分子晶体NH 3分子分子间力、氢键低5.在 0.1mol?L-1NH3 ?H2O 中加入下列物质,写出 NH 3 ?H2O 的解离度α和 pH 值变化趋势加入物质NH 4NaOH (s)2 OCl (s)H α减小减小增大pH 值减小增大增大二、填空题(20分)2-/Cr 3+、Cl2-、 MnO 4-2-的 E 值将分别减小、1. 随着溶液的 pH 值增加,下列电对 Cr2O7/Cl/MnO 4不变、不变。
2. MgO 晶体比金属 Mg 的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比 SiF4晶体的硬度大;I2晶体比 NaI 晶体在水中的溶解度小。
3.健康人血液的 pH 值为 7.35~7.45。
患某种疾病的人的血液 pH 可暂时降到 5.90,此时血液中 c(H+)为正常状态的28~ 35 倍。
*****4. 已知 B2轨道的能级顺序为σ1sσ1sσ2sσ2sπ2pyπ2pzσ2pxπ2pyπ2pzσ2px,则B2的分子轨道分布式为2* 2 2 * 2 1 1。
(σ1s ) (σ1s ) (σ2s ) (σ2s ) (π2py ) (π2pz ) ,成 数目及名称 两个 子 π ,价 构式θ θ - /Mn 2+ θ 4+ 2+5. 根据 E (PbO 2/PbSO 4) >E (MnO 4 ) >E (Sn /Sn ),可以判断在 成 的六种物 中,氧化性最的是 PbO 2 , 原性最 的是Sn 2+ 。
无机化学期中试卷2015.11.17班级 姓名 学号 分数一、 选择题 ( 共10题 20分 )1. 2 分 (3778) 3778对于一个氧化还原反应,下列各组中所表示的 m r G ∆, E 和K 的关系应是…………………………………………………………………………………………… ( )(A) m r G ∆>0; E <0;K <1 (B) m r G ∆>0; E >0;K >1 (C) m r G ∆<0; E <0;K >1 (D) m r G ∆<0; E >0;K <12. 2 分 (0438) 0438关于熵,下列叙述中正确的是…………………………………………………………( )(A) 298K 时,纯物质的 m S = 0 (B) 一切单质的 m S = 0(C) 对孤立体系而言, m r S ∆> 0的反应总是自发进行的(D) 在一个反应过程中,随着生成物的增加,熵变增大3. 2 分 (3515)25℃,2NO 2(g)N 2O 4(g),K c 与K p ( K )的比值( p = 100 kPa )K c /K p 等于…( )(A) 2980831.01⨯= 0.0404(B) 8.31 ⨯ 25 = 207.8 (C) 0.0831 ⨯ 298 = 24.8(D) 0.0821 ⨯ 298 = 24.54. 2 分 (3871) 3871HI 的生成反应的焓变为负值,HI 的分解反应的焓变为正值,则HI 分解反应的活化能E a ……………………………………………………………………………………………( )(A) E a <ΔH 分解 (B) E a >ΔH 分解 (C) E a = 0 (D) E a =ΔH 分解5. 2 分 (6709) 6709常用的三种甘汞电极,即(1) 饱和甘汞电极 (2) 摩尔甘汞电极 (3) 0.1 mol ·dm -3 甘汞电极 其电极反应为:Hg 2Cl 2(s) + 2e -= 2Hg(l) + 2Cl -(aq),在25℃ 时三种甘汞电极的ϕ的大小次序为…………………………………………………………………………………( )(A) 1ϕ> 2ϕ>3ϕ (B) 2ϕ> 1ϕ>3ϕ (C) 3ϕ> 2ϕ> 1ϕ(D) 1ϕ= 2ϕ= 3ϕ6. 2 分 (0436)下列反应中,m r S ∆值最大的是………………………………………………………( )(A) C(s) + O 2(g)−→−CO 2(g) (B) 2SO 2(g) + O 2(g)−→−2SO 3(g)(C) CaSO 4(s) + 2H 2O(l)−→−CaSO 4·2H 2O(s) (D) 3H 2(g) + N 2(g)−→−2NH 3(g)7. 2 分 (0715) 0715已知V 3+ / V 2+ 的 ϕ= -0.26 V ,O 2/H 2O 的 ϕ= 1.23 V ,V 2+离子在下述溶液中能放出氢的是………………………………………………………………………………………… ( )(A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 (C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液8. 2 分 (3427) 3427已知25℃时 H 2O(g) H 2(g) O 2(g)m S / J ·mol -1·K -1 188.7 130.6 205.0在标准状态下,生成1 mol 气态水的 m r S ∆为……………………………………………( )(A) 205.0 J ·mol -1·K -1 (B) 188.7 J ·mol -1·K -1 (C) 44.4 J ·mol -1·K -1 (D) -44.4 J ·mol -1·K -19. 2 分 (0616) 06160.1 mol/L 和0.05 mol/L 的H 2S 水溶液中:…………………………………………( )A. 两者的H + 浓度近似相等B. 两者的S 2- 浓度近似相等C. 前者的H + 浓度是后者的两倍D. 前者的S 2- 浓度是后者的两倍10. 2 分(3481)3481下列说法中正确的是…………………………………………………………………()(A) 稳定单质的标准生成焓、标准吉布斯生成自由能和标准熵都为零(B) 放热反应总是可以自发进行的(C) H2(g)的标准燃烧热等于H2O(l)的标准生成焓(D) CO2(g)的标准生成焓也就是CO(g)的标准燃烧热二、填空题( 共7题20分)11. 5 分(0770)0770写出锌电极[ϕ= 0.2415V)组成的原电池ϕ(Zn2+/Zn) = -0.763V]与饱和甘汞电极(符号_____________________________________________________________________________;正极反应______________________________________________________________ ;负极反应______________________________________________________________ ;电池反应______________________________________________________________ ;平衡常数______________________________________________________________。
12. 5 分(0705)0705配平下列各反应方程式:−Pb(NO3)2 + Br2 + HMnO4 + H2O(1)PbO2 + MnBr2 + HNO3 −→−K2CrO4 + KIO4 + KCl + H2O(2)CrI3 + Cl2 + KOH−→13. 2 分 (0819) 0819请填写下面的空格:化学反应条件的改变对E ,k ,K 的影响活化能E a速率常数k平衡常数K升高温度 加正催化剂14. 2 分 (3487) 3487已知反应:2-4MnO + 10Cl - + 16H+2Mn 2+ + 5Cl 2 + 8H 2Om r G ∆ 1 = -142.0kJ ·mol -1Cl 2 + 2Fe 2+2Cl - + 2Fe 3+mr G ∆ 2= -113.6kJ ·mol -1则反应-4MnO + 5Fe2+ + 8H +Mn 2+ + 5Fe 3+ + 4H 2O 的m r G ∆为kJ ·mol -1。
15. 2 分 (0569) 0569由N 2和H 2化合生成NH 3的反应中,m r H ∆< 0,当达到平衡后,再适当降低温度则正反应速率将_____________,逆反应速率将_____________,平衡将向________方向移动;平衡常数将________________。
16. 2 分 (0137) 0137将 N 2和H 2 按 1:3 的体积比装入一密闭容器中,在 400 ℃ 和 10 MPa 下达到平衡时,NH 3 的体积分数为 39% , 这时3NH p =____________________________ MPa,2N p =_____________________________ MPa ,2H p =___________________________ MPa 。
17. 2 分 (0676) 0676pH = 9.56的NH 4Cl 和NH 3·H 2O 的混合溶液中NH 4Cl 和NH 3·H 2O 的物质的量浓度比是_____________________________________。
( NH 3·H 2O 的p K b = 4.74 )三、计算题 ( 共 6题 40分 ) 18. 10 分 (3638) 36380.090 mol ·dm -3 Mn(ClO 4)2,0.060 mol ·dm -3Cu(ClO 4)2,0.45 mol ·dm -3 HClO 4等体积混合,再通入H 2S(g) 至饱和,计算该溶液中Cu 2+、Mn 2+的浓度。
(已知:H 2S :K 1 = 5.7 ⨯ 10-8, K 2 = 1.2 ⨯ 10-15, K sp (MnS) =1.4 ⨯ 10-15,K sp (CuS) =3.6 ⨯ 10-36)19. 10 分 (3569) 3569已知气相反应N 2O 4(g)2NO 2(g),在45℃时向 1.00 dm 3真空容器中引入6.00mmol N 2O 4,当平衡建立后,压力为25.9 kPa 。
(1) 计算45℃时N 2O 4的解离度α 和平衡常数 p K ;(2) 已知该反应m r H ∆= 72.8 kJ ·mol -1,求该反应的 m r S ∆;(3) 计算100℃时的 p K 和m r G ∆。
20. 5 分(6604)6604将2.16 g丙酸HC3H5O2与0.56 g NaOH混合溶于足量水后,准确稀释到100 dm3容量瓶中,计算该溶液pH值。
(丙酸p K a = 4.89)21. 5 分 (9614) 9614根据下列热力学数据计算MgSO 4和MgCO 3溶解过程的吉布斯自由能变m sol G ,判断它们溶解的难易。
若难溶还应计算其K sp 。
MgSO 4(s) MgCO 3(s) Mg 2+(aq) SO 42-(aq)CO 32-(aq)m f H / kJ ·mol -1 -1278.2 -1112.9 -461 -909.2 -677.0 m S / J ·mol -1·K -1 91.665.7 -117.9 20.1-56.822. 5 分 (0486)0486由以下热化学方程, 计算298 K 时N 2O(g) 的标准摩尔生成焓。
(1) C(s) + N 2O(g)−→−CO(g) + N 2(g)m r H ∆ 1 = -192.9 kJ ·mol -1 (2) C(s) +O 2(g)−→−CO 2(g)m r H ∆ 2 = -393.5 kJ ·mol -1 (3) 2CO(g) + O 2(g)−→−2CO 2(g) m r H ∆ 3 = -566.0 kJ ·mol -13703已知[H+] = 1.0 mol·dm-3时,锰的元素电位图(ϕ/ V):MnO-4───MnO-24───MnO2───Mn3+───Mn2+───Mn(1) 指出哪些物质在酸性溶液中会发生歧化反应;(2) 求ϕ(MnO4-/Mn2+);(3) 写出用电对Mn2+/Mn与标准氢电极组成原电池的电池符号及该电池的自发反应的方程式。