物理化学实验二 中和热的测定
- 格式:pdf
- 大小:102.68 KB
- 文档页数:2


中和热的测定一、实验目的1.掌握中和热的测定方法;2.通过中和热的测定,计算弱酸的离解热。
二、实验原理一摩尔的一元强酸溶液与一摩尔的一元强碱溶液混合时,所产生的热效应是不随着酸或碱的种类而改变的,因为这里所研究的体系中各组分是全部电离的。
因此,热化学方程式可用离子方程式表示:H++OH==H20 ΔH中和=一57.36kJ·mol-1上式可作为强酸与强碱中和反应的通式。
由此还可以看出,这一类中和反应与酸的阴离子或碱的阳离子并无关系。
若以强碱(NaOH)中和弱酸(CH3COOH)时,则与上述强酸、强碱的中和反应不同。
因为在中和反应之前,首先是弱酸进行解离,其反应为:CH3COOH = H++CH3COO—ΔH解离H++OH==H20 ΔH中和总反应:CH3COOH+OH—=H20+CH3COO—ΔH由此可见,ΔH是弱酸与强碱中和反应总的热效应,它包括中和热和解离热两部分。
根据盖斯定律可知,如果测得这一反应中的热效应ΔH以及ΔH中和,就可以通过计算求出弱酸的解离热ΔH解离。
三、仪器和试剂数字式贝克曼温度计; 杜瓦瓶; 量筒; 秒表;双路可跟踪直流稳定电源;浓度各为1.0mol的NaOH、HCI和CH3COOH溶液。
四、操作步骤1、实验准备清洗仪器。
打开数字式贝克曼温度计,预热5分钟。
调节基温选择按钮至20~C,按下温度/温差按键,使表盘显示温差读数(精确至0.001℃)。
打开直流稳压电源,调节电压10.0V。
连接稳压直流电源与量热计。
2.量热计常数的测定用量筒量取500ml蒸馏水注入用净布或滤纸擦净的杜瓦瓶中,轻轻塞紧瓶塞。
接通电源,调节旋钮记下10.0V时电流读数。
均匀搅拌4分钟。
然后,切断电源,每分钟记录一次贝克曼温度计的读数,记录10分钟。
读第10个数的同时,接通电源,并连续记录温度。
在通电过程中,电流、电压必须保持恒定(随时观察电流表与电压表,若有变化必须马上调节到原来指定值)。
记录电流、电压值。

学生实验中和热的测定实验目的测定强酸与强碱反应的中和热,加深理解中和反应是放热反应。
实验用品大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
mol/L 盐酸、mol/L NaOH 溶液①。
实验步骤1 •在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
碎泡沫塹飄圏中和热的测定2 •用一个量筒量取L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
3. 用另一个量筒量取50mL mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
4. 把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。
用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
5. 重复实验两次,取测量所得数据的平均值作为计算依据6. 根据实验数据计算中和热为了使计算简便一些,我们近似地认为:⑴mol/L盐酸和LNaOH溶液的密度都是1g/cm3,所以50mL L盐酸的质量m1=50g, 50mL mol/L NaOH 溶液的质量m2=50 g。
⑵中和后生成的溶液的比热容c= J/(g「C ),由此可以计算出,50mL mol/L盐酸与50mL mol/L NaOH溶液发生中和反应时放出的热量为:(m1+m2) • c • (t2-t1)=(t2-t1) kJ又因50 mol/L盐酸中含有mol的HCI,mol的HCI与mol NaOH发生中和反应,生成molH2O,放出的热量是(t2-t1) kJ,所以,生成1molH2O时放出的热量即中和热为:A H =0.418(t a- tj0.025kJ / mol问题和讨论要想提高中和热测定的准确性,实验时应注意什么?实验说明:1.作为量热器的仪器装置,其保温隔热的效果一定要好。


实验 中和反应热的测定【实验目的】1、理解中和热的概念。
2、学习中和热的测定方法。
3、通过实验,进一步领会做定量实验的方法。
【知识点回顾】中和热概念:酸与碱发生中和反应生成1molH 2O 时所释放的热量【实验原理】1、0.50mol ·L -1盐酸和0.55 mol ·L -1NaOH 溶液的密度都是1g ·cm -3,所以50mL 0.50mol ·L-1盐酸的质量m 1=50g ,50mL 0.55mol ·L -1NaOH 溶液的质量m 2=50g 。
2、中和后生成的溶液的比热容c=4.18J ·(g ·℃)-1,由此可以计算出0.50mol ·L -1盐酸与0.55mol ·L -1NaOH 溶液发生中和反应时放出的热量为(m 1+m 2)·c ·(t 2-t 1)=0.418(t 2-t 1)kJ又因50mL 0.50mol ·L -1盐酸中含有0.025molHCl ,0.025molHCl 与0.025molNaOH 发生中和反应,生成0.025molH 2O ,放出的热量是0.418(t 2-t 1)kJ ,所以生成1 molH 2O 时放出的热量即中和热为 △H=-025.0)(418.012t t kJ ·mol -1 【实验用品】大烧杯(500mL )、小烧杯(100mL )、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料或硬纸板(中心有两个小孔),环形玻璃搅拌棒。
0.50mol ·L -1盐酸、0.55mol ·L -1NaOH 溶液。
注:为了保证0.50mol ·L -1盐酸完全被NaOH 中和,采用0.55mol ·L -1NaOH 溶液,使碱稍微过量。
【实验过程】一、测定前的准备工作1、 温度计的使用。

中和热
一.中和热的定义:在中,和发生中和反应而生成水,这时的反应热叫做中和热
1. 条件:稀溶液
2. 反应物:强酸与强碱的稀溶液
3. 生成1mol水,若反应过程中有其它物质生成,这部分反应热不在中和热之内
二.中和热的测定实验
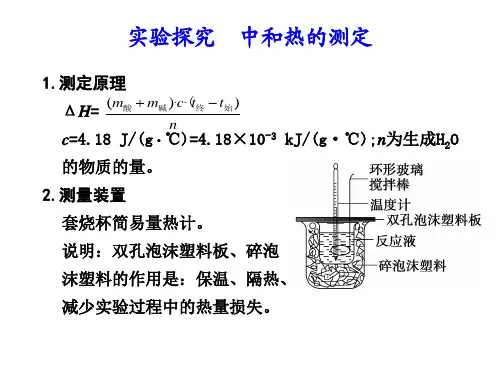
1、测量装置:
1、环形玻璃搅拌棒的作用
2、能否将环形玻璃搅拌棒换成铁质的
3、温度计的作用
4、碎泡沫塑料的作用
5.实验过程中为什么不用0.5mol/l的NaOH溶液
2、操作步骤
(1)量取50 mL0.50 mol/L的盐酸,倒入小烧杯中,测定其温度,记作tHCl,然后将温度计上的酸用水冲洗干净。
原因:__________
(2)用另一个量筒量取50 mL 0.55 mol/L NaOH溶液,测定其温度,记作tNaOH。
(3)先将温度计和环形玻璃搅拌棒放入小烧杯中,然后把量筒中的NaOH溶液一次倒入小烧杯中(注意不要洒到外面),用环形玻璃搅拌棒轻轻搅动溶液并准确读取混合溶液的________温度,记作t终。
(4)重复上述实验两次,取测量所得数据的________作为计算依据。
3、实验原理
4、误差分析。


中和热的测定一、实验目的:1.通过实验了解中和热的概念;2.了解用量热计来直接测定反应热的实验方法与操作技能;3.学习用图解法进行数据处理,以求得正确 T 的方法;4.学习使用精密直流稳压电源和精密数字温度温差仪。
二、实验原理:在一定温度和浓度下,酸和碱进行中和反应时产生的热效应称为中和热。
对于强酸和强碱,由于它们在水中完全解离,中和反应实质上是+H 和-OH 的反应。
因此在浓度足够低的条件下,不同的强酸强碱的中和热几乎是相同的,例如在25℃时,进行一个单位反应的热化学方程式为O H OH H 2→+-+1.36.57--=∆mol kj H m r (1)对于弱碱和强碱进行的中和反应,情况有所不同。
以醋酸的中和反应为例,因为醋酸的解离度很小,故可以认为是-OH 与HAc 进行的中和反应。
因为中和热θmr H ∆只决定于始终态,而与过程无关,所以将其设计为两步进行:生成和的解离反应和O H OH H 2-+c HA解,m r H Ac H HAc ∆+⇔-+,中m r H O H OH H ∆→+-+2根据盖斯定律,有中解,,m r m r m r H H H ∆+∆=∆ (2)则中解,,m r m r m r H H H ∆-∆=∆ (3)本实验利用热量计分别测定盐酸和氢氧化钠中和反应的中,m rH ∆,利用(3)式即可求得醋酸的解离热解rHm ∆。
为此首先利用电热法标定热量计常数K ,对热量计施以电压U (伏)、电流强度I (安倍),并通过t (秒)后,使热量计温度升高T ∆(K).根据焦耳——楞次定律可知,热量计常数K 为: TIU K t∆=(4) K 的物理意义是热量计升高1K 时所需要的热量。
它是热量计中的水及各部分的热容之和。
等量酸碱的中和热均由下式计及中r H m ,∆∆r H m :1000⨯∆-=∆CVTK H m r (5) 三、实验仪器和试剂:热量计(包括杜瓦瓶、电热丝、储液管、磁力搅拌器);精密直流稳压电源;精密数字温度温差仪;量筒(500ml 、50ml )各一个;1 mol ·dm-3NaOH;1mol ·dm-3HCl;;1mol ·dm-3CH 3COOH 。

实验: 中和热的测定●实验用品大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液●教学过程[引言]前两节课我们了解了什么是放热反应和吸热反应,怎么写热化学方程式。
回忆一下放热反应有哪些?包括:中和反应,燃烧反应,大多数化合反应,金属与酸或水的反应,铝热反应等等,在写这些反应的热化学方程式时,他们的反应热是正还是负?负值[板书]实验二中和热的测定●实验目的测定强酸、强碱反应的中和热。
[设问]在了解这个实验之前我们先来了解下这个中和热是什么,他和反应热一样吗?【板书】中和热:在稀溶液中,强酸强碱发生中和反应时生成1mol水时释放的热量称为中和热。
[问]中和热与反应热是否相同?它们之间有什么区别和联系?【答】不同!它们都是指化学反应放出的能量,但中和热仅指在稀溶液中,酸跟碱发生中和反应而生成1 mol水时的反应热。
任何一个化学反应发生所放出的热量都叫反应热,但却不一定是中和热。
[师]回答得很好!本节课,我们取一定量的盐酸和氢氧化钠溶液发生中和反应,哪些数据可以帮助测出它们的反应热呢?请大家讨论回答。
【答】测量温度[教师板书]Q=mcΔt ①Q:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
[问]我们如何得到上述数据呢?[生]m的质量为所用酸、碱的质量和,测出参加反应的酸、碱质量相加即可;c需要查阅,Δt可用温度计测出反应前后的温度相减得到。
[问]酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?[讲解]本实验中,我们所用一元酸、一元碱的体积均为50 mL,它们的浓度分别为0.50 mol/L和0.55 mol/L。
由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃)[板书]V酸=V碱=50 mL。

中和热的测定一、实验目的1.了解中和热测定原理;2.掌握中和热的测定方法。
二、实验原理在一定的温度,压力和浓度下,1mol酸和1mol碱中和所放出的热量叫做中和热。
对于强酸和强碱在水溶液中几乎完全电离,中和反应的实质是溶液中氢离子和氢氧根离子反应生成水。
这类中和反应的中和热与酸的阴离子的碱的阳离子无关。
当在足够稀释的情况下中和热不随酸和碱的种类而改变的,中和热几乎是相同的。
20℃,△H中和=-57.11KJ/mol25℃,△H中和=-57.30KJ/mol当溶液相当浓时,中和热数值常较高,因为离子间相互作用力及其因素影响。
电热标定法:对量热计及一定量的水在一定的电流,电压下通电一定时间,使量热计升高一定温度,根据供给的电能及量热计温度升高值,计算量热计的热容K。
K=IUt/△T (K的物理意义是热量计升高1K时所需的热量)△rHm=-1000K△T/CV上式中C为酸或碱的初始浓度(mol/L),V为酸或碱的休积(ml),负号代表放热反应。
三、实验主要仪器与试剂热量计(包括杜瓦瓶,电热丝,储液管,磁力搅拌器)1套精密直流稳压电流1台精密数字温度温差仪1台量筒1 mol/LNaOH溶液1 mol/LHCl溶液四、实验步骤1.热量计常数K的测定①.在杜瓦瓶中放入500mL蒸馏水,打开磁力搅拌器,搅拌。
②.开启精密直流稳压电流,调节输出电压和电流(电压为5V左右),电压稳定后将其中一根接线断开。
③.按下精密数字温度温差仪开关,片刻后按一下“采零”键,再设定“定时”1分钟,此后每分钟记录一次温差,当记下第十个读数时,立即将接线接上(此时即为加热的开始时刻),并连续记录温差。
④.待温度升高0.8-1.0时,关闭稳压电源开关,并记录通电时间t。
继续搅拌,每间隔一分钟记录一次温差,断电后测定10个点为止。
用作图法确定由通电而引起的温度变化△T1。
2.中和热的测定①将杜瓦瓶中的水倒掉,用干布擦干,重新用量筒取400mL蒸馏水注入其中,然后加入50mL1 mol/LHCl溶液,再取50mL1 mol/LNaOH溶液注入储液管中。
实验二中和热的测定一目的1掌握中和热的测定方法2经过中和热的测定计算弱酸的解离热3学习贝克曼温度计的使用方法二原理1一元强酸强碱的中和反响,中和热不随酸碱种类而改变。
热化学方程式可用离子方程式表示(系统中各组分所有电离):H++OH-=H2O△H=-57.36 kj/mol2强碱中和弱酸( HAC )时,HAC 解离出 H+,进一步与 OH-反响,反响式为:CH3COOH=H++CH3COO-△H解离H+-2△H中和+OH =H O总反响为: CH32△HCOOH+OH-=H O依据盖斯定律:△ H=△ H中和 +△H 解离3弱酸的解离热:△ H解离=△ H-△H中和三仪器及药品量筒 500ml( 一只 ) 50ml(一只)中和热丈量装置一套剖析天平纯水机浓度各为 1mol/l的NaOH,HCl,HAC溶液四操作1量热计常数的测定(1)准备①量热杯中加入 500ml 水, 放入磁珠,调整适合的转速。
②传感器插入量热杯中,接通电热丝和夹子,“测试状态”调理“加热功率”为 2.5 “待机状态”,取下电热丝上的随意夹子③温度稳固后,切换到“测试状态”,仪器队温差自动采零 , 设定“准时”60s 记录一次温差,蜂鸣(2)加热①记录第十次时,接通电热丝和夹子。
加热开始,记录温度和时间②待温度高升 0.8-1 ℃时,取下电热丝上的夹子。
记录通电时间t③持续搅拌,一次 / 分,记录十次温度(3)求△ T1,作图法求出通电惹起的△ T1(雷诺校订法确立)2 中和热的测定(1)量热杯中注入 400ml 水,再加入 50ml1mol/l的HCl,取50ml1mol/l的NaOH 溶液注入碱储液管中(2)调理磁珠转速,放入碱管,盖好瓶盖。
记温度( 1 次/ 分),10 次(3)加入碱液,连续记录温度 1 次/ 分(4)温度上涨后,温度保持一段时间不变,即可停止(5)作图法求△ T23醋酸解离热的测定用 1mol/l 的醋酸取代盐酸溶液重复 2 操作求△ T3五数据记录和办理记录 P=2.5W△T1△T2△T31量热计常数的计算K=Pt/ △T1量热计每高升1℃时所需的热量J/K2中和热的计算△H中和 =-K△ T2*1000/CV C:mol/l V:ml3解离热的计算△H=-K △T3*1000/CV△H解离=△H-△H中和六注意事项1电热丝不可以干烧,杯中加水后才能接上电源夹子。
实验中和热的测定(恒压量热法)[实验目的]1、掌握量热计常数k值的化学标定法(ΔH = - K·ΔT);2、测定HAc与NaOH反应的反应热ΔH总并计算HAc的电离热ΔH电离;3、学会用雷诺图解法校正温差ΔT的方法。
[基本原理]强酸强碱反应:H + + OH - === H2O ΔH中和第一步:HAc === H + + Ac -ΔH电离弱酸强碱反应:第二步:H + + OH - === H2O ΔH中和总反应:HAc + OH - === H2O + Ac - Δ总H = ΔH中和+ΔH电离1、热平衡式:ΔH总= - K·ΔTΔH总-- 恒压热效应k -- 量热计常数ΔT -- 反应前后的温差2、k值的标定:利用NaOH与HCl的中和热确定k值。
H + + OH - === H2O ΔH m,中和= -57111.6+209.2(t/℃-25)J·mol-1k = -n·ΔH m,中和/ΔT HCl = - C HCl·V HCl·ΔH m,中和/ΔT HCl (ΔT: 测定)3、测定HAc的电离热ΔH电离利用NaOH与HAc的反应热确定。
ΔH电离= ΔH总- ΔH中和= - K·ΔT HAc - C HCl·V HCl·ΔH m,中和[实验装置图][实验步骤]1、k值的标定(利用HCl与NaOH反应的热效应ΔH中和)①取750ml蒸馏水和100ml 1.1mol•L-1 NaOH溶液倒入杜瓦瓶中。
取100ml 1mol•L-1的HCl待用,去25ml蒸馏水待用。
注意:分别用25、100、250和500ml的容量瓶取;反应物质的量按HCl计算,NaOH是过量的。
②调节搅拌速度(不要太快),调好后固定不变,即在整个实验过程中都不要变;③依上图装好仪器,按“温度/温差”按钮,置温度显示为温差状态,运行中和热软件,点击“开始实验”,待温差曲线走平后,按“置零”按钮,使温差为0。
中和反应反应热的测定实验报告《中和反应反应热的测定》实验报告班别:姓名:定义:在稀溶液中,强酸和强碱发⽣中和反应,⽣成1mol⽔时的反应热,叫中和热。
⼀、实验⽬的测定强酸与强碱反应的反应热。
(热效应)⼆、实验⽤品⼤烧杯(500 mL)、⼩烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或纸条、泡沫塑料板或硬纸板(中⼼有两个⼩孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
三、实验步骤1.在⼤烧杯底垫泡沫塑料(或纸条),使放⼊的⼩烧杯杯⼝与⼤烧杯杯⼝相平。
然后再在⼤、⼩烧杯之间填满碎泡沫塑料(或纸条),⼤烧杯上⽤泡沫塑料板(或硬纸板)作盖板,在板中间开两个⼩孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的⽬的,如图所⽰。
该实验也可在保温杯中进⾏。
2.⽤⼀个量筒量取50mL0.50mol/L盐酸,倒⼊⼩烧杯中,并⽤温度计测量盐酸的温度,记⼊下表。
然后把温度计上的酸⽤⽔冲洗⼲净。
3.⽤另⼀个量筒量取50mL 0.55 mol/L NaOH溶液,并⽤温度计测量NaOH溶液的温度,记⼊下表。
4.把温度计和环形玻璃搅拌棒放⼊⼩烧杯的盐酸中,并把量筒中的NaOH溶液⼀次(防⽌造成热量损失)倒⼊⼩烧杯(注意不要洒到外⾯)。
⽤环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最⾼温度,记为终⽌温度,记⼊表格中。
5.重复实验步骤2~4三次6.根据实验数据计算中和热。
四、实验数据处理13、计算反应热五、实验分析1、中和热与反应热的区别与联系?答:2、本实验中若把50 mL 0.50 mol/L的盐酸改为50 mL 0.50 mol/L醋酸,所测结果是否会有所变化?为什么?答:3、若改⽤100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的⼆倍(假定各步操作没有失误)?答:4、⽤相同浓度和体积的氨⽔代替NaOH50 mL0.50mol/L NaOH5、是什么原因使中和热测定结果往往偏低?答:6、离⼦⽅程式H++OH-=H2O代表了酸碱中和反应的实质,能否⽤此代表所有中和反应的离⼦⽅程式?答:7、为什么中和热测定中要⽤稍过量的碱?能不能⽤过量的酸?答:8、为什么要⽤环形玻璃棒搅拌?若⽤铁丝取代环⾏玻璃棒会不会有影响?答:。
实验:中和热(焓)测定在一定温度和浓度下,酸和碱进行中和反应时产生的热效应称为中和热。
对于强酸和强碱,由于它们在水中完全解离,中和反应实质上是H +和OH -的反应。
因此在浓度足够低的条件下,不同的强酸强碱的中和热几乎是相同的。
对于弱酸和强碱进行的中和反应,情况有所不同。
以醋酸的中和反应为例,因为醋酸的解离度很小,故可以认为是HAc 与OH -进行的中和反应。
一 实验目的:1.通过实验了解中和热的概念;2.了解用热量计来直接测定反应热效应的实验方法与操作技能;3.学习用图解法进行数据处理,以求得正确ΔT 的方法;二 实验原理:在25℃时,强酸和强碱进行一个单位中和反应的热化学方程式为:H + + OH - → H 2O ΔγHm0= -57.36KJ·mol -1 (1)在弱酸和强碱进行的反应中,因为中和热ΔγHm 只决定于始终态,而与过程无关,所以将其设计为HAc 的解离反应和H +和OH - 生成H 2O 两步进行:根据盖斯定律,有 △rHm =△rH 解离 + △rH 中和 (2)则 △rH 解离=△rHm —△rH 中和 (3)本实验利用热量计分别测定盐酸和氢氧化钠中和反应的ΔγH 中和以及醋酸和氢氧化钠中和反应的ΔγH 中和,利用(3)式即可求得醋酸的解离热ΔγH 解离。
为此首先利用电热法标定热量计常数K ,对热量计施以电压U (伏)、电流强度I (安培),并通过t (秒)后,使热量计温度升高ΔT (K )。
根据焦尔-楞次定律可知,热量计常数K 为:K = IUT/ ΔT (4) K 的物理意义是热量计升高1K 时所需要的热量。
它是热量计中的水及各部分的热容之和。
等量酸碱的中和热ΔγH 中和及ΔγHm 均由下式计算:ΔγHm = - (K ΔT/cV)×1000 (5)式中c - 酸(或碱)溶液的初始浓度,mol·dm -3;V - 酸(或碱)溶液的体积,ml 。
实验二中和热的测定
一目的
1 掌握中和热的测定方法
2 通过中和热的测定计算弱酸的解离热
3 学习贝克曼温度计的使用方法
二原理
1 一元强酸强碱的中和反应,中和热不随酸碱种类而改变。
热化学方程式可用离子方程式表示(体系中各组分全部电离):H++OH-=H2O △H=-57.36kj/mol
2 强碱中和弱酸(HAC)时,HAC解离出H+,进一步与OH-反应,反应式为:CH3COOH=H++CH3COO- △H解离
H++OH-=H2O △H中和
总反应为:CH3COOH+OH-=H2O △H
根据盖斯定律:△H=△H中和+△H解离
3弱酸的解离热:△H解离=△H-△H中和
三仪器及药品
量筒500ml(一只) 50ml(一只)中和热测量装置一套分析天平纯水机
浓度各为1mol/l的NaOH,HCl,HAC溶液
四操作
1 量热计常数的测定
(1)准备
①量热杯中加入500ml水, 放入磁珠,调整适当的转速。
②传感器插入量热杯中,接通电热丝和夹子,“测试状态”调节“加热功率”为2.5“待机状态”,取下电热丝上的任意夹子
③温度稳定后,切换到“测试状态”,仪器队温差自动采零,设定“定时”
60s记录一次温差,蜂鸣
(2)加热
①记录第十次时,接通电热丝和夹子。
加热开始,记录温度和时间
②待温度升高0.8-1℃时,取下电热丝上的夹子。
记录通电时间t
③继续搅拌,一次/分,记录十次温度
(3)求△T1,作图法求出通电引起的△T1(雷诺校正法确定)
2 中和热的测定
(1)量热杯中注入400ml水,再加入50ml1mol/l的HCl,取50ml1mol/l的NaOH 溶液注入碱储液管中
(2)调节磁珠转速,放入碱管,盖好瓶盖。
记温度(1次/分),10次
(3)加入碱液,连续记录温度1次/分
(4)温度上升后,温度维持一段时间不变,即可停止
(5)作图法求△T2
3 醋酸解离热的测定
用1mol/l的醋酸代替盐酸溶液重复2操作求△T3
五数据记录和处理
记录P=2.5W △T1△T2 △T3
1 量热计常数的计算
K=Pt/△T1 量热计每升高1℃时所需的热量J/K
2 中和热的计算
△H中和=-K△T2*1000/CV C:mol/l V:ml
3 解离热的计算
△H=-K△T3*1000/CV
△H解离=△H-△H中和
六注意事项
1 电热丝不能干烧,杯中加水后才能接上电源夹子。
2 加热过程中要保持加热功率稳定
3 要认真检查碱储液管,不能漏液,否则重装。
4 加碱液时要小心,用力过猛,容易损坏仪器。
5 通电时间要记录准确。
6 倾倒液体时,要先把磁珠取出,以免丢失。
七问题与讨论
1两次取下夹子,哪一次取下夹子后,夹子碰触会短路?
2 加热丝停止通电,与“待机状态”的区别在哪里?
3 测量中影响实验结果的因素有哪些?
4 若用NaOH固体代替NaOH溶液,测得的中和热是否变化?若变化,如何变化?为什么?
NaOH固体溶解放热
八规定自行
1教材上要求每个操作要重复三次,由于时间关系只操作一遍。
2 1mol/l的NaOH,HCl,HAC溶液,由教师提前配好。
3 贝克曼温度计有温度传感器代替。
4 仪表上显示有温度,温差,要求学生记录温度。
九作业
1 P58六思考讨论题
2 实验报告
3 阅读贝克曼温度计的结构及使用P42。