中和热的测定.ppt
- 格式:ppt
- 大小:81.50 KB
- 文档页数:9



中和热的测定实验原理:∆H1=0(T1)HCl + NaOH = NaCl + H2O(T2)∆H2 ⎣NaCl + H2O (T1)⎦∆H3∆H为状态函数⇒∆H1=∆H2+∆H3=0⇒∆H2=-∆H3其中∆H电为反应产物,溶剂水以及量热器在温度由T1到T2的焓变:∆H3=Cp∆T中⇒∆H2= - Cp∆T中(∆T中为中和反应前后温度变化)Cp求算:中和反应后再次使体系升温,记为∆T电,此时有Q=IUt= Cp∆T电⇒Cp=IUt/∆T电⇒∆H2= - IUt∆T中/∆T电⇒∆H中和= - IUt∆T中/∆T电*CV {其中C, V分别为酸的浓度和体积}可见:实验的关键测量出∆T中和∆T电实验步骤:1.双击桌面上的中和热测定软件图标2.参数设定:有电压参数校正、电流参数校正、纵坐标设置(-1~3℃)、横坐标设置(0~1800s)、数据采集周期设置五个子菜单,电压参数和电流参数一般情况不需要校正,其他参数一般也不需要设置(系统有默认值)。
3开始实验(按开始菜单开始实验):A根据软件提示输入HCl的浓度和体积。
B将温度传感器擦干净置于空气中,预热5min,待温度稳定后测定室温。
C按软件提示用1000mL容量瓶取1000mLNaOH溶液注入保温瓶,加盖;D量取100mLHCl溶液放置一旁备用。
E将温度传感器置于保温瓶中,按接口装置上的切换按钮将显示切换位显示温差。
F 温差显示稳定后,再按置零键将温差置零。
G 打开恒流源,调节电流位400mA,马上切断电源。
H 打开磁力搅拌器,调节搅拌速度到合适位置。
I输入自定义的保存数据的文件名(文件自动存入C\nhfwin\dat 目录下)。
J提示框提示“正在实验,请按实验步骤操作”,观察计算机显示器绘图窗口的数据采集线,当温度基本不变且数据采集300秒左右后,迅速将HCl溶液由漏斗注入保温瓶内,并且用少量的去离子水冲洗容量瓶。
K 观察计算机显示器窗口的数据采集线至反应完毕,温度几乎不变时而且有下降趋势时,再记录300秒左右。


中和热的测定一、 目的1.掌握中和热的测定方法。
2. 通过中和热的测定,计算弱酸的解离热。
二、 基本原理在一定的温度、压力和浓度下,1mol 酸和1mol 碱中和时放出的热量叫做中和热。
强酸和强碱在水溶液中几乎完全电离,热化学方程式可用离子方程式表示:H + + OH — → H 2O在足够稀释的情况下中和热几乎是相同的,在25℃时:ΔH 中和 = -57.3kJ ·mol -1若所用溶液相当浓,则所测得的中和热值常较高。
这是由于溶液相当浓时,离子间相互作用力及其他影响的结果。
若所用的酸(或碱)只是部分电离的,当其和强碱(或强酸)发生中和反应时,其热效应是中和热和电离热的代数和。
例如,醋酸和氢氧化钠的反应,则与上述强碱、强酸的中和反应不同,因为在中和反应之前,首先是弱酸进行解离,然后才与强碱发生中和反应,反应为:+33+2 CH COOHH +CH COO H +OH H O H H ∆∆—解离—中和——————————————————————————————总反应: 323CH COOH+OH H O+CH COO H ∆——由此可见,强碱与弱酸反应包括了中和和解离两个过程。
根据盖斯定律可知,ΔH =ΔH 解离+ΔH 中和。
如果测得这一类反应中的热效应ΔH 以及ΔH 中和,就可以通过计算求出弱酸的解离热ΔH 解离。
二.仪器与试剂三.实验步骤1. 量取220ml 蒸馏水放入干净的杜瓦瓶中,轻轻盖紧瓶塞。
快速调节加热电流在1安培左右选定某一定值。
切断电源均匀搅拌,观察温度至不变,则表明杜瓦瓶内的水已达热平衡,记下水温。
再接通电源,同时开始计时,记录电压和电流数据,并充分搅拌使瓶内各部分温度均匀,每隔一分钟记录水温一次。
待水温升高约1C 。
,停止加热,记下加热时间。
继续搅拌并再记十次温度即停止实验。
用温度~时间数据作雷诺图,求出ΔT 1。
2. 量取200ml 0.100mol/L 的HCl 溶液放入干净的杜瓦瓶中。

实验一中和热的测定——恒压量热法一、目的:测定醋酸与氢氧化钠的中和热,计算醋酸的电离热。
二、原理在一定的温度、压力和浓度下,1摩尔酸和1摩尔碱中和时放出的热量叫做中和热。
强酸和强碱在水溶液中几乎完全电离,在足够稀释的情况下中和热几乎是相同的,在25℃时:H+ + OH-→H2O △中和H=-57.3 kJ/mol若所用溶液相当浓,则所测得的中和热值较高。
这是由于溶液相当浓时,离子间相互作用力及其他因素影响的结果。
若所用的酸只部分离解,放出的热量则大大小于57.3千焦。
弱酸(或弱碱)在水溶液中部分电离,当其和强碱(或强酸)发生中和反应时,其热效应是中和热和电离热的代数和。
例如醋酸和氢氧化钠的反应:根据盖斯定律,有△中和H=△电离H+△中和H所以△电离H=△中和H-△中和H本实验,系采用化学反应标定法,标定量热计的热容量,即将盐酸和氢氧化钠水溶液在量热计中反应利用其已知的中和反应热和测得反应前后量热计的温差△T,计算量热计的热容量。
在相同的条件下,将待测反应在量热计中进行,利用它的热容量和反应测得的温差,求出反应热。
四、仪器和药品杜瓦瓶量热计(包括杜瓦瓶、内管、橡皮塞、夹子、木盒)250 mL容量瓶2只50 mL移液管3只400 mL烧杯1只洗耳球1只洗瓶1只1.5 mol/L NaOH 溶液 1.0 mol/L HCl 标准溶液 1.0 mol/L HAc 标准溶液五、操作说明1. 调节贝克曼温度计到合适的位置。
2. 50 mL移液管移取1.0 mol/L HCl入250 mL 容量瓶,定容。
250 mL 溶液全部加入杜瓦瓶中,内管加入1.5 mol/L NaOH 溶液50 mL。
3. 调节好的温度计插入杜瓦瓶中,稳定后读数,用洗耳球将内管中的NaOH 溶液吹入杜瓦瓶中(可以有剩余),摇匀杜瓦瓶中的溶液,观察温度上升。
直到温度不变,记下读数。
重复两次,取平均值ΔT。
4. HAc溶液按同样的操作两次,记下平均值ΔT’。



实验 中和热的测定实验的教学要求学生应通过量热实验,掌握热化学的主要研究手段,并以此为基础,分析过程中能量的来源及变化情况。
本实验的具体要求是:1.学生应通过中和热的测定,明确量热实验的基本方法。
2.掌握量热计的构造原理及特点,并能独立设计测定非反应体系热效应(例如溶解热、稀释热等)的仪器构造及操作过程。
3.学会测定量热计常数的几种方法,比较各自的优点与不足。
4.了解中和反应所用酸的种类及浓度对中和热引起的偏差及其原因。
实验内容一、实验目的1、掌握中和热的测定方法2、通过中和热的测定,计算弱酸的解离热。
二、实验原理在一定温度、压力和浓度下,一摩尔的H +和一摩尔OH -完全发生中和反应时放出的热叫中和热。
对于强酸和强碱来说,由于其在水溶液中几乎全部电离,所以其中和反应实际上是H ++OH - H 2O ,由此可见,这类反应的中和热与酸的阴离子无关,故任何强酸和强碱的中和热都相同。
而对于弱强弱碱来说,它们在水溶液中没有完全电离,因此,在反应的总热效应中还包含着弱酸弱碱的电离热,如以强碱(NaOH)中和弱酸(HAc)时,其在中和反应之前,首先进行弱酸的电离,故其中和反应情况可以表示如下:HAc =H ++Ac - ΔH 电离H ++OH -=H 2O ΔH 中和总反应 HAc +OH -=H 2O +Ac - ΔH′中和由此可见,ΔH′中和是弱酸与强碱中和反应的总热效应,它包括中和热和电离热两部分。
根据盖斯定律可知,如果测得这一反应的ΔH′中和和ΔH 中和。
就可以计算出弱酸的电离热ΔH 电离。
即: ΔH′中和=ΔH 中和+ΔH 电离ΔH 电离=ΔH′中和-ΔH 中和 (1)如果中和反应是在绝热良好的杜瓦瓶中进行,让酸和碱的起始温度相同,同时使碱稍微过量,以使酸能被中和完全,则中和放出的热量可以全部为溶液和量热计所吸收,这时可写出如下的热平衡式:T K H 1000V M ∆-=∆⋅中和酸酸 (2) 式中 M 酸——酸的浓度(mol∙dm -1);V 酸——酸得体积(dm 3);ΔH 中和——反应温度下的中和热(J∙mol -1);K ——量热计热容量(J∙K -1);(表示量热器各部分热容量之和,亦即加热此量热器系统,使温度升高1 K所需的热量)ΔT——溶液真实温差,可用雷诺图解法求得。

实验:中和热的测定一、中和热的概念:在稀溶液中,酸和碱发生中和反应生成1mol 液态水时所放出的热量叫做中和热。
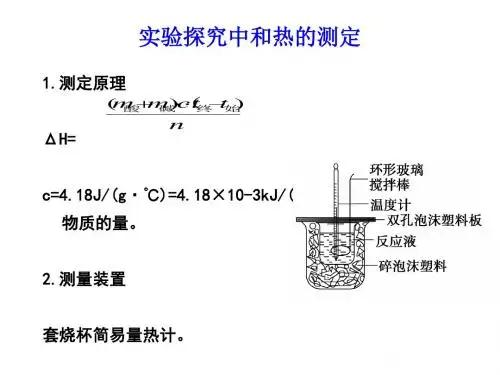
强酸、强碱稀溶液中和热的表示方法为:H +(aq)+OH -(aq)===H 2O(l) △H=-57.3 kJ·mol -1 二、中和热的测定:1.热量计算公式:Q =c 0·m(溶液)·(t 2-t 1)c 0:比热容,指单位质量的物质温度每升高1℃所吸收的热量。
常温下,液态水的比热容为4.18×10-3kJ·mol -1·g -1m :溶液质量,单位gt :t 1——起始温度,t 2——终止温度2.测定反应热的仪器——量热计简易量热计示意图 自制简易量热计示意图3.中和热实验原理: 通过一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,进而换算出生成1mol 液态水时所放出的热量。
△H= kJ·mol -14.18×10-3·m(溶液)·(t 2-t 1) n(H 2O)4.实验步骤与数据测量(1)初始温度(t1)用一量筒量取50 mL 0.50 mol·L-1盐酸,倒入小烧杯中并测量其温度;用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液并用温度计(温度计需用蒸馏水洗净并恢复至室温)测量其温度,取两温度平均值为溶液的初始温度t1。
(2)终止温度(t2)把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次性倒入小烧杯中并盖好盖板。
用环形玻璃搅拌棒轻轻搅动溶液,准确读取混合溶液的最高温度,记录终止温度为t2。
(3)重复实验操作,记录每次的实验数据,取其平均值作为计算依据。
提示:盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm-3,反应前后溶液的比热容为4.18×10-3kJ·mol-1·g-1。
10-4-中和热(焓)的测定中和热是指在一定条件下,酸和碱溶液配制成盐的过程中,放出或吸收的热量。
中和反应是化学反应中重要的一种,常常用于将酸、碱中和成盐,这种反应在生活中也有很多应用,在化学实验中常常需测定中和热的大小,以便掌握化学反应情况和控制反应过程。
中和热的测定方法有多种,本文主要介绍几种比较常用的方法。
一、稀酸稀碱溶液中和法稀酸稀碱溶液中和法是一种简单易行的测定中和热的方法,只需将酸、碱溶液分别加到两个容量相等的烧杯中,通过热浸方法来测定中和反应释放或吸收的热量。
具体步骤如下:1、分别取两个容量相等的烧杯,分别称出一定质量的稀酸和稀碱溶液。
2、将酸溶液倒入一个烧杯中,再将等量的碱溶液倒入另一个烧杯中。
3、用温度计测量两个烧杯中溶液的初温,并记录下来。
5、根据混合前溶液的温度、混合后溶液的最高温度和酸、碱溶液的质量计算出中和反应的热量。
二、热量计法热量计法比较准确地测定中和热,常用仪器为热量计,热量计以上称量、计时、测温为基础,通过等定压、等兑换等方法来测定中和反应释放或吸收的热量。
具体步骤如下:1、将热量计的内胆充满水,测定水的初始温度,并记录下来。
3、将酸溶液倒入热量计中,并迅速加入过量的碱溶液,通过搅拌将酸、碱彻底混合。
4、观察水温的变化,并测定混合后溶液达到最高温度的时间。
1、取一定量的酸溶液和碱溶液,在恒温水槽中将两种试液浸泡至相同温度。
2、在实验室桌子上,将两个容器分别置于恒流量热计的两侧。
3、开启热量计和流量计,并在一段时间后稳定读取制冷器功率输出和恒流量值。
4、将酸溶液从制冷器侧加入一侧容器,然后将碱溶液从恒流量热计一侧加入另一侧容器,同时打开相应的阀门。
5、记录实验过程中的各个参数,并计算中和反应的热量。
以上就是几种测定中和热的方法,每种方法都有其优缺点,具体选择方法应考虑实验条件、仪器设备以及实验要求等因素。