初三化学:工艺流程图专题(1)
- 格式:doc
- 大小:256.50 KB
- 文档页数:6
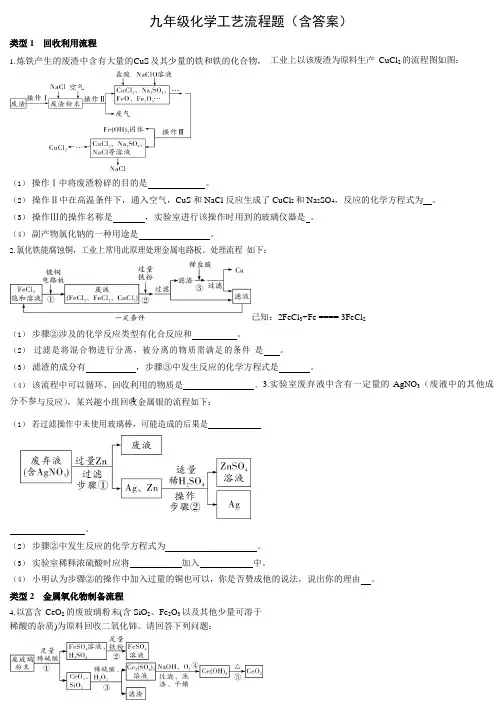
1九年级化学工艺流程题(含答案)类型 1 回收利用流程1. 炼铁产生的废渣中含有大量的CuS 及其少量的铁和铁的化合物, 工业上以该废渣为原料生产 CuCl 2 的流程图如图:(1)操作Ⅰ中将废渣粉碎的目的是。
(2) 操作Ⅱ中在高温条件下,通入空气,CuS 和 NaCl 反应生成了CuCl 2 和 Na 2SO 4,反应的化学方程式为 。
(3) 操作Ⅲ的操作名称是,实验室进行该操作时用到的玻璃仪器是 。
(4) 副产物氯化钠的一种用途是。
2. 氯化铁能腐蚀铜,工业上常用此原理处理金属电路板。
处理流程 如下:已知:2FeCl 3+Fe ==== 3FeCl 2(1) 步骤②涉及的化学反应类型有化合反应和。
(2) 过滤是将混合物进行分离,被分离的物质需满足的条件 是 。
(3) 滤渣的成分有,步骤③中发生反应的化学方程式是 。
(4) 该流程中可以循环、回收利用的物质是。
3.实验室废弃液中含有一定量的 AgNO 3(废液中的其他成分不参与反应),某兴趣小组回收金属银的流程如下:(1) 若过滤操作中未使用玻璃棒,可能造成的后果是。
(2) 步骤②中发生反应的化学方程式为 。
(3) 实验室稀释浓硫酸时应将加入中。
(4) 小明认为步骤②的操作中加入过量的铜也可以,你是否赞成他的说法,说出你的理由 。
类型 2 金属氧化物制备流程4. 以富含 CeO 2 的废玻璃粉末(含 SiO 2、Fe 2O 3 以及其他少量可溶于稀酸的杂质)为原料回收二氧化铈。
请回答下列问题:2已知: CeO 2 不溶于稀硫酸,也不溶于 NaOH 溶液。
(1) 稀硫酸属于 (填“混合物”或“纯净物”)。
(2) 滤渣的成分是,过滤后发现滤液仍比较浑浊, 可能的原因是。
(3) 步骤③中通入氧气的目的是。
(4) 氢氧化铈受热分解生成CeO 2 和 H 2O ,写出反应的化学方程式 。
5. 氧化镁在医药、建筑等行业应用广泛。
以菱镁矿(主要成分为MgCO 3,含少量 FeCO 3)为原料制备高纯度氧化镁的实验流程如下:(1) 操作 X 的名称是 ,该操作需要用到的玻璃仪器主要有: 烧杯、 、玻璃棒。

一、中考初中化学流程图1.黄铜矿(主要成分2CuFeS )经初步处理后,所得溶液甲中的溶质为243Fe SO ()、4CuSO 及24H SO 。
某同学通过废铁屑与溶液甲反应,制取补血剂的原料碳酸亚铁并回收铜。
主要步骤如下图所示:温馨提示:2434+Fe (SO )Fe=3FeSO﹙1﹚操作a 的名称是________,该操作中会用到玻璃棒,其作用是___________ 。
﹙2﹚不溶物的成分为___________________ 。
﹙3﹚步骤Ⅰ中生成铜的化学方程式为_________;废铁屑中含有少量铁锈,却对产物的成分没有影响,原因是________。
步骤Ⅲ中加入一种可溶性试剂可实现转化,从复分解反应的条件分析,该试剂可以是___________(填化学式)溶液。
【答案】过滤 引流 Cu 、Fe 44=Fe+CuSO FeSO +Cu 铁锈可与硫酸反应生成硫酸铁,硫酸铁再和铁反应生成硫酸亚铁 23Na CO【解析】【分析】铁和硫酸铜反应生成硫酸亚铁和铜,氧化铁能和稀硫酸反应生成硫酸铁和水,硫酸铁能和铁反应生成硫酸亚铁。
【详解】(1)操作a 的名称是过滤,该操作中会用到玻璃棒,其作用是引流;(2)不溶物的成分为铁和硫酸铜反应生成的铜和过量的铁;故不溶物的成分为Cu 、Fe 。
(3)步骤I 中,铁和硫酸铜反应生成硫酸亚铁和铜,生成铜的化学方程式为44=Fe+CuSO FeSO +Cu ;废铁屑中含有少量铁绣,却对产物的成分没有影响,原因是铁锈中的氧化铁能和稀硫酸反应生成硫酸铁,硫酸铁能和铁反应生成硫酸亚铁。
步骤Ⅲ中,加入碳酸钠溶液时,碳酸钠能和硫酸亚铁反应生成碳酸亚铁和硫酸钠,从而得到碳酸亚铁,因此从复分解反应的条件分析,该试剂可以是Na 2CO 3溶液。
2.某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO 2)和少量石灰石。
下图是利用该镁矿石制备七水硫酸镁(MgSO 4·7H 2O)的工艺流程。



2024年中考化学复习专题:工艺流程题1.合成氨人类科学技术上的一项重大突破,为化肥工业奠定了基础,以下是合成氨的工艺流程图。
(1)“液氮的沸点是−196℃,液氧的沸点是−183℃”,这属于 (填“物理性质”或“化学性质”);氮气常温下化学性质较稳定,可用做 。
(2)下列有关氮气和氢气反应的催化剂说法正确的是 。
a.化学反应前后其化学性质改变了b.其改变了生成物的质量c.只是改变了化学反应速率(3)根据上图,写出氮气和氢气反应生成氨气的文字表达式 。
(4)上述流程图中,“净化压缩”过程,从微观角度解释是气体分子的 改变。
2. 垃圾分类, 有利于变废为宝。
利用废旧白口铁(镀锌铁皮) 制备磁性Fe 3O 4胶体粒子及副产物ZnO ,其工艺流程图如下:(资料:铁不与氢氧化钠溶液反应,锌会与氢氧化钠溶液反应;不溶性碱受热分解生成金属氧化物和水。
)(1)℃中将不溶物和溶液A 分离的操作为 。
(2)℃中发生反应的化学方程式为 。
(3)溶液B 中含有的金属离子为 ,℃中加入适量H 2O 2溶液的目的是 。
3.某品牌电器的废旧电路板中还有Fe 、Cu 、Ag 、Ni (镍,银白色金属)等金属,如下图是某车间回收部分金属的工艺流程,已知22442Δ2Cu+O +2H SO 2CuSO +2H O 。
回答下列问题。
(1)滤渣℃中含有的金属是。
(2)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(3)滤液℃中加入足量铁粉的主要目的是,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为。
(4)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是。
4.消毒剂在公共场所进行卫生防疫时发挥着重要作用。
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。
以粗盐为原料生产ClO2的工艺主要包括:℃粗盐精制;℃电解微酸性NaCl 溶液制NaClO3; ℃ClO2的制取。

化学工艺流程图专项(1)1.国内制碱工业先驱侯德榜发明了“侯氏制碱法”。
其模拟流程如下:(1)反映①旳化学方程式________________,反映②旳基本反映类型为_______。
(2)工业上用分离液态空气 旳措施制取氢气,属于_______变化(填“物理”或“化学”)。
(3)操作a 旳名称是_____,实验室进行此操作所需旳玻璃仪器有烧杯、玻璃棒、______。
(4)写出NH 4Cl 旳一种用途________________。
2. 过氧化钙晶体﹝CaO 2·8H 2O ﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。
以贝壳为原料制备CaO 2流程如下:(1)气体X 是CO 2,其名称是 ;将过氧化钙晶体与溶液分离旳措施是 。
(2)反映Y 需控制温度在0~5℃,可将反映容器放在 中,该反映是化合反映,反映产物是CaO 2·8H 2O ,请写出化学方程式 。
获得旳过氧化钙晶体中常具有Ca(OH)2杂质,因素是 。
(3)CaO 2旳相对分子质量为 ,过氧化钙晶体﹝CaO 2·8H 2O ﹞中H 、O 元素旳质量比为 。
(4)为测定制得旳过氧化钙晶体中CaO 2·8H 2O 旳质量分数,设计旳实验如下:称取晶体样品50g ,加热到220℃充足反映(方程式为2CaO 2·8H 2O=====△2CaO +O 2↑+16H 2O ↑,杂质不发生变化),测得生成氧气旳质量为3.2g ,请计算样品中CaO 2·8H 2O 旳质量分数(CaO 2·8H 2O 相对分子质量为216),写出必要旳计算过程。
3. 空气中氮气旳含量最多,氮气在高温、高能量条件下可与某些物质发生反映。
下图是以空气和其她必要旳原料合成氮肥(NH4NO3)旳工业流程。
请按规定回答问题:(1)环节①中发生旳是________变化(填“物理”或“化学”)。

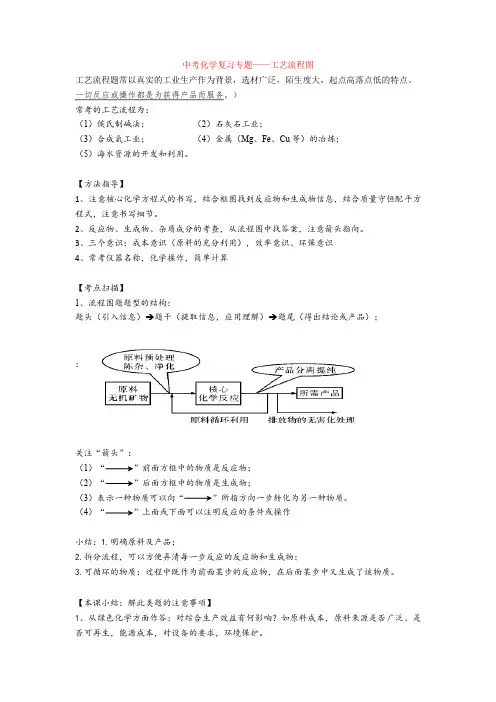
中考化学复习专题——工艺流程图工艺流程题常以真实的工业生产作为背景,选材广泛,陌生度大,起点高落点低的特点。
一切反应或操作都是为获得产品而服务。
)常考的工艺流程为:(1)侯氏制碱法;(2)石灰石工业;(3)合成氨工业;(4)金属(Mg、Fe、Cu等)的冶炼;(5)海水资源的开发和利用。
【方法指导】1、注意核心化学方程式的书写,结合框图找到反应物和生成物信息,结合质量守恒配平方程式,注意书写细节。
2、反应物、生成物、杂质成分的考查,从流程图中找答案,注意箭头指向。
3、三个意识:成本意识(原料的充分利用),效率意识、环保意识4、常考仪器名称,化学操作,简单计算【考点扫描】1、流程图题题型的结构:题头(引入信息)→题干(提取信息,应用理解)→题尾(得出结论或产品);:关注“箭头”:(1)“”前面方框中的物质是反应物;(2)“”后面方框中的物质是生成物;(3)表示一种物质可以向“”所指方向一步转化为另一种物质。
(4)“”上面或下面可以注明反应的条件或操作小结:1.明确原料及产品;2.拆分流程,可以方便弄清每一步反应的反应物和生成物;3.可循环的物质:过程中既作为前面某步的反应物,在后面某步中又生成了该物质。
【本课小结:解此类题的注意事项】1、从绿色化学方面作答:对综合生产效益有何影响?如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护。
2、常见文字叙述套路(1)分离可溶物与不溶物:过滤(2)从溶液中得到晶体:蒸发浓缩-冷却结晶-过滤-(洗涤)。
[含结晶水的一般降温结晶](3)在写某一步骤是为了除杂是,应该注明“是为了除去某某杂质”。
3、控制反应条件的方法•①pH 的控制:控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀•②加热的目的:加快反应速率•③降温反应的目的:防止某物质在高温时会溶解•④趁热过滤:防止某物质降温时会析出•⑤冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。


《工艺流程图》专题复习教学设计教学目标:1、认识和熟悉工艺流程图这类题型;2、掌握工艺流程图试题的解题思路和方法。
教学重难点工艺流程图的解题思路和方法。
课时安排:1课时教学过程:专题分析:工艺流程题的内容往往与生产、生活实际联系密切,因此从题干部分看一般都是采取流程图的模式。
(1)流程图的形式各异,有的以操作名称作为框图形成流程的主线,有的以物质作框,有的以设备作框,但每一题都固定某一种形式作框,从近几年的试题看常见的是以操作名称为主线,物质随着操作流程发生变化。
(2)这类题目中通常还包含简单的实验设计,实验一般为制备或对样品的定性、定量分析实验。
解题方法:关注流程“三线”(去线、进线和可逆线)和“核心”(如图)。
可总结为“读正文,找信息,灵活运用;看框内,看框外,里外结合;边分析,边思考,易处着手;先局部,后全盘,逐步深入。
”归类示范:类型一:粗盐的提纯例1[2014·菏泽]粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。
某班同学在粗盐提纯实验中,为把少量可溶性杂质CaCl2、MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题。
(1)实验操作A的名称是_________,该操作的目的是______________________。
解析:实验操作A的名称是过滤,该操作的目的是除去难溶性杂质。
(2)写出步骤③中发生的主要反应的化学方程式:___________________________________;步骤⑥的作用是________________________解析:实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,步骤⑥加适量稀盐酸的作用是除去过量的氢氧化钠和碳酸钠。
(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由:________________________________________________解析:因为在实验过程中有氯化钠生成,故该方案实际得到的氯化钠比粗盐中含有的氯化钠要多。

一、中考初中化学流程图1.高纯氧化铁可作为现代电子工业的材料,以下是硫铁矿烧渣(主要成分为Fe 2O 3、FeO 、SiO 2)为原料制备高纯氧化铁(Fe 2O 3)的生产流程示意图:[(NH 4)2CO 3溶液呈碱性,40℃以上时(NH 4)2CO 3分解]。
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器玻璃棒、_______、烧杯等。
(2)写出通入CO 后所发生反应的化学方程式_______(任意写一个)。
(3)在该生产流程中当加入(NH 4)2CO 3后,应该控制的条件是 ______ 。
(4)滤液Ⅱ中可回收的物质在农业上可做 _____(5)写出在空气中煅烧FeCO 3的化学方程式_____。
【答案】漏斗 3CO+Fe 2O 3高温2Fe+3CO 2(或FeO+CO 高温Fe+CO 2) 温度控制在40℃以下(或控制溶液的酸碱度) 氮肥或肥料 322324FeCO +O 2Fe O +4CO 高温【解析】【分析】【详解】 (1)操作Ⅰ、操作Ⅱ都是将固体与液体分开,操作为过滤,过滤操作用到的玻璃仪器玻璃棒、漏斗、烧杯等。
(2)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,氧化亚铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe 2O 3+3CO 高温2Fe+3CO 2,FeO+CO 高温Fe+CO 2。
(3)因为40℃以上时(NH 4)2CO 3分解,因此加入(NH 4)2CO 3后,温度控制在40℃以下;(NH 4)2CO 3溶液呈碱性,所以要控制酸碱性。
(4)滤液Ⅱ中可回收的产品中含有硫酸铵,在生活中可作为氮肥。
(5)在空气中煅烧FeCO3,是碳酸亚铁和氧气在高温下生成二氧化碳和氧化铁,对应的化学反应方程式4FeCO3+O2高温2Fe2O3+4CO2。
故答案为:(1)漏斗;(2)3CO+Fe2O3高温2Fe+3CO2(或FeO+CO高温Fe+CO2);(3)温度控制在40℃以下(或控制溶液的酸碱度);(4)氮肥或肥料;(5)4FeCO3+O2 高温2Fe2O3+4CO2。
初中化学流程图过关训练1. 某校化学实验室废液桶中收集了溶解大量FeSO 4、CuSO 4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。
初三(2)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
① 复习常见金属活动性顺序表,在下表空格中分别填入对应的元素符号。
K Ca Mg Al Fe Sn Pb (H) Cu Hg Pt Au 金属活动性依次减弱② 设计回收硫酸亚铁晶体和铜的实验方案如下:请回答下列问题:Ⅰ.整个实验过程中多次采取过滤,该操作用到的玻璃仪器有烧杯、 和玻璃棒。
Ⅱ.金属X 是 ,其加入废水后发生反应的化学方程式为 ;溶液Y 是 ,利用其除去铜中杂质,有关反应的化学方程式为 。
2.海洋是一个巨大的资源宝库,我们可以从海水中提取氯化钠,并以氯化钠和冰为原料制得氢氧化钠、氢气和氯气(Cl 2)。
其制取的主要工艺流程如下:(1)利用风吹日晒可以从海水中提取粗盐,该过程主要发生_ _变化(选填:“物理”或“化学”)。
(2)要除去食盐水中混有少量的泥沙,你选择的操作方法是_____ 。
(3)请你写出氯化钠在生活中的一种用途_____________ 。
(4)氯化钠饱和溶液在通电条件下发生反应的化学方程式是:____________。
3.下面是几种常见的转化关系图(假设各反应均完全)。
请回答下列问题:加入足量的溶液Y 过滤、洗涤 加入过量 的金属X 过滤 含FeSO 4和CuSO 4的废水 滤液 铜 不纯 的铜 滤液热饱和溶液 冷却结晶 硫酸亚 铁晶体(1)物质A 是 ,物质B 在反应中①的作用是(2)实验室检验气体D 的方法是 。
(3)请写出反应④的化学方程式 。
4. 实验结束时,同学们将含有CuSO 4、ZnSO 4、FeSO 4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。
于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。
工艺流程图专题一、工艺流程路线示意图箭头:进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
出线、进线:表示物料流向或操作流程;反向线:表示物质循环使用;方框:表示经过反应或操作后剩余的物质。
二、工艺流程题的解题方法与策略1.一般采用首尾分析法,明确原始物质及目标产物2.读流程,观其大略,找出流程主线(即从流程开始到达产品或是达成实验目的的为主线,其他的是支线,如上图)。
3.常考的操作术语及目的:(1)对原料进行预处理的常用方法及其作用①粉碎(研磨):增大反应物的,加快或使反应。
②灼烧(煅烧):使固体在高温下分解或使杂质在高温下氧化、分解等。
使反应充分进行或增大转化率。
(2)明确常用的分离方法①过滤:和的分离。
所需仪器有铁架台(带铁圈)、滤纸、。
洗涤:尽量除去晶体表面的杂质或干扰物质。
干燥:除去固体中的水。
4.答题技巧:(1)所设问题一般都是孤立的,在解答时不要求流程全看懂后再解答,看不懂的地方先跳过去,继续解答后面的问题。
有时候可以直接使用“节点法”进行解题,即进入“节点”的物质是反应物,流出“节点”的是生成物。
(2)抓住一个关键点:一切反应或操作都是为了获得产品或是达成实验的目的。
(3)推断流程图某一步中的物质,可以从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有过量(剩余),要关注物质在流程“节点”中转移情况(三大转移):反应产物转移;不反应物质转移和过量物质转移。
(4)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
(5)循环利用的物质:某物质不在流程的主线上而在流程的支线上,它是某一步骤中的产物同时也是另一步骤中的原料,它即是这个流程中的循环利用物质。
题型三工艺流程图题基础作业1.铝是一种重要金属,从铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)中冶炼Al的工业生产流程如图所示:(1)操作Ⅰ的名称是。
(2)溶液A中含有的阳离子为Al3+、Fe3+和 (填离子符号)。
(3)电解氧化铝时还会生成一种气体,该反应的化学方程式为。
(4)溶液C中含有Na2CO3,则该生产流程中可循环使用的物质除NaOH外,还有、。
2.某化学活动小组在实验室以MnO2固体为原料制取少量MnCO3,基本流程如下:已知:MnSO4可溶于水;MnCO3难溶于水且在100 ℃时开始分解。
(1)操作a的名称为。
(2)反应①中生成物只有MnSO4,该反应的化学方程式为。
(3)产品MnCO3(Ⅱ)比MnCO3(Ⅰ)更纯净,原因是产品MnCO3(Ⅰ)经过洗涤、烘干以后,除去了表面附着的和。
(4)烘干MnCO3时需要控制的条件是。
3.某同学以金泥(含有Au、CuS、ZnS等)为原料制备Au和Cu的流程如图所示:已知:①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放,会导致。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是。
(3)“过程Ⅲ”分离Au的操作是 ,加入过量稀硫酸的目的是。
(4)“系列进程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 ,该反应属于 (填写基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为。
4.硫酸锌可制备各种含锌材料,在防腐、医学上有很多应用。
菱锌矿的主要成分是ZnCO3,还含有少量的二氧化硅和氧化铁。
以菱锌矿为原料制备ZnSO4·7H2O的工艺流程如下图所示。
(二氧化硅难溶于水,也不与稀硫酸反应)ZnSO4·7H2O回答下列问题:(1)菱锌矿属于 (选填“纯净物”或“混合物”)。
化学工艺流程图专题(1)1.我国制碱工业先驱侯德榜发明了“侯氏制碱法”。
其模拟流程如下:(1)反应①的化学方程式________________,反应②的基本反应类型为_______。
(2)工业上用分离液态空气 的方法制取氢气,属于_______变化(填“物理”或“化学”)。
(3)操作a 的名称是_____,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、______。
(4)写出NH 4Cl 的一种用途________________。
2. 过氧化钙晶体﹝CaO 2·8H 2O ﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。
以贝壳为原料制备CaO 2流程如下:(1)气体X 是CO 2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y 需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO 2·8H 2O ,请写出化学方程式 。
获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(3)CaO 2的相对分子质量为 ,过氧化钙晶体﹝CaO 2·8H 2O ﹞中H 、O 元素的质量比为 。
(4)为测定制得的过氧化钙晶体中CaO 2·8H 2O 的质量分数,设计的实验如下:称取晶体样品50g ,加热到220℃充分反应(方程式为2CaO 2·8H 2O=====△2CaO +O 2↑+16H 2O↑,杂质不发生变化),测得生成氧气的质量为3.2g ,请计算样品中CaO 2·8H 2O 的质量分数(CaO 2·8H 2O 相对分子质量为216),写出必要的计算过程。
高3. 空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。
下图是以空气和其他必要的原料合成氮肥(NH 4NO 3)的工业流程。
请按要求回答下列问题:(1)步骤①中发生的是________变化(填“物理”或“化学”)。
(2)写出步骤③中发生反应的化学方程式_________________________________。
(3)上述化学反应中属于化合反应的有________个。
(4)右图是化肥硝酸铵包装袋上的部分说明:硝酸铵应具有的性质是 (填字母)。
A .易溶于水B .有挥发性C .受热易分解施用该类肥料时,要避免与碱性物质混合使用,写出硝酸铵与 熟石灰反应的化学方程式__________________________________。
4. 炼铁产生的废渣中含有大量CuS 及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl 2的流程图如下,下列有关说法错误的是( )A . 操作1中粉碎的目的是增大反应物的接触面积B . 操作2中,CuS 、NaCl 和O 2在高温条件下反应生产CuCl 2和Na 2SO 4化学方程式为CuS + 2NaCl +2O 2 ===CuCl 2 + Na 2SO 4C . 操作3的名称是过滤D . 流程图中能循环利用的物质是NaCl 和Na 2SO 45. 醋酸钙[Ca(AC)2]是国家允许使用的补钙制剂之一。
以蛋壳为原料回收膜并制备醋酸钙的一种工艺流程如下。
硝酸铵 化学式:NH 4NO 3 含氮量:≥30% 注意事项:密封储存 防潮防晒⑴写出煅烧时的化学方程式。
CO2的任意排放会引发的环境问题是。
CO2与CH4一定条件下化合生成甲醛(HCHO),则此反应中与最佳质量比是。
下列做法能减少二氧化碳排放的是。
(填序号)⑵在反应I中制备石灰乳,而不是制备澄清石灰水的目的是。
写出熟石灰的一种用途。
⑶在反应II中醋酸过量的目的是。
写出反应II的化学方程式。
⑷膜分离时,盐酸不能过量的主要原因是。
6. 含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途I.以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
⑴粉碎的目的是。
⑵若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管﹑玻璃棒﹑和,此处玻璃棒的作用是。
⑶物质X是,滤渣中含有的金属单质有,除铜时发生的反应属于反应(填基本反应类型)⑷流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑洗涤和低温烘干。
⑸某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式。
⑹除铁过程中,温度pH对除铁效果的影响分别对如图所示。
由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。
II.以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):↑+23n CO ZnO CO Z 高温 2CO Zn CO ZnO ++高温则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)7. 绿矾又名七水硫酸亚铁(FeSO 4·7H 2O ),其用途广泛,可用于制铁盐、氧化铁颜料、净水剂、防腐剂、消毒剂等。
绿矾(FeSO 4·7H 2O )的一种综合利用工艺如下:(1)细铁丝在氧气中可以燃烧,请写出铁在氧气中燃烧的化学方程式 。
(2)绿矾与NH 4HCO 3在溶液中反应,有CO 2生成,反应的化学方程式为 。
(3) 隔绝空气进行“焙烧”,铁元素的转化途径是,实际作还原剂的是CO 。
写出“焙烧”过程中各步反应的化学方程式:A.;B.____________________________________________;C.___________________________________________(3)母液“除杂”后,欲得到(NH 4)2SO 4粗产品,操作步骤依次为蒸发浓缩、____________、过滤、洗涤、干燥。
工艺流程图准提(1)答案1、(1)CaCO 3 =CaO+CO 2↑;分解反应。
(2)物理;(3)过滤;漏斗。
(4)做化肥或氮肥等。
2、(1)二氧化碳,过滤。
(2)冰水混合物,CaO 2+H 2O 2+7H 2O =CaO 2·8H 2O ,CaO 或Ca(OH)2过量,且Ca(OH)2微溶。
(3)72,1:10 。
(4)解:设样品中CaO 2·8H 2O 的质量为x2CaO 2·8H 2O=====△2CaO +O 2↑+16H 2O ↑432 32x 3.22.332432=x ∴x =43.2(g )∴ 样品中CaO 2·8H 2O 的质量分数为%1005032.4⨯=86.4% 答:样品中CaO 2·8H 2O 的质量分数为=86.4%3、(1)物理(2) 4NH 3+5O 2=4NO +6H 2O (3)3 (4)A C 2NH 4NO 3+Ca(OH)2 =Ca(NO 3)2 +2H 2O +2NH 3↑4、D5、(1)根据煅烧产生的CO 2和蛋壳的主要成分为CaCO 3,可以确定化学方程式↑+23a CO CaO CO C 高温。
CO 2的任意排放会引发温室效应;根据HCHO CH CO 242→+一定条件,计算CO 2与CH 4的质量比是44:16=11:4。
(2)石灰乳中的Ca(OH)2含量比澄清石灰水中多,更利于提高醋酸钙的产量;(3)保证与Ca(OH)2完全反应,提高醋酸钙的含量;O H AC Ca HAC OH Ca 2222)(2)(+=+⑷加入盐酸就是为了将蛋壳与膜分开,过量的话会与CaCO 3反应,会使制作醋酸钙的原料量减少。
6、 (1)固体的表面积越大,化学反应速率越快。
含锌废渣粉碎的目的是增大接触面积,加快反应速率,充分反应。
(2)浓硫酸稀释过程中需用用到:量筒、滴管、细口瓶、玻璃棒和烧杯,通过比较可知,还缺少烧杯和量筒。
此处玻璃棒的作用是搅拌,将热量及时地扩散。
(3)加入过量的X ,目的是除去铜,本小题实质是物质的除杂,既要除去杂质又要避免引入新的杂质,考虑到金属活动性顺序,故X 可以是锌,滤渣含有锌和置换的铜,这个反应过程是置换反应。
(4)这是分离可溶性固体和液体的方法:先将热的饱和溶液冷却,晶体就会析出,将此有晶体析出的饱和溶液,过滤,用少量的水洗涤,再低温烘干。
所以操作的步骤是:加热浓缩,冷却结晶,过滤,洗涤和低温烘干(5)Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,铁的氧化物有三种,Fe 2O 3,FeO, Fe 3O 4.比较铁氧的质量比21:8只有Fe 3O 4符合题意。
(6)关键看懂两张图的X 轴和Y 轴代表的含义,为了除铁效果最佳,我们需要找出最高除铁率对应的温度和pH. II.题目要求求出理论上最多制得锌多少吨故设理论上最多制得锌的质量为X ,根据题意可知ZnCO3的质量是=100t×62.5%=62.5t↑+23n CO ZnO CO Z 高温 2CO Zn CO ZnO ++高温由两个方程式可知道 ZnCO 3 ~ Zn125 6562.5t X t 5.6212565=X x=32.5t7、(1)3Fe+2O 2点燃Fe 3O 4(2分)(2)FeSO 4·7H 2O + 2NH 4HCO 3 = FeCO 3 +(NH 4)2SO 4 + CO 2↑+ 8H 2O(2分) (3)CO 2+C 高温2CO (2分) FeO+CO 高温Fe+CO 2(2分)(4)降温结晶(或冷却热的饱和溶液)(2分)。