沉积物中酶的测定方法
- 格式:doc
- 大小:47.50 KB
- 文档页数:6
![酶检测方法[001]](https://uimg.taocdn.com/a7cd3ad2846a561252d380eb6294dd88d1d23d77.webp)
酶检测方法酶是生物体内一类具有特定功能的蛋白质,它们在生物体内发挥着关键的催化作用。
酶的活性能够反映生物体内代谢的运行状态,因此酶检测在生物学研究、临床诊断和生物工程等领域起着重要的作用。
本文将介绍酶检测的方法,并分析其原理和应用。
一、酶检测的原理每种酶都具有特定的底物,当底物被酶催化后产生一定的产物,可以通过测量产物的数量或者相关反应的速率来间接反映出酶的活性。
酶的检测方法主要有光度法、荧光法、比色法和电化学法等。
光度法是利用酶催化反应后产生的物质溶液的吸收特性来检测酶活性的方法。
首先,选择具有特定光学属性的底物,使酶催化后的产物能够吸收特定波长的光线。
然后,通过测量反应体系中吸光度的变化来确定酶的活性。
举例:以辣根过氧化物酶的检测为例,辣根过氧化物酶能够将辣根过氧化物(HRP)和底物间的过氧化氢催化成高活性的自由基,进而氧化显色底物,形成有色产物。
利用比色法测定产物的吸光度变化,即可定量检测出辣根过氧化物酶的活性。
荧光法是利用酶催化反应产物的荧光特性来检测酶活性的方法。
在酶催化反应中,有些底物和产物具有荧光特性,通过测量产物的荧光强度变化可以确定酶的活性。
举例:以葡萄糖氧化酶的检测为例,葡萄糖氧化酶能够将葡萄糖氧化成葡萄糖酸,产生荧光物质NADH。
通过测量NADH的荧光强度变化,可以判断葡萄糖氧化酶的活性。
比色法是利用酶催化反应后产生的有色产物来检测酶活性的方法。
在酶催化反应中,底物与其他试剂反应产生有色产物,通过测量产物的吸光度变化来确定酶的活性。
举例:以碱性磷酸酶的检测为例,碱性磷酸酶能够将对硝基苯磷酸钠底物催化成黄色产物对硝基苯胺。
通过测量对硝基苯胺的吸光度变化,可以确定碱性磷酸酶的活性。
五、电化学法电化学法是利用酶在电极表面催化产生电流来检测酶活性的方法。
在电极表面固定酶,底物被酶催化后,产生电荷转移,可以通过测量电流变化来确定酶的活性。
举例:以谷胱甘肽还原酶的检测为例,谷胱甘肽还原酶能够将还原型谷胱甘肽(GSH)氧化为氧化型谷胱甘肽(GSSG)。

一、脲酶测定(比色法)1.方法原理脲酶广泛存在于土壤中,它能酶促尿素分解生成氨、二氧化碳和水。
测定脲酶的方法很多,包括比色法、扩散法、电极法等,其中比色法最为常用。
现介绍苯酚一次氯酸钠比色法,该方法以尿素为基质,根据酶促产物氨与苯酚次氯酸钠作用(在碱性溶液中及在亚硝基铁氰化钠催化剂作用下)生成蓝色的靛酚,来分析脲酶活性。
2.试剂配制(1)pH6.7柠檬酸盐溶液:取368g柠檬酸溶于600mL蒸馏水中,另取295g氢氧化钾溶于水,再将两种溶液合并,用1N氢氧化钠将pH调至6.7,并用水稀释至2L。
(2)苯酚钠溶液:称取62.5g苯酚溶于少量乙醇中,加2mL甲醇和18.5mL丙酮,后用乙醇稀释至100mL(A液),保存再冰箱中。
称取27g氢氧化钠溶于100mL水中(B液),保存于冰箱中。
使用前,取A、B两液各20mL混和,并用蒸馏水稀释至100mL备用。
(3)次氯酸钠溶液:用水稀释制剂至活性氯的浓度为0.9%,溶液稳定。
(4)10%尿素溶液:10g尿素溶于100mL水中。
(5)N的标准溶液:精确称取0.4717g硫酸铵溶于水稀释至1L,则得1mL含0.1mgN的标液,再将此液稀释10倍制成氮工作液(0.01mg/mL)。
3.操作步骤取5g风干土置于50mL三角瓶中,加1mL甲苯。
15min后加10mL10%尿素溶液和20mLpH=6.7柠檬酸盐缓冲液。
摇匀,37℃恒温箱中培养24h。
过滤,取1mL滤液注入50mL 容量瓶中,然后按配制标准曲线显色方法进行比色测定(为了消除土壤中原有的尿素而引起的误差,每一土壤需做无基质对照,整个试验需做无土壤对照。
)。
标准曲线配制:分别取0、l、3、5、7、9、11、13mL氮工作液,移于50mL容量瓶中,然后加蒸馏水至20mL。
再加4mL苯酚钠溶液和3mL次氯酸钠溶液。
随加随摇匀。
20min 后显色,定容。
lh内在分光光度计上于波长578nm处比色。
根据吸光值与氮溶液浓度绘制标准曲线。

沉积物检测相关标准沉积物亦可以由风(风成过程(eolian processes))及冰川搬运。
沙漠的沙丘及黄土是风成运输及沉积的例子。
冰川的冰碛石(Moraine)矿床及冰碛(Till)是由冰所运输的沉积物。
简单的重力崩塌制造了如碎石堆、山崩沉积及喀斯特崩塌特色的沉积物。
每一种类型的沉积物有不同的沉降速度,依据其大小、容量、密度及形状而定。
(14.11.28)(001)检测项目:六六六、滴滴涕、油类、多氯联苯、汞、镉、铅、总铬、砷、铜、锌、硒、硫化物、有机碳等。
检测标准:GB/T20260-2006海底沉积物化学分析方法GB/T25282-2010土壤和沉积物13个微量元素形态顺序提取程序GB/T27853-2011化学品水-沉积物系统中好氧厌氧转化试验GB/T27858-2011化学品沉积物-水系统中摇蚊毒性试验加标于水法GB/T27859-2011化学品沉积物-水系统中摇蚊毒性试验加标于沉积物法GB/T30738-2014海洋沉积物中放射性核素的测定γ能谱法GB/T30739-2014海洋沉积物中正构烷烃的测定气相色谱-质谱法GB/T30740-2014海洋沉积物中总有机碳的测定非色散红外吸收法GB/T31270.8-2014化学农药环境安全评价试验准则第8部分:水―沉积物系统降解试验HJ642-2013土壤和沉积物挥发性有机物的测定顶空/气相色谱-质谱法HJ650-2013土壤、沉积物二噁英类的测定同位素稀释/高分辨气相色谱-低分辨质谱法HJ679-2013土壤和沉积物丙烯醛、丙烯腈、乙腈的测定顶空-气相色谱法环境保护部HJ680-2013土壤和沉积物汞、砷、硒、铋、锑的测定微波消解/原子荧光法HJ703-2014土壤和沉积物酚类化合物的测定气相色谱法HJ77.4-2008土壤和沉积物二噁英类的测定同位素稀释高分辨气相色谱-高分辨质谱法HY/T132-2010海洋沉积物与海洋生物体中重金属分析前处理微波消解法HY/T147.2-2013海洋监测技术规程第2部分:沉积物HY/T153-2013海水、沉积物中致突变性的测定鼠伤寒沙门氏菌/哺乳动物微粒体酶试验HY/T172-2014海洋沉积物标准物质研制及保存技术规范JT/T494-2003汽油机进气阀沉积物模拟试验方法NB/SH/T0834-2010发动机油适度高温活塞沉积物的测定热氧化模拟试验法(TEOSTMHT)SH/T0514-1992汽油机油低温沉积物评定法(MS程序VD法)SH/T0672-1998汽油机油低沉积物性能评定法(CEPT-V法)SH/T0750-2005发动机油高温氧化沉积物测定法(热氧化模拟试验法)SN/T0801.6-2011出口动植物油脂第6部分:豆油中沉积物的检验方法。



土壤纤维素酶活性测定(3,5- 二硝基水杨酸比色法)一、原理纤维素是植物残体进入土壤的碳水化合物的重要组分之一。
在纤维素酶作用下,它的最初水解产物是纤维二糖,在纤二糖酶作用下,纤维二糖分解成葡萄糖。
所以,纤维素酶是碳素循环中的一个重要的酶。
纤维素酶解所生成的还原糖与3,5- 二硝基水杨酸反应而生成橙色的3-氨基-5-硝基水杨酸。
颜色深度与还原糖量相关,因而可用测定还原糖量来表示蔗糖酶的活性。
二、试剂1)甲苯2)1%羧甲基纤维素溶液:1g 羧甲基纤维素钠,用50%的乙醇溶至100ml。
3)pH5.5醋酸盐缓冲液:0.2mol/L 醋酸溶液 11.55ml 95% 冰醋酸溶至1L.0.2mol/L 醋酸钠溶液 16.4g C2H3O2Na或27.22g C2H3O2Na.3H2O溶至1L.取11ml 0.2mol/L 醋酸溶液和88ml 0.2mol/L 醋酸钠溶液混匀即成PH 5.5醋酸盐缓冲液. 4)3,5-二硝基水杨酸溶液:称1.25g二硝基水杨酸,溶于50ml 2mol/LNaOH和125ml水中,再加75g酒石酸钾钠,用水稀释至250ml(保存期不过7天),5)葡萄糖标准液(1mg/mL)预先将分析纯葡萄糖置80℃烘箱内约12小时。
准确称取50mg葡萄糖于烧杯中,用蒸馏水溶解后,移至50mL容量瓶中,定容,摇匀(冰箱中4℃保存期约一星期)。
若该溶液发生混浊和出现絮状物现象,则应弃之,重新配制。
三、操作步骤葡萄糖标准曲线:分别吸1mg/mL的标准葡糖糖溶液0、0.1、0.2、0.4、0.6、0.8mL 于试管中,再补加蒸馏水至1mL,加DNS溶液3ml混匀,于沸腾水浴中加热5min,取出立即泠水浴中冷却至室温,以空白管调零在波长540nm处比色,以OD值为纵坐标,以葡萄糖浓度为横坐标绘制标准曲线。
称10g土壤置于50ml三角瓶中,加入1.5ml甲苯,摇匀后放置15min,再加5ml 1%羧甲基纤维素溶液和5ml pH5.5醋酸盐缓冲液,将三角瓶放在37℃恒温箱中培养72h。

城市河流表层沉积物碱性磷酸酶分布及其成因探讨马天海;孙娟【摘要】以南京城市河流秦淮河、运粮河为研究对象,通过测定11个点位表层沉积物中碱性磷酸酶活性(APA),分析了不同类型城市河道沉积物APA分布差异性;通过测定沉积物pH值、营养元素(碳、氮、磷)含量,探讨了沉积物理化特征对APA 分布影响.结果表明:(1)外秦淮河沉积物APA平均浓度最低,为10214.9m·g·kg-1·h-1,内秦淮河最高,为20021.2 mg·kg-1·h-1,APA分布与河道水力流通性及优势植物类型有关;(2)APA含量与总磷、氨氮、硝酸盐氮、有机质含量显著正相关(p<0.05),与pH显著负相关(p<0.05),表明表层沉积物丰富的营养成分充足情况下,将促使微生物新陈代谢,使得APA升高,而pH升高则会抑制APA.【期刊名称】《青海环境》【年(卷),期】2018(028)004【总页数】4页(P170-172,202)【关键词】碱性磷酸酶;营养元素;表层沉积物;城市河流【作者】马天海;孙娟【作者单位】南京大学金陵学院,江苏南京 210089;南京大学金陵学院,江苏南京210089【正文语种】中文【中图分类】X52水体沉积物是水体营养元素的重要蓄积库,是水体营养盐的缓冲剂,维持水中营养盐平衡,在水体缺乏营养时,水生生物的生长主要是靠沉积物释放的营养盐维持调节。
磷是造成水质富营养化的关键性的限制性因素之一[1]。
城市河流闸控滞流,水力流通性差,造成大量沉积物淤积,内源负荷累积。
城市河流沉积物磷的沉积物-水界面交换和输送研究具有重要意义。
本文研究了南京城市河流秦淮河、运粮河表层沉积物中碱性磷酸酶分布特征,测定了相应沉积物中pH值、营养元素(碳、氮、磷)含量及氮、磷形态,分析了南京城市河流中表层沉积物中碱性磷酸酶活性(APA)与营养元素、pH值的相关性。
研究结果可初步揭示南京城市河流表层沉积物中碱性磷酸酶的分布状况,以及与营养元素的关系。

土壤酶的测定方法(一)蔗糖酶方法:比色法1 试剂配制(1)20%蔗糖(质量分数)(2)甲苯(3)pH=5.5醋酸盐缓冲液:取120 ml 冰醋酸用水稀释至1 L(a),取164 g无水CH3COONa 溶于水并稀释至1 L(b),将(a)与(b)二液按1:8混合再用pH计校正pH。
(4)0.2 M Na2HPO4·12H2O(5)钼溶液:配制5%钼酸铵水溶液(a),再取200 ml浓硫酸加800 ml水(b)。
使用前将(a)、(b)二液按1:1混合。
(6)铜试剂:取50 g CuSO4·5H2O溶于500 ml水中(a),取25 g Na2CO3、25 g酒石酸钾钠、20 g NaHCO3和200 g Na2SO4溶于水并稀释至1 L再加几滴甲苯(b)。
使用前将(a)、(b)二液混合。
(7)葡萄糖标准溶液:将葡萄糖先在50-58℃条件下,真空干燥至恒重。
然后取500 mg溶于100 ml苯甲酸溶液(饱和)中(5 mg还原糖/ml),即成标准葡萄糖溶液。
再用标准液制成1 ml含0.01-0.5 mg葡萄糖的工作溶液。
2 标准曲线绘制:将(7)所述的葡萄糖标准溶液稀释成1 mg/ml 还原糖工作液。
然后,取不同体积(0.5-50 ml)工作液移于100 ml容量瓶中,加入10 ml pH=5.5醋酸盐缓冲液,用水稀释至刻度。
吸取此液5 ml移于100 ml容量瓶中,加4 ml铜试剂。
在沸腾水浴上放置25 min,冷却至室温。
再加2 ml 0.2 M磷酸氢二钠和5 ml钼溶液,显色1 min定容,在分光光度计上于578 nm 处比色,根据光密度值和浓度绘制标准曲线。
3 操作步骤取10 g土壤(&填料)置于100 ml容量瓶中,加2 ml甲苯。
15 min后加10 ml 20 %蔗糖和10 ml pH=5.5醋酸盐缓冲液,置于37℃恒温箱中培养24 h。
培养结束后,过滤并定容,按绘制标准曲线操作步骤显色、比色。

实验四酶的提取及比活性测定一.酶的提取、比活测定概论1.方法:酶的本质是蛋白质,酶的分离提纯方法常采用分离提纯蛋白的方法――即利用蛋白的理化性质进行分离,如:前面血清γ球蛋白的分离纯化。
一般采用:透析法,有机溶剂沉淀法(乙醇,丙酮等)、层析法,透析、离心、电泳等。
通常需要多种方法配合使用。
2.体液――直接提取酶组织细胞――先破碎,再用一定的试剂提取方法3.原则①制备的原料必须新鲜,酶含量丰富,在提取过程中要保护酶的活性②初期采用粗而简单的方法,后期采用高分辨率而费时的方法③注意事项(影响因素)――回顾蛋白的变性因素ⅰPH:多数情况下酶作用的最适PH不一定是酶最稳定的PH,两者可能相差1个以上的PH单位。
根据不同的情况选择合适PH和合适缓冲容量的缓冲溶液,以稳定酶的活性。
ⅱ温度: 0℃,酶比较稳定。
提取酶的操作在0-4℃进行。
如果用有机溶剂沉淀法应先将有机溶剂预冷,例外:丙酮酸羟化酶,26℃时最稳定,有些酶低至-20℃或-70℃才能保留其活性,有些酶溶液经冻融处理十分有害。
ⅲ氧化:-SH(巯基)对有些酶的活性所必需,若被氧化,形成-S-S-(二硫键),酶活性丧失。
为防止失活,可加入还原剂:β-巯基乙醇、二硫苏糖醇(DTT)、半胱氨酸、谷胱甘肽等ⅳ重金属离子的污染:-SH可被Pb、Fe、Cu等重金属离子起作用而失活。
可加入1-3×10-4M的EDTA(乙二胺四乙酸)来螯合这些离子ⅴ蛋白酶的污染:细胞内蛋白酶释放,可能水解破坏酶。
可加入蛋白酶抑制剂,如:PMSF (苯甲基磺酰氟)、DFP(二异丙基氟磷酸)等。
ⅵ介质的极性和离子强度有些酶需疏水环境则加入1-10%甘油、蔗醣4.评估指标①酶的纯度――用比活性代表比活性:单位重量(mg)蛋白样品中所含酶的活性单位,随着酶的逐步纯化其比活性逐步升高,可借以鉴定酶的纯化程度和纯化步骤的正确性表示方法:每mg蛋白质具有酶的活性单位测定方法:ⅰ每ml样品中的蛋白质mg数ⅱ每ml样品中酶的活性单位酶活性单位:酶促反应在单位时间(秒,分钟,小时)内生成一定量的产物或消耗一定量(如1umol)的底物所需的酶量。

土壤酶活性测定方法综合引言:土壤酶活性是指土壤中特定酶在一定时间内分解特定底物的能力,是评估土壤生态系统功能和土壤肥力状况的重要指标。
土壤酶活性测定方法是研究土壤酶活性的关键手段之一、本文将综合介绍常用的土壤酶活性测定方法,包括蔗糖酶活性测定方法、过氧化氢酶活性测定方法和脲酶活性测定方法。
一、蔗糖酶活性测定方法:蔗糖酶是一种重要的有机磷酸酶,广泛存在于土壤中,能够水解蔗糖为葡萄糖和果糖。
测定土壤蔗糖酶活性可以反映土壤中酶的数量和活性。
1.提取土壤酶液:将土壤与玻璃棒研磨均匀,用0.5mol/L甘油缓冲液(pH6.8)溶解土壤,离心沉淀,得到土壤酶液。
2.酶活性测定:取一定量的土壤酶液加入蔗糖底物和缓冲液,在37℃恒温振荡下反应30分钟,用酒精停止反应,加入硫酸,取样测定比色液的吸光度。
3.统计分析:根据比色液吸光度与标准曲线对照,计算出土壤蔗糖酶活性。
二、过氧化氢酶活性测定方法:过氧化氢酶是一种氧化还原酶,能够催化过氧化氢分解为氧气和水。
测定土壤过氧化氢酶活性可以反映土壤中氧化还原反应的发生情况。
1.提取土壤酶液:将土壤与甘油缓冲液混合,加入液氮使其冷冻破碎,离心沉淀得到土壤酶液。
2.酶活性测定:取一定量的土壤酶液加入过氧化氢底物和缓冲液,在25℃恒温振荡下反应一定时间,停止反应后加入酒精,用紫外分光光度计测定吸光度。
3.统计分析:根据吸光度与过氧化氢递减曲线对照,计算出土壤过氧化氢酶活性。
三、脲酶活性测定方法:脲酶是一种解脲酸酯的酶,能够水解尿素为氨和二氧化碳。
测定土壤脲酶活性可以反映土壤中氮循环的情况。
1.提取土壤酶液:将土壤与脲酸酯缓冲液混合,用玻璃棒研磨均匀,离心沉淀得到土壤酶液。
2.酶活性测定:将一定量的土壤酶液加入脲酶底物和缓冲液,在37℃恒温振荡下反应一定时间,反应停止后加入酒精,用比色法测定吸光度。
3.统计分析:根据吸光度与标准曲线对照,计算出土壤脲酶活性。
结论:以上就是蔗糖酶活性测定方法、过氧化氢酶活性测定方法和脲酶活性测定方法的综合介绍。
沉积物中酶的测定方法水解酶一、脲酶(靛酚比色法)大多数细菌、真菌和高等植物均具有脲酶(urease)。
它是一种酰胺酶(amidase),能酶促有机质分子中肽键的水解。
土壤的脲酶活性与土壤的微生物数量、有机质含量、全氮和速效氮含量呈正相关。
人们常用土壤的脲酶活性表征土壤的氮素状况。
根据脲酶水解时生成的氨与苯酚钠及次氯酸钠反应,形成兰色靛酚这一原理。
此法的精确性较高,重现性较好。
试剂配制:1.甲苯(分析纯)2.10%尿素:尿素(分析纯)10g溶于100ml蒸馏水中。
3.柠檬酸盐缓冲液:368g柠檬酸(分析纯)溶于600ml蒸馏水中;295g氢氧化钾溶于1000ml蒸馏水;将二种溶液合并,用1mol/L氢氧化钠调pH至6.7,并用蒸馏水稀释至2L。
4.苯酚钠溶液:A.62.5g苯酚溶于少量95%乙醇,加2ml甲醇和18.5ml丙酮,用乙醇稀释至100ml,存于冰箱中。
B.27g氢氧化钠溶于100ml水中保存于冰箱中。
使用前,将溶液A、B各吸取20ml混合,用蒸馏水稀释至100ml备用。
5.次氯酸钠溶液:用蒸馏水稀释试剂,至活性氯浓度为0.9%。
(次氯酸钠活性氯浓度为5.2%)。
标准溶液:氮的标准溶液:精确称取称0.4717g硫酸铵(105℃烘干)溶于水,稀释至1L,则得1ml含0.1mg氮的标准溶液,即100ppm。
将100ppm的标准溶液稀释为10ppm。
标准曲线绘制:分别吸取0.5ml、1.5ml、2.5ml、3.5ml、4.5ml、5.5ml、6.5ml、7.5ml稀释后的标准溶液于50ml容量瓶或刻度试管中,然后加蒸馏水至25ml。
再加4ml苯酚钠溶液和3ml次氯酸钠溶液,随加随摇匀。
20min后显色,定容至50ml。
1h内在分光光度计上于波长578nm处比色。
根据吸光度和溶液浓度绘制标准曲线。
(溶液浓度为:0.1ppm、0.3ppm、0.5ppm、0.7ppm、0.9ppm、1.1ppm、1.3ppm、1.5ppm。
土壤酶的测定方法土壤酶是指存在于土壤中的各种生物所分泌的酶。
它们在土壤中起着关键的生物地球化学功能,包括有机质分解、养分循环和抑制有害物质等。
由于土壤酶的活性会受到环境因素的影响,因此准确测定土壤酶活性对于了解土壤生态系统的功能和健康状态至关重要。
测定土壤酶活性的方法有多种,下面将介绍几种常用的方法。
1.pH酶效应法pH酶效应法利用不同pH条件下土壤酶活性的变化来测定。
该方法通常使用缓冲液调节土壤pH,然后测定不同pH下的酶活性。
酶活性与pH变化的关系可以反映土壤酶的稳定性和耐受性。
2.酶活法酶活法是测定土壤中特定酶活性的一种常用方法。
常见的酶活性测定有蔗糖酶、脱氢酶和过氧化物酶等。
该方法通常在实验室条件下进行,通过添加特定底物并测定反应产物来测定酶活性。
3.酶基质法酶基质法是利用添加特定底物并测定底物降解产物的方法来测定土壤酶活性。
常见的酶基质法有蔗糖基质法、硝酸盐还原酶基质法和过氧化物酶基质法等。
该方法通常在实验室条件下进行,通过添加特定底物并测定底物降解产物来测定酶活性。
4.比色法比色法是利用特定化学反应物质与酶活性相关产物发生反应产生颜色变化来测定酶活性的方法。
常见的比色法有3,5-二硝基水杨酸盐法、PCP法和甲醛法等。
该方法通常是测定土壤酶活性的一种快速、简单和经济的方法。
以上介绍的方法只是常用的几种,实际上还有许多其他方法可以用来测定土壤酶活性。
需要注意的是,不同的酶活性测定方法适用于不同的酶和底物,因此在选择方法时应根据具体情况进行选择。
综上所述,测定土壤酶活性是了解土壤生态系统功能和健康状态的重要手段之一、通过选择合适的方法,可以准确测定土壤酶活性,为土壤管理和保护提供科学依据。
自然科学实验中酶的活性测量技巧与方法酶是一类生物催化剂,能够加速化学反应的速率。
在自然科学研究中,测量酶的活性对于了解生物体内的化学过程以及开发新药物具有重要意义。
本文将介绍一些常用的酶活性测量技巧与方法。
一、酶活性的测量原理酶活性通常通过测量酶催化反应产生的产物的生成速率来间接反映。
酶活性的测量原理可以分为两类:连续测量法和间断测量法。
连续测量法是指在酶催化反应过程中,通过连续监测反应物浓度的变化来计算酶活性。
这种方法常用于反应物浓度较高的情况下,如酶催化的酶促反应。
其中,常用的连续测量法包括比色法、荧光法和发光法等。
比色法是通过测量反应物或产物的吸光度来间接测量酶活性。
例如,过氧化氢酶催化过氧化氢分解反应产生的水可以与碘化钾反应生成碘,通过测量碘的吸光度来计算酶活性。
荧光法是通过测量反应物或产物的荧光强度来间接测量酶活性。
例如,琼脂糖酶催化琼脂糖水解反应产生的葡萄糖可以与荧光探针结合,通过测量荧光强度的变化来计算酶活性。
发光法是通过测量反应物或产物的发光强度来间接测量酶活性。
例如,ATP酶催化ATP水解反应产生的ADP可以与荧光素结合,通过测量发光强度的变化来计算酶活性。
间断测量法是指在酶催化反应过程中,通过在一定时间间隔内取样,然后测量样品中反应物或产物的浓度来计算酶活性。
这种方法常用于反应物浓度较低的情况下,如酶催化的酶抑制反应。
其中,常用的间断测量法包括比色法、滴定法和高效液相色谱法等。
二、酶活性测量技巧与方法1. 比色法比色法是一种简单且常用的酶活性测量方法。
它通过测量反应物或产物在特定波长下的吸光度来计算酶活性。
这种方法适用于颜色变化明显的反应体系。
例如,过氧化氢酶催化过氧化氢分解反应产生的水可以与碘化钾反应生成碘,通过测量碘的吸光度来计算酶活性。
2. 荧光法荧光法是一种高灵敏度的酶活性测量方法。
它通过测量反应物或产物在特定波长下的荧光强度来计算酶活性。
这种方法适用于荧光探针与反应物或产物结合的反应体系。
酶的检测教案:教授酶检测的方法和技术酶是一种生物催化剂,广泛应用于医疗、食品、环保等领域。
因此,酶检测也成为各领域的重要检测手段。
本文将介绍酶检测的方法和技术。
一、酶的检测方法1.酶的全量测定法全量测定法是一种简单、快速、准确的酶测定方法,适用于一般的酶测定,如过氧化物酶、乳酸脱氢酶等。
其步骤如下:(1)样品制备:将待检测样品或标准品稀释至不同浓度。
(2)试剂制备:根据不同酶的性质选择适当的试剂。
(3)反应体系组装:按标准要求组装反应体系。
(4)样品反应:将样品加入反应管后,在适当的反应温度和时间下进行反应。
(5)色谱检测:按照酶特性及反应体系选择适当的检测方法进行检测。
2.酶的分子测定法分子测定法是一种比较复杂、需要特殊仪器的酶检测方法,适用于DNA酶、RNA酶等酶的检测。
其步骤如下:(1)提取DNA或RNA:从样品中提取DNA或RNA,纯化后制备成存储物。
(2)PCR扩增:通过PCR扩增,使得目标DNA或RNA的特异性更加突出。
(3)电泳分析:通过电泳分析,使目标DNA或RNA的特异性更加突出。
(4)其他方法:如荧光标记、原位杂交等。
二、酶的检测技术1.酶速率测定技术酶速率测定技术是衡量酶活性的常用方法之一。
它是通过测定反应过程中底物消耗量或生成物的增加量,来确定酶催化速率和酶活性的方法。
在反应过程中,酶催化底物转化为产物,或催化产物逆反应向底物转化。
酶反应过程中的速率和浓度关系可以使用公式V=K[S]/(Km+[S])描述。
V为反应速率,[S]为底物浓度,Km为酶底物结合力,K为酶最大活性。
2.酶抑制测定技术酶抑制测定技术是测定抑制剂对酶活性影响的方法。
酶抑制作用是把酶从正常催化转化为变形催化,以致催化能力降低。
常用的酶抑制剂有竞争性抑制剂、非竞争性抑制剂等。
通过测定抑制剂在酶催化反应中的活性影响,可以进行酶催化反应速率的抑制分析。
3.酶免疫分析技术酶免疫分析技术是一种高灵敏度、高特异性、简便易行的酶检测方法。
酶活性的测定方法生物样品预处理预冷解剖用具,采用颈后断头的方法将鱼杀死,立即取肝脏、腮、脑,操作均在4℃下进行,用预冷的0.15 mol/L KCl 溶液洗去血丝,用滤纸吸干后称重。
将肝、脑组织放入预冷的Tris-HCl缓冲液(0.1 mol/L Tris-HCl, pH 7.4, 0.15 mol/L KCl)匀浆(匀浆比(W/V)1:5),腮组织放入组织匀浆(匀浆缓冲液含40mmol/L咪唑,250mmol/L蔗糖,5mmol/L EDTA,pH7.0),匀浆比为1:40,匀浆速率为10000g,以15s为周期,重复3次。
分别取1ml匀浆液放入1.5ml离心管进行离心,4℃下离心(9000g,20min),取上清液-80℃下保存,待测。
(1)250mL 0.15 mol/L KCl:取2.7956g(2)Tris-HCl缓冲液:125mL 0.1 mol/L Tris(1.5143g)+ 105mL 0.1 mol/L HCl+ KCl(0.15*0.23*74.55=2.5720g)(Na++K+)-ATPase活性的测定1、试剂(1)匀浆液(250ml):40mmol/L咪唑0.6808g+250mmol/L 蔗糖21.3931g +5mmol/LEDTA 0.3653g(2)反应缓冲液(250ml):80mmol/L咪唑1.3616g+4mmol/LMgCl2 0.2033 g+40mmol/LKCl 0.7455g(3)16mmol/L Na2ATP(10ml):0.0988g(4)30%三氯乙酸(TCA)9g TCA+21mlH2O(5)定磷试剂(硫酸亚铁-钼酸胺试剂100ml):10ml 5mol/LH2SO4+1.3556 g钼酸铵+90mlH2O每10ml加入FeS040.5g(FeS04·7H2O 0.0941g),25ml加入FeSO4·7H2 O 0.2353g,临用前配制。
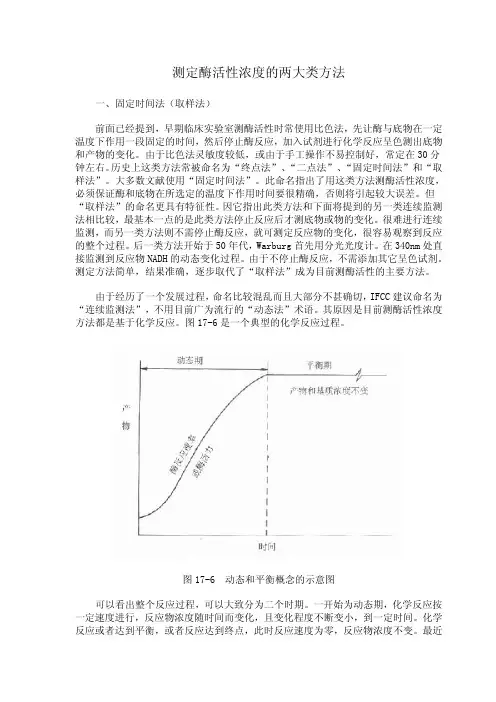
1.按反应时间分类法:20世纪50年代以前大都使用固定时间法。
这种方法是以酶催化反应的平均速度来计算酶的活性,现多已不用。
50年代中期开始采用连续监测法。
这种方法用自动生化分析仪上完成,可以测酶反应的初速度,其结果远比固定时间法准确,在高浓度标本尤为明显,但本法也受到反应时间,反应温度,试剂等的影响,应加以注意。
(1)定时法:(两点法)通过测定酶反应开始后某一时间段内(t1到t2)产物或底物浓度的总变化量来求取酶反应初速度的方法。
其中t1往往取反应开始的时间。
酶与底物在一定温度下作用一段固定的时间,通过加入强酸、强碱、蛋白沉淀剂等,使反应完全停止(也叫中止反应法)。
加入试剂进入化学反应呈色测出底物和产物的变化。
该法最基本的一点是停止反应后才测定底物或物的变化。
优点:简单易行,对试剂要求不高。
缺点:难保证测定结果的真实性。
难以确定反应时间段酶促反应是否处于线性期。
随着保温时间的延续,酶变性失活加速。
(2)连续监测法:又称为动力学法或速率法、连续反应法。
在酶反应过程中,用仪器监测某一反应产物或底物浓度随时间的变化所发生的改变,通过计算求出酶反应初速度。
连续监测法根据连续测得的数据,可选择线性期的底物或产物变化速率用于计算酶活力。
因此连续监测法测定酶活性比定时法更准确。
实际工作中,采用工具酶的酶偶联法已经成为应用最广、最频繁测酶活性浓度的方法。
(3)平衡法:通过测定酶反应开始至反应达到平衡时产物或底物浓度总变化量来求出酶活力的方法,又叫终点法。
2.按检测方法分类法:①分光光度法;②旋光法;③荧光法;④电化学方法;⑤化学反应法;⑥核素测定法;⑦量热法。
沉积物中酶的测定方法水解酶一、脲酶(靛酚比色法)大多数细菌、真菌和高等植物均具有脲酶(urease)。
它是一种酰胺酶(amidase),能酶促有机质分子中肽键的水解。
土壤的脲酶活性与土壤的微生物数量、有机质含量、全氮和速效氮含量呈正相关。
人们常用土壤的脲酶活性表征土壤的氮素状况。
根据脲酶水解时生成的氨与苯酚钠及次氯酸钠反应,形成兰色靛酚这一原理。
此法的精确性较高,重现性较好。
试剂配制:1.甲苯(分析纯)2.10%尿素:尿素(分析纯)10g溶于100ml蒸馏水中。
3.柠檬酸盐缓冲液:368g柠檬酸(分析纯)溶于600ml蒸馏水中;295g氢氧化钾溶于1000ml蒸馏水;将二种溶液合并,用1mol/L氢氧化钠调pH至6.7,并用蒸馏水稀释至2L。
4.苯酚钠溶液:A.62.5g苯酚溶于少量95%乙醇,加2ml甲醇和18.5ml丙酮,用乙醇稀释至100ml,存于冰箱中。
B.27g氢氧化钠溶于100ml水中保存于冰箱中。
使用前,将溶液A、B各吸取20ml混合,用蒸馏水稀释至100ml备用。
5.次氯酸钠溶液:用蒸馏水稀释试剂,至活性氯浓度为0.9%。
(次氯酸钠活性氯浓度为5.2%)。
标准溶液:氮的标准溶液:精确称取称0.4717g硫酸铵(105℃烘干)溶于水,稀释至1L,则得1ml含0.1mg氮的标准溶液,即100ppm。
将100ppm的标准溶液稀释为10ppm。
标准曲线绘制:分别吸取0.5ml、1.5ml、2.5ml、3.5ml、4.5ml、5.5ml、6.5ml、7.5ml稀释后的标准溶液于50ml容量瓶或刻度试管中,然后加蒸馏水至25ml。
再加4ml苯酚钠溶液和3ml次氯酸钠溶液,随加随摇匀。
20min后显色,定容至50ml。
1h内在分光光度计上于波长578nm处比色。
根据吸光度和溶液浓度绘制标准曲线。
(溶液浓度为:0.1ppm、0.3ppm、0.5ppm、0.7ppm、0.9ppm、1.1ppm、1.3ppm、1.5ppm。
)分析步骤:称2-5g过20目风干土于50ml三角瓶中,加5-10滴甲苯,盖好,15分钟后加10ml 10%尿素和20ml pH6.7柠檬酸盐缓冲液,摇匀后,在37℃恒温箱中培养24小时,过滤。
取滤液1~3毫升(视样品浓度定)于50ml刻度试管中,加蒸馏水至25ml,再加入4ml苯酚钠溶液和3ml次氯酸钠溶液,边加边摇匀。
20分钟后定容,在分光光度计波长578nm处比色(1cm比色皿)。
反应生成的靛酚兰能在60分钟以内稳定。
每一土样设置用水代替基质(即尿素)的对照,以除掉土壤中氨态氮引起的误差。
还需减去无土基质(尿素+柠檬酸盐)。
结果计算:脲酶活性以24小时内每克土中氨态氮的毫克数来表示。
NH3-N(mg/1g土24h)=(浓度×稀释倍数×比色体积)÷(1000×干土重)1000为ug换算成mg二、磷酸酶(磷酸苯二钠比色法)磷酸酶(phosphatase)能酶促有机磷化合物的水解。
试验表明,土壤微生物对于土壤含磷有机物的矿化起着重要的作用;某些高等植物的根系也有磷酸酶活性。
土壤的磷酸酶活性可以表征土壤的肥力状况(特别是磷的状况),是评价土壤磷素生物转化方向与强度的指标。
研究证明,磷酸酶有三种最适pH:4-5,6-7和8-10。
所以,测定酸性、中性和碱性反应土壤的磷酸酶,要提供相应的pH缓冲液才能测出该土壤的磷酸酶最大活性。
测定磷酸酶常用的pH缓冲体系有醋酸缓冲液(pH5.0-5.4),柠檬酸盐缓冲液(pH7.0),硼酸缓冲液(pH9-10)。
本法测定是以磷酸苯二钠为基质,在磷酸酶的作用下,用水解基质所生成的苯酚的量来表示酶的活性。
试剂配制:1.甲苯(CR)2.①pH5醋酸盐缓冲液:(酸性土壤)A:0.2N醋酸溶液:称取1.776g冰醋酸和9.58g醋酸钠溶解,加蒸馏水定容到1000毫升。
B:0.2mol/L氢氧化氨溶液:取含25%~28%的氨水14.02ml稀释至500毫升。
取A、B溶液各250ml用蒸馏水定容至1000ml。
②pH7柠檬酸盐缓冲液:(中性土壤)A:0.1M柠檬酸溶液:称21.01g柠檬酸溶于1000ml蒸馏水中。
B:0.2M磷酸氢二钠溶液:Na2HPO4•7H2O53.63g或Na2HPO4•12H2O71.7g稀释至1000ml。
取A溶液64ml,B溶液436ml稀释至1000ml。
③pH10硼酸盐缓冲液:(碱性土壤)A:0.05M硼砂溶液(Na2B4O710•H2O)称取19.05g硼砂溶于1000ml蒸馏水中。
B:0.2M氢氧化钠:8g氢氧化钠溶于1000ml蒸馏水中。
取A溶液50ml,B溶液43ml,加水稀释至200ml。
3.pH9.8氨性氯化铵溶液:称取20g氯化氨溶于100ml浓氨水中,储存在橡皮塞瓶中,保存于冰箱。
4.0.5%磷酸苯二钠(Na2C6H5PO4•2H2O):称5g磷酸苯二钠溶于1000ml缓冲液。
5.2%4-氨基安替匹林:称取2g4-氨基安替匹林,先用少量水溶解,最后稀释至100ml,浑浊时用滤纸过滤后使用。
(一周内有效)6.8%铁氰化钾溶液:称8g铁氰化钾溶于少量水,定容至100ml,储存在棕色瓶中。
(一周内有效)酚的标准溶液:a.原液配制:0.5g重蒸酚溶于蒸馏水中,稀释至500毫升,储存于棕色瓶中,浓度即为1000ppm。
b.工作液配制:取2.5ml原液稀释至250ml,即浓度为10ppm,储存于棕色瓶中。
标准曲线绘制:分别取工作液1、3、5、7、9、11、13、15毫升于50毫升容量瓶或50毫升比色管中,加蒸馏水至25ml,再加0.25ml氨性氯化铵,0.5ml2%4-氨基安替匹林和0.5ml 8%铁氰化钾溶液,边加边摇匀,15分钟后定容,1.5h内在波长510nm处比色。
(溶液的浓度分别为0.2、0.6、1.0、1.4、1.8、2.2、2.6、3.0ppm试剂与测定相同。
)分析步骤:称过20目的风干土2g于50ml三角瓶中,加5-10滴甲苯,盖好瓶塞,15分钟后加0.5%磷酸苯二钠溶液20ml(对照直接加20ml缓冲液),摇匀并置37℃恒温培养24小时,培养结束后立即过滤。
吸滤液1~5毫升于50ml容量瓶(或比色管)中,加蒸馏水至25ml,再加入0.25ml氨性氯化氨,0.5ml2%4-氨基安替匹林和0.5ml8%铁氰化钾溶液,边加边摇匀,15分钟后定容,在波长510nm处比色。
(用1cm比色杯,显色后1.5h内稳定)每一土样设置用水代替基质的对照,还需减去无土基质。
结果计算:磷酸酶活性以24小时1克土酚的毫克数表示酚(mg/1g土•24h)=(土样浓度×分取倍数×比色体积)÷(1000×干土重)1000:ug换算成mg氧化还原酶一、过氧化氢酶土壤过氧化氢酶是研究的最早的土壤酶,与土壤有机质含量、土壤呼吸强度和土壤微生物含量等有关,在一定程度上反映了土壤微生物学过程的强度。
此方法是定量滴定酶促反应后剩余的过氧化氢来表示酶活性反应式为2KMnO4 + 5H2O2 + 3H2SO4– 2MnSO4 + K2SO4 + 8H2O + 5O2,此法测定结果较好。
试剂配制:1.0.3%H2O2:按1:100将30%H2O2用水稀释。
2.1.5mol/L的H2SO4。
3.0.002mol/LKMnO4溶液:称取高锰酸钾0.3161g,溶于1000ml无CO2蒸馏水中,储于棕色瓶中,备用。
分析步骤:1.称取5g过1mm筛的风干土,置于150ml三角瓶中,注入40ml蒸馏水和5ml0.3%过氧化氢。
2.同时设置对照,即三角瓶中注入40ml蒸馏水和5ml0.3%过氧化氢,而不加土样。
3.塞紧瓶塞,置于120r/min往返式摇床上,震荡30min。
4.随即注入5ml1.5mol/L硫酸以终止反应,用致密滤纸过滤。
5.取滤液25ml,用0.002mol/L高锰酸钾溶液滴定至微红色。
结果计算:以单位土重消耗的0.002mol/L高锰酸钾毫升数(对照与试验测定的差)表示土壤过氧化氢酶活性,其计算式为土壤过氧化氢酶活性(mlKMnO4/g干土)=V/dwt式中,V为0.002mol/L高锰酸钾毫升数(ml);dwt为烘干土壤重量(g)。
二、过氧化物酶(邻苯三酚比色法)过氧化物酶能酶在腐殖质的形成过程中具有重要作用。
过氧化物酶酶促有机物质氧化成醌,可通过有色化合物(如焦性没食子酸)比色测定。
试剂配制:1.1%1,2,3-邻苯三酚溶液:取10g1,2,3-邻苯三酚溶于蒸馏水中,并定容至1000ml。
2.0.5%H2O2溶液。
3.乙醚(分析纯)。
4.0.5mol/L盐酸。
标准溶液:重铬酸钾标准溶液:取0.75g重铬酸钾溶于1000ml0.5mol/L盐酸中,此溶液相当于50ml乙醚中含5mg焦性没食子酸。
取重铬酸钾标准溶液,用0.5mol/L盐酸再稀释成各种浓度,然后在比色计上,于波长430nm处比色。
分析步骤:1.称取1g过1mm筛的风干土样于50ml三角瓶中,然后加入10ml 1%邻苯三酚溶液和2ml 0.5%过氧化氢溶液,摇匀,塞好塞子,置于30℃培养箱中,培养2h (活性低时刻延长培养时间)。
与此同时进行12ml蒸馏水代替基质的对照。
2.培养结束后,取出三角瓶,加入0.5mol/L盐酸2.3ml(4 ml柠檬酸-磷酸缓冲溶液),摇匀,用乙醚将生成的焦性没食子酸抽出(如含量高时需提取多次)于50ml比色管中,合并提取液并定容,于430nm处比色。
结果计算:以1g土壤,在2h内生成的焦性没食子酸的毫克数表示酶的活性单位,其计算式为土壤过氧化物酶活性[mg焦性没食子酸/(g干土.h)] = m/(dwt.h)式中,m为2h内生成的焦性没食子酸的毫克数(mg);dwt为烘干土壤重量(g)。
三、多酚氧化酶(邻苯三酚比色法)测定土壤多酚氧化酶的活性,能在一定程度上了解土壤的腐殖化进程。
土壤中基质邻苯三酚,经多酚氧化酶的酶促作用生成红紫棓精,用乙醚萃取,萃取液经紫外光谱比色,测得红紫棓精的量,即可表示多酚氧化酶的活性。
试剂配制:1.1%1,2,3-邻苯三酚溶液:取10g1,2,3-邻苯三酚溶于蒸馏水中,并定容至1000ml。
2.柠檬酸-磷酸缓冲液(pH4.5):A. 0.1mol/L的柠檬酸溶液;B. 0.2mol/L的磷酸二氢钠溶液。
取A液45.03ml,B液54.97ml混合即为pH4.5的柠檬酸-磷酸缓冲溶液。
3.乙醚(分析纯)。
4.0.5mol/L盐酸。
标准溶液:重铬酸钾标准溶液:称取0.75g重铬酸钾溶于1000ml0.5mol/LHCl,相当于50ml 乙醚中含5mg红紫棓精。
取重铬酸钾标准溶液,用0.5mol/L盐酸再稀释成各种浓度,然后在比色计上,于波长430nm处比色。