物质结构练习题
- 格式:doc
- 大小:39.00 KB
- 文档页数:2

第1章物质结构基础习题一、思考题1. 试述下列各名词的意义(1)量子化(2)物质波(3)波函数(4)原子轨道(5)几率密度(6)量子数(7)电子云2. 原子中的能级主要由哪些量子数来确定?3. 试述描述核外电子运动状态的四个量子数的意义和它们的取值规则。
4. 基态原子的核外电子排布应遵循哪些规律?5. s轨道、p轨道、d轨道分别对应的l值为多少?6. s,2s,2s1各代表什么意义?指出4s、3d、5p各能级相应的量子数及轨道数。
7. n =2时,电子有哪些可能的空间运动状态?8. l =2的轨道,空间伸展方向有几种?9. p轨道角度分布图和p电子云角度分布图形的区别是什么?10. 用原子轨道符号表示下列各套量子数。
(1)n =2,l = 1,m = -1(2)n = 4,l = 0,m = 0(3)n =5,l =2,m = 011. 为什么任何原子的最外层上最多只能有8个电子?次外层最多只能有18个电子?12. 指出下列各元素的基态原子的电子排布式的写法违背了什么原理并予以改正。
(1)Be 1s22p2 (2)B 1s22s3(3)N 1s22s22p x22p y113. 现行的周期表中有几个区?每一个区包括哪几个族?各区的外层电子构型有何特征?14. 什么叫共价键的饱和性和方向性?为什么共价键具有饱和性和方向性,而离子键无饱和性和方向性?15. 共价键的轨道重叠方式有哪几种?16. 举例说明什么是σ键,什么是π键?它们有哪些不同?17. 价键理论和分子轨道理论的基本要点是什么?18. s、p原子轨道主要形成哪几种类型的杂化轨道?中心原子利用上述杂化轨道成键时,其分子构型如何?19. 实验测定BF3为平面三角形,而[BF4]-为正四面体形。
试用杂化轨道的概念说明在BF3和[BF4]-中硼的杂化轨道类型有何不同?20. 试用分子轨道表示式写出O2+的电子构型。
21. 分子间力有几种?各种力产生的原因是什么?试举例说明极性分子之间、极性分子和非极性分子之间以及非极性分子之间的分子间力。

高中物质结构练习题及讲解1. 题目:原子核外电子排布规律内容:在原子中,电子按照特定的规律排布在原子核外的轨道上。
电子排布遵循以下原则:- 泡利不相容原理:一个轨道最多只能容纳两个电子,且这两个电子的自旋必须相反。
- 洪特规则:在能量相等的轨道中,电子将尽可能地单独占据轨道,并且自旋方向相同。
- 能量最低原理:电子将首先占据能量最低的轨道。
例如,氧原子的原子序数为8,其电子排布为1s² 2s² 2p⁴。
根据这些规律,我们可以预测不同元素的电子排布。
2. 题目:化学键的形成与性质内容:化学键是原子之间通过共享或转移电子形成的相互作用力。
主要类型包括:- 离子键:由正负离子之间的静电吸引力形成,常见于金属和非金属之间。
- 共价键:由两个原子共享一对电子形成,常见于非金属元素之间。
- 金属键:由金属原子的外层电子形成的电子海,金属原子通过这些自由电子相互连接。
- 氢键:一种较弱的相互作用力,通常在氢原子与电负性较高的原子(如氧、氮或氟)之间形成。
了解化学键的性质对于预测化合物的物理化学性质至关重要。
3. 题目:晶体结构的类型与特性内容:晶体是具有规则排列的固体,其内部原子、离子或分子按照一定的几何图案重复排列。
晶体结构的类型包括:- 立方晶系:原子排列成立方体形状,如食盐(NaCl)。
- 六方晶系:原子排列成六边形的基底,如石墨。
- 四方晶系:原子排列成四边形的基底,如锡(Sn)。
- 单斜晶系:原子排列不完全对称,如硫酸铜(CuSO₄)。
晶体结构影响材料的物理性质,如硬度、电导率和光学性质。
4. 题目:摩尔概念及其计算内容:摩尔是化学中用来表示物质量的单位,它定义为包含6.022 x 10²³个实体(原子、分子、离子等)的集合。
摩尔质量是物质的摩尔质量,单位为克/摩尔。
使用摩尔概念可以方便地进行化学计算,例如:- 计算给定质量的物质的摩尔数:摩尔数 = 质量 / 摩尔质量。

1.放射性原子在人类的生活中的很多地方都有着特殊的作用,对人类的科学研究有着很大的帮助,其中最主要的作用是作为示踪原子。
最近医学界通过用放射性14C 来标记,发现一种C 60的羧酸衍生物在特定条件下可通过断裂DNA 来杀死细胞,从而抑制艾滋病 。
下面有关14C 的叙述错误的是:A.14C 与14N 含有相同的中子数B.14C 与C 60是同分异构体C.14C 与12C 的化学性质几乎相同D.14C 与12C 互为同位素,是碳的两种核素2.下列微粒半径从大到小排列的是A 、K 、Na 、Mg 、ClB 、K +、Na +、Mg 2+、Cl -C 、Cl -、F -、Mg 2+、Al 3+D 、Cl 、Mg 、Al 、F3.A 、B 是同周期非金属元素,若A 原子半径大于B ,则A 、A 的氢化物比B 的稳定 B 、A 的最高价氧化物对应水化物的酸性比B 的强C 、A 的阴离子还原性比B 的强D 、A 的非金属性比B 的强4.A 元素的阳离子和B 元素的阴离子具有相同的电子层数,下列叙述正确的是A 、原子半径:A>B B 、原子序数A>BC 、最外层电子数A>BD 、A 的正价和负价绝对值相等5.下列说法中正确的是A .非金属元素呈现的最高化合价不超过该元素原子的最外层电子数B .非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数C .最外层有2个电子的原子都是金属原子D .最外层有5个电子的原子都是非金属原子6.下列叙述正确的是A .原子间通过共价键而结合成分子的物质一定是共价化合物B .在化合物中只要含有非金属原子就一定存在共价键C .在离子化合物中若有共价键存在,则至少由三种元素组成D .在共价化合物分子中一定存在共价键 7.右表为元素周期表前四周期的一部分,下列有关R 、W 、X 、Y 、Z五种元素的叙述中,正确的是A .常压下五种元素的单质中Z 单质的沸点最高B .Y 、Z 的阴离子电子层结构都与R 原子的相同C .W 的氢化物沸点比X 的氢化物的沸点高D .Y 元素的非金属性比W 元素的非金属性强 8.短周期元素X 、Y 的原子序数相差2。

初中化学物质结构练习题及答案一、单选题(30分)1.某原子的结构示意图为:,下列说法正确的是( )2.氧在元素周期表中信息如图所示,下列有关氧元素的说法正确的是( )A16B C .原子的核外有8个电子 D .在地壳中的含量为16.00%3.核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电。
锶元素在元素周期表中显示的信息和粒子结构示意图如图所示。
以下表述中正确的是( )4.如图是元素周期表中的一格,依据图中的信息得到的下列认识错误的是( )A 145.取一滤纸条,等间距离滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内A 处有浓厚的白烟,等白烟消失后还可观察到如图所示的现象。
则下列说法中正确的是()D .该实验两端管口敞口放置,就不会观察到如图所示的现象6.A 、B 、C 三只小烧杯内依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按图所示进行探究活动,不能得到的结论是( )7.世纪年代,就有人预言可能存在由个氧原子构成的氧分子(4到证实。
最近,意大利的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它的存在。
下列叙述中正确的是( )8.年卢瑟福为探索原子的内部结构进行了“α粒子散射实验”用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔。
实验时发现(示意图如下):(1)大多数α粒子能穿透金箔而不改变原来的运动方向; (2)一小部分α粒子改变了原来的运动方向;(3)有极少部分α粒子被弹了回来。
下列由该实验分析得出的认识中,正确的是( )9.臭氧(O3)能够吸收紫外线保护地球生命,打雷放电时,空气中有极少量氧气会转化成臭氧(O3),即3O22O3。
下列有关说法中正确的是()①O2和O3都是单质②O2和O3是不同的物质③该变化属于物理变化A B C D10.根据下列四种粒子的结构示意图,所获取的信息不正确的是()二、填空题(28分)11.根据所学化学知识解释:(1)50mL水和50mL酒精混合,所得混合物的体积小于100mL说明。

/jiegou/wlkch/index.html例题与习题一、练习题1.立方势箱中的粒子,具有的状态量子数,是A. 211 B. 231 C. 222 D. 213。
(参考答案)解:(C)。
2.处于状态的一维势箱中的粒子,出现在处的概率是多少?A.B.C.D.E.题目提法不妥,以上四个答案都不对。
(参考答案)解:(E)。
3.计算能量为100eV光子、自由电子、质量为300g小球的波长。
( )(参考答案)解:光子波长自由电子300g小球。
4.根据测不准关系说明束缚在0到a范围内活动的一维势箱中粒子的零点能效应。
(参考答案)解:。
5.链状共轭分子在波长方向460nm处出现第一个强吸收峰,试按一维势箱模型估计该分子的长度。
(参考答案)解:6.设体系处于状态中,角动量和有无定值。
其值是多少?若无,求其平均值。
(参考答案)解:角动量角动量平均值7.函数是不是一维势箱中粒子的一种可能的状态?如果是,其能量有没有确定值?如有,其值是多少?如果没有确定值,其平均值是多少?(参考答案)解:可能存在状态,能量没有确定值,8.求下列体系基态的多重性。
(2s+1) (1)二维方势箱中的9个电子。
(2)二维势箱中的10个电子。
(3)三维方势箱中的11个电子。
(参考答案)解:(1)2,(2)3,(3)4。
9.在0-a间运动的一维势箱中粒子,证明它在区域内出现的几率。
当,几率P怎样变?(参考答案)解:10.在长度l的一维势箱中运动的粒子,处于量子数n的状态。
求 (1)在箱的左端1/4区域内找到粒子的几率?(2)n为何值,上述的几率最大?(3),此几率的极限是多少?(4)(3)中说明什么?(参考答案)解:11.一含K个碳原子的直链共轭烯烃,相邻两碳原子的距离为a,其中大π键上的电子可视为位于两端碳原子间的一维箱中运动。
取l=(K-1)a,若处于基组态中一个π电子跃迁到高能级,求伴随这一跃迁所吸收到光子的最长波长是多少?(参考答案)解:12.写出一个被束缚在半径为a的圆周上运动的质量为m的粒子的薛定锷方程,求其解。

物质结构练习题1.量子力学的一个轨道是指()(A)玻尔理论中的原子轨道(B)n值一定时的一个波函数(C)n,l值一定时的一个波函数(D)n,l和m 值一定时的一个波函数2.不同原子的光谱()(A)都是连续光谱(B)都是不连续光谱(C)仅仅波长不同(D)都是一些孤立的暗色线条3.最先成功解释氢光谱的科学家是()(A)里德伯(B)玻尔(C)薛定谔(D)普朗克4.下列原子轨道那一个的描述是错误的()(A)7d (B)9s (C)2d (D)4f5.关于电子的量子数,下列那一个可能存在()(A)2,1,-1,1/2 (B)3,0,1,1/2(C)4,-3,2,1/2 (D)2,2,-2,-1/26.比较下列轨道中的电子,哪一个能量较高()(A)2P x1(B) 2P z2(C) 2P y1(D)3s17.某基态原子的最外层只有2个电子,则其次外层的电子数()(A)一定为8个(B)一定为18个(C)一定为2个(D)不能确定8.镧系收缩造成同周期后面的过度元素的原子半径与同族上一周期的原子半径相比()(A)要更大一些(B)要更小一些(C)更无规律(D)更相似9.下列哪一个参数近似,会造成元素的性质最相近()(A)第一电离能(B)电负性(C)原子半径(D)电子层构型10.某金属离子M2+的第三电子层中有13个电子,则该原子的外层电子构型一定为()(A)3d74s0 (B) 3d54s2 (C) 3d54s0 (D) 3d74s211.对于基态原子的外层轨道的能量,存在E3d>E4s的现象,可以用()来解释(A)钻穿效应(B)能量最低原理(C)屏蔽效应(D)A和C12.下列各组量子数中哪一组是正确的? ( )a. n =3 l = 2 m = -2b. n =4 l = -1 m = 0c. n =4 l = 1 m = -2d. n =3 l = 3 m = -313.一个原子中,量子数n =3, l = 2, m = 0时可允许的最多电子数是多少?()a. 9b. 2c. 18d. 1014.下列原子半径大小顺序中正确的是()a. Be<Na<Mg;b. Be>Na>Mg;c. Be< Mg< Na ;d. Na< Be <Mg;15.n相同,l不同的电子云穿透作用大小的次序是什么?()a. n相同时,l愈大穿透作用愈强。

高三化学物质结构练习题一、选择题1. 下列关于原子结构的说法,正确的是()A. 原子中,质子数等于核外电子数B. 原子中,质子数等于中子数C. 原子中,电子层数等于电子数D. 原子中,电子层数等于质子数2. 下列关于同位素的说法,错误的是()A. 同位素具有相同的质子数B. 同位素具有相同的电子数C. 同位素具有相同的原子质量D. 同位素具有不同的中子数3. 下列关于共价键的说法,正确的是()A. 共价键只存在于非金属元素之间B. 共价键一定比离子键稳定C. 共价键的形成是由于原子间共享电子对D. 共价键的键能一定大于离子键的键能4. 下列关于分子晶体的说法,错误的是()A. 分子晶体由分子间作用力维持B. 分子晶体具有高熔点C. 分子晶体通常具有较低的硬度二、填空题1. 原子核由________和________组成,原子核外电子按________、________、________的规律排布。
2. 同种元素形成的不同种单质互为________,如碳元素形成的金刚石和石墨。
3. 离子键的形成是由于________和________之间的电荷作用,共价键的形成是由于原子间________。
4. 分子间作用力比________键弱,比________键强,分子间作用力包括________、________等。
三、简答题1. 简述原子核外电子排布规律。
2. 解释什么是同位素,并举例说明。
3. 说明离子键和共价键的区别。
4. 分析分子晶体和原子晶体的异同。
四、计算题1. 某元素的原子序数为25,求其核外电子排布式。
2. 氯化钠晶体的晶胞边长为a,求晶胞中钠离子和氯离子的数量比。
3. 某分子中含有两个氧原子,其中一个氧原子的质量数为18,另一个氧原子的质量数为16,求该分子的相对分子质量。
4. 已知氢气分子的键长为0.074 nm,求氢气分子的键能。
五、判断题1. 原子中,电子层数越多,该原子的化学性质越稳定。

高三化学物质的组成与结构练习题
题目一:
1. 以下哪一种物质是由不同种类的原子通过共价键连接而成?
a) 钠氯化合物
b) 氧气分子
c) 硝酸铵
d) 甲烷
2. 已知物质X由两种元素A和B组成,A的原子质量为12,B的原子质量为16,化学式为AB2。
则物质X的分子质量是多少?
3. 以下哪个物质属于离子化合物?
a) 硫酸
b) 氨气
c) 氯气
d) 硫化氢
题目二:
1. 以下哪个化学式代表的物质是有机物?
a) HCl
b) CH4
c) NaCl
d) CO2
2. 已知某物质由碳、氢、氧三种元素组成,其化学式为C6H12O6。
该物质属于什
么类型的有机化合物?
3. 葡萄糖是一种单糖,化学式为C6H12O6。
根据该化学式,葡萄糖的分子中包含
了多少个碳原子?
题目三:
1. 以下哪一种物质不属于元素?
a) 氧气
b) 纯净水
c) 金属铁
d) 氢气
2. 已知某物质由两种元素组成,其中一种元素只含一种同位素,而另一种元素含
有多种同位素。
该物质是什么类型的物质?
3. 氯气是由两个氯原子通过共价键连接而成的分子。
根据该信息,氯气的分子式
是什么?
请注意,以上练习题旨在帮助高三学生复习和巩固化学中有关物质的组成与结构
的知识。
通过解答这些问题,学生可以加深对共价键、离子键、化学式等概念的理解,并提升解题能力。
希望这些练习题对学生们的化学学习有所帮助。
2023届高考化学一轮备考专题练习题:物质结构与性质一、结构与性质1.(2022·山东滨州·高三期末)前四周期元素A 、B 、C 、D 、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状态;基态B 原子s 能级的电子总数比p 能级的多1;基态C 原子和基态E 原子中成对电子数均是未成对电子数的3倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。
回答下列问题:(1)E 的元素名称为_______,它位于元素周期表的_______区。
(2)元素A 、B 、C 中,电负性最大的是_______(填元素符号,下同),元素B 、C 、D 第一电离能由大到小的顺序为_______。
(3)与同族其他元素X 形成的3XA 相比,3BA 易液化的原因是_______。
(4)3BC -中B 原子轨道的杂化类型为_______,3A C +离子的空间结构为_______。
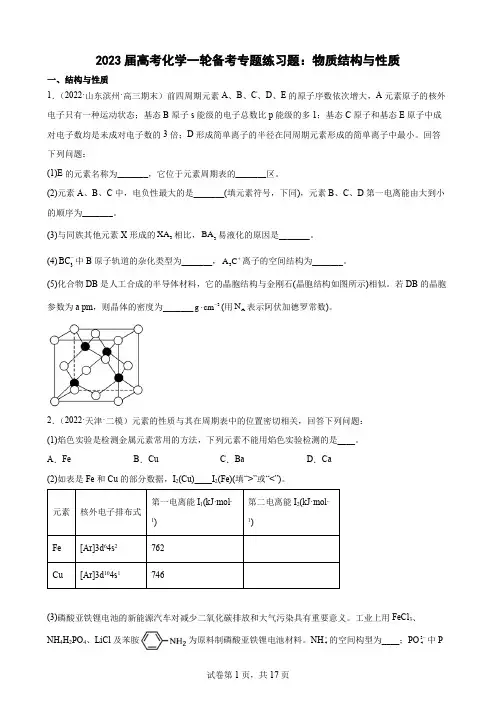
(5)化合物DB 是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。
若DB 的晶胞参数为a pm ,则晶体的密度为_______3g cm -⋅(用A N 表示阿伏加德罗常数)。
2.(2022·天津·二模)元素的性质与其在周期表中的位置密切相关,回答下列问题:(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是____。
A .FeB .CuC .BaD .Ca(2)如表是Fe 和Cu 的部分数据,I 2(Cu)____I 2(Fe)(填“>”或“<”)。
(3)磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。
工业上用FeCl 3、NH 4H 2PO 4、LiCl 及苯胺为原料制磷酸亚铁锂电池材料。
NH 4+的空间构型为____;PO 34-中P的杂化轨道类型是____;O、P、Cl原子的半径最大的是____。
(填元素符号)(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是____。

化学选修3物质结构练习物质结构是化学中的一个重要概念,指的是物质内部的排列方式和各个原子或离子之间的相互作用关系。
化学选修3中的物质结构练习主要包括晶体结构、分子结构和离子结构等方面的题目。
以下是一些与物质结构相关的练习题,并附上详细解析。
1.以下是一种晶体的晶胞示意图:A/\BC\/D如果A是晶格点,B、C、D是晶胞内部的原子,该晶体属于什么类型的晶体?解析:根据晶胞示意图可知,晶体中包含一个中心原子A和三个周围原子B、C、D,且结构排列呈立方体状。
由于晶体中只有一个晶胞,所以该晶体属于简单晶体。
2.对于以下两种分子:H2O:O-H(键角约为104.5°)NH3:H-N-H(键角约为107°)说明两种分子中键角大小的差异。
解析:分子中的键角大小取决于原子之间的电子云排布情况。
对于H2O分子,氧原子与氢原子之间带有两对孤电子,这些孤电子云的电子排斥作用会增大氢原子之间的碰撞距离,使键角变大。
而NH3分子中氮原子与氢原子之间也带有一个孤电子对,这对电子云同样会增大氢原子之间的碰撞距离,使键角变大。
因此,NH3分子中的键角会比H2O分子中的键角稍大。
3.下列离子中,哪个离子的离子半径最大?A.Na+B.Mg2+C.Al3+D.Si4+解析:离子半径的大小与电子层数及电子云的屏蔽效应密切相关。
根据周期表的规律,离子的半径大小随着核电荷的增加而减小。
在给定周期内,正离子的电子层数减少,电子云对核的屏蔽效应减弱,使得离子半径减小。
因此,由于Al3+离子的电子层数最少,所以Al3+离子的离子半径最小。
4.以下是一个离子的电子排布示意图:现有的离子是电荷为+2的正离子,那么该离子最可能属于下列哪个元素?A.氧B.氮C.硫D.锗解析:根据电子排布示意图,该离子含有2个电子,电子的排布可以与氧原子(1s22s22p4)相一致。
因此,该离子最可能属于氧元素。
以上是一些关于物质结构的练习题及其详细解析。

物质结构(元素周期律)练习题(后附答案)一、选择题1.已知氢元素有3 种同位素,氧元素也有3 种同位素.假定能准确测定单个水分子的质量,则所测得数据将有种[ ]A. 6 种 B . 7 种 C . 18 种 D . 27 种2 .某元素原子的最外层电子数与次外层电子数相同,且最外层电子数与次外层电子数之和小于8,它是[ ]A. 锂 B .铍 C .氦 D .钙3.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是[ ]A.R(OH)3 B.R2O7 C.HRO3 D.H2R4.下列各组微粒具有相同质子数和电子数的是[ ]A.CH4,NH3,H2O,Ar B.OH-,NH4+,H3O+,NeC.H3O+,NH4+,Na+,HF D.OH-,F-,Mg2+,Na+5 .下列叙述中正确的是[ ]A. 40K和40Ca原子中的质子数和中子数都不相等B•金刚石和石墨的性质相同C. H和D互为同位素D. 某物质中只含一种元素,该物质一定是纯净物6.某化合物由A, B 2种元素组成,已知A, B两元素的质量比为7 : 4,相对原子质量之比为7 : 8,则此化合物分子式可能是[ ]A.A2B B .AB C.AB2 D.A2B47.氧化性由弱到强,原子或离子半径由大到小的一组微粒是[ ]A.O,Cl,S,P B.K+,Al3+,Ca2+,Ba2+A. 某元素原子最外层只有一个电子,则它一定是I A元素B. 任何原子或离子的组成中都含有质子C. 质子数相同的微粒一定属于同种元素D. 构成原子核的微粒中都含有中子9.目前含有元素硒(Se) 的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是[ ]A. 原子序数为24B. 最高价氧化物为SeQ为酸性氧化物C•原子半径比钙小D.气态氢化物分子式为HSe,性质不稳定10. 关于化学键的各种叙述中,下列说法中正确的是[ ]A. 在离子晶体里,只存在离子键B. 共价化合物里,一定不存在离子键C•非极性键只存在于双原子的单质分子里D.由不同元素组成的多原子分子里,一定只存在极性键11. 第3周期元素R,它的原子核外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍.则关于R的正确说法是[ ]A. 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应B. R的最高价氧化物对应水化物是强酸C. R和R的氧化物的熔点和硬度都很高D. R能形成稳定的气态氢化物12. 下列关于元素化合价的叙述中,错误的是[ ]A. m A族的B和Al都能形成+ 3价的化合物B. V A 族的N 和P 都能形成一3价的化合物C. I A 族的Na 和K 都能形成+ 1价的化合物D. W A 族的F 和Cl 都能形成+ 7价的化合物 13.下列属于同位素的是[ ]A,红磷和白磷B.阳和;HC. H 2,O^D 2O14. A, B, C 均为短周期元素,它们在周期表中的位置如图 5-2所示.已 知:B, C 两元素原子最外层电子数之和等于 A 元素原子最外层电子数的2倍;B ,15.下列说法错误的是[ ]A. 非金属两原子间不可能形成离子键B. 非金属元素不可能形成离子化合物C. 含有非极性键的分子,不一定是共价化合物D. 离子化合物中一定不含共价键16. 共价键、离子键、分子间作用力等都是构成物质微粒间的不同作用,含 有以上所说的两种作用的晶体是[ ]A.白磷B .石英C .烧碱D .食盐17. 短周期元素X 和Y 中,X 原子的最外层电子数是内层电子总数的一半, 丫元素在X 元素的前一周期,7离子和Ne 原子的电子层结构相同,关于 X 和丫 形成的化合物Z 的说法正确的是[ ]A. Z 是一种酸酐B . Z 是一种碱性氧化物C 两元素的核电荷数之和是 A 元素原子序数的4倍•则A , B, C 分别是JLE n 0A. C, Al , PB. N, Si , SC. 0, P , ClD. F , S , Ar图5-2C. Z 的分子式是XY5D . Z 是一种离子晶体18. 元素X 的原子获得3个电子或元素丫的原子失去2个电子后,其离子的 电子层结构与氖原子的电子层结构相同,X, Y2种元素的单质在高温下得到的化 合物的正确的分子式是[ ]A. YX2B . XYC . XYD .畑19. 同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合 物PH 4I 是一种无色晶体,下列对它的描述中不正确的是 [ ]A. 在加热时此化合物可以分解B. 它是一种离子化合物C. 这种化合物不能跟强碱发生化学反应D. 该化合物在一定条件下由PH 3与HI 化合而成20. 有主族元素A 、B ,A 的原子序数为n ,A 2+离子比B 2-离子少8个电子, 则B 的原子序数是[ ]A. n + 4B . n + 6C . n + 8D . n + 1021 . R 元素原子的质量数为A, Rn 核外电子数为X ,则WgR +离子所含中子 数为[ ]22 .某元素由2种同位素组成,其原子比为5 : 2,第一种同位素的二价阳 离子有27个电子,34个中子;第二种同位素原子的中子数比第一种多 2个,该 元素的平均近似相对原子质量为[ ]A. 59.57B . 61.57C . 63.57D . 64.5723 .砷为第四周期V A 族元素,根据它在周期表中的位置推测,砷不可能具 有的性质是[ ]A.砷在通常状况下为固体B .可以有一3,+ 3,+ 5等多种化合价 C. AsO 对应水化物的酸性比HPQ 弱A. (A _x + n)molW ,C. — CA - x + n)molB. (A -x -n)mol WD. — (A -x _n)molD. 砷单质的还原性比磷单质的还原性弱24.下列物质按沸点降低顺序排列的一组是[ ]A. CI4, CB R, CCb, CF4B. O, S, Se, TeC. HF, HCI, HBr, HI D . F2, CI2, Br2, I2*25 .根据表5-3列出的各化学键的键能数据,判断如下分子中最稳定的是[]A. CI2 B . Br2 C . HCI D. H?26. 元素周期表里金属元素和非金属元素分界线附近能找到[ ]A.新制农药元素 B .制催化剂元素C.制半导体元素 D .制耐高温合金元素27. 与OH具有相同电子数和质子数的是[ ]A. NH B . Nd C. F- D . DH+28 .高温超导体中铊(TI)是有效成分之一,已知铊是铝的同族元素,关于铊的性质判断可能错误的是[ ]A.铊是银白色质软的金属B •铊能形成+ 3价的化合物C. TI(OH) 3与AI(OH)3—样,具有两性D. 铊可以与稀硝酸反应生成硝酸盐29 .某主族元素R原子的质量数为79,已知R离子含有45个中子和36个电子,下列关于R元素的叙述错误的是[ ]A. R元素属于U A族B. R元素在周期表里处于第4周期C. R元素最高氧化物对应水化物的分子式为HRQD. R元素气态氢化物的分子式为HR30. 下列关于稀有气体的描述不正确的是[ ]①原子的最外层都有8个电子;②其原子与同周期I A,n A族阳离子具有相同的核外电子排布;③有些稀有气体能跟某些物质反应;④原子半径比同周期VD A族元素原子的大.A.① B .①和③ C .①和② D .②和④31. 按C, N, O, F 的顺序,下列递变规律正确的是[ ]A.原子半径逐渐增大 B .非金属性逐渐减弱C•气态氢化物的稳定性逐渐增强 D .单质的氧化性逐渐减弱32. 有a X+和bY-2种元素的简单离子,若它们的电子层结构相同,贝U下列关系正确的是[ ]A. b —a= n+ m B . a—b= n+ mC.离子半径Y-v X+ D .原子序数丫>X33. 在元素周期表中的前四周期,两两相邻的5种元素如图5—3所示.若B 元素的核电荷数为a,则5种元素的核电荷总数之和可能为①5a;②5a + 18;③ 5a+ 10;④ 5a + 8.A.只有①,③ B .只有① C .只有③ D .全部1A叵S5-334. 无机化学命名委员会(国际)在1989年做出决定:把长式周期表原先的主、副族号取消,由左至右按原顺序编为18列.如碱金属为第一列,稀有气体为第18列.按这个规定,下列说法正确的是[ ]A.第3列元素种类最多,第14列元素的化合物种类最多B•第10列元素中全部是金属元素C. 从上到下,第1列元素单质熔点逐渐升高,第17列元素单质熔点逐渐降低D. 只有第2列元素的原子最外层有2个电子35. X,丫,Z 3种元素的原子分别在周期表I A,川A,W A族中,由这3种元素组成的化合物分子式(或化学式)可能是[ ]A. XYZ B . XYZ C . XYZ D. X s YZ36. 某元素R的核外电子数等于核内中子数,2.8 g该元素单质与氧气完全反应,可得到6g化合物RQ该元素在周期表中的位置是[ ]A.第3周期B .第2周期C . W A族 D . A族二、填空题1. 某元素的同位素?X,已知M® 且M-Z = 161则:⑴x元素为__________(2) X的气态氢化物电子式 ________(3) X氧化物的晶体类型 _______(4) X氧化物与强碱溶液反应的化学方程式 _________(5) X氧化物与酸反应的化学方程式 _________2. 器嚇粒中的质子数是_,中子数_是核卜电子数是_.(1) 它与Na+形成的化合物的电子式_______ 晶体类型________ .(2) 它与氢元素形成的共价化合物的电子式__________ 稳定性_________ .3. 写出4种共价型分子(其分子都只有10个质子和10个电子)的分子式和电子式、_______ 、_________ 、________ 、 _______ 水溶液呈弱酸性的是________ 、呈弱碱性的是________ .4 . W,X, Y,Z为短周期内除稀有气体元素外的4种元素,它们的原子序数依次增大,其中只有丫为金属元素,丫的最外层电子数和W相等,丫,Z两元素原子的质子数之和为W,丫两元素质子数之和的3倍,由此可知:(1) _________ W 为 ________ 、X 为______ 、Y 为 ________ 、Z 为:(2) 它们之间可以组成的酸有_______ .(3) 它们之间可以组成的盐有_______ .5. A, B, C, D四种元素的最高正价依次为1, 4, 5, 7,其核电荷数按B, C, D, A的次序增大;已知B原子的次外层电子数为2, C, D, A原子的次外层电子数均为8;A原子核外电子总数不超过20.试回答:(1) 各元素符号为:A _______ B ______ C _____ D ______(2) 写出B, C, D最高价氧化物对应水化物的分子式:__________ 、 _______ ________ ,并比较其酸性强弱:_________(3) 写出下列分子的电子式:AD BD4三、推断题1. W X Y, Z4种元素都位于短周期内,它们的原子序数依次递增. W原子核内仅有一个质子,X原子的电子总数与之原子的最外层电子数相等,W原子与X原子的最外层电子数之和与丫原子的最外层电子数相等.Z原子L层电子数是K层电子数的3倍,且Z只能形成阴离子•由此推断它们的元素符号是:W _ X _____ , 丫,Z ______ .已知W Y, Z可组成一个化合物,其原子个数之比为1 : 1 :2,该化合物的名称是 ______ .2•有A, B, C, D4种元素,它们均为主族元素,最外层电子数分别为1, 4, 6, 7,原子序数大小为D< B v A v C•又知C元素的一种同位素原子核中有46个电子,它的最高价氧化物的相对分子质量与气态氢化物的相对分子质量之比值为 1.56 .(1) 根据计算确定C元素的名称、符号,所在周期及族?(2) 推断A, B, D的元素名称和符号.(3) 写出D, A单质分别与水反应的方程式.、选择题1. C2.B3. B4. A5. A6. A7. D8.B9. A10. B11. A,12. DC13. B,1415. B,16. A,17. A,18. AD C D C C19. C2021. D22. C23. D24. AA25. D2627. C28. C29. A30. CC31. C3233. C34. A,35. A,36. AB B D C、填空题H1-⑴硅元素S】(2) HiSiH⑶原子晶体* xH(4)SiO 2+ 2NaOH k Na2SiO3+ HO; (5)SiO 2 + 4HF= SiF“+ 2HO 2. 16, 18, 16(l)Na+[虫汀-N曲离子晶休⑵H疗:)较弱H H H3 . CH;JKCxH j NH3H X N:;H3O Hx 6 :(HF Hx¥:HF?NH3*x 卄H H H4. (1)H ; O; Na; S(2) H 2S, HSO, HSO(3) Na2S, NaHS N Q SO,NaHSQ NaSO, NaHSO5. (1)K , C, P, Cl(2)H2CO, HPQ, HCIQ; HCIO>HPQ>HCO:ci:(3JK+[ ]- :QxgxCl::C1:♦■•-三、推断题1. W H X. He Y. Al Z . O;偏铝酸2. (1)经计算可得C质量数约为80,由于其处于切族,且有同位素中子数为46,可推知其质子数为34,则确定为立元素]所以硒貓亡是第四周期切族.⑵A :钾K B:硅Si D:氟F(3)2F 2 + 2HO= 4HF+ O2K+ 2HO=2KO!H H T。
2023届高考化学专项练习:物质结构与性质1.(2022·陕西渭南·统考一模)回答下列问题:(1)氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。
如图是氨基酸锌的结构简式。
①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是__________________。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为____________。
(2)分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
①配合物中每个中心离子的配位数为____________________________。
②Co2+的最高能层电子排布式为________________。
③下列状态的钴中,电离最外层一个电子所需能量最大的是____________(填标号)A.[Ar]3d74s1B.[Ar]3d74s2C.[Ar]3d74s14p1D.[Ar]3d74p1(3)二氯甲醛的结构简式为,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是________________________________________________。
(4)碳酸亚乙酯()是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因______________________________________________。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)m RO n,如果成酸元素R相同,则n值越大的R正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱__________________________。
2.(2022·天津·模拟预测)1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
化学—选修3:物质结构与性质1.【13新课标Ⅰ】硅是重要的半导体材料,构成了现代电子工业的基础。
回答下列问题: (1)基态Si原子中,电子占据的最高能层符号,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。
工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是②SiH4的稳定性小于CH4,更易生成氧化物,原因是(6)在硅酸盐中,四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为。
Si与O的原子数之比为化学式为2.【14新课标Ⅰ】早期发现的一种天然二十面准晶颗粒由Al、Cu、Fe三种金属元素组成。
回答下列问题:(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有个未成对电子,Fe3+的电子排布式为:可用硫氰化钾检验Fe3+,形成的配合物的颜色为。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为;1mol乙醛分子中含有的σ键的数目为。
乙酸的沸点明显高于乙醛,其主要原因是:。
氧化亚铜为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 ,列式表示铝单质的密度g·cm-3(不必计算出结果)。
3.【15新课标Ⅰ】碳及其化合物广泛存在于自然界中,回答下列问题:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。
物质结构练习题一.是非题1. 氢原子2s 轨道和2p 轨道能量相同,但氟原子的2s 轨道能量低于2p 轨道能量。
(√)2. 氧原子的2s 轨道的能量与碳原子的2s 轨道的能量相同。
(×)3. 主量子数n 为3 时有3s,3p,3d,3f 四条轨道。
(×)4. 所有微粒都既有粒子性又有波动性。
(√)5.原子轨道图是ψ的图形,故所有原子轨道都有正、负部分。
(×)6.多电子原子中,若几个电子处在同一能级组,则它们的能量也相同。
(×)7. 元素所处的族数与其原子最外层的电子数相同。
(×)8.通常所谓的原子半径,并不是指单独存在的自由原子本身的半径。
(√)9. 当 2 个原子形成共价键时,可以是σ加π键,也可以都是σ键。
(×)10. C 和O 的电负性差值很大,为此CO 中键的极性很大。
(√)11. 相同原子的双键的键能等于其单键键能的 2 倍。
(×)12.SnF4,XeF4,CCl4,SnCl4分子的几何构型均为正四面体。
(×)13. 与共价键相似,范德华力具有饱和性和方向性。
(×)14.由于Si 原子和Cl 原子的电负性不同,所以SiCl4分子具有极性。
(×)15. 根据原子基态电子构型,可以判断若有多少个未成对电子就能形成多少个共价键。
(×)16. 原子在基态时没有成对电子,就不能形成共价键。
(×)17.甲烷分子与水分子间存在着色散力、诱导力。
(√)18. 在N2分子中存在σ键和 键。
(√)19.氢键都是直线型。
(×)二.选择题1. 玻尔的氢原子理论主要成功之处是(c)a. 证明了原子核外电子是在球形轨道上运动。
b. 说明了原子中电子的能量只具有某些特定数值。
c. 解释了氢原子的光谱线。
d. 证明了氢原子中,电子距核越远,电子的运动速度越大。
2. 证明电子具有波粒二象性的方法是(d)a. 玻尔理论不能解释多电子原子的光谱。
第一章 物质结构 元素周期律一、选择题1 6 个电子、 7 其中子,呈电中性,则它的化学符号可能是 ( ) 。
.某粒子含有 A . 13AlB . 13AlC . 13CD . 13 C2.以下粒子半径最小的是 () 。
+B . NaC .Cl-A . NaD .Cl3.以下各组中属于同位素关系的是 () 。
A . 4019 K 与 4020 CaB . T 2O 与 H 2OC . 4019 K 与 3919 KD .金刚石与石墨4.在元素周期表中位于金属元素和非金属元故旧界处最简单找到的资料是 ( ) 。
A .制催化剂的资料B .耐高温、耐腐化的合金资料C .制农药的资料D .半导体资料5.以下递变规律不正确的选项是() 。
A . Na 、 Mg 、 Al 还原性依次减弱B .I 2 、Br 2 、Cl 2 氧化性依次增强C . C 、N 、 O 原子半径依次增大D . P 、 S 、 Cl 最高正价依次高升6.以下各组微粒拥有相同的质子数和电子数的是 () 。
A . OH 、 H 2O 、 FB .NH 3、 NH +4 、NH -2--C . H 3O 、 NH +4 、 NH -2D . HCl 、 F 2、 H 2S+7. X 元素的阳离子和 Y 元素的阴离子拥有相同的核外电子结构,以下表达正确的选项是( ) 。
A .原子序数: X < YB .原子半径: X < YC .离子半径: X > YD .原子最外层电子数: X < Y8.以下各组化合物的性质比较,不正确的选项是 () 。
A .酸性: HClO 4442> Al ( O H ) 3> HBrO > HIOB .碱性: NaOH >Mg ( OH )C .牢固性: PH 3>H 2S >HClD .非金属性: F > O > S9.同周期的 X 、Y 、Z 三种元素, 已知其最高价氧化物对应的水化物的酸性强弱序次是:424 > H 34 ,则以下各判断中正确的选项是( ) 。
物质结构练习题一一、选择题 1、 电子被1000V 的电场加速,打在靶上,若动能可转化为光能,则相应的光波应在什么区? A 、X 光区(~10-10 m ) B 、紫外光区(~10-7 m ) C 、可见光区(~10-6 m ) D 、红外光区(~10-5 m )答:[ ]2、 下列哪个是de Broglie 关系式?A 、ν=E hB 、λ=h mcC 、λ=h mvD 、2=E mc答:[ ]3、 动量x 分量x p 相应的算符ˆx p是哪一个?A 、2π∂∂ih xB 、∂∂ihxC 、2π∂-∂h xD 、2π∂-∂ih x答:[ ]4、 下列哪个函数是算符dd x的本征函数?A 、cos kxB 、()exp ikxC 、kxD 、()2exp ax -答:[ ]5、如果算符ˆQ 对任意两个波函数1ψ和2ψ的任意L.C. 1122C C ψψ+(1C ,2C 为任意常数)满足()11221122ˆˆˆQ C C C Q C Q ψψψψ+=+,则称算符ˆQ 线性算符,下列哪个是线性算符?A 、222d 3d x xB 、^2C 、d x ⎰D 、exp答:[ ]6 粒子处于定态意味着?A 、粒子处于几率最大的状态B 、粒子处于势能为零的状态C 、粒子的力学量平均值及几率密度分度都与时间无关D 、粒子处于静止状态答:[ ]7、 由一维势箱的Schrödinger 方程求解结果所得的量子数n ,下面叙述正确的是? A 、可取任意整数 B 、与势箱宽度一起决定节点数C 、能量与2n 成正比D 、对应于可能的简并态答:[ ]8、 立方势箱中在2264h E ml ≤的能量范围内,能级数和状态数为?A 、5,20B 、6,6C 、5,11D 、6,17答:[ ]二、简答题1、微观粒子有哪些特性?2、品优波函数的条件?物质结构练习题二一、是非题1、 用量子力学处理氢原子和类氢离子不能精确求解,只能用核固定近似法2、 求解氢原子和类氢离子的薛定谔方程时,在经过坐标变换后,要通过变数分离法,把二阶偏微分的薛定谔方程分解为单个常微粉方程即R 方程、Θ方程、Φ方程 3、 对于波函数来说,包括径向和角度两部分的总节面数为2n -个4、 自旋波函数η也有角动量s M =5、 对氢原子的所有定态,在核处ψ为零6、 对氢原子基态,在原点处2ψ最大7、 量子数n 的最小允许值为零8、 准确的He 原子基态波函数是每个电子波函数的乘积9、 每一个费米子体系的波函数对交换任意两个粒子的所有坐标必须为反对称 10、一个电子的自旋量子数s 的可能值为12±二、选择题 1、 决定角动量在z 轴方向分量大小的量子数是?A 、nB 、lC 、mD 、s m答:[ ]2、决定角动量大小的量子数是? A 、n B 、l C 、m D 、s答:[ ]3、 径向分布图中有多少个极小值?A 、n l -B 、1n -C 、1n l --D 、1n +答:[ ]4、 23zp ψ有几个节面?A 、0B 、1C 、2D 、3答:[ ]5、 对于氢原子和类氢离子的径向分布图下列叙述错误的是?A 、径向峰数与节面数都与n ,l 有关B 、核周围电子出现的几率为零C 、l 相同,n 越大,最高峰离核越远D 、最高峰所对应的r 处,电子出现的几率密度最大答:[ ]6 5f 的径向分布图的极大值与节面数为?A 、2,1B 、2,3C 、4,2D 、1,3答:[ ]7、 钪原子的价层排布为123d 4s ,这是依据? A 、3d 4s >E EB 、3d 4s <E EC 、轨道能级高低次序D 、使体系总能量降低答:[ ]8、 若原子在基态时第六层电子只有4个,则原子的第五层电子数为? A 、8 B 、18 C 、32 D 、8~18答:[ ]9、银原子的基态光谱支项为? A 、252PB 、31PC 、31SD 、212S答:[ ]物质结构练习题三一、是非题1、 氢分子离子的基态中,在每一个元自的核附近出现最大的电子几率密度2、 同核双原子分子中两个2p 原子轨道组合总是产生π型分子轨道3、 对于同核双原子分子成键的σ轨道都是中心对称的,而成键的π轨道都是中心反对称的4、 同种类型的原子轨道组合成σ型轨道必然比相应的π型轨道能量低5、 B 2,O 2分子中3g σ轨道的能量低于1u π轨道6、 分子的每个对称操作都具有其相应的逆操作7、 n 重旋转轴必然生成n 个对称操作8、 自旋相同的两个电子,在空间的同一点上几率为零 二、选择题 1、 在线性变分法中,对两个原子形成化学键起主导作用的积分是? A 、库仑积分 B 、交换积分 C 、重叠积分 D 、重叠积分平方答:[ ] 2、 与有效组合成分子轨道无关的性质是? A 、轨道的对称性 B 、轨道能量C 、波函数的正交性D 、轨道间的重叠程度答:[ ] 3、 在同核双原子分子中,两个2p 轨道组合产生两个()轨道? A 、σ B 、π C 、δ D 、σ或π答:[ ] 4、 当以z 轴为键轴时,两个π型的d 轨道是A 、22x y d -,xy dB 、xz d ,yz dC 、xy d ,xz dD 、2z d ,22x y d -答:[ ]5、氢分子的总自旋量子数S 为 A 、0 B 、1/2 C 、1 D 、3答:[ ]6杂化轨道不必满足下列哪个性质?A 、正交归一B 、简并轨道C 、杂化前后数目守恒D 、每个轨道在杂化前后总成分保持不变答:[ ]7、 sp 3d (2z d )杂化的空间构型为? A 、平面三角形B 、三角锥C 、三角双锥D 、四方锥答:[ ]8、 参加dsp 2杂化形成平面正方形构型的d 轨道为?A 、22x y d -B 、2z dC 、xy dD 、xz d答:[ ]9、垂直于主对称轴n C 的对称面通常记作? A 、v σB 、h σC 、d σD 、yz σ答:[ ]10、 旋转反映轴S 2相当于分子的何种对称元素? A 、v σB 、h σC 、2CD 、i答:[ ]11、 线性分子的对称轴的轴次为? A 、奇数 B 、偶数 C 、0D 、∞答:[ ]13、下列说法正确的是?A 、凡是八面体配合物一定属于h O 点群B 、异核双原子分子一定没有对称中心C 、凡是四面体构型分子一定属于d T 点群D 、在分子点群中,对称性最低的是1C ,对称性最高的是h O答:[ ]12、 分子具有对称轴n C ,且有2n nC C ⊥,则该分子所属点群? A 、n CB 、n DC 、n SD 、nh D答:[ ]14、Heitler-London 处理氢分子问题时采用的变分函数是?A 、()()12a b ψψψ=B 、()()12b a ψψψ=C 、()()1212a b c c ψψψ=+D 、()()()()121212b a a b c c ψψψψψ=+答:[ ]。
初三化学物质的结构练习题及答案2023一、选择题1. 以下哪个不是物质的基本性质?A. 密度B. 颜色C. 溶解性D. 熔点2. 下列物质中属于元素的是:A. 水B. 铁C. 空气D. 石油3. 水是由什么元素组成的?A. 氧气和二氢B. 氧气和氮气C. 氧气和氢气D. 氧气和二氯4. 下列哪个不属于化合物的辨识性质?A. 沸点B. 密度C. 燃烧性D. 溶解性5. 以下哪个物质具有分子构造?A. 纯金属B. 水C. 氯气D. 盐二、填空题1. 表示元素符号的字母为_________。
2. 氧气的化学式是_________。
3. 一种物质只包含一种元素,这种物质属于_________。
4. 盐的化学式是_________。
5. 分子是由_________构成的。
三、判断题1. 连接两个非金属元素的是离子键。
(√/×)2. 分子是物质的最小单位。
(√/×)3. 水是由氧气和氢气反应生成的。
(√/×)4. 溶液是由溶质和溶剂组成的。
(√/×)5. 金属和非金属元素形成的化合物通常具有离子结构。
(√/×)四、简答题1. 什么是化合物?2. 什么是分子?3. 什么是元素?4. 描述金属和非金属元素之间的键合方式。
5. 分子和离子有什么共同点和区别?答案:一、选择题1. B2. B3. C4. B5. B二、填空题1. 字母2. O23. 元素4. NaCl5. 原子三、判断题1. ×2. √3. ×4. √5. √四、简答题1. 化合物是由两个或更多元素以固定比例结合形成的物质。
2. 分子是由两个或多个原子以共享电子形式连接在一起的物质单位。
3. 元素是由相同类型的原子组成的物质,无法通过化学反应进一步分解成其他物质。
4. 金属和非金属元素之间的键合方式通常是通过电子转移形成离子键。
5. 分子和离子都是物质的基本单位,但分子是由原子以共享电子方式连接而成,而离子是由电子转移形成的带电粒子,具有正负电荷。
物质结构练习题
一、选择
1.在一个多电子原子中,具有下列各套量子数(n,l,m,m s )的电子,能量最大的电子具有的量子数是-------- ( )
(A) 3,2,+1,+1/2 (B) 2,1,+1,-1/2 (C) 3,1,0, -1/2 (D) 3,1, -1,+1/2
2. 原子序数为19 的元素的价电子的四个量子数为----------- ( )
(A) n=1,l=0,m=0,m s =+1/2 (B) n=2,l=1,m=0,m s =+1/2
(C) n=3,l=2,m=1,m s =+1/2 (D) n=4,l=0,m=0,m s =+1/2
3. 氢原子中的原子轨道的个数是----------- ( )
(A) 1个(B) 2个(C) 3个(D) 无穷多个
4. 对于原子的s轨道,下列说法中正确的是----------- ( )
(A) 距原子核最近(B) 必有成对电子(C) 球形对称(D) 具有方向性
5. 下列各组量子数中,合理的一组是---------- ( )
(A) n=3,l=1,m1 =+1,m s=+1/2 (B) n=4,l=5,m1 =-1,m s= +1/2
(C) n=3,l=3,m1 =+1,m s=-1/2 (D) n=4,l=2,m1 =+3,m s= -1/2
6. 在能量简并的d轨道中电子排布成,而不排布成,其最直接的根据是---------- ( )
(A) 能量最低原理(B) 保里原理(C) 原子轨道能级图(D) 洪特规则
7. 若将N 原子的基态电子构型写成1s2 2 s 2 2p x2 2p y1,这违背了---- ( )
(A) Pauli 原理(B) Hund 规则(C) 对称性一致的原则(D) Bohr 理论
8. 在分子中衡量原子吸引成键电子的能力用------------ ( )
(A) 电离能(B) 电子亲合能(C) 电负性(D) 解离能
9. 能和钠形成最强离子键的单质是----------------- ( )
(A) H2 (B) O2 (C) F2 (D) Cl2
10. 下列物质中,既有离子键又有共价键的是--------( )
(A) KCl (B) CO (C) Na2SO4 (D) NH4+
11. 下列说法中正确的是-----------( )
(A) 共价键仅存在于共价型化合物中(B)由极性键形成的分子一定是极性分子
(C) 由非极性键形成的分子一定是非极性分子(D) 离子键没有极性
12. 下列化学键中,极性最弱的是------------ ( )
(A) H-F (B) H-O (C) O-F (D) C-F
13. 下列分子中属极性分子的是------------------- ( )
(A) SiCl4(g) (B) SnCl2 (g) (C) CO2 (D) BF3
14. BF3 分子的偶极矩数值( D )为-------------- ( )
(A) 2 (B) 1 (C) 0.5 (D) 0
15. 下列各组判断中正确的是-------------------- ( )
(A) CH4,CO2非极性分子(B) CHCl3 ,BCl3 ,H2S,HCl极性分子
(C) CH4,H2S,CO2非极性分子(D) CHCl3 ,BCl3 ,HCl极性分子
16. 为确定分子式为XY2 的共价化合物是直线型还是弯曲型的,最好要测定它的----( )
(A)与另一个化合物的反应性能(B)偶极矩(C)键能(D) 离子性百分数
17. 下列说法中正确的是---------------- ( )
(A) BCl3分子中B—Cl键是非极性的(B) BCl3分子和B—Cl键都是极性的
(C) BCl3分子是极性分子,而B—Cl键是非极性键
(D) BCl3分子是非极性分子,而B—Cl键是极性键
18. 下列物质中,含极性键的非极性分子是------------------------- ( )
(A) H2O (B) HCl (C) S O3 (D) NO2
19. 在单质碘的四氯化碳溶液中,溶质和溶剂分子之间存在着------------ ( )
(A) 取向力(B) 诱导力(C) 色散力(D) 诱导力和色散力
20. 下列液态物质中只需克服色散力就能使之沸腾的是: -----------( )
(A) H2O (B) CO (C) HF (D) Xe
21. 乙醇的沸点比乙醚的高得多,主要原因是------------ ( )
(A) 由于分子量不同(B) 由于分子的极性不同
(C) 由于乙醇分子间存在氢键(D) 由于乙醇分子间取向力强
22. 下列能形成分子间氢键的物质是-----------( )
(A) NH3 (B) C2H4 (C) HI (D) H2S
23. SO2 分子之间存在着------------( )
(A) 色散力(B) 色散力加诱导力
(C) 色散力加取向力(D) 色散力加诱导力和取向力
24. 下列各体系中,溶质和溶剂分子之间,三种范德华力和氢键都存在的是---------( )
(A)I2的CCl4溶液(B)I2的酒精溶液(C)酒精的水溶液(D)CH3Cl的CCl4溶液
25. 干冰升华吸收能量以克服---------- ( )
(A) 键能(B) 取向力(C) 诱导力(D) 色散力
26. 列说法中正确的是------------ ( )
(A) 色散力仅存在于非极性分子之间
(B) 极性分子之间的作用力称为取向力
(C) 诱导力仅存在于极性分子与非极性分子之间
(D) 分子量小的物质,其熔点、沸点也会高于分子量大的物质
二、填空
1. 某电子处在3d轨道,它的轨道量子数n为_______,l为______m可能是________。
2. 在下列空白处填入所允许的量子数:(1) n= 1,l= _____,m= _____; (2) n= 2,l= 1,m= _____;(3) n= 3,l= 2,m= _____。
3. 符号“5p”表示电子的主量子数n等于_______ ,角量子数l等于______ ,该电子亚层最多可以有____种空间取向,该电子亚层最多可容纳____个电子。
4. 原子核外电子排布服从两个原理:____________和____________________。
5. 原子核外电子层结构为4f 75s2 5p6 5d1 6s2 的元素的原子序数是________________,该元素位于周期表第____________周期、第__________族。
6. 47号元素Ag 的电子结构是_________________________,它属于_____周期______族; Ag+ 的电子结构是___________________。
7. 周期表中最活泼的金属是________,最活泼的非金属是________。
8. CO2是非极性分子,SO2是_____________分子,BF3 是______________分子,NF3 是
_______________分子,PF5是_______________分子。
(“极性”或“非极性”)
9. 冰融化要克服H2O分子间的_____作用力。
S 粉溶于CS2中要靠它们之间的____作用力。
10. 氢键一般具有_________性和_________性,分子间存在氢键使物质的熔沸点______,而具有内氢键的物质的熔沸点往往是_________________。
.
11. 形成氢键必须具备的两个基本条件是:(1)___________,(2)_______________。
12. 在极性分子之间存在着____________力;在极性分子和非极性分子之间存在着_____力;
在非极性分子之间存在着____________力。
13. 下列各对分子之间,存在的相互作用力分别是:
(1) CH3Cl和CCl4分子之间存在_____ ;(2) CH3Cl和CH3Cl分子之间存在___;(3) CCl4和CCl4分子之间存在__________ ;(4) CH3OH和C2H5OH 分子间存在______ 。
14. 在液态时,每个HF分子可形成____个氢键,每个H2O分子可形成___个氢键。