常见物质的性质
- 格式:docx
- 大小:14.70 KB
- 文档页数:1

常见物质的物理性质归纳
常见物质的物理性质主要包括以下几个方面:
1. 电导率:物质导电能力的大小,常用于区分导体、绝缘体和半导体。
2. 密度:物质的质量与体积之比,表示物质的紧密程度。
3. 熔点和沸点:物质转变为液态和气态的温度。
4. 热容:物质吸热或释热的能力,即单位质量物质升高1度所需的热量。
5. 热导率:物质导热的能力,即单位时间内单位面积的热量通过物质的能力。
6. 界面张力:液体和气体或液体之间的表面张力,是液体分子因相互作用而表面不能膨胀或收缩的现象。
7. 扩散性:物质分子在空气或溶液中的自由移动能力。
8. 折射率:光线从一种介质射入另一种介质时,光线的传播方向发生了改变的程度。
9. 导热系数:物质导热的能力,即单位时间内两个相邻处的温度差距单位长度。
10. 融化热和汽化热:物质熔化和汽化时吸收的能量。

化学常见物质的性质和用途化学是一门研究物质组成、性质及变化的科学。
在日常生活中,人们常常接触到各种各样的化学物质。
本文将介绍一些常见的化学物质的性质和用途。
1.水(H2O)性质:水是一种透明、无色、无味的液体。
它的熔点是0°C,沸点是100°C,水分子由一个氧原子和两个氢原子组成。
用途:水是生命的基础,广泛用于饮用、洗涤、烹饪、种植等各个方面。
此外,水还被用作溶剂、冷却剂、反应物和中和剂等。
2.盐(NaCl)性质:盐是一种结晶固体,有盐味。
它的熔点是801°C,沸点是1413°C。
盐由钠离子和氯离子组成。
用途:盐被广泛用于食品加工和调味。
此外,盐还用于农业灌溉、制冰、储存食品以及工业化学合成等领域。
3.糖(C12H22O11)性质:糖是一种可溶于水的有机化合物,味甜。
常见的糖包括蔗糖、果糖和乳糖等。
4.油(如植物油和动物脂肪)性质:油是一种有机化合物,常为黄色或无色液体,在常温下为液态。
油主要由脂肪酸甘油酯组成。
用途:油被广泛用于烹饪和食品加工中,提供热量和风味。
此外,油还被用作燃料、润滑剂和化妆品的成分。
5.酒精(乙醇,C2H6O)性质:酒精是一种无色、具有刺激性气味的液体。
它的沸点是78.4°C,密度约为0.79 g/cm³。
用途:酒精是一种重要的消毒剂和溶剂。
此外,酒精还广泛用于酒类制作、药品生产和化学实验室中。
6.氮气(N2)性质:氮气是一种无色、无味的气体,不可燃。
它占据大气中的78%。
用途:氮气被用于保护氧敏感物质,制备高纯度金属和防止食品腐败。
此外,氮气还用于焊接、发动机冷却和气球充气等领域。
7.氧气(O2)性质:氧气是一种无色、无味的气体。
它是一种强氧化剂,能够维持燃烧和呼吸过程。
用途:氧气广泛用于医疗领域,为病人提供呼吸支持。
此外,氧气还被用于焊接、氧化反应和化学合成等。
8.碳酸氢钠(NaHCO3)性质:碳酸氢钠是一种白色固体粉末,味苦。

初中化学常见物质的性质和用途常见物质的性质和用途:1.水(H2O):性质:水是一种无色、无味、无臭的液体。
它的分子由两个氢原子和一个氧原子组成,呈现出特殊的极性质,并且具有高的比热容和高的表面张力。
用途:水是生命的基础,广泛应用于日常生活中的饮用、洗涤、煮食等方面。
此外,水还应用于农业灌溉、工业制造、能源生产等众多领域。
2.氧气(O2):性质:氧气是一种无色、无味、无臭的气体。
它是空气中最常见的组分之一,具有高的氧化性,能够支持燃烧和维持动植物的呼吸过程。
用途:氧气广泛应用于医疗领域,用于治疗呼吸系统疾病或急救情况下的氧疗。
此外,氧气还用于工业中的氧化、切割、焊接等领域。
3.二氧化碳(CO2):性质:二氧化碳是一种无色、无味的气体,具有较高的密度。
它在自然界中广泛存在,是植物进行光合作用的重要物质之一用途:工业上,二氧化碳被用作冷却剂、溶剂、气体保护剂等。
此外,它还用于特殊场合下的灭火、人造饮料的气泡制造等。
4.氨(NH3):性质:氨是一种无色、有刺激性气味的气体。
它具有较强的碱性,能够与酸反应,产生相应的盐类。
用途:氨用于制造化肥、合成尼龙等化学物质。
此外,氨的溶液被用作清洁剂、玻璃表面涂层等。
5.盐酸(HCl):性质:盐酸是一种无色、刺激性气味的挥发液体,呈酸性。
它具有很强的腐蚀性,能够溶解许多金属。
用途:盐酸广泛用于实验室中的化学分析、金属表面的清洗等领域。
此外,盐酸也用于工业上的冶炼、染料制备等过程。
6.硝酸(HNO3):性质:硝酸是一种无色、刺激性气味的液体,呈酸性。
它可以与多种物质发生剧烈的反应,具有很强的腐蚀性。
用途:硝酸被广泛应用于农业中的肥料制备、爆炸物品生产、矿石的提取等领域。
此外,硝酸还可用于电子工业、药物制造等。
7.硫酸(H2SO4):性质:硫酸是一种无色、黏稠的液体,呈酸性。
它具有很强的腐蚀性和漂白性。
用途:硫酸被广泛用于工业中的废水处理、金属表面涂层等。
此外,它还可以用于制造肥料、玻璃、洗涤剂等。

初中化学常见物质的性质和用途化学是一门研究物质的组成、结构、性质、变化规律以及与能量之间相互关系的科学。
在日常生活中,我们经常使用一些常见的物质,这些物质具有各种各样的性质和用途。
下面我将介绍一些常见物质的性质和用途。
1.水(H2O):水是地球上最为普遍的物质之一,它的特性包括无色、无味、无臭、透明等。
水的用途非常广泛,包括生活用水、农业灌溉、工业生产、能源生产等等。
此外,水还可以被用于溶解其他物质,起到溶解剂的作用。
2.盐(NaCl):盐是化学中常见的物质之一,它的特性包括白色固体、易溶于水、味道咸等。
盐的用途非常广泛,包括用作调味品、食品加工、防腐剂、冰融化剂等等。
3.纯碱(Na2CO3):纯碱是一种白色的固体,可溶于水,味道碱性。
纯碱的用途包括玻璃制造、纺织工业、皮革工业等等。
4.硫酸(H2SO4):硫酸是一种无色的液体,具有强酸性。
硫酸被广泛应用于电池、化肥、染料、燃料等方面。
5.石油:石油是一种复杂的混合物,具有可燃性。
石油的用途非常广泛,主要用于化肥、塑料、汽车燃料、机械润滑剂等方面。
6.天然气:天然气是一种无色、无味、无害的气体,主要成分是甲烷。
天然气的用途包括供暖、燃料、发电等方面。
8.氧气(O2):氧气是空气中的一种气体,无色、无味。
氧气是维持生命所必需的,用于进行呼吸以及多种化学反应。
9.氮气(N2):氮气是空气中的一种气体,无色、无味。
氮气用途广泛,主要包括电子工业、食品冷冻保鲜、制造金属等。
10.铁(Fe):铁是一种常见的金属,具有银灰色,具有良好的导热和导电性。
铁被广泛应用于建筑、制造业、交通工具等领域。
以上仅仅是一小部分常见物质的性质和用途,每种物质都有独特的性质和广泛的应用领域。
化学的发展和研究使得我们能够更好地了解和利用这些物质,推动社会的进步和发展。
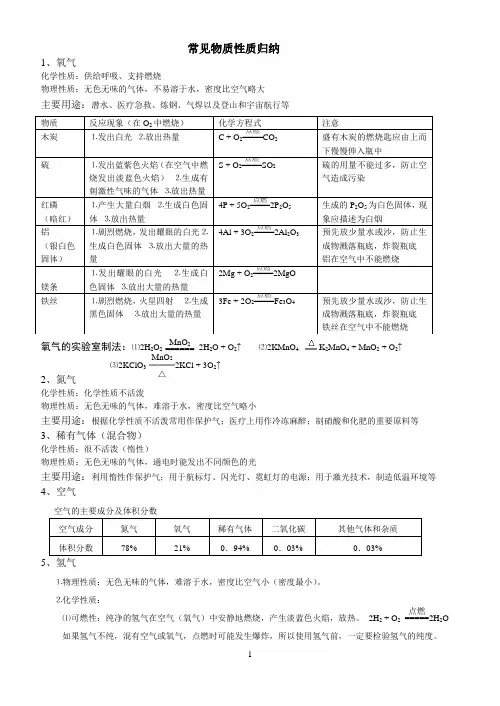
常见物质性质归纳1、氧气化学性质:供给呼吸、支持燃烧物理性质:无色无味的气体,不易溶于水,密度比空气略大主要用途:潜水、医疗急救、炼钢、气焊以及登山和宇宙航行等氧气的实验室制法:⑴2H 2O 2 MnO 2====== 2H 2O + O 2↑ ⑵2KMnO 4K 2MnO 4 + MnO 2 + O 2↑⑶2KClO 3 MnO 2═══△2KCl + 3O 2↑2、氮气化学性质:化学性质不活泼物理性质:无色无味的气体,难溶于水,密度比空气略小主要用途:根据化学性质不活泼常用作保护气;医疗上用作冷冻麻醉;制硝酸和化肥的重要原料等 3、稀有气体(混合物)化学性质:很不活泼(惰性)物理性质:无色无味的气体,通电时能发出不同颜色的光主要用途:利用惰性作保护气;用于航标灯、闪光灯、霓虹灯的电源;用于激光技术,制造低温环境等 4、空气空气的主要成分及体积分数5⒈物理性质:无色无味的气体,难溶于水,密度比空气小(密度最小)。
⒉化学性质:⑴可燃性:纯净的氢气在空气(氧气)中安静地燃烧,产生淡蓝色火焰,放热。
2H 2 + O 2 点燃=====2H 2O 如果氢气不纯,混有空气或氧气,点燃时可能发生爆炸,所以使用氢气前,一定要检验氢气的纯度。
⑵还原性(氢气还原CuO)实验现象:黑色粉末变红色;试管口有水珠生成H2 + CuO Cu + H2O⒊氢气的用途:充灌探空气球;作高能燃料;冶炼金属。
6、碳的单质⒉木炭、活性炭⑴木炭:有吸附作用,用于吸附一些食品和工业产品里的色素,吸附有异味的物质。
⑵活性炭:有较强的吸附作用,用于防毒面具、冰箱的除臭剂。
7、碳⒈常温下,碳的化学性质不活泼(碳原子最外层有4 个电子)应用:解释古代字画为什么经历几千年而不变色?档案资料为什么要求用碳素墨水书写?⒉碳的可燃性(相同的反应物,因反应物的量不同,生成物不同)充分燃烧 C + O2点燃===== CO2放热不充分燃烧2C + O2点燃===== 2CO⒊碳的还原性⑴C + 2CuO 2Cu + CO2↑现象:黑色粉末变红色,澄清的石灰水变浑浊。

初中化学常见物质的性质和用途的知识总结化学是一门研究物质的性质、组成、结构、变化以及化学反应的科学。
在初中化学中,我们学习了很多常见物质的性质和用途,下面是一个关于常见物质的性质和用途的知识总结。
1.水(H2O):性质:水具有无色、无味、无臭的性质,是一种透明液体。
它的固态是冰,气态是水蒸气。
水的沸点为100℃,冰点为0℃。
水是一种极化分子,有良好的溶解性。
用途:水是生命的基本要素,对人类和其他生物来说至关重要。
它用于饮用、洗涤、农业灌溉,工业生产过程中的冷却和清洗,以及发电等。
此外,水还用于制备溶液、合成化学反应的媒介,以及净化和消毒。
2.盐(NaCl):性质:盐是一种白色晶体,味道咸。
它易溶于水,不溶于有机溶剂,并且具有良好的热稳定性。
用途:盐是一种重要的调味品,用于增加食物的口感。
此外,盐也用于防腐、腌制和烟熏食品。
在工业上,盐被用作电解质、水处理剂、冶金过程的辅助剂,以及制备其他化学物质的原材料。
3.糖(C6H12O6):性质:糖是一种固体晶体,味道甜。
它在水中具有良好的溶解性。
糖是一种碳水化合物,有着高能量的特性。
4.氧气(O2):性质:氧气是一种无色、无味、无臭的气体。
它的存在对支持燃烧过程至关重要。
氧气是一种强氧化剂,可与其他物质发生化学反应。
用途:氧气是人类和其他生物所需的呼吸气体,用于呼吸和氧化代谢。
此外,氧气还被用于医疗设备、氧疗、工业炉燃烧和金属切割等方面。
5.空气:性质:空气是地球大气层的主要成分,主要由氮气、氧气、二氧化碳、水蒸气等组成。
用途:空气对地球生物的生存至关重要。
空气中的氮气是植物生长的重要元素,氧气是人类和其他动物进行呼吸的基本要素。
空气还被用于气垫、气胎、气动工具、制冷等方面。
6.铁(Fe):性质:铁是一种金属元素,呈银白色。
它在常温下是固态的,具有一定的延展性和塑性。
铁具有良好的导电性和热传导性。
用途:铁是一种重要的结构材料,被用于制造建筑、桥梁、车辆、机器和工具。

初中化学物质性质大全物质性质分类化学物质可以根据不同的性质进行分类。
常见的物质性质包括物态、颜色、燃烧性质、化学反应性质等。
1. 物态物态是指物质的存在形态,主要分为固态、液态和气态。
- 固态:具有一定形状和体积的物质。
固态物质分子排列紧密,能保持自己的形状。
- 液态:具有一定体积但没有固定形状的物质。
液态物质分子间距离较大,能自由流动。
- 气态:不具有一定形状和体积的物质。
气态物质分子间距离较大,能自由扩散。
2. 颜色物质的颜色是由其吸收和反射光线的特性决定的。
不同的物质吸收和反射不同波长的光,导致它们呈现出不同的颜色。
3. 燃烧性质燃烧性质描述了物质在与氧气接触时发生燃烧的能力。
- 可燃物质:能与氧气发生反应并放出热能的物质,如木材、纸张等。
- 不燃物质:无法与氧气反应并支持燃烧的物质,如金属、石头等。
4. 化学反应性质化学反应性质指的是物质与其他物质发生化学反应时产生的变化。
- 酸碱性质:物质与酸或碱反应产生的结果。
- 氧化还原性质:物质在与氧气或其他物质发生氧化还原反应时表现出来的性质。
常见物质性质示例下面列举了一些常见物质的性质示例:1. 水:- 物态:液态- 颜色:无色透明- 燃烧性质:不燃- 化学反应性质:与酸反应呈中性2. 金属铁:- 物态:固态- 颜色:灰黑色- 燃烧性质:不燃- 化学反应性质:易氧化3. 氯气:- 物态:气态- 颜色:黄绿色- 燃烧性质:易燃- 化学反应性质:与水反应产生盐酸请注意,物质性质的描述只是一般性的概括,具体的性质可能会受到其他因素的影响。
此文档只提供了一些常见物质性质的示例,不具有详尽的信息。

化学常见物质的性质化学是自然科学的一个重要分支,研究物质的组成、性质和变化规律。
在化学研究中,常用的实验材料包括一些常见的物质,它们具有独特的性质。
本文将探讨一些化学常见物质的性质。
一、水(H2O)水是地球上最为常见的化合物,它的性质十分特殊。
首先,水是一种无色、无味、无臭的液体。
其次,水的沸点为100摄氏度,冰点为0摄氏度,因此在大部分环境条件下,水处于液态状态。
此外,水在纯净状态下电离极少,因此电导性较低。
最重要的是,水是一种极好的溶剂,在许多化学反应和生命过程中发挥着重要的作用。
二、氧气(O2)氧气是一种无色、无臭的气体,也是地球上最为常见的元素之一。
氧气在大气中的百分比约为21%,对维持生命起着至关重要的作用。
氧气的存在促使许多燃烧过程的进行,也是许多生物呼吸的基础。
此外,氧气具有较强的氧化性,可以与许多物质发生反应。
三、二氧化碳(CO2)二氧化碳是一种无色、无臭的气体,广泛存在于自然环境中。
它是一种非常重要的温室气体,对地球的气候和生态环境有着重要影响。
二氧化碳在大气中的浓度的变化与地球的气候变化密切相关。
此外,二氧化碳也是植物进行光合作用的原料。
四、硫酸(H2SO4)硫酸是一种无色、油状的液体,为无机酸中的一种。
硫酸具有很强的腐蚀性和氧化性,能与许多物质反应,常用于实验室和工业上的许多化学反应中。
此外,硫酸也是制取许多化学物质的重要原料,广泛应用于矿产提取、化肥生产和药品制造等领域。
五、盐酸(HCl)盐酸是一种无色、刺激性气味的气体,其水溶液呈酸性。
盐酸是一种强酸,具有强烈的腐蚀性。
在实验室和工业上,盐酸常用于金属清洗和调节酸碱度等方面。
六、氨水(NH3·H2O)氨水是一种无色气体溶液,呈碱性。
氨水有很强的刺激性气味,常用于实验室中的分析试剂和清洗剂。
此外,氨水也被广泛应用于农业领域,作为一种重要的氮肥。
七、乙醇(C2H5OH)乙醇是一种常见的有机溶剂,也是一种常见的饮用酒精。

化学物质的常见性质总结化学物质是构成物质世界的基本单位,不同的化学物质具有不同的性质。
本文将对常见的化学物质性质进行总结,包括物理性质、化学性质和特殊性质。
一、物理性质1.密度:指单位体积物质的质量,常用于确定物质的浮沉性质。
2.颜色:不同的物质吸收和反射不同波长的光线,从而呈现出不同的颜色。
3.熔点和沸点:不同物质在不同温度下会发生熔化和汽化,熔点是指物质由固态转变为液态的温度,沸点是指物质由液态转变为气态的温度。
4.溶解性:不同的物质在不同的溶剂中具有不同的溶解性,可溶性物质会在溶剂中形成溶液,而不溶性物质则会以悬浮物的形式存在。
二、化学性质1.反应性:化学物质会与其他物质发生各种化学反应,如氧化、还原、酸碱反应等。
2.氧化性:某些物质具有与氧气或氧化剂发生反应的能力,被氧化的物质叫做还原剂。
3.还原性:某些物质具有与还原剂发生反应的能力,被还原的物质叫做氧化剂。
4.酸碱性:物质可以根据其在溶液中生成的离子来判断其是酸性还是碱性。
5.氧化数:指在化合物中元素的氧化状态,用来描述元素在化学反应中的变化情况。
三、特殊性质1.电导性:某些物质在溶液中能够导电,这是因为其溶解后会生成可以移动的离子。
2.磁性:部分物质在外加磁场下会表现出吸引或排斥的性质,这是由于物质内部的微观结构产生的。
3.放射性:某些元素的原子核不稳定,会自发地放出α、β、γ粒子或电磁波,这种现象称为放射性。
通过对化学物质的常见性质总结,我们可以更加深入地了解物质的本质和性质,这对于化学工业生产、实验研究以及环境保护等领域具有重要意义。
本文所提到的性质只是化学物质性质的一小部分,具体的性质还包括凝固性质、光学性质、燃烧性质等。
进一步研究化学物质的性质可以帮助我们更好地认识和利用化学物质,为人类发展和进步做出更大的贡献。

常见物质的性质与用途一、物质的分类在日常生活中,我们会接触到许多常见物质,它们都具有不同的性质和用途。
常见物质可以按照化学性质、物理性质、用途等多种方式进行分类。
本文将主要从物质的性质与用途两个方面来探讨。
二、物质的化学性质1.化学反应性不同的物质具有不同的化学反应性。
例如,金属铁可以与氧气发生反应生成铁的氧化物,这个过程就是我们常说的生锈;水可以与氢气发生反应生成氢氧化物;苯酚与氯仿反应可以生成苯酚乙酸等。
物质的化学反应性主要由物质的分子结构和元素组成决定。
2.酸碱性酸碱性也是物质的一个重要性质。
酸具有酸性,可导电,可以与碱反应生成盐和水;碱具有碱性,可导电,可以与酸反应生成盐和水。
常见的酸有盐酸、硫酸、醋酸等;常见的碱有氢氧化钠、氢氧化铝等。
3.可燃性可燃性是指物质在氧气存在下能够燃烧的性质。
常见的可燃物质有木材、纸张、石油等。
可燃性主要取决于物质的分子结构和元素组成。
三、物质的物理性质1.颜色和形状物质的颜色和形状是物质的显著特征。
常见的物质颜色有红、黄、蓝、绿等,形状有固体、液体、气体等。
例如,氧气是无色无味的气体,铁是固体。
2.密度和相对密度物质的密度是指单位体积内物质的质量。
相对密度是指物质的密度与水的密度的比值。
常见物质的密度可以通过称重和测量体积计算得出。
3.熔点和沸点物质的熔点和沸点是指在一定的温度下,物质由固态转为液态和由液态转为气态的温度。
常见的物质熔点和沸点可以通过实验确定。
四、物质的用途1.日常生活中的应用常见物质在日常生活中有着广泛的应用。
例如,水被广泛用于饮用、洗涤、农业等方面;钢铁被用于建筑、交通工具制造等;塑料被用于制造日用品、包装材料等。
2.工业应用常见物质在工业领域也有着重要的用途。
例如,铝被广泛用于航空、汽车制造等;石油和天然气是重要的能源;化肥是农业生产和食品生产的重要物质。
3.医药应用常见物质在医药领域也有着不可或缺的作用。
例如,抗生素被用于治疗感染性疾病;药物用于治疗各种疾病;麻醉药被用于手术过程中。

初中化学常见物质的性质和用途总结常见物质的性质和用途:1.水(H2O):性质:水是一种无色、无味、无臭的液体,呈现独特的氢键结构,具有高的比热和热膨胀系数。
用途:水是生命之源,广泛用于饮用、农业灌溉、工业生产、能源生产等方面。
此外,水还被用于制造纸张、化学品和药物,以及冷却汽车和电子设备等。
2.氧气(O2):性质:氧气是一种无色、无味、无毒的气体,具有高的化学反应活性。
用途:氧气广泛用于呼吸,为维持生命提供必要的氧气。
另外,氧气还被用于燃烧、焊接、氧割等工业生产过程,以及医疗用途中提供氧疗和氧气吸入。
3.纯碳(C):性质:纯碳可以以不同的晶体结构形式存在,如金刚石(硬度高)、石墨(导电性好)和纳米碳管(具有强韧性)等。
用途:金刚石主要用作磨料和工具,如砂纸和刀具。
石墨常用于生产铅笔芯、涂料、润滑剂和碳纤维等。
纳米碳管具有很多领域的应用,如电子器件、储能材料、生物医学和材料强化等。
4.纯铁(Fe):性质:纯铁是一种灰白色的金属,具有良好的导热性和导电性,且可磁化。
用途:铁是制造钢铁的主要原材料,广泛用于建筑、机械制造、汽车制造和航空航天等领域。
此外,铁还用于制造家具、厨具和电力输配设备等。
5.盐(NaCl):性质:盐是一种晶体固体,无色或白色,容易溶解于水,在常温下凝固成晶体。
用途:食用盐是人体必需的矿物质,用于调味和储存食品。
此外,盐还广泛用于制造化学品、肥料、储能和水处理等。
6.硫磺(S):性质:硫磺是一种黄色固体,具有特殊的臭味,能够燃烧产生二氧化硫气体。
用途:硫磺主要用于制造硫酸、火药、洗涤剂和农药等化学品。
此外,硫磺还可用于杀虫、防腐、减轻皮肤病症状等。
7.二氧化碳(CO2):性质:二氧化碳是一种无色、无味、无毒的气体,具有较高的溶解度和稳定性。
用途:二氧化碳广泛用于饮料工业中产生气泡和保持饮料的新鲜度。
此外,二氧化碳还用于制造化学品、消防灭火、草地除草和实验室的培养条件等。
8.石油(石油):性质:石油是一种混合物,主要由碳氢化合物组成,具有分子量较大和密度较小的特点。
初中化学常见物质的性质用途归纳常见物质是指日常生活中广泛应用、大家熟知的化学物质。
这些物质具有各种各样的性质和用途,下面是对常见物质的性质和用途进行归纳。
1.水(H2O):性质:水是无色、无味、无臭的液体,是地球上最常见的化合物。
水具有高的比热容和比热导率,能吸收和释放大量的热量。
用途:水是一种必需的生命物质,用于饮用、烹饪和清洁。
水也广泛用于工业生产、农业灌溉和发电。
2.空气:性质:空气由氧气(O2)和氮气(N2)等气体组成,是一种无色、无味的混合物。
3.盐(NaCl):性质:盐是白色晶体,具有较高的溶解度。
盐是离子化合物,可分解成阳离子(钠)和阴离子(氯)。
用途:盐是食品的重要调味品,也用于食品加工和保鲜。
盐还用于化学实验室、水处理和农业等方面。
4.糖:性质:糖是一类有机化合物,包括蔗糖、果糖、葡萄糖等。
糖具有甜味、可溶性和高能量。
用途:糖是食品的重要成分,用于制作糕点、饼干和饮料。
糖也用于发酵过程中产生酒精和乳酸。
5.酒精(乙醇,C2H5OH):性质:酒精是一种无色、具有特殊气味的液体。
酒精可溶于水,并具有挥发性和易燃性。
用途:酒精被广泛用于酒类、香水和药物的制造。
酒精也常用于溶剂和除菌剂。
6.油:性质:常见的油类物质包括食用油(如植物油)和矿物油(如机油)。
油是非极性物质,不溶于水。
用途:油是烹饪和炒菜中常用的食品添加剂。
油还用于润滑、隔热和保护机器。
7.纸:性质:纸是由纤维素聚合而成的薄片,具有较好的韧性和柔韧性。
纸具有一定的吸水性。
用途:纸是写字、打印和绘画的主要材料。
纸也广泛用于包装、纸巾和卫生巾等方面。
8.金属:性质:金属是一类具有光泽、可塑性和导电性的物质。
常见的金属包括铁、铜、铝等。
用途:金属广泛用于制造工具、建筑材料和家电。
金属还被用于制造货币、珠宝和交通工具。
9.塑料:性质:塑料是一类合成聚合物,具有可塑性、耐候性和耐腐蚀性。
塑料可以根据需求制作成不同形状和硬度。
用途:塑料被广泛应用于包装、建筑和电子产品制造。
化学初一常见物质的性质和分类一、引言化学是一门研究物质和物质之间相互作用的科学。
在我们日常生活中,我们接触和使用了许多不同的物质。
了解这些物质的性质和分类有助于我们更好地理解和应用化学知识。
本文将介绍化学初一学生最常见的物质的性质和分类。
二、常见物质的性质1. 固体物质固体是一种形状和体积都比较稳定的物质。
常见的固体物质包括石头、木头、纸张等。
固体物质的性质可以通过观察其外观、触摸、弯曲等方式来了解。
2. 液体物质液体是一种具有固定体积但没有固定形状的物质。
常见的液体物质包括水、饮料、汽油等。
液体物质的性质可以通过观察其流动性、表面张力等方式来了解。
3. 气体物质气体是一种没有固定形状和体积的物质。
常见的气体物质包括空气、二氧化碳等。
气体物质的性质可以通过观察其扩散速度、压力等方式来了解。
4. 颗粒物质颗粒物质是由微小的颗粒组成的物质。
常见的颗粒物质包括盐、糖、沙子等。
颗粒物质的性质可以通过观察其颗粒的形状、颜色等方式来了解。
三、常见物质的分类1. 根据物质的组成物质可以根据其组成的不同进行分类,主要分为纯物质和混合物。
纯物质是由相同种类的原子或分子组成的物质。
常见的纯物质有金属、非金属等。
纯物质的性质在整个物质中是均匀一致的。
混合物是由两种或两种以上不同种类的物质按一定比例混合而成的物质。
常见的混合物有空气、盐水等。
混合物的性质可以根据混合物中各组分的性质来判断。
2. 根据物质的状态物质可以根据其状态的不同进行分类,主要分为固体、液体和气体。
固体是物质在常温常压下的最稳定状态,具有固定的体积和形状。
固体物质分子间的相互作用力较强,分子相对固定。
液体是物质在常温常压下具有固定体积但没有固定形状的状态。
液体物质分子间的相互作用力较弱,分子可以在一定范围内自由运动。
气体是物质在常温常压下没有固定形状和体积的状态。
气体物质分子间的相互作用力很小,分子可以自由运动。
3. 根据物质的化学性质物质可以根据其化学性质的不同进行分类,主要分为金属和非金属。
初中化学常见物质性质和用途常见物质性质和用途:一、金属1.铁(Fe):性质:铁是一种有强烈的金属性的金属,它有较高的熔点和较好的导电性和导热性。
铁在空气中会发生氧化反应,并形成铁锈。
用途:铁被广泛用于制造建筑结构、汽车、电机、机械设备等。
同时,铁还是制造钢的重要原材料之一2.铜(Cu):性质:铜是一种有着良好导电性和导热性的金属。
它具有良好的延展性和韧性,易于加工成各种形状。
铜会随着时间的推移而逐渐氧化,形成绿锈。
用途:铜广泛用于制造电线、导管、管道、硬币、艺术品等。
铜和它的合金还被广泛应用于制造合金门把手、锁、钟表等。
3.铝(Al):性质:铝是一种轻便、耐腐蚀的金属。
它具有良好的导电性、导热性和韧性。
铝在空气中形成一层氧化膜,起到保护作用。
用途:铝广泛用于制造飞机、汽车、铁路、轮船等交通工具。
此外,铝还可用于制造各种容器,如易拉罐、铝箔等。
4.锌(Zn):性质:锌是一种有良好银白色光泽的金属。
它具有良好的延展性和可塑性,在室温下不被空气氧化。
锌能溶解在酸性溶液中。
用途:锌广泛用于制造镀锌钢板、电池、合金等。
二、非金属1.石油:性质:石油是一种黏稠的混合物,由碳、氢等元素组成。
它是一种可燃物,不溶于水,有较低的熔点和沸点。
2.天然气:性质:天然气主要由甲烷组成,是一种无色、无味的气体。
它具有较低的密度,能够燃烧并释放出大量的能量。
用途:天然气被广泛用于燃料供应系统,如家庭煮饭、供暖系统、发电厂等。
此外,天然气还被用作工业生产中的原料。
3.水(H2O):性质:水是地球上最常见的物质,无色、透明,无味、无臭。
它是一种极好的溶剂,有较高的比热容和熔点。
用途:水是人类最基本的生活物质,用于饮用、煮饭、洗涤等日常生活。
同时,水也是工业生产和农业灌溉的重要资源。
4.空气:性质:空气主要由氮气、氧气、二氧化碳等组成。
它是无色无味的气体,具有一定的压力。
用途:空气是生命维持的必需物质,用于呼吸、氧化等生命过程。
初中化学常见物质的性质用途归纳常见物质是我们日常生活中经常接触到的物质,了解这些物质的性质和用途对于我们的生活非常有帮助。
下面是一些常见物质的性质和用途的归纳:1.水(H2O):性质:水是无色无味的液体,具有流动性、挥发性和蓄热性。
用途:作为生物体的组成部分和重要的溶剂,维持生物体的正常代谢、运输物质和调节体温等。
此外,水还用于农业灌溉、工业生产、食品加工、清洁和消防等。
2.盐(NaCl):性质:盐是具有晶体结构的固体,能溶于水,呈无色或白色晶体。
用途:盐是调味品的重要成分,能够增加食物的口感和风味。
此外,盐还用于食品加工、农业肥料、工业生产和消毒等。
3.酒精(乙醇,C2H5OH):性质:酒精是一种无色、透明的液体,具有挥发性和可燃性。
用途:酒精是最常见的消毒剂之一,能够有效地杀灭细菌和病毒。
它也用于制备化妆品、医药制剂、饮料和清洁剂等。
4.氧气(O2):性质:氧气是一种无色、无味、无毒的气体,能够燃烧和支持燃烧。
用途:氧气是呼吸过程中必不可少的,生物体借助氧气进行呼吸代谢,产生能量。
此外,氧气还广泛应用于医疗、工业生产、环境保护和科学实验等领域。
5. 石油(Petroleum):性质:石油是一种复杂的混合物,主要由碳氢化合物组成,呈黑色油状液体。
用途:石油是重要的能源资源,用于汽车燃料、机动车油、润滑剂和润滑脂等。
此外,石油还有许多化工用途,如生产塑料、合成纤维、化肥和汽油等。
6.氯(Cl2):性质:氯是一种黄绿色气体,具有刺激性气味,并能与水反应生成盐酸。
用途:氯被广泛应用于水处理、消毒、漂白、消毒剂制备和农药制造等。
此外,氯化合物还用于制备塑料、溶剂、绝缘材料和染料等。
7.铁(Fe):性质:铁是常见的金属元素,具有良好的导电、导热性和可塑性。
用途:铁是最重要的金属之一,广泛用于制造建筑材料、机械、车辆、电器和工具等。
此外,铁还用于制备钢铁、电池和磁性材料等。
8. 玻璃(Glass):性质:玻璃是无定形的硬质物质,具有透明、坚硬、耐腐蚀和良好的绝缘性。
1.颜色的规律(1)常见物质颜色①以红色为基色的物质红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等。
碱液中的酚酞、酸液中甲基橙、石蕊及pH试纸遇到较强酸时及品红溶液。
橙红色:浓溴水、甲基橙溶液、氧化汞等。
棕红色:Fe(OH)3固体、Fe(OH)3水溶胶体等。
②以黄色为基色的物质黄色:难溶于水的金、碘化银、磷酸银、硫磺、黄铁矿、黄铜矿(CuFeS2)等。
溶于水的FeCl3、甲基橙在碱液中、钠离子焰色及TNT等。
浅黄色:溴化银、碳酦银、硫沉淀、硫在CS2中的溶液,还有黄磷、Na2O2、氟气。
棕黄色:铜在氯气中燃烧生成CuCl2的烟。
③以棕或褐色为基色的物质碘水浅棕色、碘酒棕褐色、铁在氯气中燃烧生成FeCl3的烟等④以蓝色为基色的物质蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。
浅蓝色:臭氧、液氧等蓝色火焰:硫、硫化氢、一氧化碳的火焰。
甲烷、氢气火焰(蓝色易受干扰)。
⑤以绿色为色的物质浅绿色:Cu2(OH)2CO3,FeCl2,FeSO4•7H2O。
绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。
深黑绿色:K2MnO4。
黄绿色:Cl2及其CCl4的萃取液。
⑥以紫色为基色的物质KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K +离子的焰色等。
⑦以黑色为基色的物质黑色:碳粉、活性碳、木碳、烟怠、氧化铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。
浅黑色:铁粉。
棕黑色:二氧化锰。
⑧白色物质★无色晶体的粉末或烟尘;★与水强烈反应的P2O5;★难溶于水和稀酸的:AgCl,BaSO4,PbSO4;★难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等;★微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4;★与水反应的氧化物:完全反应的:BaO,CaO,Na2O;不完全反应的:MgO。
化学常见物质的化学性质化学是研究物质的组成、性质、变化以及它们之间相互作用的科学领域。
化学性质是描述物质在发生化学反应时表现出的特性。
本文将讨论一些化学常见物质的化学性质。
1. 水(H2O)水是地球上最常见的物质之一,它的化学性质广泛应用于各个领域。
首先,水是一种极好的溶剂。
由于水分子的极性,它能够溶解许多种类的物质,包括离子化合物和极性分子。
其次,水对电解质具有电离能力。
当水分子与电解质反应时,它们能够形成氢离子(H+)和氢氧根离子(OH-)。
2. 氧气(O2)氧气是自然界中的重要成分之一,它在燃烧和呼吸等过程中发挥关键作用。
氧气具有很强的氧化性,在与其他物质反应时能够引发剧烈的燃烧。
许多火灾都是由氧气与可燃物质反应而引起的。
此外,氧气还参与到生物体内进行呼吸作用,它与有机物质的氧化反应产生能量。
3. 二氧化碳(CO2)二氧化碳是一种无色、无臭的气体,广泛存在于环境中。
它的化学性质主要体现在与水反应形成碳酸溶液,使水呈现酸性。
此外,二氧化碳对植物生长也有重要影响。
通过光合作用,植物能够吸收二氧化碳,并将其转化为有机物质,释放氧气。
4. 盐(NaCl)盐是一种常见的化合物,具有重要的化学性质。
首先,盐是一种电解质,它在水中能够电离为钠离子(Na+)和氯离子(Cl-)。
其次,盐具有溶解度,它在水中的溶解度随着温度的升高而增加。
此外,盐还具有融化作用,可以降低冰的熔点。
5. 硫酸(H2SO4)硫酸是一种无色、无臭的强酸,具有广泛的化学性质。
首先,硫酸是一种腐蚀性酸,具有强烈的腐蚀作用。
其次,硫酸具有强酸性,可以与碱反应生成盐和水。
此外,硫酸还具有氧化性,可以与其他物质发生氧化反应。
6. 乙醇(C2H5OH)乙醇是一种常见的有机溶剂,也是一种常见的饮用酒精。
它的化学性质主要体现在与水的混溶性和可燃性。
乙醇能够与水混溶形成醇溶液,这一性质在制备药物和化学实验中有广泛应用。
另外,乙醇也是易燃物质,与氧气相遇时容易发生燃烧。
常见物质的颜色、气味
固体
●红色:红磷P、铜Cu、氧化铁Fe2O3、氧化汞HgO
●红褐色:氢氧化铁Fe(OH)3
●黄色:金Au、硫S
●绿色:碱式碳酸铜Cu2(OH)2CO3
●紫黑色:高锰酸钾晶体KMnO4
●淡蓝色:固态氧O2
●蓝色:氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O
●银白色:大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……)
●黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO
等
●深灰色:石墨C
●灰白色:大多数磷肥
●无色:金刚石C、干冰CO2、冰H2O
●白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。
●有刺激性气味的固体:碳酸氢铵NH4HCO3
液体
●淡蓝色:液态氧O2
●蓝色:含有Cu2+的溶液
●浅绿色:含有Fe2+的溶液
●黄色:含有Fe3+的溶液
●银白色:汞Hg
●我们学过的大多数液体都是无色的。
●有特殊气味的液体:乙醇C2H5OH
●有刺激性气味的液体:醋酸CH3COOH
气体
●红棕色气体:二氧化氮NO2
●有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等
●有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等
●我们学过的大多数气体都是无色无味的。
●计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物
和臭氧O3等
●能产生温室效应的气体:二氧化碳、臭氧O3、甲烷CH4、氟氯代烷等。