初三化学原子的结构
- 格式:docx
- 大小:1.71 MB
- 文档页数:9



九年级化学- 原子的结构1.原子是由居于原子中心的原子核和__核外电子__构成的,原子核是由__质子__和__中子__构成的。
2.由于原子核内质子所带电荷与核外电子的电荷数量__相等__,电性__相反__,因此原子不显电性。
3.在原子中,核电荷数=核内__质子数__=核外__电子数__。
4.原子中的核外电子是分层排布的,可以用__原子结构示意图__表示。
5.相对原子质量是以__一种碳原子质量的1/12__作为标准,其他原子的__质量__与它相比较所得到的比。
6.原子结构示意图的含义:小圆圈和圈内的数字表示__原子核__和__核电荷数__,弧线表示__电子层__,弧线上的数字表示该电子层上的__电子数__。
7.稀有气体最外层有__8__个(除氦外)电子,形成相对稳定的结构;金属的原子最外层电子一般少于__4__个,在化学反应中易__失去__电子;非金属的原子最外层电子一般多于__4__个,在化学反应中易__得到__电子。
9.构成物质的的粒子除了原子、分子之外,还有__离子__,__带电__的原子叫做离子。
其中带正电的原子叫做__阳__离子,带负电的原子叫做__阴__离子。
9.原子的质量主要集中在__原子核__上,因此相对原子质量≈__质子数__+__中子数__。
小节练习题1.原子核中一定含有的粒子是(B)A.中子B.质子C.电子D.质子和中子2.锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)A.1 B.3C.4 D.73.下列粒子不显电性的是(D)A.质子B.电子C.原子核D.分子4. 氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是(A)A.离子B.分子C.原子D.中子5. 下列关于原子结构的认识错误的是(C)A.原子内部有相对较大的空间B.原子由原子核和核外电子构成C.原子由质子和中子构成D.原子核带有正电荷6.下列有关离子的认识错误的是(D)A.原子失去电子,形成了阳离子B.原子得到电子,形成了阴离子C.离子也是构成物质的粒子D.原子失去电子后带负电荷7.下列结构示意图中,表示阴离子的是(D)8.下图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。

化学九年级上册知识点原子在化学的世界中,原子是构成一切物质的基本单位。
对于九年级的学生来说,理解原子的基本概念和相关知识点是非常重要的。
本文将从原子的结构、原子的组成以及原子的性质等方面详细介绍九年级上册化学中关于原子的知识。
一、原子的结构原子是物质的最小单位,由原子核和电子云组成。
原子核位于原子的中心,由带电的质子和不带电的中子组成。
电子云则是环绕原子核运动的带负电荷的粒子。
原子的结构可以用以下公式表示:原子 = 质子 + 中子 + 电子。
1.1 原子核原子核是原子的中心部分,由带正电的质子和不带电的中子组成。
质子的质量约为1.67 × 10^-27千克,电荷为+1。
质子的数量决定了元素的原子序数,也就是元素周期表中的序号。
中子的质量与质子相近,但不带电。
1.2 电子云电子云是环绕原子核的带电粒子的区域。
电子的质量非常轻,约为9.11 × 10^-31千克,电荷为-1。
电子云并不是一个轨道,而是一个模糊的区域,表示了电子的可能位置。
电子云的分布与能级有关,能级越低,电子云越接近原子核。
二、原子的组成原子由带电的质子和不带电的中子组成原子核,周围环绕着带负电荷的电子。
这些组成部分的数量决定了原子的特性。
2.1 质子数质子数决定了原子的元素。
不同的元素具有不同数量的质子。
例如,氧原子的质子数为8,铁原子的质子数为26。
我们可以通过查看元素周期表来确定不同元素的质子数。
2.2 中子数中子数是指原子核中不带电的粒子的数量。
相同元素的不同同位素具有不同数量的中子。
例如,氧的同位素有氧-16和氧-17,分别具有8个和9个中子。
2.3 原子序数原子序数即为元素周期表中的序号,它等于原子核中的质子数。
原子序数决定了元素的特性和元素在周期表中的位置。
例如,氧的原子序数为8,铁的原子序数为26。
三、原子的性质原子具有一系列的性质,包括原子的尺寸、原子的质量以及原子的化学活性等。
3.1 原子的尺寸原子的尺寸极小,约为0.1纳米(1纳米等于10^-9米)。

初中原子的结构摘要:1.原子的基本概念2.原子结构的发现历程3.原子的基本结构4.原子结构的相关理论5.初中生如何学习原子结构正文:1.原子的基本概念原子是构成物质的基本单位,它由原子核和电子组成。
原子核由带正电荷的质子和不带电荷的中子构成,而电子则带负电荷,围绕原子核运动。
原子的种类由其原子序数决定,原子序数等于原子核中质子的数量。
2.原子结构的发现历程原子结构的发现历程经历了几个阶段。
最早,人们认为原子是不可分割的实心球体。
随着科学技术的发展,科学家们发现了电子,并提出了“葡萄干布丁模型”来描述原子结构。
随后,经过一系列实验和理论研究,科学家们逐渐认识到原子核的存在,提出了“行星模型”来描述原子结构。
最后,随着粒子加速器等大型实验装置的出现,科学家们对原子结构有了更加深入的了解。
3.原子的基本结构原子的基本结构包括原子核和电子云。
原子核位于原子的中心,由质子和中子组成,带正电荷。
电子云则分布在原子核周围,由带负电荷的电子组成。
电子在原子核的引力作用下围绕原子核运动,同时受到原子核的斥力作用,形成特定的轨道。
原子的性质,如化学反应、光电效应等,都与电子的运动有关。
4.原子结构的相关理论为了解释原子结构的现象,科学家们提出了一系列理论。
其中,最著名的是量子力学。
量子力学是一种描述微观世界的数学工具,它能够准确地预测原子的能级、电子的运动轨道等。
此外,相对论、场论等理论也在原子结构研究中发挥了重要作用。
5.初中生如何学习原子结构对于初中生来说,学习原子结构需要掌握一些基本的概念和原理。
首先,要了解原子的基本概念,如原子核、电子、原子序数等。
其次,要了解原子结构的发现历程,以便更好地理解原子结构的来龙去脉。
此外,学习一些简单的原子结构相关理论,如量子力学的基本原理,有助于加深对原子结构的理解。
最后,多做一些有关原子结构的练习题,巩固所学知识。


第三单元物质构成的奥秘课题2 原子的结构★知识点一、原子的构成1、构成物质的三粒子:原子、分子、离子。
构成原子的三种粒子:质子、中子、电子。
原子由原子核和核外电子两部分构成。
2、原子不显电性的原因:原子核带的正电荷数与核外电子所带电量相等,电性相反。
3、原子的质量主要集中原子核;原子的质量主要由质子和中子决定。
4、不是所有原子都含有中子,如氢原子就不含中子。
5、原子中的等量关系:核电荷数=质子数=电子数。
二、原子核外电子的排布1、核外电子是分层排布的。
2、核外电子排布的规律:第一层最多2个;第二层最多8个;最外层不超过8个(只有一层不超过2个)3、120号元素的原子结构示意图。
4、元素在周期表中的周期数等于原子的电子层数。
5、元素的化学性质主要取决于原子的最外层电子数。
注:(1)稳定结构:最外层具有8个电子(只有一层具有2个电子)的结构。
(2)各类元素性质与原子结构的关系:最外层电子数得失电子倾向化学性质金属元素一般少于4个易失不稳定非金属元素一般为47个易得不稳定1、离子:带电荷的原子或原子团。
2、离子的分类阳离子;带正电荷的离子。
如:H+、Na+、Mg2+、Al3+、Ca2+、NH4+、Fe3+、Fe2+阴离子:带负电荷的离子。
O2、S2、Cl、OH、SO42、CO32、NO3、3、离子符号的意义:Mg2+:表示镁离子;1个镁离子带2个单位的正电荷2Mg2+:表示2个镁离子.4、离子的判断:质子数>电子数的是阳离子。
质子数<电子数的是阴离子。
5、离子与形成离子的原子在质量上相等,且属于同种元素。
四、相对原子质量1、概念:以一种碳原子质量的1/12为标准,其它原子的质量跟它相比较所得的比,就是相对原子质量。
2、计算式:某元素相对原子质量=()()kg1 12kg12⨯一个该原子的实际质量一种碳原子的实际质量3、相对原子质量=质子数+中子数。
注意:相对原子质量不是实际质量,单位是1,省略。

初中化学原子的结构知识点总结和基础练习第一章、原子的构成1.原子是由下列粒子构成的:原子由原子核和核外电子(带负电荷)构成,原子核由质子(带正电荷)以及中子(不带电)构成,但并不是所有的原子都是由这三种粒子构成的。
例如:普通的氢原子核内没有中子。
2.原子中的等量关系:核电荷数=质子数=核外电子数在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),每个质子带1个单位正电荷,每个电子带一个单位负电荷,原子整体是呈电中性的粒子。
3.原子内部结构揭秘—散射实验(如下图所示):实验结论:(1)原子核体积很小,原子内部有很大空间,所以大多数α粒子能穿透金箔;(2)原子核带正电,α粒子途经原子核附近时,受到斥力而改变了运动方向;(3)金原子核的质量比α粒子大得多,当α粒子碰到体积很小的金原子核被弹了回来。
(2)第二章、相对原子质量1.概念:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量(符号为Ar)。
根据这个标准,氢的相对原子质量约为1,氧的相对原子质量约为16。
2.计算式:总结:1.相对原子质量只是一个比值,单位是“1”(一般不读也不写),不是原子的实际质量。
2.每个质子和每个中子的质量都约等于1个电子质量的1836倍,即电子质量很小,跟质子和中子相比可以忽略不计。
原子的质量主要集中在质子和中子(即原子核)上。
3.在相对原子质量计算中,所选用的一种碳原子是碳12,是含6个质子和6个中子的碳原子,它的质量的1/12约等于1.66×10-27 kg。
4.几种原子的质子数、中子数、核外电子数及相对原子质量比较:原子种类质子数中子数核外电子数相对原子质量氢 1 0 1 1碳 6 6 6 12氧8 8 8 16钠11 12 11 23氯17 18 17 35.5铁26 30 26 56通过分析上表,得到以下结论:(1)质子数=核外电子数;(2)相对原子质量≈质子数+中子数;(3)原子核内质子数不一定等于中子数;(4)原子核内质子数不同,原子的种类不同;(5)不是所有的原子核内都有中子(或普通的氢原子核内无中子)。
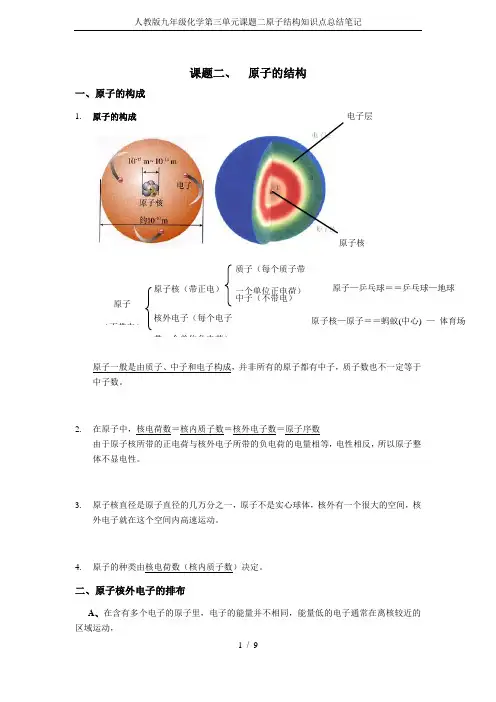
课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。

《原子的结构》讲义在我们探索物质世界的奥秘时,原子无疑是一个关键的基石。
了解原子的结构,就像是打开了一扇通往微观世界的大门,让我们能够更深入地理解物质的本质和各种化学、物理现象。
一、什么是原子原子是化学变化中的最小粒子。
这意味着在化学反应中,原子不会被“创造”或“毁灭”,只是以不同的方式重新组合。
它是构成物质的基本单位,我们身边的各种物质,无论是固体、液体还是气体,都是由原子组成的。
二、原子的构成原子并不是一个实心的小球,而是由位于中心的原子核和围绕原子核高速运动的电子组成。
原子核又由质子和中子构成。
质子带正电荷,中子不带电。
一个原子中质子的数量决定了它的元素种类,这被称为原子序数。
比如氢原子有 1 个质子,氧原子有 8 个质子。
电子带负电荷,其质量相比质子和中子要小得多。
电子在原子核外分层排布,不同的电子层能容纳的电子数量是有限的。
三、原子核的特点原子核虽然体积很小,但却集中了原子的绝大部分质量。
想象一下,如果把原子比作一个巨大的体育场,原子核就如同场中央的一只蚂蚁,而电子则像在看台上高速奔跑的微小粒子。
原子核的密度极大,其内部的粒子之间存在着强大的相互作用,使得原子核保持稳定。
四、电子的排布规律电子围绕原子核运动并不是随意的,而是遵循一定的规律。
电子层从内到外依次被命名为 K、L、M、N 等。
第一层(K 层)最多容纳 2 个电子,第二层(L 层)最多容纳 8 个电子,第三层(M 层)最多容纳 18 个电子,以此类推。
此外,电子在填充电子层时,会先填充能量较低的电子层,然后再填充能量较高的电子层,这被称为“能量最低原理”。
五、原子的电性由于原子核内质子带正电荷,电子带负电荷,当原子中质子数等于电子数时,原子整体呈电中性。
但在某些情况下,原子会失去或得到电子,从而形成带正电或带负电的离子。
例如,钠原子容易失去一个电子,形成带一个正电荷的钠离子;氯原子容易得到一个电子,形成带一个负电荷的氯离子。
六、原子的相对原子质量以一种碳原子质量的 1/12 为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量。

初中化学知识点解析物质结构在初中化学学习中,物质结构是一个重要的知识点。
了解物质的结构可以帮助我们更好地理解它们的性质和行为。
下面,我们将解析一些常见的物质结构知识点。
1. 原子结构:物质的结构起源于它的基本单位——原子。
原子由中心的原子核和外部的电子云组成。
原子核由质子和中子组成,质子带有正电荷,中子不带电。
电子带有负电荷,在外部电子云中运动。
2. 元素周期表:元素周期表是所有已知元素的有序排列。
元素按照原子序数的大小进行排列,并且按照相似的化学性质进行分组。
周期表可以帮助我们了解元素的原子结构以及它们的周期性性质。
3. 分子结构:分子是由两个或更多的原子通过共价键连接在一起的化合物的最小单位。
共价键的形成是通过电子的共享来完成的。
分子的结构对化合物的性质和行为有着重要影响。
4. 离子结构:离子是带电的原子或分子。
当原子失去或获得电子时,会形成带电的离子。
离子根据电荷的正负可以分为阳离子和阴离子。
离子之间通过电荷的吸引力相互结合,形成离子晶体。
5. 金属结构:金属是由金属原子通过金属键连接在一起的物质。
金属原子由正离子和自由流动的电子组成。
金属结构中的正离子排列成紧密的球形结构,而自由电子在正离子之间自由流动。
6. 离子晶体结构:离子晶体是由离子通过电荷的吸引力形成的化合物。
离子晶体的结构是由正负离子相互排列形成的。
正离子和阴离子按照比例排列,形成具有规则结构和平衡电荷的晶体。
7. 水的结构:水是一个特殊的分子,由两个氢原子和一个氧原子通过共价键连接在一起。
水分子呈现出一个带有部分正电荷的氧原子和带有部。
初三化学知识点归纳化学是一门关于物质组成、结构、性质、变化以及它们之间的相互作用的科学。
学习化学有助于我们理解世界万物的本质和原理。
下面将对初三化学知识点进行归纳。
一、物质的组成和性质1. 原子与元素:原子是构成一切物质的基本单位,元素是由相同种类的原子组成的物质。
2. 原子结构:原子由质子(正电荷)、中子(中性)和电子(负电荷)组成,其中质子和中子位于原子核心,电子绕核心轨道运动。
3. 元素周期表:元素周期表是按照原子序数(质子数)排列的化学元素的周期性表格。
元素周期表可以用来预测元素的性质和组成化合物。
4. 化学键:化学键是原子之间的相互作用力,常见的有共价键、离子键和金属键。
不同类型的化学键决定了物质的性质。
二、化学反应和化学方程式1. 化学反应:化学反应是指物质在化学变化过程中发生的转化。
例如,金属与非金属元素结合形成化合物,可视为化学反应。
2. 化学方程式:化学方程式是描述化学反应的符号表示方法。
反应物在左侧,生成物在右侧,用箭头表示转化过程。
方程式中的化学式表示物质的元素成分和数量。
三、酸、碱和盐1. 酸碱中和反应:酸和碱反应生成盐和水的反应称为酸碱中和反应,是一种重要的化学反应。
2. 酸的性质:酸具有酸味,能与碱中和,可以腐蚀金属,可以产生氢气等特点。
3. 碱的性质:碱具有苦味,能与酸中和,能使红色石蕊试剂变蓝等特点。
4. 酸碱指示剂:酸碱指示剂是一种能够根据溶液的酸碱性改变颜色的物质,常用的酸碱指示剂有酚酞、酸碱性紫色试剂等。
5. 盐的性质:盐是酸和碱中和生成的化合物,具有结晶性、可溶性、导电性等特点。
四、氧化还原反应1. 氧化还原反应:氧化还原反应是指物质中的电子转移过程。
氧化是指物质失去电子,还原是指物质获得电子。
2. 氧化剂和还原剂:在氧化还原反应中,起氧化作用的物质称为氧化剂,起还原作用的物质称为还原剂。
五、重要化合物1. 水:水是自然界中最常见的化合物,由氧原子和氢原子组成。
物质的结构一、原子的构成 1. 原子的结构:(1)原子结构示意图的认识决定元素种类(3)原子的质量主要集中在 上 (5)三决定 决定元素化学性质 (4)相对原子质量≈质子数 中子数 决定原子的质量 说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2) 最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构)(5)原子是最小粒子。
分子与原子的本质区别: 在化学反应中,分子可以,而原子2.原子中的电子:电子排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
3.离子:带的原子或原子团叫做离子。
(1)离子符号的书写及意义:元素符号右上角,数字前,正负后,“1”不用写。
:如Fe 3+ :一个铁离子带3个单位正电荷(2)离子结构示意图的认识注意:与原子示意图的区别:质子数=电子数则为原子结构示意图*原子数≠电子数为离子结构示意图(3)分子:分子是保持物质最小的微粒;、、都是构成物质的粒子,大多数物质是由构成的,还有些物质是由或直接构成的。
如:水是由构成的,铁是由构成的,氯化钠是由构成的,氖气是由构成的,二氧化碳是由构成的。
4. 相对原子质量: 以碳12原子质量的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量 。
它只是一个计算公式:相对原子质量 =12112)原子实际质量(碳)原子的实际质量(n m 相对原子质量 ==数 + 数二、元素1.元素 (1)具有相同数(即数)的一类原子的总称。
元素的种类由决定 (2)最外层电子数决定了元素的,金属元素,最外层电子数<个,在化学反应中容易电子,带电荷,形成离子。
非金属元素,最外层电子数≥个,在化学反应中容易电子,带电荷,形成离子。
稀有气体元素,既不容易电子,也不容易电子,是一种结构 地壳中:元素的含量前四位的是(3)表示方法——元素符号——拉丁文名称的第一个字母大写注意:(1)、元素是以核电荷数(质子数)为标准对原子分类(2)、质子数是划分元素种类的标准:质子数相同的原子和单核离子都属于同种元素 (3)、同种元素可以有不同的存在状态:化合物和单质中 (4)、同种元素的离子因带电荷数不同,性质也不同2.元素符号的意义:①②注意:*有些元素符号还可表示一种单质 如Fe 、He 、C 、Si*元素符号前有系数,只有观意义。
《原子的构成》拓展练习一:原子的结构1、原子是由居于原子中心带电的和核外带电的构成的,原子核一般是由、构成的,质子带,中子,原子的质量主要集中在上。
2、由于所带电量和核外所带的电量,但电性,因此整个原子不显电性。
原子核所带的正电荷数称为,在原子里核电荷数=数=数。
3、原子是构成物质的一种基本粒子,具有以下性质:(1)原子的质量和体积;(2)原子之间存在和;(3)原子在不断。
二:原子中的电子1、在多电子的原子里,核外电子的能量是不同的。
能量___的离核较近,能量___的离核较远。
通常把电子在离核远近不同的区域运动称为电子的。
2、原子的核外电子分层排布可用表示。
在画原子结构示意图的时候,第一层上最多排布个电子,排满后再排第二层,第二层上最多排布个电子,排满后剩下的电子排在第三层(只适用质子数从1~18的原子)。
3、原子结构示意图的意义:圆圈和圈内的数字表示和,弧线表示,弧线上面的数字表示该层的。
4、在化学反应中,是不变的,发生改变的只是原子核外的。
5、金属原子最外层电子数一般个,在化学反应中易电子;非金属原子最外层电子数一般个,在化学反应中容易电子;稀有气体的原子最外层都有个电子(氦除外,是个),一般不易得、失电子。
6、原子得、失电子后会形成。
离子分为:带的(核内质子数大于电子数)和带的(核内质子数小于电子数);常见的离子如:钠离子:(符号)、氯离子:(符号)。
三:相对原子质量1、公式:相对原子质量=2、相对原子质量= 数+ 数。
针对练习1.与原子的化学性质关系最密切的是()A.核内质子数B.核内电子数C.电子层数D.最外层电子数2.下列说法不正确的是()A.在多个电子的原子里,电子是分层排布的B.具有稳定结构的粒子一定是稀有气体原子的原子C.非金属原子的最外电子层上电子一般多于4个D.原子结构示意图可简明、方便地来表示原子的结构3..铝原子失去三个电子后,发生变化的是()A.相对原子质量B.中子数C.质子数D.电子层数4. Al3+右上角的数字表示的确切意义是()A.铝原子最外层有3个电子B.铝原子有3个电子层C.铝离子带3个单位正电荷D.3个铝离子5. 1个氢原子由一个质子和一个电子构成,不含中子,当一个氢原子失去1个电子后,它不会变成()A.质子B.原子核C.阳离子D.带负电的离子6. 原子变成离子,一定发生变化的是()A.核外电子的排布B.原子的核电荷数C.相对原子质量D.电子层数7.一种离子变成原子,下列叙述正确的是()A.一定失去电子B.一定得到电子C.得失电子都有可能D.既不能得到电子,也不能失去电子8. 某原子结构示意图,有关说法错误的是()A.原子的核内质子数为16B.原子的核外有3个电子层C.原子的最外层电子数为6D.属于金属原子 9. 核内有19个质子和20个中子,核外有18个电子的粒子一定是( ) A.原子 B.分子C.阴离子D.阳离子 10. 原子A 和B 的核电荷数分别为10和18,它们在结构上的共同特点是( )A.核外电子总数相等 B .核内中子数相等 C.最外层电子数相等 D 原子种类相同12. 下列说法正确的是( )A.分子是保持物质性质的一种粒子B.原子是不能再分的粒子C.离子是带电荷的原子或原子团D.不同种离子的核外电子数一定不相同 13. 下列说法正确的是( )A.钠原子失去一个电子就变成稀有气体的原子B.氯原子得到一个电子后,就变成了与氩原子核外电子排布相同的阴离子C.两种离子,核外电子排布相同,化学性质一定相同D.原子最外层电子数少于4个的原子,一定是金属原子14. 某粒子X 3+核外有23个电子,核内有30个中子,则该原子的核内质子数为( )A .23B .26C .30D .5615. 关于Fe 、Fe 2+、Fe 3+三种粒子,下列判断错误的是( )A .它们质子数相同B .它们核外电子数不同C .它们三者质量几乎相等D .三者都是稳定结构16.某粒子第二电子层上有8个电子,则该粒子( )A .一定是稀有气体的原子B .一定是已达到稳定结构的阴离子C .一定有10个质子D .以上说法都不对17. 已知M 2-离子核外有n 个电子,则该原子核内质子数为( )A.nB.n -2C.n +2D.2-n18. 下列有关说法中,正确的是( )A .原子不显电性,是因为原子中不存在带点的粒子B .水通电产生氢气和氧气,说明水中含有氢分子和氧分子C .在化学反应中,反应前后的原子的种类没有改变,数目没有增减D .不同元素最本质的区别在是相对原子质量不同19.下列叙述错误的是( )A .分子、原子和离子都能直接构成物质B .原子中原子核与核外电子的电量相等,电性相反,所以整个原子不显电性C .决定原子质量大小的主要是质子和电子D .原子如果得到或失去电子就变成离子20.下列粒子结构示意图中,表示阴离子的是( ) A B C D 21.根据右表判断,下列说法正确的是( )A.铝的相对原子质量是13B.钠离子核外有三个电子层C.第二、三周期元素的原子从左至右最外层电子数逐渐增多D.在化学变化中镁元素容易失去最外层2个电子形成镁离子22.下列变化能证明分子可以再分的是( )A.水蒸发B.石蜡熔化C.干冰升华D.水通电分解23.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如613C 表示核内有6个质子和7个中子的碳原子。
初三化学教学设计原子的结构一、教学目标知识与技能1.了解原子是由质子、中子和电子构成的。
2.初步了解相对原子质量的概念,并会查相对原子质量表。
过程与方法1.充分发挥学生的空间想象力。
2.学习运用对比、归纳的方法在微观世界和宏观世界之间架起一座桥梁。
3.运用形象恰当的比喻减少学生对微观世界的神秘感。
情感、态度与价值观1.对学生进行世界的物质性、物质的可分性的辩证唯物主义观点教育。
2.逐步提高学生抽象思维的能力、想象力和分析、推理能力。
重点1.原子的构成。
2.相对原子质量。
难点1.核电荷数、核内质子数和核外电子数的关系。
2.相对原子质量概念的形成。
课件及相关图片二、教学过程一、导入新课师:可能同学们都不熟悉原子,但是提起原子弹大家肯定都不陌生。
在1945年抗日战争的末期,美国空军将两颗原子弹投在了日本的广岛和长崎两个城市,使这两个城市遭受了灭顶之灾。
可见原子弹的巨大威力。
由此我们也可以看出科学技术对于人类的重大作用。
希望同学们努力学习,使用科技为人类造福。
那么原子和核武器原子弹之间有什么关系原子是一种怎样的微观粒子相信同学们对它非常感兴趣,那就让我们共同来认识一下吧。
二、推进新课师:原子到底能不能分如果能分,它又是由哪些部分构成的呢带着这些问题,我们来学习本课题的第一个问题:原子的构成。
原子的构成师:让学生阅读课本第53页内容“原子的构成”,在阅读的基础上讨论问题。
打出下列讨论题:1.原子是由哪两部分构成的2.原子核和核外电子都带电,为什么整个原子不显电性3.原子核是由哪些粒子构成的这些粒子有什么异同4.不同类原子的内部构成有什么不同讨论结束后,由学生代表陈述讨论结果,其他小组可以表明自己的不同意见。
师:原子核居于原子中心,它在原子中的体积如何占很大一部分吗生:原子核居于原子中心,但比原子小得多,原子核的半径只有原子半径的几万分之一,如果把原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。
因此,原子里有很大的空间,电子就在这个空间里做高速运动。
原子的结构【情景激活】原子还可以再分吗?原子究竟是什么样子呢?今天,咱们就来畅游原子的世界!知识回顾:在过氧化氢分解制氧气的实验中,过氧化氢________分裂为氢________和氧________ ,该反应的文字表达为: __________________________________。
分子很小,但在化学反应中可以_____________,而________在化学变化中不可再分,所以说_________ 是化学变化中的最小的粒子。
(提示:填“分子”或“原子”)那同学们想一想,那原子还能再分吗?一. 科学史话——原子结构的探索历程1.公元前5世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子。
2.1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
3.1897年,汤姆生在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
4.1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转。
二.原子的构成1.原子结构2.构成原子的微粒有三种:质子、中子、电子。
决定原子种类的是:质子数。
(所有原子都是三种粒子构成原子吗?有没有例外?)氢原子例外,它没有中子。
3. 原子中:质子数 = 核电荷数 = 核外电子数 = 原子序数4. 原子不显电性的原因:原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带的正电荷数(核电荷数)和核外电子所带的负电相等,但电性相反,所以整个原子不显电性。
三. 原子核外的电子是如何运动的?(1).高速运动(2).无规则运动(3).分层运动把电子在不同的区域内运动的现象叫做核外电子的分层排布。
1. 核外电子的分层排布电子层:1 2 3 4 5 6 7离核:由近到远。
能量:由低到高。
(能量低的在离核近的区域运动,能量高的在离核远的区域运动。
)2.核外电子分层排布的规律(仅限前3层)(1)先“里”后“外”;(能量最低原则)(2)第一层最多安排2个,第二层最多安排8个;(3)最外层最多安排8个电子(最外层同时这第一层时最多安排 2个子)。
3.原子结构示意图画法:画圆圈,标核电,弧线呈扇面,数字一条线。
四. 离子的形成在化学反应中,金属元素的原子易失去最外层电子,非金属元素的原子易得到电子,目的是达到最外层8电子的稳定结构。
1.离子的定义: 带电荷的原子或原子团叫做离子。
2.离子的分类⑴阳离子:带正电荷的原子或原子团。
⑵阴离子:带负电荷的原子或原子团。
3.离子的表示方法⑴离子符号来表示离子阳离子:H+ Na+ K+ Mg2+ Al3+ NH4+氢离子钠离子钾离子镁离子铝离子铵根离子阴离子:F- Cl- O2- S2-氟离子氯离子氧离子硫离子NO3- OH- CO32-SO42-硝酸根离子氢氧根离子碳酸根离子硫酸根离子4.离子符号的意义例如 ----- 镁离子: Mg2 +;5个硫酸根离子:5 SO42-5.离子的结构特点:6.离子与原子的关系五. 相对原子质量(Ar)相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。
相对原子质量的单位是“1”。
相对原子质量 = 质子数 + 中子数知识点一:原子的结构解析:根据在原子中质子数 = 核电荷数 = 核外电子数 = 原子序数例2. 原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。
由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。
例3. 能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有、、。
例4. 据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。
知识点二:原子结构示意图例 5.“嫦蛾一号”的任务之一是探测月球上的氦-3资源,He-3的原子结构示意图为图中x为( )。
A.1B. 2C. 3D. 4例6.镁有“国防金属”的美誉。
在元素周期表中,镁元素的信息如下图所示,对图中信息解释不正确的是()A.原子序数为12B.核外电子数为24C.元素符合为MgD.相对原子质量为24.31知识点三:离子符号例7.说出下列离子符号前面的数字和右上角数字的含义。
(1)2O2-(2)6Na+(3)3Al3+(4)2Cl-知识点四:相对原子质量例8. 氧原子的相对原子质量为()A.16gB.16C.2.657×10-26kgD.16kg【基础演练】1.决定元素种类的是()A.质子数 B.电子数 C.中子数D.最外层电子数2.分子、原子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是()A.干冰 B.黄金C.金刚石D.氯化钾3.右图是金元素在元素周期表中的信息示意图。
从图中获取的信息正确的是()A.金元素属于非金属元素B.一个金原子的中子数为197C.一个金原子的核外电子数为79D.一个金原子中粒子总数为2764.日本大地震引发了核泄漏事故。
事故发生时,放射性原子氮—16可短时存在,氮—16的质子数7,中子数为9。
下列有关氮—16的说法正确的是()A.核外电子数为9 B.相对原子质量为14C.和普通氮原子是相同的原子D.和普通氮元素属于同种元素5. 元素符号“H”除表示氢元素外,还能表示()A.氢气B.一个氢原子C.一个氢分子D.一个氢离子6.(14丰台一模)雄伟壮观的国家大剧院主体建筑表面安装了近2万块钛(Ti)金属板。
已知一种Ti原子的原子核内有22个质子和26个中子,该钛原子核外的电子数为()A.4 B.22 C.26 D.487.下列说法正确的是()A.具有相同核电荷数的一类原子总称为元素B.原子是不能再分的最小粒子C.分子是保持物质化学性质的唯一粒子D.分子、原子是构成物质的粒子,而离子不是8.下列化学符号中,数字“2”表示的意义不正确的是()A. 2Na:两个钠元素B. 2OH-:两个氢氧根离子C.2Mg:镁元素的化合价为+2价 D. NO2:一个二氧化氮分子含有两个氧原子9.某微粒的结构示意图如右图所示,下列有关该微粒的说法错误的是()A.该微粒的原子核内有11个质子B.该微粒在化学反应中易失去1个电子C.该微粒的原子核外有3个电子层D.该图表示的微粒是一种离子【巩固提高】1.2011年3月,日本强烈地震后,海啸引发福岛第一核电站的放射性物质外泄,有关131I(碘-131)的相关报道成为热门话题。
请回答下列问题:(1)131I原子中含有53个质子,78个中子。
①131I原子的核外电子数为__________。
②自然界中普遍存在另一种稳定的碘原子127I,它和131I同属于碘元素。
127I原子的质子数为__________。
(2)专家指出,服用碘片(有效成分为KI)可以治疗131I造成的辐射,但服用碘酒(有效成分为I2)却会引起碘中毒。
KI和I2的性质不同的原因是_________。
(3)日本地震后,个别居民抢购食盐。
假设某人经医生确认,每日需要补充166 mg KI。
已知每千克某品牌碘盐中KIO3的加入量为42、8 mg,如果用该食盐替代碘片提供治疗辐射所需的碘元素,则每日需食用该食盐的质量为__________kg。
2.用化学用语填空:(1) ①2个氧分子___________;②3个氢离子 _____________ 。
(2)某粒子的结构示意图为,它的电子数为_____ 。
3.人体中约有50多种元素,其中钙元素主要存在于骨骼牙齿中,是人体的必需元素。
右图是钙元素在元素周期表中的相关信息。
请回答:(1)钙元素的原子序数是___________ 。
(2)钙元素属于__________ (填“金属”或“非金属”)元素。
(3)青少年缺钙易引起_____________________(填序号) A. 佝偻病 B .坏血病 C .甲状腺肿大4.化学用语是学习化学的重要工具,请用数字和符号表示下列粒子: ① 3个氢分子 ___________,②5个硫酸根离子___________。
5.我国有大面积含丰富硒的土壤资源,在这种土壤中种植的白莲、甘薯、大米等,由于含丰富的硒被称为富硒产品,出口欧美市场。
富硒产品中的“硒”指的是_________ (选填“元素”、“分子”或“原子”),已知硒原于的核电荷数为34,相对原子质量为79,则一个硒原子的原子核由34个质子和45_________个构成。
1.元素周期表是学习化学的重要工具。
右下图是元素周期表 中的一格,从中获取的信息不正确的是( ) A .该元素的元素符号为ArB .该元素属于金属元素C .该元素的原子核外有18个电子D .该元素的相对原子质量为39.952.2011年3月,日本近海强震引发的海啸,造成福岛核电站发生核泄露事件,导致周边环境出现碘131超标,碘131原子的核电荷数为53,相对原子质量为131。
碘原子的核外电子数为( )A.131B.127C.78D.533.根据原子结构示意图不能确定的是( )A .元素的化学性质B .相对原子质量C .原子序数D .元素种类 4.下列叙述错误的是( )A .分子、原子和离子都能直接构成物质2 8 1+11B.原子中原子核与核外电子的电量相等,电性相反,所以整个原子不显电性C.决定原子质量大小的主要是质子和电子D.原子如果得到或失去电子就变成离子5.右图为汞元素的信息,下列说法正确的是()A.汞的核电荷数为80B.汞属于非金属元素C.汞的相对原子质量为200.6gD.在化学反应中,汞原子容易得到电子6.请在横线上用恰当的化学用语表示:(1)2个一氧化碳分子 __________;(2)钙离子 ________;(3)碳酸氢钠的化学式_________。
1.如图是某化学反应的微观示意图,相同的球代表同种原子。
下列说法不正确的是()A.分子由原子构成B.该反应属于置换反应C.原子在化学反应中不可再分D.化学反应前后原子的种类和数目不变2.如图所示为某化学反应的微观示意图,其中“○”和“●”表示两种不同元素的原子。
该反应()A.是化合反应B.可表示氢气和氧气的反应C.反应前后原子种类发生了变化D.反应前后元素化合价没有发生变化3.(14东城二模)“2H”表示()A. 2个氢原子B. 2个氢离子C. 2个氢分子D. 2个氢元素4.根据右表提供的信息,下列判断正确的是()A.元素所在的周期数等于其原子的电子数B.钠离子核外有三个电子层C.第二、三周期元素的原子从左至右最外层电子数逐渐增大D.在化学变化中镁元素容易失去最外层2个电子形成镁离子,其离子符号是Mg+25.如图是核聚变燃料氦的原子结构模型。