有机化合物的结构解析模板
- 格式:pptx
- 大小:927.69 KB
- 文档页数:43

有机化合物的命名和结构解析有机化合物是由碳元素与氢、氧、氮等其他非金属元素组成的化合物。
它们广泛存在于自然界和人造物质中,对生命起着重要的作用。
为了能够准确地描述和研究有机化合物,科学家们开发了一套命名体系,以及结构表示法。
本文将介绍有机化合物的命名规则和常用的结构解析方法。
一、有机化合物的命名规则有机化合物的命名规则遵循国际纯粹与应用化学联合会(IUPAC)制定的《命名化合物的简化规则和首选名称》。
根据IUPAC规定,有机化合物的命名应包括三个部分:前缀、根名和后缀。
1. 前缀表示有机修饰基或取代基的名称和位置,可以有多个前缀。
常见的前缀有甲(methyl)、乙(ethyl)、丙(propyl)等。
2. 根名表示有机化合物主链的长度和类型。
根名一般以碳原子数作为前缀,如甲烷(methane)表示有一个碳原子的链烷烃。
3. 后缀表示有机化合物中存在的官能团或功能基团的名称。
如醇(-ol)、醛(-al)、酮(-one)等。
当一个有机化合物中存在多个取代基时,需要按照一定的优先顺序进行命名。
优先级较高的取代基的位置应尽量靠近根名中数标记。
如果有几个相同的取代基,则用前缀表示其数目。
例如,1,2-二氯甲烷表示有两个氯原子取代在甲烷的1号和2号碳上。
二、有机化合物的结构解析方法有机化合物的结构解析是通过分析分子构建确定各原子的相对位置和化学键的连接方式的过程。
下面介绍几种常用的结构解析方法。
1. 维尔切年图谱(Wiggle Formula)维尔切年图谱是一种直观显示碳原子和它们之间化学键关系的结构表示法。
在维尔切年图谱中,碳原子由顶点表示,化学键由边表示。
每个碳原子上写有带氢原子个数的代表符号。
维尔切年图谱能够清晰地显示出有机化合物的分子结构,并且方便分析其化学性质。
2. 全球性公式(Condensed Formula)全球性公式是一种简化的有机化合物结构表示法,省略了分子中间的碳原子和氢原子。
它只显示有机化合物的主链和官能团,并用括号和数字表示取代基的个数和位置。



【学习目标】1. 进一步认识有机化合物的成键特点;通过有机化合物常见的同分异构体现象的学习体会物质结构的多样性决定物质性质的多样性.2。
能准确判断同分异构体及其种类的多少【重点难点】正确书写同分异构体;【自主学习】一、有机化合物中碳原子的成键特点 1.碳原子的结构及成键特点碳原子的最外层有 个电子,很难得失电子,易与碳原子或其他原子形成 个共价键。
2.碳原子的结合方式⑴ 碳原子之间可以形成稳定的单键,还可以形成稳定的双键或三键. ⑵ 多个碳原子可以相互结合成长短不一的碳链,碳链也可以带有支链,还可以结合成碳环,碳链和碳环也可以相互结合。
⑶ 碳原子还可以和氧原子等多种非金属原子形成共价键。
(氯乙烷)。
⑷ 有机物分子中还普遍存在 现象. 二。
有机物的分子构型名称分子式结构模型键角空间构型甲烷(四氯甲烷)CH 4109。
50 正四面体乙烯 C 2H 41200 平面三。
有机化合物的同分异构现象同分异构体的概念:是指分子式相同而结构式不同的物质之间的互称。
关键要把握好以下两点:⑴分子式相同CH3—CH—CH—CH3 CH3—C—CH2—CH3CH3CH3CH3CH3故己烷(C6H14)的同分异构体的数目有5种。
变式训练2—1。
写现庚烷的同分异构体.2.位置异构⑴烯炔的异构(碳链的异构和双键或叁键官能团的位置异构)方法:先写出所有的碳链异构,再根据碳的四键,在合适位置放双官能团。
例C5H10属于烯烃的同分异构体典例3.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是()三、判断同分异构体数目的常见方法和思路:⑴记忆法①碳原子数目1~5的烷烃异构体数目:甲烷、乙烷、丙烷均无异构体,丁烷有二种异构体,戊烷有三种异构体.②碳原子数1~5的一价烷基:甲基一种(-CH3),乙基一种(—CH2—CH3)、丙基二种[—CH2CH2CH3、-CH(CH3)2], 【方法指导】⑴按照同分异构体的书写步骤书写.⑵先碳链异构后位置异构。

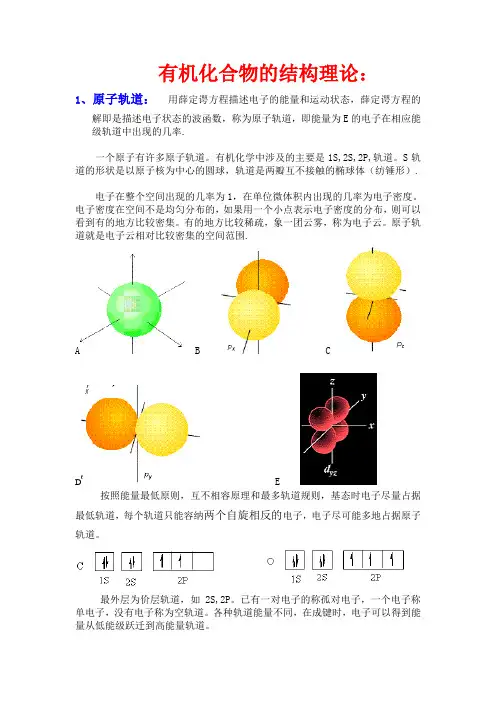
有机化合物的结构理论:1、原子轨道:用薛定谔方程描述电子的能量和运动状态,薛定谔方程的解即是描述电子状态的波函数,称为原子轨道,即能量为E的电子在相应能级轨道中出现的几率.一个原子有许多原子轨道。
有机化学中涉及的主要是1S,2S,2P,轨道。
S轨道的形状是以原子核为中心的圆球,轨道是两瓣互不接触的椭球体(纺锤形).电子在整个空间出现的几率为1,在单位微体积内出现的几率为电子密度。
电子密度在空间不是均匀分布的,如果用一个小点表示电子密度的分布,则可以看到有的地方比较密集。
有的地方比较稀疏,象一团云雾,称为电子云。
原子轨道就是电子云相对比较密集的空间范围.A B CD E按照能量最低原则,互不相容原理和最多轨道规则,基态时电子尽量占据最低轨道,每个轨道只能容纳两个自旋相反的电子,电子尽可能多地占据原子轨道。
最外层为价层轨道,如2S,2P。
已有一对电子的称孤对电子,一个电子称单电子,没有电子称为空轨道。
各种轨道能量不同,在成键时,电子可以得到能量从低能级跃迁到高能量轨道。
1S22S22P2 ——→1S22S12P32、价键理论:价键理论认为,两个原子各有成单电子且自旋方向相反,则这两个单电子可以通过原子轨道重叠而配成一对形成共价键。
轨道重叠后,电子密度更多地集中在量重叠范围内,即两个原子核间,同时吸引着两个原子核,并且屏蔽两原子核间的斥力,于是两个原子结合在一起形成共价键。
轨道重叠或电子配对后,体系能量降低,所以是一种稳定的结合。
一个原子的单电子与另一个原子的单电子配对后,就不能与第三个电子配对,所以原子的成单电子个数就等于它所能形成的共价键数,即共价键的饱和性.形成共价键时轨道要实现最大重叠,原子轨道在看空间伸展的方向不同,电子云密度不同,要实现最大重叠,只有在原子轨道的一定方向上即电子云密度最大的地方重叠,所以共价键具有方向性.若一个原子的价层轨道有孤对电子,而另一个原子或离子有空的轨道,两个原子也可以成键而共用电子对,称为配位键。


第2课时有机化合物的结构特点)[目标导航]1.了解有机化合物的成键特点,体会有机化合物的多样性。
2.了解甲烷的结构,烷烃的概念、通式、结构特点。
3.理解同分异构体的含义,会书写简单烷烃的结构简式、结构式。
一、有机化合物分子中碳原子的成键特点1.烃(1)概念:仅由碳和氢两种元素组成的有机化合物总称为烃,又叫碳氢化合物。
(2)最简单的烃:甲烷。
2.烷烃(1)几种烷烃名称乙烷丙烷正丁烷异丁烷分子式C2H6C3H8C4H10C4H10结构简式CH3CH3CH3CH2CH3CH3CH2CH2CH3(2)烷烃的结构特点每个碳原子形成4个共价键,碳原子之间以单键相连成链状,碳原子的其他价键都被氢原子所饱和。
(3)烷烃的组成通式:C n H2n+2(n≥1且n为整数)。
3.有机化合物的结构特点碳原子成键特点碳原子的连接方式键的个数键的类型每个C碳原子与其他原子形成 4个共价键两个C原子之间可以通过共用电子对形成单键、双键或叁键多个C原子间以共价键构成碳链或碳环【议一议】1.CH4及其氯代物都是正四面体结构吗?CH3Cl 、CH2Cl2、CHCl3、C2H5Cl只有一种,C3H7Cl、C2H4Cl2有两种。
CH4分子为正四面体结构,所以CH3Cl、CH2Cl2、CHCl3都只有一种;C2H4Cl2有两种:CH2ClCH2Cl和CH3CHCl2;C3H7Cl有两种:CH3CH2CH2Cl、。
一、烷烃的结构与性质烷烃⎩⎪⎪⎪⎨⎪⎪⎪⎧组成结构⎩⎪⎨⎪⎧通式:CnH2n+2(n≥1且n为整数),符合此通式的烃一定是烷烃结构⎩⎪⎨⎪⎧碳原子之间都以碳碳单键结合成链状;任1个C原子和与其连接的4个原子的空间构型都是四面体结构大于或等于3个C原子的直链烷烃空间构型是折线形或锯齿状物理性质⎩⎪⎨⎪⎧随碳原子个数增加,熔、沸点逐渐升高,密度逐渐增大常温下,碳原子数≤4的烷烃为气态(新戊烷也为气态,除外)化学性质⎩⎪⎨⎪⎧稳定性→通常情况不与强酸、强碱、强氧化剂反应可燃性→CnH2n+2+3n+12O2――→点燃nCO2+(n+1)H2O取代反应→CH3CH3+Cl2――→光CH3CH2Cl+HCl【例1】运动会火炬一般使用丙烷作燃料。


