无机非金属材料科学基础 作业 第4章
- 格式:docx
- 大小:1.17 MB
- 文档页数:6


第4章非晶态构造与性质一、名词解释1.熔体与玻璃体:熔体即具有高熔点的物质的液体。
熔体快速冷却形成玻璃体。
2.聚合与解聚:聚合:各种低聚物相互作用形成高聚物解聚:高聚物分化成各种低聚物3.晶子学说与无规那么网络学说:晶子学说〔有序、对称、具有周期性的网络构造〕:1硅酸盐玻璃中含有无数的晶子2晶子的互相组成取决于玻璃的化学组成3晶子不同于一般微晶,而是带有晶体变形的有序区域,在晶子中心质点排列较有规律,远离中心那么变形程度增大4晶子分散于无定形物质中,两者没有明显界面无规那么网络学说〔无序不对称不具有周期性的网络构造〕1形成玻璃态的物质与晶体构造相类似,形成三维的空间网格构造2这种网络是离子多面体通过氧桥相连进而向三维空间规那么-4.网络形成体与网络变性体:网络形成体:能够单独形成玻璃的氧化物网络变性体:不能单独形成玻璃的氧化物5.桥氧与非桥氧:桥氧:玻璃网络中作为两个成网多面体所共有顶角的氧非桥氧:玻璃网络中只与一个成网多面体相连的氧二、填空与选择1.玻璃的通性为:各向同性、介稳性、由熔融态向玻璃态转化是可逆与渐变的,无固定熔点、由熔融态向玻璃态转化时,物理、化学性质随温度的变化连续性和物理化学性质随成分变化的连续性。
2.氧化物的键强是形成玻璃的重要条件。
根据单键强度的大小可把氧化物中的正离子分为三类:网络形成体、网络中间体和网络改变体;其单键强度数值范围分别为单键强度>335KJ/mol、单键强度介于250~335KJ/mol 和单键强度<250~335KJ/mol。
3.聚合物的形成可分为三个阶段,初期:石英颗粒的分化;中期:缩聚与变形;后期:在一定时间内分化与缩聚到达平衡。
4.熔体构造的特点是:近程有序、远程无序。
5.熔体是物质在液相温度以上存在的一种高能量状态,在冷却的过程中可以出现结晶化、玻璃化和分相三种不同的相变过程。
-6.在玻璃性质随温度变化的曲线上有二个特征温度Tg〔脆性温度〕和Tf 〔软化温度〕,与这二个特征温度相对应的粘度分别为1012Pa·s和108Pa·s。

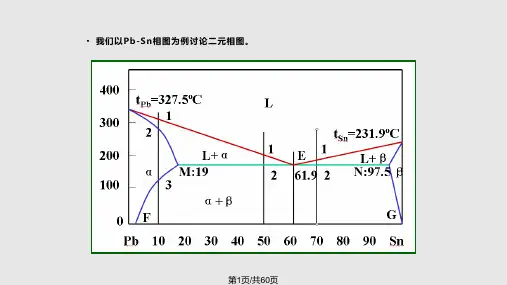
第4章——三元合金相图习题及答案12.图4-120为Pb-Sn-Zn 三元相图液面投影图。
(1)在图上标出合金X(w Pb =0.75,w Sn =0.15,w Zn =0.10)的位置,合金Y(w Pb =0.50,w Sn =0.30,w Zn =0.20)的位置及合金Z(w Pb =0.10,w Sn =0.10,w Zn =0.80)的位置。
(2)若将2kgX ,4kgY 及6kgZ 混熔成合金W ,指出W 成分点位置。
(3)若有3kg 合金X ,问需要配何种成分的合金才能混合成6kg 合金Y 。
解:(1)(2)W 合金的成分: w Pb =(0.75×2+0.50×4+0.10×6)/(2+4+6)=0.342 w Sn =(0.15×2+0.30×4+0.10×6)/(2+4+6)=0.175 w Zn =(0.10×2+0.20×4+0.80×6)/(2+4+6)=0.483 (3)需要合金6-3=3kg 合金A ,其成分为: w Pb =(0.50×6-0.75×3)/3=0.25 w Sn =(0.30×6-0.15×3)/3=0.45 w Zn =(0.20×6-0.10×3)/3=0.314.试分析图4-96中所示①,②,③,④和⑤区内合金的结晶过程,冷却曲线及组织变化示意图,并在图上标出各相成分变化的路线。
解:时间温度15.试分析图4-102所示中Ⅰ,Ⅱ,Ⅲ,Ⅳ和Ⅴ区内合金的结晶过程,冷却曲线及组织组成物。
解:温度时间 温度时间时间温度。

第四章非晶态结构与性质4-3试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?解:利用X射线检测。
晶体SiO2——质点在三维空间做有规律的排列,各向异性。
SiO2熔体——内部结构为架状,近程有序,远程无序。
SiO2玻璃——各向同性。
硅胶——疏松多孔。
4-4影响熔体粘度的因素有哪些?试分析一价碱金属氧化物降低硅酸盐熔体粘度的原因。
解:(1)影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
(2)通常碱金属氧化物(Li2O、Na2O、K2O、Rb2O、Cs2O)能降低熔体粘度。
这些正离子由于电荷少、半径大、和O2-的作用力较小,提供了系统中的“自由氧”而使O/Si比值增加,导致原来硅氧负离子团解聚成较简单的结构单位,因而使活化能减低、粘度变小。
4-5熔体粘度在727℃时是107Pa·s,在1156℃时是103 Pa·s,在什么温度下它是106 Pa·s?解:根据727℃时,η=107Pa·s,由公式得:(1)1156℃时,η=103 Pa·s,由公式得:(2)联立(1),(2)式解得∴A=-6.32,B=13324当η=106 Pa·s时,解得t =808.5℃。
4-14影响玻璃形成过程中的动力学因素是什么?结晶化学因素是什么?试简要叙述之。
解:影响玻璃形成的关键是熔体的冷却速率,熔体是析晶还是形成玻璃与过冷度、粘度、成核速率、晶体生长速率有关。
玻璃形成的结晶化学因素有:复合阴离子团大小与排列方式,键强,键型。
4-16有两种玻璃其组成(mol%)如下表,试计算玻璃的结构参数,并比较两种玻璃的粘度在高温下何者大?解:1号:Z=4,Al3+被视为网络形成离子X1=2R-Z=0.5,Y1=4-0.5=3.52号:Z=4,Al3+被视为网络改变离子X2=2R-Z=1.5,Y2=4-1.5=2.5Y1>Y2 高温下1号玻璃的粘度大。


【复习方略】(天津专供)2014版高考化学第四章第一节无机非金属材料的主角——硅课时作业新人教版(45分钟100分)一、选择题(本题包括10小题,每小题6分,共60分)1.节能减排对发展经济、保护环境有重要意义。
下列措施不能减少二氧化碳排放的是( )A.利用太阳能制氢B.关停小火电企业C.举行“地球一小时”熄灯活动D.推广使用煤液化技术2.下列说法摘自一些科普杂志或广告用语,你认为没有科学性错误的是( )A.化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐B.夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛C.“白雪牌”漂粉精,令所有化学物质黯然失“色”,没有最白,只有更白D.硅的提纯与应用,促进了半导体元件与集成芯片产业的发展,可以说“硅是信息技术革命的催化剂”3.下列关于碳和硅的叙述中,正确的是( )A.其氧化物都能与NaOH溶液反应B.其单质在加热时都能跟O2反应C.其氧化物都能溶于水生成相应的酸D.碳和硅两种元素共有两种单质4.(2013·芜湖模拟)用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )5.下列离子方程式书写正确的是( )A.往澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2====CaCO3↓+H2OB.往碳酸钠溶液中加入二氧化硅:C错误!未找到引用源。
+SiO2====Si错误!未找到引用源。
+CO2↑C.二氧化硅与烧碱溶液反应:SiO2+2OH-====Si错误!未找到引用源。
+H2↑D.硅酸与烧碱溶液中和:H2SiO3+2OH-====Si错误!未找到引用源。
+2H2O6.(2013·大连模拟)证明生石灰中既混有石英,又混有石灰石的正确方法是( )A.加入过量的盐酸,观察是否有气泡冒出B.加入过量的烧碱溶液,观察是否有固体溶解C.加热至高温,观察是否有气泡冒出,是否有硅酸钙生成D.先加过量的盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有不溶物则滤出,投入到氢氧化钠溶液中看其是否溶解7.硅及其化合物在材料领域中应用广泛。

注意:习题按以下内容结构给出,加深理解本课程的内容和结构。
绪论第一篇材料的原子结构第一章材料的原子结构第二篇材料的晶体结构与缺陷第二章材料的结构第三章晶体结构缺陷第七章晶态固体材料中的界面第三篇材料的组织结构第五章相平衡与相图第四章晶态固体中的扩散第六章材料的凝固-----材料的制备工艺基础理论材料的结构相图与相变【综合习题】绪论一、填空题1、材料科学主要研究的核心问题是结构和性能的关系。
材料的结构是理解和控制性能的中心环节,结构的最微细水平是原子水平,第二个水平是原子的排列方式,第三个水平是显微组织。
2. 根据材料的性能特点和用途,材料分为结构材料和功能材料两大类。
根据原子之间的键合特点,材料分为金属、陶瓷、高分子和复合材料四大类。
第一篇材料的原子结构第一章材料的原子结构一、填空题1. 金属材料中原子结合以金属键为主,陶瓷材料(无机非金属材料)以共价键和离子键结合键为主,聚合物材料以共价键和氢键和范德华键为主。
第二篇 材料的晶体结构与缺陷第二章 材料的结构一、填空题1、晶体是 基元以周期性重复的方式在三维空间作有规则排列的固体。
2、晶体与非晶体的最根本区别是 晶体长程有序,非晶体长程无序短程有序 。
3、晶胞是 晶体结构中的最小单位 。
4、根据晶体的对称性,晶系有 3 大晶族, 7 大晶系, 14 种布拉菲Bravais 点阵, 32 种点群, 230 种空间群。
5、金属常见的晶格类型有 面心立方 、 体心立方 、 密排六方 。
6、fcc 晶体的最密排方向为 【111】 ,最密排面为 (110) ,最密排面的堆垛顺序为 ABCABCABC …… 。
7、fcc 晶体的致密度为 0.84 ,配位数为 12 ,原子在(111)面上的原子配位数为 6 。
8、bcc 晶体的最密排方向为 【110】 ,最密排面为 (111) ,致密度为 0.76 ,配位数为 8 。
9、晶体的宏观对称要素有 对称点 、 对称轴 、 对称面 。

§4-4 纯金属晶体的长大
不论是均匀形核还是非均匀形核,稳定的晶核形成后都要继续长大。
首先讨论纯金属晶体的长大,就是不考虑溶质成分对晶体长大的影响。
晶体长大同样需要一定的过冷度,以获得由液态转变为固态的驱动力。
晶体的长大可以从宏观和微观两个方面分析:
宏观长大:主要研究晶体长大过程中液
微观长大:主要研究原子进入固相表面(液
一、宏观长大方式
纯金属晶体长大过程中,液-固界面的形态取决于界面前沿液相中的温度分布(温度梯度)。
温度梯度:温度随距离的变化(d
光滑界面二维晶核长大:。

第二章答案2-1略。
2-2(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求该晶面的晶面指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的晶面指数。
答:(1)h:k:l==3:2:1,∴该晶面的晶面指数为(321);(2)h:k:l=3:2:1,∴该晶面的晶面指数为(321)。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[],(111)与[],()与[111],()与[236],(257)与[],(123)与[],(102),(),(),[110],[],[]答:2-4定性描述晶体结构的参量有哪些?定量描述晶体结构的参量又有哪些?答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5依据结合力的本质不同,晶体中的键合作用分为哪几类?其特点是什么?答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6等径球最紧密堆积的空隙有哪两种?一个球的周围有多少个四面体空隙、多少个八面体空隙?答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8个四面体空隙、6个八面体空隙。
2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙?不等径球是如何进行堆积的?答:n个等径球作最紧密堆积时可形成n个八面体空隙、2n个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。
2-8写出面心立方格子的单位平行六面体上所有结点的坐标。
答:面心立方格子的单位平行六面体上所有结点为:(000)、(001)(100)(101)(110)(010)(011)(111)(0)(0)(0)(1)(1)(1)。

第三章玻璃第一节玻璃的定义与通性一、玻璃的定义目前,玻璃这一名词包括了玻璃态、玻璃材料和玻璃制品。
玻璃态是指物质的一种结构;玻璃材料指用作结构材料、功能材料或新材料的玻璃,如建筑玻璃等;玻璃制品指玻璃器皿、玻璃瓶罐等。
玻璃的定义应该包括玻璃态、玻璃材料与玻璃制品的内涵和特征。
随着人们认识的深化,玻璃的定义也在不断地修改和补充,有狭义和广义的玻璃定义类型。
(一)狭义的定义玻璃:采用无机矿物为原料,经熔融、冷却、固化,具有无规则结构的非晶态固体。
(二)广义的定义玻璃是呈现玻璃转变现象的非晶态固体。
玻璃转变现象是指当物质由固体加热或由熔体冷却时,在相当于晶态物质熔点绝对温度的2/3~1/2温度附近出现热膨胀、比热等性能的突变,这一温度称为玻璃转变温度。
二、玻璃的通性一种具有无规则结构的非晶态固体,其原子不像晶体那样在空间作长程有序的排列,而近似于液体那样具有短程有序。
玻璃像固体保持一定的外形,而不像液体态一样能在本身的重力作用下流动。
玻璃态物质具有以下五个特性:(一)各向同性近程有序、远程无序,不像晶体那样按定向排列,玻璃态物质的质点排列总的说是无规则的,是统计均匀的,因此,它的物理化学性质在任何方向都是相同的。
例如硬度、弹性模量、热膨胀系数、折射率、导电率等。
而非等轴结晶态物质在不同方向上的性质是不同的,表现为各向异性。
必须指出,当结构中存在内应力时,玻璃均匀性就遭受破坏,玻璃就显示出各向异性,例如产生双折射现象。
此外,由于玻璃表面与内部结构上的差异,其表面与内部的性质也不相同。
(二)介稳性玻璃态物质一般是由熔融体过冷却而得到。
在冷却过程中粘度急剧增大,质点来不及作有规则排列而形成晶体,没有释出结晶潜热(凝固热),因此,玻璃态物质比相应的结晶态物质含有较大的能量。
它不是处于能量最低的稳定状态,而属于亚稳状态。
按热力学观点,玻璃态是不稳定的,它有自发释放能量向晶体转化的趋势;但由于玻璃常温粘度很大,动力学上是稳定的,实际上玻璃又不会自发地转化成晶体。
第四章 非晶态结构与性质-习题答案4.2 解:聚合物的形成是以硅氧四面体为基础单位,组成大小不同的聚合体。
可分为三个阶段。
初期:石英的分化;中期:缩聚并伴随变形;后期:在一定时间和一定温度下,聚合和解聚达到平衡。
4.5解:影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
4.6.解:根据弗伦克尔公式lgη=A+B/T ,结合有关数据,即727℃时,η=107Pa ·s ,1156℃时,η=103Pa ·s ,得出:7lg10727273B A =++ 3l g 101156273B A =++∴A=–6.324,B=13324,当η=106Pa ·s 时,613324lg10 6.324273t =-++,则t=808℃。
4.9.解:根据lgη=A+B/(T-T 0),对于1号熔体,带入数据A=1.631,B=4229,T 0=219;对于2号熔体,带入数据A=1.769,B=4690,T 0=216;去下表中的数据点:由上述数据点画出两种熔体的粘性曲线:4567891011l g η1/T(×10-3K -1)4.14 解:(1)影响玻璃形成的动力学因素:析晶过程必须克服一定的势垒,如果这些势垒较大,尤其当熔体的冷却速率很快时,粘度剧烈增加,质点来不及进行有规则排列,晶核形成和晶体长大均难以实现,从而有利于玻璃的形成。
因此,玻璃形成的关键的熔体的冷却速率,影响玻璃形成的动力学因素还有过冷度、粘度、成核速率、晶体生长速率。
(2)影响玻璃形成的结晶化学因素有聚合阴离子团大小与排列方式、键强、键型。
熔体中负离子团的聚合程度越低,越不易形成玻璃,聚合程度越高,特别当具有三维网络或歪扭链状结构时,越易形成玻璃。
氧化物的键强越大,结晶的倾向越小,越容易形成玻璃。
具有离子键或金属键向共价键过度的混合键型才能生成玻璃。
4.16.解:对1#玻璃:2232010110Na O CaO Al O ++=>,Al 3+为网络形成离子 12010103602 2.2510260R ++⨯+⨯==⨯+ Z 1=4 11120.5X R Z =-=11122 3.5Y Z R =-=对2#玻璃:22310120Na O Al O =<,Al 3+为网络变性离子。
材料科学基础课后习题第1-第4章《材料科学基础》课后习题答案第一章材料结构的基本知识4. 简述一次键和二次键区别答:根据结合力的强弱可把结合键分成一次键和二次键两大类。
其中一次键的结合力较强,包括离子键、共价键和金属键。
一次键的三种结合方式都是依靠外壳层电子转移或共享以形成稳定的电子壳层,从而使原子间相互结合起来。
二次键的结合力较弱,包括范德瓦耳斯键和氢键。
二次键是一种在原子和分子之间,由诱导或永久电偶相互作用而产生的一种副键。
6. 为什么金属键结合的固体材料的密度比离子键或共价键固体为高?答:材料的密度与结合键类型有关。
一般金属键结合的固体材料的高密度有两个原因:(1)金属元素有较高的相对原子质量;(2)金属键的结合方式没有方向性,因此金属原子总是趋于密集排列。
相反,对于离子键或共价键结合的材料,原子排列不可能很致密。
共价键结合时,相邻原子的个数要受到共价键数目的限制;离子键结合时,则要满足正、负离子间电荷平衡的要求,它们的相邻原子数都不如金属多,因此离子键或共价键结合的材料密度较低。
9. 什么是单相组织?什么是两相组织?以它们为例说明显微组织的含义以及显微组织对性能的影响。
答:单相组织,顾名思义是具有单一相的组织。
即所有晶粒的化学组成相同,晶体结构也相同。
两相组织是指具有两相的组织。
单相组织特征的主要有晶粒尺寸及形状。
晶粒尺寸对材料性能有重要的影响,细化晶粒可以明显地提高材料的强度,改善材料的塑性和韧性。
单相组织中,根据各方向生长条件的不同,会生成等轴晶和柱状晶。
等轴晶的材料各方向上性能接近,而柱状晶则在各个方向上表现出性能的差异。
对于两相组织,如果两个相的晶粒尺度相当,两者均匀地交替分布,此时合金的力学性能取决于两个相或者两种相或两种组织组成物的相对量及各自的性能。
如果两个相的晶粒尺度相差甚远,其中尺寸较细的相以球状、点状、片状或针状等形态弥散地分布于另一相晶粒的基体内。
如果弥散相的硬度明显高于基体相,则将显著提高材料的强度,同时降低材料的塑韧性。
例题4-2 (1)在MgO晶体中,肖特基缺陷的生成能为6ev,计算在25℃和1600℃时热缺陷的浓度。
(2)如果MgO晶体中,含有百万分之一mol的Al2O3杂质,则在1600℃时,MgO晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
答:
4.4 对某晶体的缺陷测定生成能为84KJ/mol,计算该晶体在1000K和1500K时的缺陷浓度。
答:
4.5 若已知在NaCl晶体中形成一对正负离子空位的形成能Ef=2.54eV,试计算当温度为296K是的肖特基缺陷浓度?
4.6 试写出在下列二种情况,生成什么缺陷?缺陷浓度是多少?(1)在Al2O3中,添加摩尔分数为0.01%的Cr2O3,生成淡红宝石。
(2)在Al2O3中,添加摩尔分数为0.5%的NiO,生成黄宝石。
答:
4.7
答:
4.10 试写出下列缺陷方程:
答:
4.15 用0.2mol YF3加入CaF2中形成固溶体,实验测得固溶体的晶胞参数a=0.55nm,测得固溶体密度ρ=3.64g/cm3,试计算说明固溶体的类型?(元素的相对原子质量:Y=88.90;Ca=40.08;F=19.00)
答:
4.20 非化学计量缺陷的浓度与周围气氛的性质、压力大小相关,如果增大周围氧气的分压,非化学计量化合物Fe1-xO及Zn1+xO的密度将发生怎样变化?增大?减少?为什么?答:
4.21 非化学计量化合物FexO中,Fe3+/Fe2+=0.1(离子数比),求FexO中的空位浓度及x值。
答:。
例题4-2 (1)在MgO晶体中,肖特基缺陷的生成能为6ev,计算在25℃和1600℃时热缺陷的浓度。
(2)如果MgO晶体中,含有百万分之一mol的Al2O3杂质,则在1600℃时,MgO晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
答:
4.4 对某晶体的缺陷测定生成能为84KJ/mol,计算该晶体在1000K和1500K时的缺陷浓度。
答:
4.5 若已知在NaCl晶体中形成一对正负离子空位的形成能Ef=2.54eV,试计算当温度为296K是的肖特基缺陷浓度?
4.6 试写出在下列二种情况,生成什么缺陷?缺陷浓度是多少?(1)在Al2O3中,添加摩尔分数为0.01%的Cr2O3,生成淡红宝石。
(2)在Al2O3中,添加摩尔分数为0.5%的NiO,生成黄宝石。
答:
4.7
答:
4.10 试写出下列缺陷方程:
答:
4.15 用0.2mol YF3加入CaF2中形成固溶体,实验测得固溶体的晶胞参数a=0.55nm,测得固溶体密度ρ=3.64g/cm3,试计算说明固溶体的类型?(元素的相对原子质量:Y=88.90;Ca=40.08;F=19.00)
答:
4.20 非化学计量缺陷的浓度与周围气氛的性质、压力大小相关,如果增大周围氧气的分压,非化学计量化合物Fe1-xO及Zn1+xO的密度将发生怎样变化?增大?减少?为什么?答:
4.21 非化学计量化合物FexO中,Fe3+/Fe2+=0.1(离子数比),求FexO中的空位浓度及x值。
答:。