H2O
CO2
3、四原子分子立体结构
(直线形、平面三角形、三角锥形、正四面体)
C2H2
CH2O NH3
COCl2 P4
4、五原子分子立体结构
最常见的是正四面体
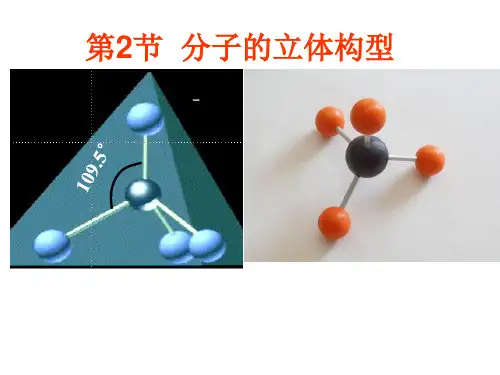
CH4
5、其它:
C6H6
C8H8
CH3OH
资料卡片 :
C60
C
C
C
分子的立体结构
大部分分子由多个原子构成,它们以 共价键形式结合,它们在空间中的形状 就是空间构型,有直线形(如 CO,N2,CO2),有平面三角形(如BFЗ), 有正四面体(CH4),有三角锥(NHз)
H H H-C-H H
中心原子 有无孤电子对
空间结构
无
直线形
有
有
无
无
V形
三角 平面正ຫໍສະໝຸດ 锥 形 三角形 四面体二、价层电子对互斥模型 (VSEPR)
基本要点 ABn 型分子(离子)中的中心原 子A周围的价电子对的几何构型,主要 取决于价电子对数,价电子对(孤电子 对、成键电子对)空间方向上尽量远离, 使它们之间斥力最小,能量最低,物质 才能最稳定。
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
(2)中心原子价电子未全部用于成键 (有孤对电子)时:
例3:H2O
电子对的空间几何 构型:四面体
分子的空间构型: V型
中心原子上的孤对电子也要占据中心原子周 围的空间,并参与互相排斥。
中心原子有孤对电子
三角锥 NH3 H3O+
V型 H2O H2S
2、分子的立体结构—— 成键电子对间的空间构型
(1)中心原子价电子全部用于成键时:
电子对的空间构型和分子的立体结构相同 例1:BeCl2