当代给水与废水处理原理第一章
- 格式:docx
- 大小:341.03 KB
- 文档页数:54




第一章、水质与水处理概论第一节、水体循环与水的利用20世纪50年代以前,给水处理与废水处理涵义的划分是很清楚的。
从天然水源取水,为供生活或工业的使用(特别是生活使用)而进行的处理,称为给水处理。
为了排除的目的,对于使用过的水所进行的处理称为废水处理。
自从水的污染日益严重,水源逐渐紧张以来,给水处理与废水处理间的界限也就逐渐模糊起来。
现在,废水可以作为水源,经处理后以供工业用水甚至生活用水。
水的再用(reuse)以及再生(revonation)这类术语的出现就反映了这种情况。
为了废水的再生或再用所进行的处理,就其水质说是废水处理,就其处理的目的说则为给水处理。
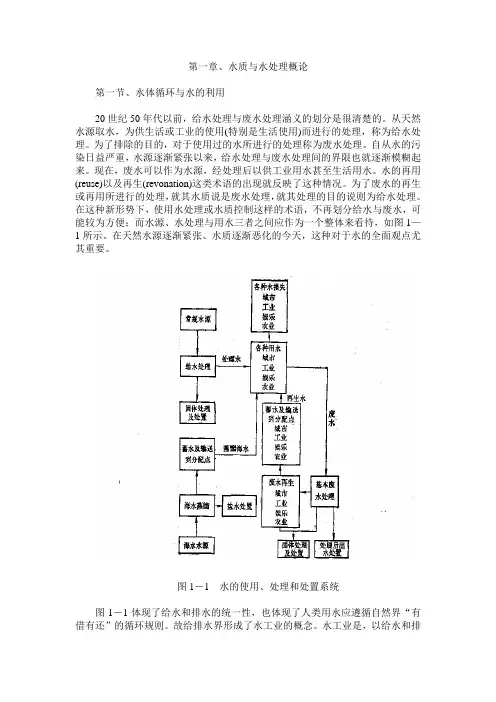
在这种新形势下,使用水处理或水质控制这样的术语,不再划分给水与废水,可能较为方便;而水源、水处理与用水三者之间应作为一个整体来看待,如图1—1所示。
在天然水源逐渐紧张、水质逐渐恶化的今天,这种对于水的全面观点尤其重要。
图1-1 水的使用、处理和处置系统图1-1体现了给水和排水的统一性,也体现了人类用水应遵循自然界“有借有还”的循环规则。
故给排水界形成了水工业的概念。
水工业是,以给水和排水为统一体,以融入高新技术的水质处理为工业核心内涵,为水资源的可持续提供社会及各种行业用水服务的工业。
水工业的应运而生必然伴随着它的依托学科——水质科学与工程的诞生。
水质科学与工程是,以高新技术时代特征为准绳,以水质处理/控制为学科核心内涵,研究水工业为水资源可持续提供社会及各种用水服务所需的科学技术的学科。
高新技术时代特征指:高度的学科之间的相互渗透;能形成精确的预测理论;高新技术的广泛应用。
而水质科学与工程的水质处理/控制的路子具有防止水资源水质灾害和缓解缺水问题的作用,其学科领域是水资源的可持续发展及环境保护的科技依据。
水处理的目的有三种:(1)去除水中的影响使用水质的杂质以及污泥的处置;(2)为了满足用水的要求,在水中加入新的成分以改变水的化学性质,如食用水中加氟以防止口齿病,循环冷却水中加缓蚀剂及缓垢剂以控制腐蚀及结垢等;(3)改变水的物理性质的处理,如水的冷却,降低水的粘滞度等。



当代给水与废水处理原理第章(1)
当代给水与废水处理原理第章是水处理行业的重要指南,它旨在为读
者介绍当今最先进的水处理方法以及相应的原理和技术。
本章将涵盖
以下几个方面的内容:
一、给水处理原理
在当代的给水处理中,根据水质和目的,通常需要进行多种预处理,如:深孔氧化、氧化过滤和反渗透等。
其中深孔氧化可有效去除大部
分物质,而反渗透则可减少含盐水的含盐度,进而达到纯净水的目的。
二、废水处理原理
非常重要的是,在当代废水处理中,除了传统的化学处理,通过生物
处理也可达到降解废水和提高处理效率的目的。
在生物处理中,废水
可以被氧化成更容易破坏的源和非源化合物,最终达到减少污染的目的。
三、膜分离处理技术
膜技术是最被广泛应用于当代水处理的一种技术。
它包括纳滤、超滤、微滤和反渗透等几种技术,在不同的水处理阶段中均能发挥重要作用。
同时,膜过滤可以过滤出大量的细菌和病毒,减少水源的污染。
四、水质测试与监测
在现代水处理过程中,水质测试和监测尤为重要,可以监测处理前后
水源的污染情况,调整处理工艺,保证处理效果以及水源使用的安全
性和可靠性。
总的来说,当代给水与废水处理原理第章是一个非常有价值的指南,
涵盖了现代水处理中各种关键的技术和方法。
通过学习这些原理,水
处理工业可以更好的应对不断变化的环境和应用需求,进而保护水源的安全和可靠性。


当代给水与废水处理原理XXX大学Xx教授第一部分:相关基本概念介冒一、理论需氧量理论需氧量(ThOD)是根据化学方程式计算求得的有机物被全部氧化所需的氧量。
例如,含有300mg / L葡萄糖溶液的理论需氧量可计算如下:C& 6CO2 + 6H2O180 6 X 32180 = 6 X 32300 _ ThODThOD = 320mg/l(以氧表示)氨基乙酸的理论需氧量,可利用下列化学方程式:(a)C H2(NH2) COOH + -|o2—- NH2 + 2CO2十H2075 48 17(b)N H a + 一> HNO2 + H2017 48 47(c)H NO2 + 尹一>HNO34716由方程式a计算得氨基乙酸的碳化需氧量为:48- 192mg/l<以氧计)3°°7^所产生的NH§为: :世沪=6沁/I由式| b,得NH3转化成HNO2所需的氧量为:%储=192mg/l(以氧计)所产生的HN6为:翌評=188mg/l 由式C ,得HNO?转化为HNOj所需的氧量为:18\y— = 64mg/l(以氧计)4 i总的硝化需氧量为:192 + 64 = 256mg/l (以氧计)•••300mg/I氨基乙酸溶液的ThOD为:192 十256 = 448mg/K以氧计)二、化学需氧量化学需氧量或耗氧量是指在一定严格条件下水中有机物与强氧化剂(如重鎔酸钾、高猛酸钾)作用所消耗的氧量。
当用重鎔酸钾作为氧化剂,硫酸银作为催化剂时,水中有机物几乎可以全部(约90%- 95%左右)被氧化。
这时所测得的耗氧量称为重銘酸钾耗氧量或称化学需氧量,以CODc「或COD 表示。
在测定过程中无机性还原物质也会被氧化。
所以一般测得的COD包括可生物降解和不可生物降解两部分,即化学需氧量区别不岀可生物降解和不可生物降解的物质。
COD=COD B+COD NB式中COD B——可生物降解的COD;COD NB——不可生物降解的COD.此外>COD不包括硝化所需的氧1 =iOI有机物+Cr z Or +H+- +C6+HQAg2S()4Ag2SO4用作催化剂。
水中Cl-多于30mg/l将明显干扰测定,因为:6Cl--PCr2O|- + 14H+ — 3C12 + 2CF「+ 7H2O 且当用Ag2SO4作催化剂时,部分Ag2SO4将消耗于与Cl■所起的化学反应Ag 卜+(:1 - 一AgCl | 加HgSQ,可以防止干扰。
Hg2+ + 2C1 - 一HgCl2;HgSO“ 应比A g2SO4^加。
三、生化需氧量在有氧的情况下,由于微生物(主要是细菌)的活动,降解有机物稳定化所需的氧量,称为生化需氧量,常以BOD表示。
下图表示示有机物氧化和微生物细胞合成的关系:呼吸(氧化)有机物介(可生物降解的〉Ofl能NH3细胞(COD B)6內源呼吸洸器•细胞心能金莖一细胞: 残存物质OrilQ、能NOz上一页符号的解释:在有氧的条件下,废水中的有机物分解一般分为两阶段。
第一阶段(亦称碳氧化阶段),主要是不合氮有机物的氧化,但也包括含氮有机物的氨化及氨化后生成的不含氮有机物的继续氧化,这也就是有机物中碳氧化为二氧化碳的过程。
碳氧化阶段所消耗的氧称为碳化需氧量或碳化BOD, —般即称BODo前面图中Oa和Ob之和即表示这部分生化需氧量。
总的碳化需氧量常称为第一阶段生化需氧量(因为碳氧化总是首先发生),也称完全或总的生他需氧量,常以-或BOD U表示。
由于硝化作用所—消耗的氧量称为硝化需氧量或硝化BOD,可以NOD表示。
Oc和Od之和表示这部分生化需氧量(忽略细菌内源呼吸产生的氨进一步氧化所消耗的氧)。
总的硝化需氧量称为第二阶段生化需氧量可以L N或NOD表示。
BOD5的含义:生化需氧量的反应速度在很大程度上取决于微生物的种类、数目及温度,而在测定过程中溶解氧又是逐渐消耗的。
所以测定生化需氧量就须保持一定的温度,同时也需要规定一定的时间。
通常是在20°C温度下培养5d检查溶解氧的损失, 用BOD5表示, 单位以O 2mg/L计。
测定温度用20°C是因为这个温度比较接近温带地区一般河水的平均温度。
BOD 反应动力学:也)碳化需氧曲线(在硝化被抑制条件下测得)⑹ 碳化加硝化需紙曲线或合并需氧曲线(未加硝化抑制剂情况下测得)时间(心二、.呼巴二O第一阶段反应动力学:生化需氧量反应动力学的研究表明,对第一阶段BOD的变化,可认为具有一级反应性质。
这是因为有机物为微生物分解的作用虽可被认为是双分子反应(见下式1),但在这个反应中当反应进行到一定时间细菌非但不减少而且往往大量增加,一旦至细菌数目无多大变化时,就有机物来说,它的分解就具有一级反应的性质,即反应速度与任何时刻剩余的有机物量成正比(如果存在着足够的氧的话)。
02有机物+徼生物—CO? + HQ积分求解(2)式可得:処話仝=K\L式中h——第一阶段BOD(BOR);L—在任何时£存有的B06K1:碳化耗氧常数如£或BODt取为t时日内所吸收的氧量或所满足的BOD,贝9:Y f =BOD r = L/1 - e—弘)=L fl(l 一10-V)£变化对BOD的影响:多年来当水温为2(rc时常采用匕=0・1占。
这是英美等国对污染河水实测而得的平均值。
自从BOD测定时采用了所谓标准稀释水和对各种不同废水进行了试验研究,发现0随水质的变化是有相当大差异的,一般变化在0.05・ 0.3屮之间,而生物处理出水的0值则又小于进水的0,常在0.05-0.1d-1之间。
(一、言心值对BOD的影响(乙一定》温度对OD的影响:9C时|ir]td)K\t 十(KM d)~^zT]7 = K * 1 — 而:用国1十学(K/〉z (K3十—6 —— 21.6故£可写成:K\i~Z~厂屮L ]心=°・43°KU = 2・61万 ・=2. 3昭疋La 和0的确定:耗氧常数0值和第一阶段需氧量-的确定有最小二乘方法、矩量法、日差 法和托马斯(Thomas)法等,但均需用到生化需氧量的测定。
下面介绍使用比较 简单,但也足够准确的托马斯图解法。
在M = 中,Z=(K\L a )-l/3+式(1)是一直线方程,根据不同 日的BOD 测定结果,井作图, 即可求得匕及La 的值。
如下图和温度的关系:0与温度的关系可根据阿累尼乌斯(Arrhenius)经验公式推导求得:阿累尼乌斯公式:K =Ae_ 齐或:LnK =—石;+ InA式中K——反应速度常数(这里就是耗氧常数九E--- 活化能•对于废水,~般为8400—84000 J/mol?T——绝对温度(K);R——气体常数,8.31 J/(K*mol);A——频率因子(即反应分子间的碰撞率);0和温度的关系式推导:K 2 =K\8「LS将阿累尼乌经验式求导并积分运算后可得:“戎=貯化⑴—『J-温度厂时的耗氧常数;•温度口时的耗氧常数; 厂及口均为绝对温度。
在室温时,氏需值几乎不变,如以C 代表,则式中K 、 K. 1 唆=CCG _曲) •筝=严-「)令』=仇(也称为温度系数),则在水污染控制工作中,习惯上写成下式二心⑴=心曲-迦 式中 K®——20C 时的耗氧常数$ S ——:TC 时的耗氧常数。
0实际上并非常数,它是随温 度而稍有变化的。
其值可通过 试验,并按下式作图求得;lg^i (T ) = lgK 如 + (T — 20)lgft一般说来,在10-30°C 时,可 米用3{ =1.047 oLa 与温度的关系:对于一给定水样,不但K1随温度而增加. 所以根据下式(1),可以写出式(2):n =申©-丁『厶灯“或 L a(r }> = ^a (T,)e i3<Tz'T>)式中芒为一常数’—展开式(3),可得:r 1厶% =厶存]> 1 + 0(7\ — 门)十 y/32(T 2— TJ1 r +押CG N・・・_]La也随温度而增加,可以认为LaocKI,取S T*=厶呵》[1十0(兀—7】)]当 7\ = 2OC,0=a 02,乙“「厂2〉=厶K2O)[0・027*2十 0. 6]习惯上9写成:厶《门=厶4o〉[°・02T + 0・6]式中5——厂C时的第一阶段BOD;乙(20)—— 20。
时的第一阶段BOD.一点说明:实验求得的La值与需氧量理论值(理论需氧量)之间的差别:多年来,有机物的第一阶段生化需氧量La被认为等于按化学方程式得到的理论值。
例如,理论上全部氧化浓度为300mg/L的葡萄糖溶液的需氧量应为320mg/L,此即所渭理论需氧量(计算见前),但实际测定发现其La在250-285mg/L之间(2(TC ), 显然,葡萄糖并末全部转化为CO?和水。
要明了这个差别必须先了解微生物对于有机物的分解过程。
要使有机物能为细菌氧化,这种有机物必须要能够作为细茵的食料,细菌由此获得能量及组成细胞的原料。
这就是说部分有机物转变成了细胞物质,细胞物质通过内源呼吸也能放出能量。
细菌死亡后,它即成为其它细菌的食料, 进一步转变为CO?和水,并合成细胞物质。
活的或死的细菌又可作为较高级微生物,如原生动物的食料。
在每次转化过程中都有进一步的氧化作用,但是最后还会有一些有机残渣遗留下来。
它们对于微生物分解的抗力十分强。
这部分残渣即代表所测定的全部生化需氧量与理论需氧量之间存在差别的一部分有机物。
第二阶段动力学:碳化和硝化虽可同时进行,但是,如前所述,对于一般的污染水,硝化常要在碳化进行了一段时间才会显著展开。
K b v——硝化耗氧常数,此常数常小于碳化耗氧常数;S——总的硝化需氧量L N和&N也可用托马斯图解法求得, 但须采用新的坐标系统。
当时(仅碳化九匕=乙(1 一10 W)当时(碳化加硝化儿儿=L a(l一10一勺)+ 厶垃1 一10-W叮氧化lmg/I的NH「N需氧4・6mg/L阶段BOD的变化也具有一级反应的性质,则可写出NOD的曲线方程:△丫「・=Eg —例题:某BOD试验在20 r温度下共进行了15d.求得K E = 0. 16cT Km = 0・1旷1,厶= 400mg/i,乙z=300mg/l,并发现硝化作用8d后显著展开,计算BOD0和BOD12.因为硝化作用在8d前影响还不大,故可认为BOD H仅是碳化需氧量y% =EOD E =乙(1 一10~^10= 400( 1 —①叫日)=426mLg/lY l2 =乙(1 — 10一&〉+ — 10—02-4〉]=400(1 - 10-5x12)十300[1 —诃= 626mg/l硝化需氧量曲线:曲线——总的BOD 曲线或碳化加硝牝BOD 曲线(在硝化未誠抑制的条 件下测得〕曲线——碳化BOD 曲线<在硝化被抑制的条件下测得)t Cd)线a)硝化EOD 曲线 LI四、总有机碳(TOC):将水样在高温下燃烧,有机碳即被氧化成co?,量测所产牛的CC>2量,便可求得水样的总有机碳(TOC),单位以碳的mg/L表示。