人教版必修一《4.3.1硫和硫的氧化物》随堂练习及答案
- 格式:pdf
- 大小:63.17 KB
- 文档页数:3

个帅哥帅哥的 ffff课时作业 23硫的氧化物时间: 45 分钟满分:100分一、选择题 (每题 4 分,共 48 分)1.以下说法正确的选项是 ()A.SO2能使 FeCl3、KMnO 4水溶液颜色变化B.能够用澄清石灰水鉴识 SO2和 CO 2C.硫粉在过度的纯氧中焚烧能够生成SO3D.少许 SO2经过浓的 CaCl2溶液能生成白色积淀分析: SO2中硫为+ 4 价,拥有较强复原性。
在水溶液中,SO2能够将氧化剂FeCl3、KMnO 4等快速复原而使溶液颜色变化;SO2通入澄清石灰水跟CO 2通入澄清石灰水反响现象近似;往常状况下,SO2很难被氧气氧化,只有在必定温度和催化剂存在的条件下才反响生成 SO3,且是可逆反响; SO2的水化物是 H 2SO3,H2SO3的酸性比盐酸弱,不可以生成白色积淀。
答案: A2.以下说法不正确的选项是 ()A.因为地壳的岩层里含硫及其化合物,所以火山喷出物中含有H2S、SO2等硫的化合物B.化石燃料直接焚烧会产生对大气有严重污染的SO2气体C.硫在空气中焚烧的产物是SO2,在氧气中焚烧的产物是SO3 D.硫是一种淡黄色晶体,不溶于水,微溶于酒精分析:SO2转变为 SO3的条件是催化剂、加热,而 S 在氧气中焚烧只好生成 SO2,不具备 SO2转变为 SO3的条件。
答案: C3.能与 SO2气体发生反响,但无积淀产生的是()①溴水②Ba(OH) 2溶液③石灰水④Na2CO3⑤稀 H 2SO4⑥Na2SO3A.只有①B.①③④C.④⑤⑥D.①④⑥分析:相关反响为:①S O2+ Br2+2H2O===H 2SO4+2HBr( 无积淀生成 );②SO2+Ba(OH) 2===BaSO3↓+H 2O(有积淀生成);③SO2+Ca(OH) 2===CaSO3↓+H2O(有积淀生成);④SO2+ Na2CO 3===Na2SO3+CO 2(无积淀生成 );⑤SO2与稀 H2SO4不反响;⑥S O2+ Na2SO3+H 2O===2NaHSO 3(无积淀生成 )。

第1课时 二氧化硫和三氧化硫课程目标1.了解硫在自然界的存在形态,硫单质的性质和用途。
2.掌握SO 2的化学性质及检验方法,学会设计实验验证SO 2的还原性及漂白性。
3.了解SO 3的主要性质。
4.了解可逆反应的特点。
图说考点,[新知预习]一、硫1.硫的存在(1)游离态:火山喷口附近、地壳的岩层内。
(2)化合态⎩⎪⎨⎪⎧硫化物:硫铁矿(FeS 2)、黄铜矿(CuFeS 2)硫酸盐:石膏(CaSO 4·2H 2O )芒硝(Na 2SO 4·10H 2O )2.物理性质俗称 色、态 溶解性硫黄 黄色晶体不溶于水,微溶于酒精,易溶于CS 23.H 2S -2、Fe S -2← S 0 ―→S +4O 2、S +4O 2-3 (1)氧化性(2)还原性硫在空气中燃烧,产生淡蓝色火焰;在纯氧中燃烧,产生蓝紫色火焰,燃烧产物为SO 2,化学方程式为S +O 2=====点燃SO 2。
二、硫的氧化物1.二氧化硫(SO2)(1)物理性质颜色状态气味密度溶解性毒性无气体刺激性比空气大易溶于水有毒(2)化学性质(3)SO2的用途①漂白纸浆、毛、丝、草帽辫等。
②用于杀菌、消毒。
2.三氧化硫(SO3)三氧化硫具有酸性氧化物的通性,主要反应如下:[即时性自测]1.判断正误,正确的打“√”,错误的打“×”(1)自然界中不存在游离态的硫单质。
()(2)S能氧化Fe,使Fe生成+3价铁的化合物。
()(3)S在空气中燃烧生成SO2,在过量的纯O2中燃烧生成SO3。
()(4)SO2和CO2可用澄清石灰水鉴别。
()(5)SO2使品红溶液褪色是因为SO2具有强氧化性。
()(6)SO2的水溶液存在SO2、H2SO3的原因是SO2与H2O的反应为可逆反应。
() 答案:(1)×(2)×(3)×(4)×(5)×(6)√2.关于SO2的说法中,不正确的是()A.使某些有色物质褪色B.无色,有刺激性气味,无毒C.既有氧化性,又有还原性D.既可溶于水,又可与水反应答案:B3.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是()A.饱和食盐水B.NaOH溶液C.足量澄清石灰水D.饱和碳酸氢钠溶液解析:CO2和SO2都能与NaOH溶液和石灰水反应,都不与饱和食盐水反应;因为H2SO3的酸性强于H2CO3,故可用饱和NaHCO3溶液除去CO2中的SO2气体。

课时作业23硫的氧化物时间:45分钟满分:100分一、选择题(每小题4分,共48分)1.下列说法正确的是()A.SO2能使FeCl3、KMnO4水溶液颜色变化B.可以用澄清石灰水鉴别SO2和CO2C.硫粉在过量的纯氧中燃烧可以生成SO3D.少量SO2通过浓的CaCl2溶液能生成白色沉淀解析:SO2中硫为+4价,具有较强还原性。
在水溶液中,SO2可以将氧化剂FeCl3、KMnO4等迅速还原而使溶液颜色变化;SO2通入澄清石灰水跟CO2通入澄清石灰水反应现象类似;通常情况下,SO2很难被氧气氧化,只有在一定温度和催化剂存在的条件下才反应生成SO3,且是可逆反应;SO2的水化物是H2SO3,H2SO3的酸性比盐酸弱,不能生成白色沉淀。
答案:A2.下列说法不正确的是()A.由于地壳的岩层里含硫及其化合物,因此火山喷出物中含有H2S、SO2等硫的化合物B.化石燃料直接燃烧会产生对大气有严重污染的SO2气体C.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3 D.硫是一种淡黄色晶体,不溶于水,微溶于酒精解析:SO2转化成SO3的条件是催化剂、加热,而S在氧气中燃烧只能生成SO2,不具备SO2转化成SO3的条件。
答案:C3.能与SO2气体发生反应,但无沉淀产生的是()①溴水②Ba(OH)2溶液③石灰水④Na2CO3⑤稀H2SO4⑥Na2SO3A.只有①B.①③④C.④⑤⑥D.①④⑥解析:有关反应为:①SO2+Br2+2H2O===H2SO4+2HBr(无沉淀生成);②SO2+Ba(OH)2===BaSO3↓+H2O(有沉淀生成);③SO2+Ca(OH)2===CaSO3↓+H2O(有沉淀生成);④SO2+Na2CO3===Na2SO3+CO2(无沉淀生成);⑤SO2与稀H2SO4不反应;⑥SO2+Na2SO3+H2O===2NaHSO3(无沉淀生成)。
对照题意,符合条件的有①④⑥。
答案:D4.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是()①饱和Na2CO3溶液②饱和NaHCO3溶液③浓H2SO4溶液④灼热的铜网⑤碱石灰A.①③④B.③④⑤C.②④③D.②③④答案:D5.如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
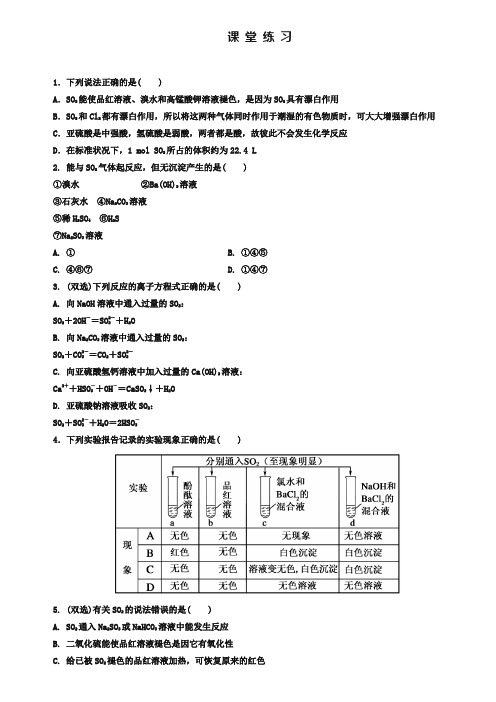
课堂练习1.下列说法正确的是( )A.SO2能使品红溶液、溴水和高锰酸钾溶液褪色,是因为SO2具有漂白作用B.SO2和Cl2都有漂白作用,所以将这两种气体同时作用于潮湿的有色物质时,可大大增强漂白作用C.亚硫酸是中强酸,氢硫酸是弱酸,两者都是酸,故彼此不会发生化学反应D.在标准状况下,1 mol SO2所占的体积约为22.4 L2. 能与SO2气体起反应,但无沉淀产生的是( )①溴水②Ba(OH)2溶液③石灰水④Na2CO3溶液⑤稀H2SO4⑥H2S⑦Na2SO3溶液A. ①B. ①④⑤C. ④⑥⑦D. ①④⑦3. (双选)下列反应的离子方程式正确的是( )A. 向NaOH溶液中通入过量的SO2:SO2+2OH-=SO2-3+H2OB. 向Na2CO3溶液中通入过量的SO2:SO2+CO2-3=CO2+SO2-3C. 向亚硫酸氢钙溶液中加入过量的Ca(OH)2溶液:Ca2++HSO-3+OH-=CaSO3↓+H2OD. 亚硫酸钠溶液吸收SO2:SO2+SO2-3+H2O=2HSO-34.下列实验报告记录的实验现象正确的是( )5. (双选)有关SO2的说法错误的是( )A. SO2通入Na2SO3或NaHCO3溶液中能发生反应B. 二氧化硫能使品红溶液褪色是因它有氧化性C. 给已被SO2褪色的品红溶液加热,可恢复原来的红色D. SO2和O2混合加热,可生成SO36. 能证明SO2具有漂白性的是( )A. 酸性KMnO4溶液中通入SO2气体后,紫色消失B. 显红色的酚酞通入SO2后,红色消失C. 品红溶液通入SO2后,红色消失D. 溴水中通入SO2后,橙色消失7. 下列物质均有漂白作用,但其中一种的漂白原理与其他三种不同,它是( )A. HClOB. SO2C. O3D. Na2O28. 向FeCl3和BaCl2的酸性混合溶液中,通入SO2气体,有白色沉淀生成,此沉淀是( )A. BaSO4B. FeSC. BaSO3D. S9.下列说法正确的是( )A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4溶液、石蕊试液褪色B.能使品红褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性10.如下图所示是实验室制取SO2并验证SO2某些性质的装置图。

第二章非金属及其化合物第三节硫和氮的氧化物(第一课时硫和硫的氧化物)【学习目标】1.通过思考交流、阅读讨论、问题探究,进一步熟悉硫单质在自然界的存在及重要的物理和化学性质。
2.通过演示实验、思考交流、分析探究,从硫、二氧化硫的属类及硫元素化合价角度认识硫及二氧化硫的性质、用途,体会性质决定用途的核心理念。
3.通过对比分析,结合真实情境中的应用实例或通过实验探究,理解SO2的酸性、漂白性及强还原性。
知道三氧化硫的物理性质及化学性质,并能正确书写相关化学方程式。
【学习重点】二氧化硫的化学性质【学习难点】二氧化硫性质的实验设计及原理探究【自主学习】旧知回顾:1.同种元素不同价态的物质,处于最高价态时只具有_氧化性;处于最低价态时只具有_还原性;处于中间价态时既有氧化性又有还原性。
如:S2-具有还原性,S具有既有氧化性又有还原性_,SO2具有既有氧化性又有还原性,Na2SO3具有既有氧化性又有还原性,SO3具有氧化性(填〝氧化性〞、〝还原性〞)。
2.酸性氧化物是指能与碱反应,并且只生成盐和水的氧化物。
酸性氧化物具有一些的通性,如:CO2+2NaOH+=_H2O+Na2CO3_;CO2+Ca(ClO)2 +H2O= CaCO3↓+2HClO等。
新知预习:1.自然界中游离态的硫存在于火山喷口附近或地壳的岩层里,化合态的硫主要以硫化物和_硫酸盐形式存在。
2.硫的氧化物有二氧化硫和三氧化硫两种,均为酸性氧化物。
二氧化硫中硫元素为 +4价,因此二氧化硫既具有氧化性,又具有还原性。
【同步学习】情景导入:阅读教材P89的图4-19,观看视频—硫及二氧化硫。
思考空气质量报告指标有哪些?为什么要把这两种物质作为空气质量报告的内容,这就是本节课要探讨的问题。
活动一、硫的存在和性质1.阅读思考:阅读教材P89页—90页内容,思考硫元素在自然界的存在形态是什么?【温馨提示】(1)游离态:存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。

一、选择题(本题包括5小题,每小题4分,共20分)1.下列说法中,不.正确的是()A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫解析:硫在空气中的燃烧产物是二氧化硫,在纯氧中燃烧产物也是SO2。
答案:D2.将SO2通入显红色的酚酞试液中,发现红色消失,主要原因是SO2()A.有漂白性B.有还原性C.有氧化性D.溶于水中显酸性解析:酚酞显红色说明溶液中存在着碱性的物质,而二氧化硫溶于水后显酸性,可将碱性物质中和,而使酚酞褪色。
答案:D3.下列有关三氧化硫的说法中,正确的是()A.三氧化硫极易溶于水,且与水反应生成H2SO4B.SO3不属于酸性氧化物C.硫粉在过量的氧气中燃烧生成SO3D.SO2、SO3均具有漂白性,能使石蕊试液褪色解析:因SO3+H2O===H2SO4,A正确。
SO3和SO2都属于酸性氯化物,B错误。
不管氧气量的多少,硫在氧气中燃烧的产物都是SO2,C错。
SO2具有漂白性,但SO3不具有漂白性,且SO2不能使石蕊试液褪色。
答案:A4.下列物质能使品红溶液褪色,且褪色原理基本相同的是()①活性炭②新制氯水③二氧化硫④臭氧⑤过氧化钠⑥双氧水A.①②④B.②③⑤C.②④⑤⑥D.③④⑥解析:新制氯水、臭氧、过氧化钠、双氧水都有强氧化性,都可以使品红褪色。
答案:C5.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是()A.饱和食盐水B.NaOH溶液C.足量澄清石灰水D.饱和碳酸氢钠溶液解析:CO2和SO2都能与NaOH溶液和石灰水反应,都不与饱和食盐水反应,因为H2SO3的酸性强于H2CO3。
故可用饱和NaHCO3溶液除去CO2中的SO2气体。
答案:D二、非选择题(本题包括3小题,共30分)6.(8分)某无色气体A中可能含有H2S、SO2、CO2、HCl气体中的一种或几种(1)将此气体通入氯水后溶液变得无色透明。
2014高中化学4.3.1 硫和硫的氧化物随堂练习新人教版必修1]1.(对应考点一)如图是研究二氧化硫性质的微型实验装置。
现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。
下列说法中错误的是()A.紫色石蕊溶液变蓝色B.品红溶液褪色C.溴水橙色褪去D.含酚酞的NaOH溶液红色变浅解析:SO2的水溶液显酸性,能使紫色石蕊溶液变红,故A错误;SO2有漂白性,能使品红溶液褪色,B正确;SO2有强还原性,与溴水发生反应:Br2+SO2+2H2O===H2SO4+2HBr,使溴水褪色,C正确;SO2能与NaOH溶液反应生成Na2SO3,使红色变浅或褪色,D正确。
答案:A2.(对应考点一)下列说法正确的是()A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好解析:A项中SO2使溴水、KMnO4/H+褪色是因为SO2具有还原性,能使品红溶液褪色是漂白性,SO2不能使指示剂褪色;能使品红试液褪色的物质很多,不仅仅是SO2;C项的这些漂白剂的漂白原理不都相同。
SO2和Cl2等物质的量混合后在溶液中发生反应SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
答案:B3.(对应考点二)香烟烟雾中往往含有CO和SO2气体,下列关于这两种气体的说法正确的是()A.两者都污染环境,危害健康B.两者都是形成酸雨的主要物质C.两者都能使品红溶液褪色D.两者都易溶于水解析:CO和SO2气体都污染环境,危害健康;SO2气体是形成酸雨的主要物质,能使品红溶液褪色,易溶于水,而CO不具有此性质,故选A。
答案:A4.(对应考点二)检验SO2中是否混有CO2气体,可采用的方法是()A.通过品红溶液B.先通过足量NaOH溶液,再通入澄清石灰水C.通过澄清石灰水D.先通过KMnO4酸性溶液,再通过澄清石灰水解析:A选项检验的是SO2;B选项不管是否混有CO2都不会产生白色沉淀;C选项不管有没有CO2都会产生白色沉淀;只有D选项,KMnO4酸性溶液将SO2完全吸收,通过澄清石灰水,若有白色沉淀一定有CO2,若无沉淀则无CO2,故正确答案为D。
第1课时硫和硫的氧化物1.下列说法中,不.正确的是()A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫2.下列关于SO2的说法中,不.正确的是()A.SO2是硫及某些含硫化合物在空气中燃烧的产物B.SO2具有漂白性,可以使品红溶液褪色C.SO2与水反应生成H2SO4D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧3.检验SO2中是否混有CO2气体,可采用的方法是()A.通过品红溶液B.先通过足量NaOH溶液,再通入澄清石灰水C.通过澄清石灰水D.先通过KMnO4酸性溶液,再通过品红溶液,再通入澄清石灰水4.CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,①②两瓶中所装的试剂应该是()A.①NaOH溶液;②浓H2SO4B.①浓H2SO4;②NaOH溶液C.①饱和NaHCO3溶液;②浓H2SO4D.①浓H2SO4;②Na2CO3溶液5.下列说法正确的是()A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.SO2和Cl2混合使用,具有更强的漂白能力6.下列溶液中能够区别SO2和CO2的是()①石灰水②H2S溶液③KMnO4溶液④氯水⑤品红溶液A.①②③B.②③④C.除①以外D.全部7.SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是()①KMnO4(H+,aq)②溴水③碘水④氯水⑤Fe3+(aq)A.①⑤B.②③C.全部D.都不是8.向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是() A.BaSO4B.Fe2(SO4)3C.BaSO3D.S9.下列实验能证明一定有SO2存在的是()①能使澄清石灰水变浑浊;②能使湿润的蓝色石蕊试纸变红;③能使品红溶液褪色;④通入足量的氢氧化钠溶液再加BaCl2溶液有白色沉淀产生,该沉淀溶于稀盐酸;⑤通入溴水能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生A.均能B.均不能C.③④⑤D.只有⑤10.SO2和Cl2能使物质漂白,若将等物质的量的这两种气体同时作用于潮湿的有色物质,此时可观察到有色物质()A.立刻褪色B.慢慢褪色C.先褪色后复原D.颜色不褪去11.A、B是两种常温下有刺激性气味的气体,将A(g)通入品红溶液中,品红溶液变为无色;将B(g)通入品红溶液中,品红溶液也变为无色。
1.下列说法中不正确的是()A.在自然界中有游离态的硫存在B.试管内壁的硫粉可以用热的碱液除去C.硫与变价金属反应,生成金属的低价态化合物D.硫的氧化性比氯气的强解析:游离态的硫存在于火山喷口附近或地壳的岩层里,A正确。
S可以与热的碱液反应,B正确。
硫的氧化性较弱,与变价金属化合时,只能生成低价态金属硫化物,如S与Fe、Cu反应,生成FeS、Cu2S;氯气的氧化性较强,Cl2与Fe、Cu反应生成高价态金属化合物FeCl3、CuCl2,C正确,D错误。
答案:D2.下列关于SO2的说法不正确的是()A.能使品红溶液褪色B.在空气中极易被O2氧化为SO3C.是酸性氧化物,能与水发生反应生成亚硫酸D.是大气污染物之一,主要来自于化石燃料的燃烧和工厂排放的废气答案:B3.下列说法不正确的是()A.硫是一种黄色、质脆的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物答案:D4.下列溶液中能够区别SO2和CO2气体的是()①澄清石灰水②H2S溶液③酸性KMnO4溶液④新制氯水⑤品红溶液A.①②③B.②③④C.除①外D.全部答案:C5.如图是实验室制取SO2并验证SO2某些性质的装置图。
(1)⑥中发生反应的化学方程式为____________________________________________________________________________。
(2)①中实验现象为__________________________________,证明SO2是气体。
(3)②中品红溶液,证明SO2有性。
(4)③中现象是______________________________________,证明SO2有性。
(5)④中现象是______________________________________,证明SO2有性。
硫和硫的氧化物题组一硫的存在与性质1.下列物质在一定条件下能够与硫黄发生反应,且硫作还原剂的是( )A.O2B.FeC.H2D.Zn答案 A解析硫是较活泼的非金属元素,能与许多金属、非金属发生反应。
硫与活泼非金属单质氧气反应时,表现出还原性;硫与金属单质、氢气等反应时,表现出氧化性;硫与变价金属反应时,一般生成低价金属的硫化物。
2.关于硫的叙述正确的是( )A.硫的非金属性较强,在自然界中只以化合态存在B.可用水溶解过滤分离硝酸钾和硫黄的混合物C.硫与金属或非金属反应时都作氧化剂D.硫的氧化性比氯气强答案 B解析硫在自然界中的存在形式既有化合态又有游离态;硝酸钾易溶于水,硫黄不溶于水,用水溶解过滤可分离二者的混合物;硫与金属、氢气等反应时作氧化剂,硫与氧气等反应时作还原剂;硫的氧化性比氯气弱(硫与铁反应生成硫化亚铁,氯气与铁反应生成氯化铁)。
3.常温下单质硫主要以S8形式存在。
加热时,S8会转化为S6、S4、S2等。
当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。
下列说法中正确的是( )A.S8转化为S6、S4、S2属于物理变化B.不论哪种硫分子,完全燃烧时都生成二氧化硫C.S2、S4、S6、S8都是硫元素形成的单质,为同种物质D.把硫单质在空气中加热到750℃即得S2答案 B解析硫单质之间的转化为化学变化,A不正确;不论哪种硫分子,完全燃烧的产物均为二氧化硫,B正确;S2、S4、S6、S8都是硫元素形成的单质,但是,构成分子的原子数不同,不是同种物质,C不正确;硫单质在空气中加热会燃烧生成二氧化硫,不可能与S2相互转化,D不正确。
题组二硫的氧化物4.(2019·扶余市一中期末)下列关于SO2变化和其相应性质对应关系不正确的是( )A.使品红溶液褪色——漂白性B.导致酸雨——酸性氧化物C.使高锰酸钾溶液褪色——漂白性D.通入H2S溶液中变浑浊——氧化性答案 C解析SO2具有漂白性,能使品红溶液褪色,但是不能漂白酸碱指示剂;SO2具有酸性氧化物的通性,能够与水反应生成亚硫酸,在空气中氧化为硫酸,随雨水落下形成酸雨;SO2具有还原性,能使高锰酸钾溶液褪色;SO2中的硫元素化合价处于+4价,具有弱氧化性,能氧化H2S:2H2S+SO2===3S↓+2H2O。