初中常见化合物
- 格式:doc
- 大小:26.00 KB
- 文档页数:2
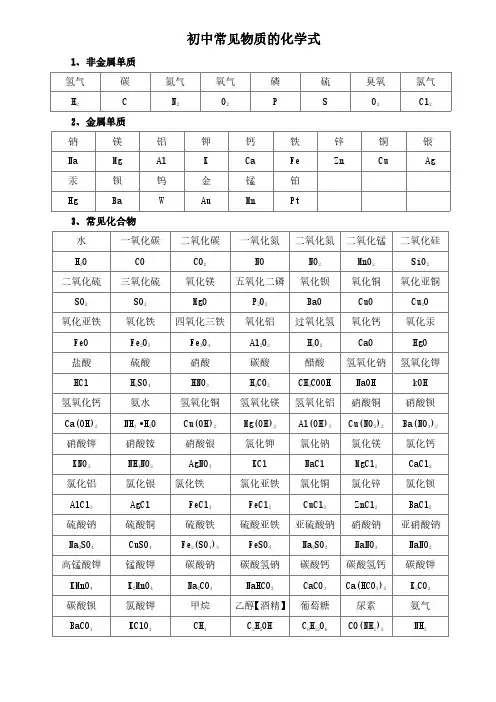
初中常见物质的化学式1、非金属单质氢气碳氮气氧气磷硫臭氧氯气H2C N2O2P S O3Cl22、金属单质钠镁铝钾钙铁锌铜银Na Mg Al K Ca Fe Zn Cu Ag 汞钡钨金锰铂Hg Ba W Au Mn Pt3、常见化合物水一氧化碳二氧化碳一氧化氮二氧化氮二氧化锰二氧化硅H2O CO CO2NO NO2MnO2SiO2二氧化硫三氧化硫氧化镁五氧化二磷氧化钡氧化铜氧化亚铜SO2SO3MgO P2O5BaO CuO Cu2O氧化亚铁氧化铁四氧化三铁氧化铝过氧化氢氧化钙氧化汞FeO Fe2O3Fe3O4Al2O3H2O2CaO HgO盐酸硫酸硝酸碳酸醋酸氢氧化钠氢氧化钾HCl H2SO4HNO3H2CO3CH3COOH NaOH kOH氢氧化钙氨水氢氧化铜氢氧化镁氢氧化铝硝酸铜硝酸钡Ca(OH)2NH3•H2O Cu(OH)2Mg(OH)2Al(OH)3Cu(NO3)2Ba(NO3)2硝酸钾硝酸铵硝酸银氯化钾氯化钠氯化镁氯化钙KNO3NH4NO3AgNO3KCl NaCl MgCl2CaCl2氯化铝氯化银氯化铁氯化亚铁氯化铜氯化锌氯化钡AlCl3AgCl FeCl3FeCl2CuCl2ZnCl2BaCl2硫酸钠硫酸铜硫酸铁硫酸亚铁亚硫酸钠硝酸钠亚硝酸钠Na2SO4CuSO4Fe2(SO4)3FeSO4Na2SO3NaNO3NaNO2高锰酸钾锰酸钾碳酸钠碳酸氢钠碳酸钙碳酸氢钙碳酸钾KMnO4K2MnO4Na2CO3NaHCO3CaCO3Ca(HCO3)2K2CO3碳酸钡氯酸钾甲烷乙醇【酒精】葡萄糖尿素氨气BaCO3KClO3CH4C2H5OH C6H12O6CO(NH2)2NH3。


初中化学基础知识梳理宋辉婵初中常见化合物化学式1、常见的酸:无氧酸:氢氯酸HCl(盐酸)氢硫酸H2S 氢氟酸HF含氧酸:硫酸H2SO4硝酸HNO3碳酸H2CO3氯酸HClO3磷酸H3PO4 亚硫酸H2SO3有机酸:乙酸(醋酸)CH3COOH2、常见碱的化学式:可溶性碱:氢氧化钾KOH 氢氧化钠NaOH 氢氧化钙Ca(OH)2 氢氧化钡Ba(OH) 2 氢氧化铵(氨水)NH3·H2O不溶性碱:氢氧化铜Cu(OH) 2 氢氧化亚铁Fe(OH) 2氢氧化镁Mg(OH) 2 氢氧化铝Al(OH) 33、常见盐的化学式:硝酸盐:硝酸钾KNO3 硝酸钠NaNO3 硝酸铵NH4 NO3硝酸铜Cu(NO3)2 硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3硝酸铝Al(NO3)3硝酸银Ag NO3硝酸镁Mg(NO3)2硝酸钙Ca(NO3)2 硝酸锌Zn(NO3)2硫酸盐:硫酸钠Na2SO4硫酸钾K2SO4硫酸铵(NH4)2 SO4硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硫酸铜CuSO4硫酸铝Al2(SO4)3硫酸锌ZnSO4硫酸镁Mg SO4硫酸钙CaSO4 硫酸钡BaSO4碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3 碳酸铵(NH4) 2 CO3碳酸铜CuCO3 碳酸钙CaCO3 碳酸钡BaCO3碳酸镁MgCO3碳酸锌ZnCO3 碳酸亚铁FeCO3盐酸盐:氯化钠NaCl氯化钾KCl 氯化铵NH4 Cl氯化钙CaCl2氯化钡BaCl2 氯化锌ZnCl2氯化铝AlCl3氯化铜CuCl2氯化铁FeCl3氯化亚铁FeCl2氯化镁MgCl2氯化银AgCl其他常用盐:高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3 碱式碳酸铜Cu2(OH) 2CO3 常用氧化物的化学式:金属氧化物:氧化铁Fe2O3 氧化亚铁FeO 四氧化三铁Fe3O4氧化铜CuO 氧化亚铜Cu2O 氧化铝Al2O3氧化镁MgO 氧化锌ZnO 氧化钙CaO 氧化钠Na2O非金属氧化物:氧化氢(水)H2O一氧化碳CO二氧化碳CO2二氧化硫SO2 三氧化硫SO3一氧化氮NO 二氧化氮NO2五氧化二氮N2O5 五氧化二磷P2O5过氧化物:过氧化氢H2O2 过氧化钠Na2O2 过氧化钙CaO2其他:甲烷:CH4 甲醇CH3OH 乙醇:C2H5OH有刺激性气味的气体:NH3SO2HCl有毒的气体:CO污染性气体:CO SO2NO2(空气中原有的成分都不是污染性气体)常见物质的主要成分及俗名物质及主要成分:石灰石、大理石、鸡蛋壳、水垢:CaCO3食盐:NaCl 食醋:CH3COOH 铁锈:Fe2O3天然气、沼气、瓦斯:CH4 草木灰:K2CO3水煤气:(H2、CO)煤气:CO 焦炉煤气:(CH4、H2、CO)福尔马林:30%--40%的甲醛溶液生理盐水:0.9%的NaCl溶液碱石灰:CaO和NaOH的混合物常见物质的俗名:干冰:固态CO2水银:Hg 火碱、烧碱、苛性钠:NaOH纯碱、碱面、苏打:Na2CO3 小苏打:NaHCO3熟石灰、消石灰、石灰水的溶质:Ca(OH)2胆矾、蓝矾:CuSO4·5H2O 绿矾:FeSO4·7H2O酒精:乙醇C2H5OH 醋酸:乙酸CH3COOH工业盐:亚硝酸钠NaNO2 工业酒精:CH3OH常见物质的颜色:1、白色固体: MgO P2O5KClO3 KCl NaCl Na2CO3 NaOH Ca(OH)2 CaO 无水CuSO4 纯铁镁带2、黑色固体:CuO Fe3O4 MnO2K2MnO4铁粉碳粉石墨3、红色固体: 红磷(P) Cu 铁锈(Fe2O3)4、黄色:硫磺(S)5、绿色:碱式碳酸铜Cu2(OH) 2CO36、紫黑色:KMnO4常见的有色离子:1、Cu2+:存在的溶液呈蓝色2、Fe2+:存在的溶液呈浅绿色3、Fe3+:存在的溶液呈棕黄色MnO4ˉ:存在的溶液呈紫红色常见沉淀及其颜色:白色沉淀:CaCO3 、BaCO3、BaSO4 、AgCl(不溶于稀硝酸)Mg(OH) 2 、Al(OH) 3蓝色沉淀:Cu(OH) 2 Cu CO3红褐色沉淀:Fe(OH) 3常见气体的检验O2:带火星的木条,观察其是否复燃CO2:澄清的石灰水,观察其是否变浑浊H2:燃着的木条,观察期是否产生淡蓝色火焰H2O:无水CuSO4粉末,观察其是否变蓝NH3:湿润的红色石蕊试纸,观察其是否变蓝常见干燥剂的选择1、浓硫酸:酸性干燥剂,不能用来干燥碱性气体。

初中化学知识点归纳常见化合物的性质和用途化学是一门研究物质的性质、组成、结构以及转化过程的科学。
在初中化学学习中,我们学习了很多常见的化合物,并对它们的性质和用途进行了总结。
本文将围绕这一主题展开,分别介绍常见化合物的性质和用途。
一、酸(Acid)酸是常见的化合物之一,常见的酸有硫酸、盐酸、硝酸等。
具有以下性质和用途:1. 酸的性质:- 酸味酸涩;- 酸能与碱发生酸碱中和反应,产生盐和水;- 酸具有导电性。
2. 酸的用途:- 许多酸被用于工业生产,如硫酸用于制造肥料和纺织品;- 酸被广泛用于实验室中,用于分析和调节溶液的pH值。
二、碱(Base)碱是另一个常见的化合物,常见的碱有氢氧化钠、氢氧化钾等。
具有以下性质和用途:- 碱具有苦味;- 碱能与酸发生酸碱中和反应,产生盐和水;- 碱具有腐蚀性。
2. 碱的用途:- 许多碱被用于清洁剂和肥皂的制造;- 碱也常被用于调节溶液的pH值。
三、盐(Salt)盐是由酸和碱中和而成的化合物,在我们的日常生活中非常常见。
具有以下性质和用途:1. 盐的性质:- 盐的味道通常是咸的;- 盐可以导电。
2. 盐的用途:- 盐被用于调味料,提高食物的口感;- 盐在化工产业中被广泛用作原料。
四、水(Water)水是生命之源,也是最常见的一种化合物。
具有以下性质和用途:- 水是无色、无味的液体;- 水具有良好的流动性和溶解性;- 水具有很高的比热容,可以吸收和释放热量。
2. 水的用途:- 水是人类生活和工业生产的基本需求;- 水被用于灌溉农田、发电和制造产品。
五、氧化物(Oxide)氧化物是氧与其他元素形成的化合物,常见的氧化物有二氧化碳、氧化铁等。
具有以下性质和用途:1. 氧化物的性质:- 不同的氧化物具有不同的性质,有些是固体,有些是气体;- 氧化物可以与水反应,形成酸或碱。
2. 氧化物的用途:- 二氧化碳被用于制造饮料和激发消防器材;- 氧化铁被用于制造磁铁和染料。
总结:通过对常见化合物的性质和用途进行归纳,我们可以更好地理解化学知识。

初中化学常见化合物知识总结化学是一门研究物质组成、结构、性质以及变化规律的科学。
在初中化学学习中,我们接触到了许多常见的化合物。
本文将对一些常见的化合物进行知识总结,旨在帮助初中学生更好地理解化学知识。
1. 水(H2O):水是生命之源,也是一种普遍存在的化合物。
水分子由两个氢原子和一个氧原子组成。
它具有高比热、高热导率和高表面张力等特性,使其在许多生活和工业应用中发挥重要作用。
2. 盐(NaCl):盐是一种常见的离子化合物。
盐可以通过饮食获取,也可以通过化学合成得到。
盐分子由一个钠离子和一个氯离子组成。
盐具有调味品的作用,同时在化学实验和工业生产中也有广泛的应用。
3. 酸(如盐酸、硫酸):酸是一类常见的化合物,其味道酸酸的。
酸可以与碱反应产生盐和水,这种反应被称为中和反应。
酸具有腐蚀性,并可以在化学实验和工业中用于溶解金属、清洁和消毒等方面。
4. 碱(如氢氧化钠):碱是与酸相对应的化合物,其味道苦。
碱可以中和酸,形成盐和水。
碱也具有腐蚀性,可用于清洁和除去腐蚀物等方面。
氢氧化钠是一种常见的碱,常用于肥皂制造和校准实验室酸度。
5. 二氧化碳(CO2):二氧化碳是一种常见的无机化合物,存在于大气中。
它是一种无色、无味、无毒的气体,常由燃烧或呼吸过程中产生。
二氧化碳是温室气体之一,过量排放会导致全球变暖和气候变化。
6. 氨(NH3):氨是一种常见的无机化合物,存在于氮肥中。
它是一种无色气体,具有刺激性气味。
氨具有碱性,可与酸发生中和反应。
氨在肥料中被植物吸收,起到促进植物生长的作用。
7. 酒精(乙醇,C2H5OH):酒精是一种常见的有机化合物,常见于酒类和洗手液中。
酒精具有挥发性和易燃性。
它在化学实验和医药领域中有广泛的应用,同时也是一种常见的毒品。
8. 糖类(如葡萄糖、果糖):糖类是一类常见的有机化合物,是身体能量的重要来源。
葡萄糖和果糖是常见的单糖,它们在体内可以通过新陈代谢产生能量。
糖类也是食物和饮料中的重要成分,提供甜味和能量。

初中化学常见化合物知识点整理在初中化学学习过程中,我们会接触到许多常见的化合物。
本文将对一些常见化合物的知识点进行整理,帮助读者更好地理解和记忆这些化合物的性质和用途。
1. 水(H2O):水是由氧元素和氢元素组成的化合物。
水是生命之源,是地球上最常见的物质之一。
它具有许多独特的性质,如极性溶剂、高比热和表面张力。
2. 盐酸(HCl):盐酸是一种无机酸,由氢元素和氯元素组成。
盐酸是一种强酸,常用于实验室中进行酸碱滴定实验。
它可以与碱中和生成盐和水。
3. 硫酸(H2SO4):硫酸是一种无机酸,由氢元素、硫元素和氧元素组成。
硫酸是一种强酸,广泛应用于工业生产和实验室中。
它具有腐蚀性,需要注意安全使用。
4. 氨气(NH3):氨气是一种无机化合物,由氮元素和氢元素组成。
它具有刺激性气味,可以与水反应生成氨水。
氨气在工业上被用作肥料和制冷剂。
5. 氧气(O2):氧气是一种无色、无味的气体,是空气中最常见的成分之一。
氧气是化石燃料燃烧和生物呼吸的重要来源。
它还可以被用于氧化反应和呼吸设备中。
6. 二氧化碳(CO2):二氧化碳是一种无色、无味的气体,由碳元素和氧元素组成。
它存在于空气中和许多碳酸饮料中。
二氧化碳在光合作用中起着重要的角色。
7. 硝酸(HNO3):硝酸是一种无机酸,由氢元素、氮元素和氧元素组成。
硝酸是强氧化剂,具有腐蚀性。
它广泛用于制造肥料、火药和炸药。
8. 氯化钠(NaCl):氯化钠是一种无机化合物,由钠元素和氯元素组成。
氯化钠是食盐的主要成分,也被广泛用于食品加工和化学实验中。
9. 硝酸铜(Cu(NO3)2):硝酸铜是一种无机化合物,由铜元素、氮元素和氧元素组成。
硝酸铜常用于实验中作为试剂,并在制备镀铜、颜料和染料方面发挥重要作用。
10. 乙醇(C2H5OH):乙醇是一种有机化合物,由碳元素、氢元素和氧元素组成。
乙醇是一种重要的溶剂和工业原料,在制备酒精饮料和消毒剂方面具有广泛应用。
以上是初中化学学习中常见的一些化合物的知识点整理。

初中常见化合物化学式
化学是一门研究物质结构、组成和性质的科学。
在研究化学过
程中,我们会遇到各种各样的化合物。
本文将介绍一些初中常见的
化合物以及它们的化学式。
盐类化合物
盐类化合物是由阳离子和阴离子组成的化合物。
常见的盐类化
合物有:
1. 氯化钠(NaCl):也被称为食盐,是一种晶体固体,呈白色
结晶。
2. 碳酸钠(Na2CO3):也被称为纯碱,常见于洗衣粉中,可
以中和酸性物质。
3. 硫酸铜(CuSO4):呈蓝色结晶,常用于制备其他铜化合物。
金属氧化物
金属氧化物由金属阳离子和氧阴离子组成。
以下是一些常见的
金属氧化物:
1. 氧化铁(Fe2O3):也被称为赤铁矿,呈红色固体,常见于
土壤和矿石中。
2. 氧化铝(Al2O3):也被称为氧化铝土,是铝的主要氧化物,常见于土壤和岩石中。
酸类化合物
酸类化合物含有H+离子,可以与碱发生中和反应。
以下是一
些常见的酸类化合物:
1. 硫酸(H2SO4):是一种无色液体,具有强酸性,常用于实
验室中。
2. 氢氯酸(HCl):也被称为盐酸,是一种无色气体,具有刺
激性气味,常用于清洗金属表面。
以上只是一些初中常见的化合物化学式。
在学习化学过程中,我们还会了解到更多种类的化合物和它们的化学式。
通过掌握这些化学式,我们可以更好地理解和应用化学知识。


初中化学常见化合物百科一、硫酸(H2SO4)硫酸,化学式H2SO4,是一种无色、无臭的液体。
它是常见的酸性化合物,常用于工业生产和实验室中。
硫酸是强酸,具有高腐蚀性和强氧化性。
硫酸的主要用途是作为化学反应的催化剂和溶剂。
它可以用来制造肥料、洗涤剂、染料和药物。
此外,硫酸还被广泛用于纺织工业、金属加工和石油炼制等领域。
在实验室中,硫酸常用于酸碱中和反应、酸性溶液的制备和酸性物质的检验。
它可以用来检测金属和非金属离子,以及硫酸盐的形成。
然而,由于硫酸具有高腐蚀性,使用时需要注意安全措施,避免与皮肤和眼睛接触。
二、水(H2O)水,分子式H2O,是地球上最常见的化合物之一。
它是无色、无味、无臭的液体,可以在自然界中以三种形态存在:固态、液态和气态。
水在生物体中具有重要的作用。
它是生物体内化学反应的介质,并参与许多生物过程,如新陈代谢、运输和溶解。
此外,水还能保持恒定的体温,起到调节环境温度的作用。
在化学反应中,水可以作为溶剂和反应物。
它具有较高的溶解度,能够溶解许多物质,使其形成溶液。
此外,水还可以通过蒸发和沸腾,帮助调节反应温度和平衡反应浓度。
三、二氧化碳(CO2)二氧化碳,化学式CO2,是一种无色、无味的气体。
它存在于大气中,也可以通过燃烧、呼吸和发酵等过程释放到环境中。
二氧化碳在自然界中起到重要的生态角色。
它是植物进行光合作用的原料之一,可以通过光合作用将二氧化碳转化为有机物质。
此外,二氧化碳还能吸收地球表面的热量,起到保持地球温暖的作用。
在实际应用中,二氧化碳有许多重要的用途。
它可以作为消防灭火剂、酒精饮料的气体克制剂和压缩空气的驱动剂。
此外,二氧化碳还被用于制造碳酸饮料、化工催化剂和植物栽培。
四、盐酸(HCl)盐酸,化学式HCl,是一种无色、有刺激性气味的液体。
它是一种强酸,可以溶解在水中。
盐酸在实验室和工业中具有广泛的应用。
盐酸主要用于酸碱反应和金属清洗。
在实验室中,它可以调节溶液的酸碱性,并用于酸化反应和产生气体的实验。

初中化学常见物质的化学式一、常见的单质:(一)金属单质:钾:K 钙:Ca 钠:Na 镁:Mg 铝:Al 锌:Zn 铁:Fe 锡:Sn 铅:Pb 铜:Cu 汞:Hg 银:Ag 铂:Pt 金:Au 钡:Ba 钨:W (二)非金属单质:碳:C 硫:S 磷:P硅:Si 碘:I2溴:Br2 氧气:O2氮气:N2氢气:H2氯气:Cl2(三)稀有气体单质:氦气:He 氖气:Ne 氩气:Ar 氪气:Kr 氙气:Xe二、常见的化合物:(一)氧化物:氧化钾:K2O 氧化钠:Na2O 氧化银:Ag2O 水:H2O氧化钙:CaO 氧化钡:BaO 氧化镁:MgO 氧化锌:ZnO 氧化铜;CuO 氧化铝:Al2O3二氧化锰:MnO2二氧化硅:SiO2五氧化二磷:P2O5一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2二氧化硫:SO2三氧化硫:SO3氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4(二)氯化物:氯化钾:KCl 氯化钠:NaCl 氯化银:AgCl 氯化氢;HCl氯化钙:CaCl2氯化钡:BaCl2氯化镁:MgCl2氯化锌:ZnCl2氯化铜:CuCl2 氯化铝:AlCl3氯化亚铁:FeCl2氯化铁:FeCl3(三)含原子团的化合物:硝酸:HNO3硫酸:H2SO4碳酸:H2CO3磷酸:H3PO4氢氧化钾:KOH 氢氧化钠:NaOH 氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2氢氧化镁:Mg(OH)2氢氧化铜:Cu(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3硝酸钾:KNO3硝酸钠:NaNO3硝酸钙:Ca(NO3)2硝酸钡:Ba(NO3)2硝酸镁:Mg(NO3)2硝酸铜:Cu(NO3)2硝酸铝:Al(NO3)3硝酸亚铁:Fe(NO3)2硝酸铁:Fe(NO3)3硫酸钾:K2SO4硫酸钠:Na2 SO4硫酸钙:Ca SO4硫酸钡:BaSO4硫酸镁:MgSO4硫酸铜:CuSO4硫酸铝:Al2 (SO4)3硫酸亚铁:FeSO4硫酸铁:Fe2 (SO4)3碳酸钾:K2CO3碳酸钠:Na2CO3碳酸钙:CaCO3碳酸钡:BaCO3碳酸镁:MgCO3碳酸铜:CuCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4)2SO4碳酸铵:(NH4)2CO3碳酸氢铵:NH4HCO3(四)其他化合物:氯酸钾:KClO3高锰酸钾:KMnO4锰酸钾:K2MnO4过氧化氢:H2O2氨气:NH3初中常用的化学方程式 一、物质与氧气的反应:1、硫燃烧:S+O 2====SO 22、碳燃烧:C+O 2====CO 23、磷燃烧:4P+5O 2====2P 2O 54、镁燃烧:2Mg+O 2====2MgO5、铁丝燃烧:3Fe+2O 2====Fe 3O 46、铝箔燃烧:4Al+3O 2====2Al 2O 37、氢气燃烧:2H 2+O 2====2H 2O8、汞加热:2Hg+O 2====2HgO 二、生成氧气的反应:1、过氧化氢制氧气:2H 2O 2 ===== 2H 2O+O 2↑2、高锰酸钾制氧气 : 2KMnO 4====K 2MnO 4+MnO 2+O 2↑3、氯酸钾制氧气: 2KClO 3===== 2KCl+3O 2↑4、电解水:2H 2O===== 2H 2↑+O 2↑5、氧化汞受热分解:2HgO====2Hg+O 2↑三、氢气的性质与制法:1、锌粒与稀硫酸反应:Zn+H 2SO 4====ZnSO 4+H 2↑2、氢气还原氧化铜:H 2+CuO====Cu+H 2O点燃点燃 点燃点燃 点燃点燃点燃 点燃MnO 2 △ MnO 2△通电 △△。
初中常见化学物质的俗称和用途一、硫酸:魔鬼酸硫酸是一种常见的无机酸,俗称为魔鬼酸。
它具有强烈的腐蚀性,对人体和物体都具有危害。
硫酸在工业中被广泛应用,用于制造肥料、染料、清洁剂等。
同时,硫酸还可以用作实验室中的试剂。
二、盐酸:鹰爪酸盐酸是一种常见的无机酸,俗称为鹰爪酸。
它具有强烈的腐蚀性,能与金属反应产生氢气。
盐酸在工业中被广泛应用,用于清洗金属表面、制造氯化物等。
同时,盐酸还可以用作实验室中的试剂。
三、氢氧化钠:苛性钠氢氧化钠是一种常见的无机碱,俗称为苛性钠。
它具有强烈的腐蚀性,能与酸反应产生盐和水。
氢氧化钠在工业中被广泛应用,用于制造肥皂、纸张、玻璃等。
同时,氢氧化钠还可以用作实验室中的试剂。
四、硝酸:燃料硝酸是一种常见的无机酸,具有强氧化性。
硝酸在工业中被广泛应用,用于制造炸药、肥料、染料等。
同时,硝酸还可以用作实验室中的试剂。
五、碳酸氢钠:小苏打碳酸氢钠是一种常见的无机盐,俗称为小苏打。
它具有中性化酸性物质的作用,在家庭中被广泛应用于调节酸碱度。
小苏打还可以用作食品加工中的膨松剂,使食品变得松软。
六、氯化钠:食盐氯化钠是一种常见的无机盐,俗称为食盐。
食盐是人类生活中必不可少的调味品,用于调味食物。
此外,食盐还在工业中被广泛应用,用于制造氯气、氢氧化钠等。
七、乙醇:酒精乙醇是一种常见的有机化合物,俗称为酒精。
酒精在家庭中被广泛应用于消毒、清洁等方面。
同时,酒精还是许多饮品和药品中的重要成分。
八、苯酚:碳酸苯酚是一种常见的有机化合物,俗称为碳酸。
碳酸在医药领域被广泛应用,用作杀菌消毒剂。
此外,碳酸还在工业中被用于制造染料、塑料等。
九、甲醛:福尔马林甲醛是一种常见的有机化合物,俗称为福尔马林。
福尔马林在医药领域被广泛应用,用作消毒剂和防腐剂。
此外,福尔马林还在工业中被用于制造树脂、涂料等。
十、硫化氢:臭鸡蛋气味硫化氢是一种常见的无机化合物,具有强烈的臭鸡蛋气味。
硫化氢在工业中被广泛应用,用于制造硫酸、染料等。
初中化学基础知识梳理 宋辉婵初中常见化合物化学式1、常见的酸:无氧酸:氢氯酸无氧酸:氢氯酸 HCl (盐酸)(盐酸) 氢硫酸氢硫酸 H 2S 氢氟酸氢氟酸 HF 含氧酸:硫酸含氧酸:硫酸 H 2SO 4 硝酸硝酸 HNO 3 碳酸碳酸 H 2CO 3 氯酸HClO 3磷酸磷酸 H 3PO 4 亚硫酸H 2SO 3 有机酸:乙酸(醋酸)CH 3COOH 2、常见碱的化学式:可溶性碱:氢氧化钾氢氧化钾 KOH 氢氧化钠氢氧化钠 NaOH 氢氧化钙氢氧化钙 Ca(OH)2 氢氧化钡氢氧化钡 Ba(OH) 2 氢氧化铵(氨水)NH 3·H 2O不溶性碱:氢氧化铜Cu (OH) 2 氢氧化亚铁Fe(OH) 2 氢氧化镁Mg(OH) 2 氢氧化铝Al(OH) 3 3、常见盐的化学式:硝酸盐:硝酸钾KNO 3 硝酸钠NaNO 3 硝酸铵硝酸铵 NH 4 NO 3 硝酸铜硝酸铜 Cu(NO 3)2 硝酸钡Ba(NO 3)2 硝酸铁Fe(NO 3)3硝酸铝Al(NO 3)3 硝酸银Ag NO 3 硝酸镁Mg(NO 3)2 硝酸钙Ca(NO 3)2 硝酸锌Zn(NO 3)2 硫酸盐:硫酸钠:硫酸钠 Na 2SO 4硫酸钾K 2SO 4硫酸铵(NH 4)2 SO 4 硫酸铁硫酸铁 Fe 2(SO 4)3硫酸亚铁FeSO 4硫酸铜CuSO 4 硫酸铝Al 2(SO 4)3硫酸锌ZnSO 4硫酸镁Mg SO4硫酸钙CaSO 4 硫酸钡BaSO 4 碳酸盐:碳酸钠Na 2CO 3 碳酸钾K 2CO 3 碳酸铵(NH 4) 2 CO 3 碳酸铜CuCO 3 碳酸钙CaCO 3 碳酸钡BaCO 3 碳酸镁MgCO 3 碳酸锌ZnCO 3 碳酸亚铁FeCO 3 盐酸盐:氯化钠:氯化钠 NaCl 氯化钾氯化钾 KCl 氯化铵NH 4 Cl 氯化钙CaCl 2 氯化钡BaCl 2 氯化锌ZnCl 2 氯化铝AlCl 3 氯化铜CuCl 2氯化铁FeCl 3 氯化亚铁FeCl 2 氯化镁MgCl 2 氯化银AgCl 其他常用盐:高锰酸钾高锰酸钾 KMnO 4 锰酸钾K 2MnO 4 氯酸钾KClO 3 碳酸氢钠NaHCO 3 碳酸氢铵NH 4HCO 3 碱式碳酸铜Cu 2(OH) 2CO 3 常用氧化物的化学式:金属氧化物:氧化铁金属氧化物:氧化铁 Fe 2O 3 氧化亚铁FeO 四氧化三铁Fe 3O 4 氧化铜CuO 氧化亚铜氧化亚铜 Cu 2O 氧化铝Al 2O 3 氧化镁MgO 氧化锌ZnO 氧化钙CaO 氧化钠Na 2O 非金属氧化物:氧化氢(水)H 2O 一氧化碳一氧化碳 CO 二氧化碳二氧化碳 CO 2 二氧化硫二氧化硫 SO 2 三氧化硫SO 3 一氧化氮一氧化氮 NO 二氧化氮NO 2 五氧化二氮N 2O 5 五氧化二磷P 2O 5过氧化物:过氧化氢过氧化物:过氧化氢 H 2O 2 过氧化钠Na 2O 2 过氧化钙CaO 2 其他:甲烷:CH 4 甲醇CH 3OH 乙醇:C 2H 5OH 有刺激性气味的气体:NH 3 SO 2 HCl 有毒的气体:CO 污染性气体:CO SO 2 NO 2(空气中原有的成分都不是污染性气体) 常见物质的主要成分及俗名 物质及主要成分:石灰石、大理石石灰石、大理石 、鸡蛋壳、、鸡蛋壳、 水垢:水垢: CaCO 3 食盐:NaCl 食醋:食醋: CH 3COOH 铁锈:Fe 2O 3 天然气、沼气、瓦斯:CH4 草木灰:K2CO3水煤气:(H2、CO)煤气:CO 焦炉煤气:(CH4、H2、CO)的甲醛溶液福尔马林:30%--40%的甲醛溶液溶液生理盐水:0.9%的NaCl溶液的混合物碱石灰:CaO和NaOH的混合物常见物质的俗名:干冰:固态CO2水银:Hg 火碱、烧碱、苛性钠:NaOH 纯碱、碱面、苏打:Na2CO3 小苏打:NaHCO3 熟石灰、消石灰、石灰水的溶质:Ca(OH)2 绿矾:FeSO4·7H2OO 绿矾:胆矾、蓝矾:CuSO4·5H2OOH 醋酸:乙酸醋酸:乙酸CH3COOH 酒精:乙醇C2H5OH工业酒精:CH CH3OH工业盐:亚硝酸钠NaNO2 工业酒精:工业酒精:常见物质的颜色:1、白色固体: MgO P2O5KClO3 KCl NaCl Na2CO3 NaOH Ca(OH)2 CaO 无水CuSO4 纯铁纯铁 镁带2、黑色固体:CuO Fe3O4 MnO2K2MnO4铁粉石墨铁粉 碳粉碳粉 石墨3、红色固体: 红磷(P) Cu 铁锈(Fe2O3)4、黄色:硫磺(S)5、绿色:碱式碳酸铜Cu2(OH) 2CO3 6、紫黑色:KMnO4 常见的有色离子:1、Cu2+:存在的溶液呈蓝色:存在的溶液呈蓝色2、Fe2+:存在的溶液呈浅绿色3、Fe 3+:存在的溶液呈棕黄色:存在的溶液呈棕黄色 MnO 4ˉ:存在的溶液呈紫红色:存在的溶液呈紫红色常见沉淀及其颜色:白色沉淀:CaCO 3 、BaCO 3 、BaSO 4 、 AgCl (不溶于稀硝酸)(不溶于稀硝酸) Mg(OH) 2 、 Al(OH) 3 蓝色沉淀:蓝色沉淀:Cu Cu (OH) 2 Cu CO 3 红褐色沉淀:红褐色沉淀:Fe Fe (OH) 3 常见气体的检验O 2:带火星的木条,观察其是否复燃:带火星的木条,观察其是否复燃 CO 2:澄清的石灰水,观察其是否变浑浊:澄清的石灰水,观察其是否变浑浊 H 2:燃着的木条,观察期是否产生淡蓝色火焰:燃着的木条,观察期是否产生淡蓝色火焰 H 2O:无水CuSO 4粉末,观察其是否变蓝粉末,观察其是否变蓝 NH 3:湿润的红色石蕊试纸,观察其是否变蓝湿润的红色石蕊试纸,观察其是否变蓝常见干燥剂的选择1、浓硫酸:酸性干燥剂,不能用来干燥碱性气体。
初中化学化合物大全
本文档收集了初中化学中常见的化合物及其性质。
以下是一些
常见的化合物。
碳酸盐类化合物
- 碳酸钠(Na2CO3):无色结晶体,可溶于水,呈碱性。
- 碳酸氢钠(NaHCO3):白色结晶体,可溶于水,呈弱碱性。
- 碳酸钙(CaCO3):白色结晶体,几乎不溶于水,是石灰石
的主要成分。
氯化物类化合物
- 氯化钠(NaCl):无色结晶体,可溶于水,呈中性。
- 氯化氢(HCl):无色气体,可溶于水,呈酸性。
- 氯化钙(CaCl2):白色结晶体,可溶于水,具有吸湿性。
水合物类化合物
- 蓝石(CuSO4·5H2O):蓝色结晶体,可溶于水,是一种普遍用于实验室的蓝色试剂。
- 明矾(Al2(SO4)3·18H2O):无色结晶体,可溶于水,常用于水处理和染料工业。
氧化物类化合物
- 二氧化碳(CO2):无色气体,不溶于水,是二氧化碳气体的主要成分。
- 二氧化硅(SiO2):白色结晶体,几乎不溶于水,是石英的主要成分。
以上只是初中化学中的一部分化合物,每种化合物都有其独特的性质和用途。
在研究化学的过程中,我们将更深入地研究这些化合物以及它们之间的反应和相互作用。
欢迎进一步探索和发现更多有趣的化学化合物!。
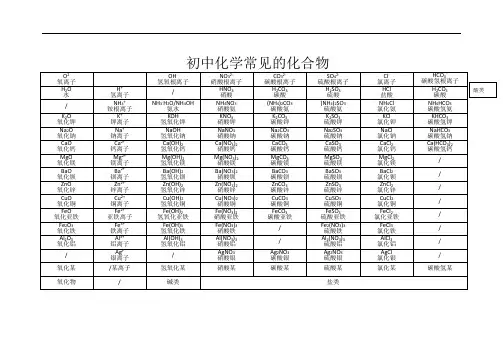
一、罕见单质二、化合物1、氧化物2、其他化合物3、罕见有机化合物一、氧气的性质:1. 镁在空气中燃烧:2Mg + O点燃 2MgO★2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 △ 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧:2H2 + O点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2点燃2P2O57. 硫粉在空气中燃烧: S + O点燃 SO28. 碳在氧气中充分燃烧: C + O点燃 CO29. 碳在氧气中不充分燃烧:2C + O点燃 2CO10. 一氧化碳在氧气中燃烧:2CO + O点燃 2CO211.玻义耳研究空气的成分实验 2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾:2KMnO4△ K2MnO4 + MnO2 + O2↑★13.氯酸钾和二氧化锰共热制取氧气2KClO2↑★14.过氧化氢二氧化锰催化剂条件下分解反应2H2O2MnO22H2O+ O2 ↑二、自然界中的水:★15.电解水(探究水的组成实验):2H2O 通电 2H2↑+ O2 ↑16.生石灰溶于水: CaO + H2O = Ca(OH)217.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:18.镁在空气中燃烧:2Mg + O2 点燃 2MgO★19.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu★20.氢气还原氧化铜:H2 + CuO △ Cu + H2O四、碳和碳的氧化物:21. 碳在氧气中充分燃烧:C + O点燃 CO2★22.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑23.焦炭还原氧化铁:3C+ 2Fe2O高温 4Fe + 3CO2↑24.煤炉的底层: C + O点燃CO225.煤炉的中层:CO2 + C 高温 2CO26.煤炉的上部蓝色火焰的发生:2CO + O点燃 2CO2★27.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑28.碳酸不稳定而分解:H2CO3 = H2O + CO2↑29.二氧化碳可溶于水: H2O + CO2=H2CO3★30.高温煅烧石灰石(工业制CO2):CaCO高温 CaO + CO2↑★31.石灰水与二氧化碳反应Ca(OH)2 + CO2 = CaCO3↓+ H2O★32.一氧化碳还原氧化铜:CO+ CuO △ Cu + CO2★33.一氧化碳的可燃性:2CO + O点燃 2CO2★34.碳酸钠与稀盐酸灭火器Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★35.甲烷在空气中燃烧:CH4 + 2O点燃 CO2 + 2H2O★36.酒精在空气中燃烧:C2H5OH + 3O点燃 2CO2 + 3H2O★37.氢气中空气中燃烧:2H2 + O点燃 2H2O六、金属38.镁在空气中燃烧: 2Mg + O点燃 2MgO39.铁在氧气中燃烧:3Fe + 2O点燃 Fe3O440. 铜在空气中受热:2Cu + O2 △ 2CuO41. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3★42. 锌和稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑★43. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑44. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑45. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑46. 锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑47. 铁和稀盐酸Fe + 2HCl =FeCl2 + H2↑48. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑49.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑★50. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu51. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu52. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg★53.金属铁的治炼原理:3CO+ 2Fe2O高温 4Fe + 3CO2↑七、酸、碱、盐★54. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O★55. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O56. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O57. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O★58.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O★59. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O 60. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O61. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★62.大理石与稀盐酸反CaCO3 +2HCl =CaCl2+H2O+CO2↑★63.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑64.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑★65. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl ★66.苛性钠流露在空气中蜕变:2NaOH + CO2 = Na2CO3 + H2O 67.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O 68.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O★69.消石灰放在空气中蜕变:Ca(OH)2 + CO2 = CaCO3↓+ H2O 70. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O★71. 铁和硫酸铜溶液(波尔多液不克不及用铁桶装):Fe + CuSO4 = FeSO4 + Cu★72.碳酸钠与稀盐酸检验NaOH蜕变 Na2CO3+2HCl=2NaCl+H2O+CO2↑★73. 碳酸氢钠与稀盐酸(小苏打治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑★74. 氢氧化钙与碳酸钠(检验NaOH蜕变):Ca(OH)2+Na2CO3=CaCO3↓+ 2NaOH★75.氯化钠和硝酸银(区别食盐和蒸馏水):NaCl + AgNO3 =AgCl↓ + NaNO3★76.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
一、常见单质一、氧气的性质:1. 镁在空气中燃烧:2Mg + O2点燃 2MgO★2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 △ 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧:S + O2点燃 SO28. 碳在氧气中充分燃烧: C + O2点燃 CO29. 碳在氧气中不充分燃烧:2C + O2点燃 2CO10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO211.玻义耳研究空气的成分实验2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾:2KMnO4△ K2MnO4 + MnO2 + O2↑2KCl+3O2↑★13.氯酸钾和二氧化锰共热制取氧气2KClO3MnO2△★14.过氧化氢二氧化锰催化剂条件下分解反应2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★15.电解水(探究水的组成实验):2H2O 通电 2H2↑+ O2 ↑16.生石灰溶于水: CaO + H2O = Ca(OH)217.二氧化碳可溶于水:H2O + CO2=H2CO3三、质量守恒定律:18.镁在空气中燃烧:2Mg + O2 点燃 2MgO★19.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu★20.氢气还原氧化铜:H2 + CuO △ Cu + H2O四、碳和碳的氧化物:21. 碳在氧气中充分燃烧: C + O2点燃 CO2★22.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑23.焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑24.煤炉的底层: C + O2点燃 CO225.煤炉的中层:CO2 + C 高温 2CO26.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2★27.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑28.碳酸不稳定而分解:H2CO3 = H2O + CO2↑29.二氧化碳可溶于水: H2O + CO2=H2CO3):CaCO3高温 CaO + CO2↑★30.高温煅烧石灰石(工业制CO2★31.石灰水与二氧化碳反应Ca(OH)2 + CO2 = CaCO3↓+ H2O★32.一氧化碳还原氧化铜:CO+ CuO △ Cu + CO2★33.一氧化碳的可燃性:2CO + O2点燃 2CO2★34.碳酸钠与稀盐酸灭火器Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★35.甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O★36.酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O★37.氢气中空气中燃烧:2H2 + O2点燃 2H2O六、金属38.镁在空气中燃烧: 2Mg + O2点燃 2MgO39.铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O440. 铜在空气中受热:2Cu + O2 △ 2CuO41. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3★42. 锌和稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑★43. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑44. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑45. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑46. 锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑47. 铁和稀盐酸Fe + 2HCl =FeCl2 + H2↑48. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑49.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑★50. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu51. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu52. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg ★53.金属铁的治炼原理:3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐★54. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O★55. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O 56. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O57. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O★58.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O★59. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O60. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O61. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★62.大理石与稀盐酸反CaCO3 +2HCl =CaCl2+H2O+CO2↑★63.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑64.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑★65. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl★66.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O67.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O68.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O★69.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O70. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O★71. 铁和硫酸铜溶液(波尔多液不能用铁桶装):Fe + CuSO4 = FeSO4 + Cu ★72.碳酸钠与稀盐酸检验NaOH变质Na2CO3+2HCl=2NaCl+H2O+CO2↑★73. 碳酸氢钠与稀盐酸(小苏打治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑★74. 氢氧化钙与碳酸钠(检验NaOH变质):Ca(OH)2+Na2CO3=CaCO3↓+ 2NaOH ★75.氯化钠和硝酸银(区别食盐和蒸馏水):NaCl + AgNO3 =AgCl↓ + NaNO3★76.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
纯碱、苏打、天然碱、口碱:Na2CO3
小苏打:NaHCO3
大苏打:Na2S2O3
石膏(生石膏):CaSO4.2H2O
熟石膏:2CaSO4·.H2O
莹石:CaF2
重晶石:BaSO4(无毒)
碳铵:NH4HCO3
石灰石、大理石:CaCO3
生石灰:CaO
食盐:NaCl
熟石灰、消石灰:Ca(OH)2
芒硝:Na2SO4·7H2O (缓泻剂)
烧碱、火碱、苛性钠:NaOH
绿矾:FaSO4·7H2O
干冰:CO2
明矾:KAl (SO4)2·12H2O
漂白粉:Ca (ClO)2、CaCl2(混和物)
泻盐:MgSO4·7H2O
胆矾、蓝矾:CuSO4·5H2O
双氧水:H2O2
皓矾:ZnSO4·7H2O
硅石、石英:SiO2
刚玉:Al2O3
水玻璃、泡花碱、矿物胶:Na2SiO3
铁红、铁矿:Fe2O3
磁铁矿:Fe3O4
黄铁矿、硫铁矿:FeS2
铜绿、孔雀石:Cu2 (OH)2CO3
菱铁矿:FeCO3
赤铜矿:Cu2O
波尔多液:Ca (OH)2和CuSO4
石硫合剂:Ca (OH)2和S
玻璃的主要成分:Na2SiO3、CaSiO3、SiO2
过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4
重过磷酸钙(主要成分):Ca (H2PO4)2
天然气、沼气、坑气(主要成分):CH4
水煤气:CO和H2
硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体
王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2
氯仿:CHCl3电石:CaC2
电石气:C2H2 (乙炔)
TNT:三硝基甲苯
酒精、乙醇:C2H5OH
氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
醋酸:冰醋酸、食醋CH3COOH
裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
甘油、丙三醇:C3H8O3
焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。
石炭酸:苯酚
蚁醛:甲醛HCHO
福尔马林:35%—40%的甲醛水溶液
蚁酸:甲酸HCOOH
葡萄糖:C6H12O6
果糖:C6H12O6
蔗糖:C12H22O11
麦芽糖:C12H22O11
淀粉:(C6H10O5)n
硬脂酸:C17H35COOH
油酸:C17H33COOH
软脂酸:C15H31COOH
草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。