17夯实十七 平衡标志
- 格式:doc
- 大小:37.50 KB
- 文档页数:2


化学平衡的特征与平衡标志一、化学平衡的概念:在一定的条件的可逆反应,当正反应速率和逆反应速率相等的时候,反应混合物各组分的浓度保持不变的状态,就叫化学平衡状态。
二、化学平衡的特征:1、逆:化学平衡体系适用于可逆反应。
可逆反应指的是在相同条件下,既可以向正反应方向进行,又可以向逆反应方向进行的反应。
可逆反应的最大特征是反应物的转化率不能达到100%。
2、等:化学平衡体系中,同一种物质的正反应速率与逆反应速率相等。
同一种物质正逆反应速率相等,是化学平衡的本质和标志之一。
3、定:可逆反应达到平衡状态时,各组分的浓度和百分含量保持不变。
反应各组分的浓度和百分含量保持不变也是化学平衡状态的标志之一。
4、动:在化学平衡体系中,虽然同一种物质的正逆反应速率相等,但正逆反应速率并不等于0。
即υ正 =υ逆 ≠0。
或者说,化学平衡状态是一个动态平衡状态。
5、变:当条件发生改变,化学平衡状态就可能发生改变,从一个旧的平衡状态就可以转变成一个新的平衡状态。
三、化学平衡的图像如图,代表一个从正反应开始的可逆反应的反应速率与时间的关系图。
随逆反应速率逐渐增加,在t 1时刻,正逆反应速率相等,该反应就达到平衡状态,各组分的浓度和百分含量保持 不变。
四、化学平衡的标志1、等的标志:同一种物质正逆反应速率相等,是可逆反应达到平衡状态的根本原因,是 的本质,是化学平衡的根本标志。
2、定的标志:各组分的浓度和百分含量保持不变,是同一种物质正逆反应速率相等引起必 然结果,也是化学平衡状态的显着标志。
一切基于同一种物质正逆反应速率相等和反应混合物浓度一定的说法和现象都可以列入 可逆反应达到平衡的标志。
五、强化练习1、在一个可逆反应中:2SO 2+O 2催化剂 加热 2SO 3 ,向容器中加入18O 2,达到平衡后,存在的18O 物质的说法正确的是( )A 、只有O 2B 、只有O 2、SO 3C 、只有O 2、SO 2中都有D 、SO 2、O 2、SO 3中都有2、在一个可逆反应CH 3COOH +CH 3CH 2OH CH 3COOCH 2CH 3+H 2O 中,向反应混合物中加入H 218O 后,重新达到平衡后,反应混合物中存在18O 的说法正确的是( )A 、只有H 2OB 、只有H 2O 、CH 3COOHC 、只有H 2O 、CH 3CH 2OHD 、CH 3COOH 、CH 3CH 2OH 、CH 3COOCH 2CH 3和H 2O 中都有3、在一定温度下,反应 A 2(气)+B 2(气) 2AB(气) 达到平衡的标志是( )A 、单位时间生成n 摩尔的A 2同时生成n 摩尔的ABB 、容器内的总压不随时间变化C 、单位时间生成2n 摩尔的AB 同时生成n 摩尔的B 2D 、单位时间生成n 摩尔的A 2同时生成n 摩尔的B 24、在一定温度下,可逆反应 达到平衡的标志是( )A 、C 生成速度与C 分解的速度相等B 、单位时间内生成nmolA ,同时生成3nmolBC 、A 、B 、C 的物质的量浓度为一个常数D 、A 、B 、C 的分子数比为1︰3︰25、一定温度下,向a L 密闭容器中加入1mol X 气体和2 mol Y 气体,发生如下反应: X (g )+2Y (g )2Z (g ),此反应达到平衡的标志是( )A 、 容器内压强不随时间变化B 、 容器内各物质的浓度不随时间变化C 、 容器内X 、Y 、Z 的浓度之比为1︰2︰2D 、 单位时间消耗0.1mol X 同时生成0.2mol Z6、下列叙述中能肯定某一可逆反应达到平衡状态的是( )A 、某固体物质的浓度没有改变B 、正逆反应的速率相等C 、各物质的浓度之比等于方程式中化学计量系数之比D 、用各物质表示的反应速率之比等于其化学计量系数之比7、对于可逆反应 H 2 (g)+I 2 (g) 2HI (g),能说明反应达到平衡的标志是( )A 、C(H 2)=C(I 2)=C(HI)B 、C(H 2):C(I 2):C(HI)=1:1:2C 、单位时间内生成n molH 2的同时生成了n molI 2D 、温度和体积一定时,混合气体的颜色不再变化8、将一定量的SO 2和O 2放入一定体积的密闭容器中,550℃,在催化剂的条件下发生反应: 2SO 2+O 2 催化剂 加热 2SO 3 ,能说明该反应达到平衡的标志是( )A 、SO 2和SO 3的浓度相等B 、SO 2的生成速率与SO 2的消耗速率相等C 、容器中的混合气体的密度保持不变D 、SO 2的反应速率是O 2的反应速率的两倍9、一定温度一定体积的密闭容器进行如下可逆反应 N 2+3H 22NH 3 ,能说明反应达到平 衡的是( )A 、1个N N 键断裂的同时,有3个H —H 形成B 、1个N N 键断裂的同时,有3个H —H 断裂C 、1个N N 键断裂的同时,有3个N —H 断裂D 、1个N N 键断裂的同时,有6个N —H 形成10、已知:2SO 2(g)+O 2(g) 催化剂加热 2SO 3 (g) △H=—QkJ·mol -1 .现将1molSO 2气体和1molO 2在一个密闭容器中,进行和上述条件下的反应,充分反应后测得放出热量为Q 2KJ ,则Q 2和Q 的关系是( )A 、Q 2=12 QB 、Q 2<12 QC 、 B 、Q 2>12 QD 、B 、Q 2=Q。

课时教学方案总第课时本节第课时难忘的小诗教学目标知识与技能1、会认,会写本课的12个生字;2、能借助词典理解生词。
过程与方法利用多媒体课件辅助教学,激发学生兴趣。
情感态度与价值观引导学生懂得同学之间要友好相处,相亲相爱,与人相处应规范自己行为。
重点、难点重点:掌握本课12个生字。
难点:理解课文意义。
教法与学法教法:质疑、引导、点拨。
学法:自读自悟,合作探究。
教学准备多媒体课件教学过程一、导入新课。
同学们,这一课,我们来学习一个与著名教育家陶行知爷爷有关的故事。
二、自读课文1、提示:请同学们自己读课文,看谁能弄清楚下面的问题:(1)课文为什么样要以“难忘的小诗”为题目?为了一件什么事?(2)朗读小诗以后,“我们”的心里觉得怎么样?(3)最后结果怎样?2、学生自读。
3、把生字的字音读准,用最好的办法识记字形。
三、检查识字情况,老师相机指导难忘、但是、难免、骂人、注视、不甘示弱,朗读四、再读课文1、要求巩固生字读音,联系上下文理解词义2、注意故事情节是怎么样发展的?五、注意结构、整体把握课文从哪到哪写的是“争吵”?六、学习第1、2自然段1、学生轻声朗读课文,要求根据人物的情绪读出相应的语气。
2、指名读、齐读、男女生赛读。
3、小结:这两自然段写了陶校长处理小磨擦自有办法,到两位同学发生争吵,为后面两首小诗的出现打下埋伏。
七、巩固生字。
重点提示字形中容易写错的地方。
第二课时教学目标知识与技能1、指导学生读懂课文。
2、指导学生尝试自编小诗过程与方法利用多媒体课件辅助教学,激发学生兴趣。
情感态度与价值观引导学生懂得同学之间要友好相处,相亲相爱,与人相处应规范自己行为。
重点、难点重点:仿写句子。
难点:理解课文内容。
教法与学法教法:质疑、引导、点拨。
学法:自读自悟,合作探究。
教学准备多媒体课件教学过程一、复习生字二、读讲课文1、学习第3—6自然段课文(1)发生争吵以后,陶行知校长是怎样做的?(2)下面请你们自己轻声朗读第3—5自然段。


化学平衡的标志和判断长乐高级中学 黄炳生化学平衡状态的判断:具体表现为“一等六定”:一等:正逆反应速率相等;六定:① 物质的量一定,② 平衡浓度一定,③ 百分含量保持一定,④ 反应的转化率一定,⑤ 产物的产率一定,⑥ 正反应和逆反应速率一定。
除了上述的“一等六定”外,还可考虑以下几点:①同一物质单位时间内的消耗量与生成量相等。
②不同物质间消耗物质的量与生成物质的量之比符合化学方程式中各物质的化学计量数比。
③在一定的条件下,反应物的转化率最大,或产物的产率最大。
④对于有颜色变化的可逆反应,颜色不再改变时。
对于反应前后气体总体积变的可逆反应,还可考虑以下几点:①反应混合物的平均相对分子量不再改变。
②反应混合物的密度不再改变。
③反应混合物的压强不再改变。
还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态。
1、等速标志:指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等。
即 V (正)= V (逆)2、各组分浓度不变标志:因为V (正)= V (逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量。
总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变。
3.有气体参与的可逆反应:(1)从反应混合气体的平均相对分子质量(M )考虑:M=m(总)/n(总)①若各物质均为气体:当气体△n(g)≠0时,若M 一定时,则标志达平衡。
如2SO 2(g)+O 2(g)2SO 3(g)当气体△n(g)=0时,若M 为恒值,无法判断是否平衡。
如H 2(g)+I 2(g)2HI(g) ②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M 一定时,则标志达平衡。
如C(s)+O 2(g) CO 2(g)、CO 2(g)+ C(s) 2CO(g)(2)从气体密度考虑:密度=质量/体积①若各物质均为气体:A.恒容:密度总为恒值,不能作为平衡标志。
化学平衡的标志和判断长乐高级中学黄炳生化学平衡状态的判断:具体表现为“一等六定”:一等:正逆反应速率相等;六定:①物质的量一定,②平衡浓度一定,③百分含量保持一定,④反应的转化率一定,⑤产物的产率一定,⑥正反应和逆反应速率一定。
除了上述的“一等六定”外,还可考虑以下几点:①同一物质单位时间内的消耗量与生成量相等。
②不同物质间消耗物质的量与生成物质的量之比符合化学方程式中各物质的化学计量数比。
③在一定的条件下,反应物的转化率最大,或产物的产率最大。
④对于有颜色变化的可逆反应,颜色不再改变时。
对于反应前后气体总体积变的可逆反应,还可考虑以下几点:①反应混合物的平均相对分子量不再改变。
②反应混合物的密度不再改变。
③反应混合物的压强不再改变。
还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态。
1、等速标志:指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等。
即V(正)= V(逆)2、各组分浓度不变标志:因为V(正)= V(逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量。
总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变。
3.有气体参与的可逆反应:(1)从反应混合气体的平均相对分子质量(M)考虑:M=m(总)/n(总)①若各物质均为气体:当气体△n(g)≠0时,若M一定时,则标志达平衡。
如2SO2(g)+O2(g)2SO3(g)当气体△n(g)=0时,若M为恒值,无法判断是否平衡。
如H2(g)+I2(g)2HI(g)②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M一定时,则标志达平衡。
如C(s)+O2(g)CO2(g)、CO2(g)+ C(s)2CO(g)(2)从气体密度考虑:密度=质量/体积①若各物质均为气体:A.恒容:密度总为恒值,不能作为平衡标志。
B.恒压:a. △n(g)=0时,密度总为恒值,不能作为平衡标志。
可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。
(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(正) =v(逆)。
(3)“动”:v(正) =v(逆) ≠0(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
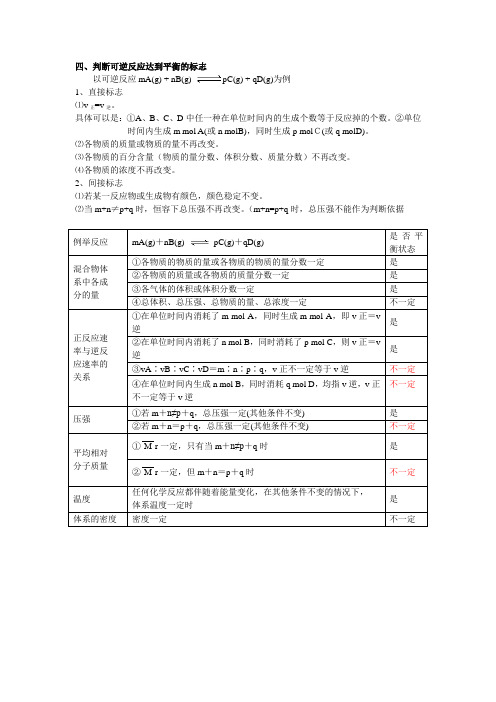
可逆反应达到平衡状态的标志及判断方法如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m : p;②反应体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+ n≠p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:m A(g) + n B(g) p C(g)+ q D(g)是否达到平衡还可以归纳如下表:化学反应m A(g) + n B(g) p C(g)+ q D(g)是否平衡混合物体系中各成分的含量①各物质的物质的量或物质的质量分数一定平衡②各物质的质量或质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压强、总物质的量一定不一定平衡正、逆反应速率之间的关系①在单位时间内消耗了m mol A,同时也生成了m molA,即v(正) = v(逆)平衡②在单位时间内消耗了n mol B,同时也消耗了p molC,即v(正) =v(逆)平衡③v(A) : v(B) : v(C) : v(D) =m : n : p : q,v(正) 不一定等于v(逆)不一定平衡④在单位时间内生成了n mol B,同时也消耗了q mol不一定平衡D,即叙述的都是v(逆)压强①其它条件一定、总压强一定,且m + n≠p + q平衡②其它条件一定、总压强一定,且m + n=p + q不一定平衡混合气体的平均相对分子质量①平均相对分子质量一定,且m + n≠p + q平衡②平均相对分子质量一定,且m + n=p + q不一定平衡温度任何化学反应都伴随着能量变化,当体系温度一定时平衡气体的密度密度一定不一定平衡颜色反应体系内有色物质的颜色稳定不变平衡三、例题分析:【例题1】可逆反应:2NO2(g) 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V ≠ 0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V ≠ 0,能说明该反应达到平衡。
夯实十七平衡标志
1、在恒温下的密闭容器中,有可逆反应2NO(气)+O2(气)⇌2NO2(气),不能说明已达到平衡状态的是()
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变
D.混合气体平均分子量保持不变
2、下列说法中,可以证明反应N
2+3H2 2NH3已达到平衡状态的标志是()
A.1 mol N≡N键断裂的同时,有3mol H-H键生成
B.1 mol N≡N键断裂的同时,有3mol H-H键断裂
C.1 mol N≡N键断裂的同时,有6mol H-H键断裂
D.1 mol N≡N键断裂的同时,有6mol H-H键生成
3、可逆反应N2+3H2⇌2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反应已达到平衡状态的是()
A.3v正(N2)=v正(H2)B.v正(N2)=v正(NH3)
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
4、在2NO2(红棕色)⇌N2O4(无色)的可逆反应中,下列状态说明达到平衡标志
的是
A.c(N2O4)=c(NO2)的状态
B.N2O4处于不再分解的状态
C.NO2的分子数与N2O4分子数比为2∶1的状态
D.体系的颜色不再发生改变的状态
5、可逆反应 H2 (气)+I2 (气)=2HI (气)达到平衡时的标志是()
A.混合气体的密度恒定不变 B.混合气体的颜色不再改变√
C. H2 、I2 、 HI的浓度相等
D. I2在混合气体中体积分数不再改变√
6、在一定的温度下,固定容器中发生可逆反应A(g)+ 3B(g) ⇌2C(g)达到平衡的标志是
A. C的生成速率与C的分解速率相等√
B. 单位时间生成n molA,同时生成3n molB
C. A、B、C的物质的量浓度保持不变√
D. A、B、C的分子数之比为1 :3 :2
E. 容器中气体的密度保持不变
F. 混合气体的平均摩尔质量保持不变√
G. 容器中气体的总压强保持不变√
7、在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的
A. A(气)+B(气) ⇌C(气) √
B. A(气)+2B(气) ⇌3C(气)
C. A(气)+B(气) ⇌C(气)+D(气)
D. 以上都达到平衡
8、能够充分说明在恒温下的密闭容器中反应:2SO2+O2⇌2SO3,已经达到平衡的标志是
A、容器中SO2、O2、SO3共存
B、容器中SO2和SO3的浓度相同
C、容器中SO2、O2、SO3的物质的量为2:1:2
D、容器中压强不随时间的变化而改变√
9、下列说法中可以充分说明反应: P(气)+Q(气) ⇌ R(气)+S(气) , 在恒温下已达平衡状态的是()
A. 反应容器内压强不随时间变化
B. P和S的生成速率相等√
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
10、在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应:
A(s)+3B(g) ⇌2C(g)+D(g) 已达平衡状态的是
A.混合气体的压强√
B. 混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量√
11、下列方法中可以证明 2HI(g)⇌H2(g)+I2(g)已达平衡状态的是__________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有两个 H—I键断裂√;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)=v(HI)/2时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化; √
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化; √
⑩温度和压强一定时,混合气体的密度不再变化。。