同系物和同分异构体
- 格式:doc
- 大小:1.01 MB
- 文档页数:16


一.同系物1.定义:通式相同,结构相似,在分子组成上相差一个或若干个“CH2”原子团的有机物。
2.判断要领:(1)结构相似,对有官能团的有机物来说,必须官能团的种类和数目都相同,例如:满足通式C n H2n+2O的饱和一元醇CH3OH, CH3 CH2OH,CH3 CH2 CH2OH互为同系物,但是CH3 CH2OH和乙二醇,丙三醇不是同系物,因为虽然它们的官能团相同都是羟基,但是羟基的数目不同,同样道理,CH3CH2Br和CH3—CHBr—CH2Br 不是同系物,CH3CH2Br和CH3CH2CL也不是同系物。
(2)同系物在分子组成上相差一个或若干个“CH2”原子团,那么同系物之间不存在同分异构体,同分异构体不可能是同系物。
3.同系物规律:(1)同系物随着碳原子数的增加,相对分子质量逐渐增大,分子间作用力逐渐增大,物质的熔沸点逐渐升高。
(2)同系物的化学性质一般相似。
( 3 )碳原子数不同的烷烃一定属于互为同系物的关系。
因为其没有类别异构例一下列各对物质,互为同系物的是()A. CH—CH===CH2和B.—OH和—CH2OH3C.CHCOOCH3和CH3 CH2COOCH3D.CH3CH2Br和CH3—CHBr—CH2Br3E.CH===CH2和环丁烷 F.戊烷和十七烷2例二下列说法中,正确的是()A.烯烃和烷烃的命名方法B.同系物之间各元素的质量分数一定相同C.不同碳原子数的烷烃一定属于互为同系物的关系D.具有相同分子通式的不同有机物一定属于同系物二.同分异构体1.定义.:具有相同的分子式,但具有不同结构的化合物,中学阶段主要研究有机物的同分异构体。
2.互为同分异构体的必备条件有二:①化合物分子式相同②化合物结构不同(如碳链骨架不同,官能团的位置不同,官能团的种类不同)3. 中学阶段要求掌握的异构方式有三种,即碳链异构,位置不同,官能团异构又叫类别异构)4.有机物还有立体异构。
常见的立体异构现象有顺反异构和对映异构,顺-2-丁烯和反-2-丁烯是顺反异构体。
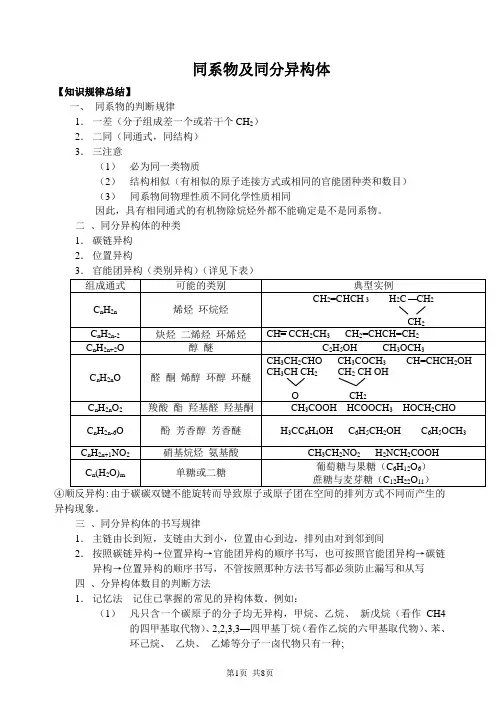
同系物及同分异构体【知识规律总结】一、同系物的判断规律1.一差(分子组成差一个或若干个CH2)2.二同(同通式,同结构)3.三注意(1)必为同一类物质(2)结构相似(有相似的原子连接方式或相同的官能团种类和数目)(3)同系物间物理性质不同化学性质相同因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。
二、同分异构体的种类1.碳链异构2.位置异构异构现象。
三、同分异构体的书写规律1.主链由长到短,支链由大到小,位置由心到边,排列由对到邻到间2.按照碳链异构→位置异构→官能团异构的顺序书写,也可按照官能团异构→碳链异构→位置异构的顺序书写,不管按照那种方法书写都必须防止漏写和从写四、分异构体数目的判断方法1.记忆法记住已掌握的常见的异构体数。
例如:(1)凡只含一个碳原子的分子均无异构,甲烷、乙烷、新戊烷(看作CH4的四甲基取代物)、2,2,3,3—四甲基丁烷(看作乙烷的六甲基取代物)、苯、环己烷、乙炔、乙烯等分子一卤代物只有一种;(2) 丁烷、丁炔、丙基、丙醇有2种; (3) 戊烷、丁烯、戊炔有3种; (4) 丁基、苯的同系物C 8H 10有4种; (5) 己烷、C 7H 8O (含苯环)有5种; (6) 戊基、苯的同系物C 9H 12有8种;2. 基元法这里的一元取代基X ,可以是原子,如卤原子,也可以是原子团,如-OH 、-CHO 、-COOH 、HCOO-等。
因此,已知丁基-C 4H 9有四种,则可断定丁醇、戊醛、戊酸以及甲酸丁酯都有4种异构体。
分子式为C 11H 16的一烷基取代苯的同分异体共有 ____ 种{说明}常可根据某些烃存在的一元取代物数目,反推原烃分子结构式。
如含碳原数少于10的烷烃中,其中一卤代物不存在异构体的有 4 种。
又如,已知烯烃C 6H 12的一氯代物只有一种,则可断定该烯烃的分子结构为3. 替元法 例如:C 6H 4Cl 2624H 替代Cl);[练已知A 的结构为A 的n 溴代物与m 溴代物的异构体数目相同,则n 和m 必满足关系式 ______4. 对称法(又称等效氢法) 判断方法如下:(1) 同一C 原子上的氢原子是等效(2) 同一C 原子所连甲基上的氢原子是等效氯(3) 处于镜面对称位置上的氢原子是等效 5.定一移一例:一氯蒽有 种同分异构体,二氯蒽有 种同分异构体。


同系物与同分异构体一、同系物1.概念:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
结构相似是指必须是同类物质,即有机物官能团的种类和个数要相同;组成上相差一个或若干个CH2原子团是指其通式必须相同。
只有同时具备二条件的有机物才互为同系物。
2.同系物的判断方法判断有机物是否是同系物需要注意以下三点:a、同系物必须符合同一通式,但通式相同的不一定是同系物,如有机物的同分异构体均不是同系物。
b、同系物结构一定相似,但结构相似的不一定是同系物,如有机物的碳链异构和位置异构体。
c、同系物的分子组成上相差一个或若干个“CH2”原子团,例如苯酚与苯甲醇在分子组成上相差一个“CH2”原子团,但它们不是同一类物质,所以也不是同系物。
二、同分异构现象及同分异构体1.概念:具有相同的分子式而又具有不同结构的化合物互称为同分异构体。
2.同分异构体的特点:(1)同分异构体具有相同的分子式、相同的最简式、相同的式量和相同的元素组成。
分子式相同是前提条件。
(2)结构不同指的是:①碳链骨架不同;②官能团在碳链上的位置不同;③官能团的种类不同。
同分异构体也存在于无机物和有机物之间,无机物与无机物之间(了解即可)。
如:尿素CO(NH2)2和氰酸铵NH4CNO互为同分异构体。
3.同分异构体的书写同分异构体的书写通常是按碳链异构→位置异构→类别异构的顺序书写,若不按一定的顺序书写容易漏写和重写,如写分子式为C5H10的同分异构体。
⑴碳链异构:①CH2==CHCH2CH2CH31—戊烯②CH2==C(CH3)CH2CH32—甲基—1—丁烯③CH2==CHCH(CH3)CH33—甲基—1—丁烯⑵位置异构:①CH3CH==CHCH2CH32—戊烯②(CH3)2C==CHCH32—甲基—2—丁烯⑶类别异构:①环戊烷②甲基环丁烷③1,1—二甲基环丙烷④1,2—二甲基环丙烷⑤乙基环丙烷碳链异构3种,位置异构2种,类别异构5种,总共十种。

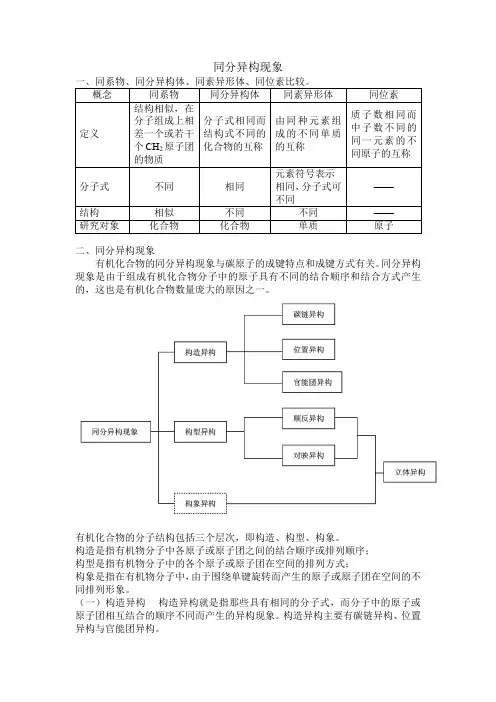
同分异构现象二、同分异构现象有机化合物的同分异构现象与碳原子的成键特点和成键方式有关。
同分异构现象是由于组成有机化合物分子中的原子具有不同的结合顺序和结合方式产生的,这也是有机化合物数量庞大的原因之一。
有机化合物的分子结构包括三个层次,即构造、构型、构象。
构造是指有机物分子中各原子或原子团之间的结合顺序或排列顺序;构型是指有机物分子中的各个原子或原子团在空间的排列方式;构象是指在有机物分子中,由于围绕单键旋转而产生的原子或原子团在空间的不同排列形象。
(一)构造异构构造异构就是指那些具有相同的分子式,而分子中的原子或原子团相互结合的顺序不同而产生的异构现象。
构造异构主要有碳链异构、位置异构与官能团异构。
①碳链异构由于碳链骨架不同而产生的异构现象。
例如:与环己烷甲基环戊烷②位置异构由于取代基或官能团在碳链或碳环上的位置不同而产生的异构现象。
例如:CH3CH2CH2CH2OH 与CH3CH2CHCH3OH1-丁醇 2-丁醇邻溴甲苯间溴甲苯对溴甲苯或2-溴甲苯或3-溴甲苯或4-溴甲苯③官能团异构具有相同的分子组成,由于官能团不同而产生的异构现象,例如:具有相同分子式的烯烃与环烷烃之间也存在异构现象:CH3CH=CH2 (丙烯)与环丙烷(二)构型异构构型异构是指分子中的原子或原子团在空间的排列方式不同而产生的异构现象,有顺反异构和对映异构两类。
1、顺反异构烯烃的同分异构现象比烷烃的要复杂,除碳链异构外,还有由于双键的位置不同引起的位置异构、分子式相同化合类别不同引起的官能团异构和双键两侧的基团在空间的位置不同引起的顺反异构。
例如:丁烷只有正丁烷和异丁烷两个异构体,而丁烯就有三个异构体:CH 3CH 2CH=CH 2 CH 3CH=CHCH 3 CH 3C=CH 2CH 31-丁烯 2-丁烯 2-甲基丙烯 双键位置异构 碳架异构由于双键不能自由旋转又产生了另一个异构现象--顺反异构,如:2-丁烯有两个:CCCCHHHHCH 3CH 3CH 3CH 3顺-2-丁烯 反-2-丁烯 单烯烃的分子通式为C n H 2n ,它与环烷烃(通式为C n H 2n )互为同分异构体,如丁烯和环丁烷(甲基环丙烷)互为同分异构体。

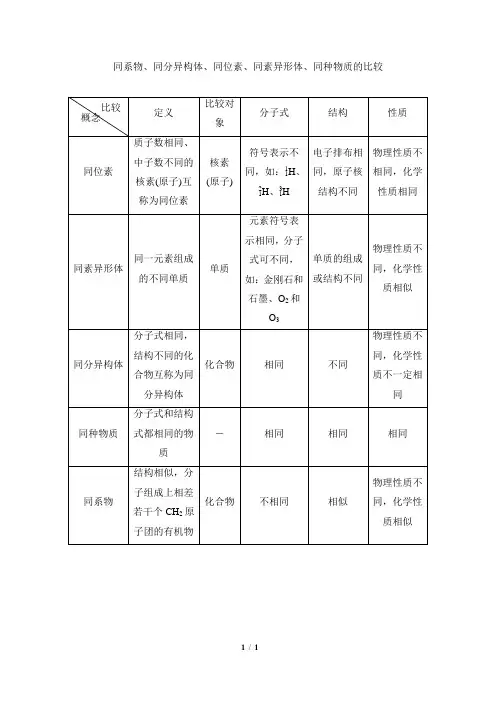
张浩祥对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素:质子数相同,中子数不同的原子(核素)对象原子同素异形体:由同一种元素组成的不同单质。
对象单质同系物; 结构相似,分子组成相差一个或若干个CH2基团的物质对象化合物同分异构体: 分子式相同,结构不同的化合物对象化合物说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如:O2和O3 。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
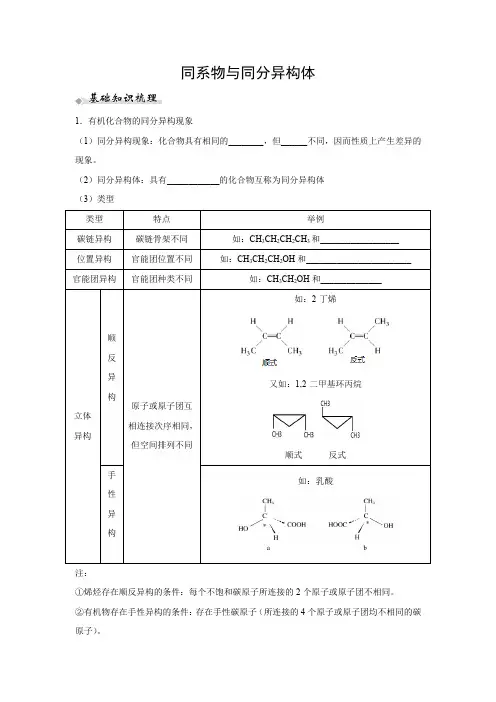
同系物与同分异构体1.有机化合物的同分异构现象(1)同分异构现象:化合物具有相同的________,但______不同,因而性质上产生差异的现象。
(2)同分异构体:具有____________的化合物互称为同分异构体(3)类型 类型特点 举例碳链异构碳链骨架不同 如:CH 3CH 2CH 2CH 3和__________________ 位置异构官能团位置不同 如:CH 3CH 2CH 2OH 和________________________ 官能团异构 官能团种类不同 如:CH 3CH 2OH 和______________立体异构顺反异构原子或原子团互相连接次序相同,但空间排列不同如:2-丁烯又如:1,2-二甲基环丙烷 顺式 反式手性异构如:乳酸 注:①烯烃存在顺反异构的条件:每个不饱和碳原子所连接的2个原子或原子团不相同。
②有机物存在手性异构的条件:存在手性碳原子(所连接的4个原子或原子团均不相同的碳原子)。
③手性异构又称对映异构或旋光异构。
2.同系物概念→结构____,分子组成上相差一个或若干个____结构→官能团种类、数目均相同、具有相同的通式、属于同类物质性质→ → 物理性质:随碳原子数的增加发生规律性变化→ 化学性质:性质相似应用体验判断正误(1)同分异构是同一物质的不同存在形式()(2)含5个碳原子的有机物,每个分子中最多可形成4个C-C单键()(3)同系物一定符合相同的通式,符合同一通式的一定是同系物()(4)和属于同系物()(5) C2H6和C3H8、C2H4和C3H6两组物质都互为同系物()(6)甲苯和邻二甲苯是同系物( )(7)乙醇和乙醚是同分异构体()(8)苯和环己烷的二氯代物都只有3种( )1、明晰同系物的概念(1)结构相似必是同类别、同数目的官能团,碳碳连接方式相同。
如乙醇和丙三醇则因官能团数目不同而不是同系物。
(2)同系物必有相同的通式,但通式相同的不一定为同系物。
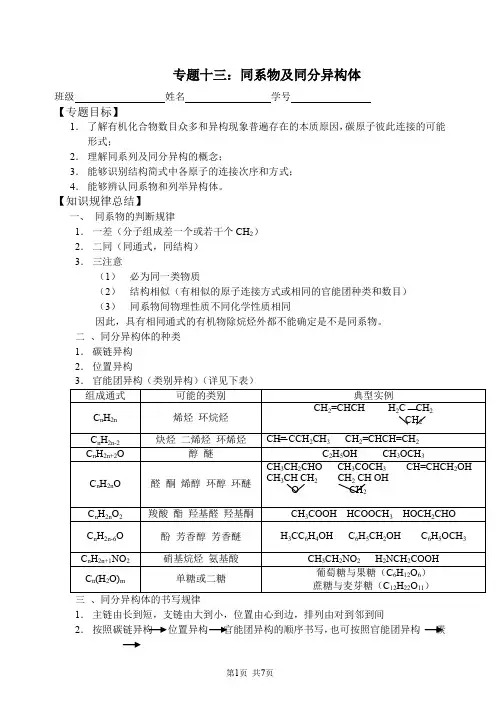
专题十三:同系物及同分异构体班级姓名学号【专题目标】1.了解有机化合物数目众多和异构现象普遍存在的本质原因,碳原子彼此连接的可能形式;2.理解同系列及同分异构的概念;3.能够识别结构简式中各原子的连接次序和方式;4.能够辨认同系物和列举异构体。
【知识规律总结】一、同系物的判断规律1.一差(分子组成差一个或若干个CH2)2.二同(同通式,同结构)3.三注意(1)必为同一类物质(2)结构相似(有相似的原子连接方式或相同的官能团种类和数目)(3)同系物间物理性质不同化学性质相同因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。
二、同分异构体的种类1.碳链异构2.位置异构三、同分异构体的书写规律1.主链由长到短,支链由大到小,位置由心到边,排列由对到邻到间2.按照碳链异构位置异构官能团异构的顺序书写,也可按照官能团异构碳链异构位置异构的顺序书写,不管按照那种方法书写都必须防止漏写和从写四、分异构体数目的判断方法1.记忆法记住已掌握的常见的异构体数。
例如:(1)凡只含一个碳原子的分子均无异构,甲烷、乙烷、新戊烷(看作CH4的四甲基取代物)、2,2,3,3—四甲基丁烷(看作乙烷的六甲基取代物)、苯、环己烷、乙炔、乙烯等分子一卤代物只有一种;(2)丁烷、丁炔、丙基、丙醇有2种;(3)戊烷、丁烯、戊炔有3种;(4)丁基C8H10有4种;(5)己烷、C7H8O(含苯环)有5种;(6)戊基、C9H12有8种;2.基元法例如:丁基有4种,丁醇、丁醛都有4种;3.替元法例如:C6H4Cl2有3种,C6H2Cl4有3种(将H替代Cl);4.对称法(又称等效氢法)判断方法如下:(1)同一C 原子上的氢原子是等效(2)同一C 原子所连甲基上的氢原子是等效氯(3)处于镜面对称位置上的氢原子是等效【经典题型】题型一:确定异构体的数目例1 某烃的一种同分异构只能生成1种一氯代物,该烃的分子式可以是()A.C3H8B.C4H10C.C5H12D.C6H14解析:分析C3H8、C4H10、、C6H14各种结构,生成的一氯代物不只1种。
专题1 同系物和同分异构体【知识要点】1.同系列、同系物分子结构相似,组成上相差若干个某原子或原子团的一系列化合物,称为同系列。
可表示为AnW B,A、B为任意一种基团(或氢原子),W为2价的某原子或有机基团,又成为该同系列的系差。
同系列的性质往往呈现规律性的变化。
同系列化合物中,若分子组成上相差一个或若干个CH2的一系列有机化合物,称为同系物。
例如:甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8)、……等一系列的分子属于烷烃同系列,甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8)等互称为同系物。
同系物一定属同类物质,具有相似的组成和结构(官能团的种类和个数均相同),相似的性质,相同的通式。
例如,烷烃的组成通式为C n H2n+2(n≥1),烯烃的组成通式为C n H2n (n≥2)。
同系物的几点补充:(1) 必须是符合同一通式同一类物质,化学式一定不同,而且符合同一通式的并不一定就是同系物。
(2) 结构相似,是结构特点相似,并不是完全相同。
如异丁烷与正戊烷,前者有支链,后者没有。
(3) 结构相似,但性质却有时相差较大,如:甲苯与苯。
(4) 官能团一定要相同,并且官能团数目也要相同。
2.同分异构现象、同分异构体化合物具有相同的化学式,但是具有不同结构的现象,叫做同分异构现象;具有相同化学式而结构不同的化合物互称为同分异构体。
例如:丁烷C4H10有两种结构,这就是同分异构现象,这两种化合物互称同分异构体。
CH3CH2CH2CH3CH3CH CH3CH3同分异构体的几点补充:(1) 结构不同,分子量相同,元素百分含量相同(或最简式相同)的有机物一定有相同的分子式,一定是同分异构体。
如:乙酸CH3COOH和甲酸甲酯HCOOCH3。
(2) 同分异构体不一定属于同类物质,性质不一定相似。
如:乙酸和甲酸甲酯、乙醇CH3CH2OH和甲醚CH3OCH3。
(3) 分子量相同的有机物不一定有相同的分子式。
如:甲酸HCOOH和乙醇CH3CH2OH、乙酸CH3COOH和丙醇CH3CH2CH2OH、壬烷C9H20和萘C10H8等。
同系物和同分异构体的概念
同系物和同分异构体是有机化合物中常见的两个概念。
它们的区别在
于它们的分子结构和性质上有所不同。
一、同系物
同系物是指在分子结构中,由于碳骨架中原子数量相等,但它们的原
子序列、功能团或立体构型不同,导致它们的化学性质也不同。
例如,苯乙烯和丙烯醛就是同系物。
它们都是由三个碳原子组成的不饱和化
合物,但它们的分子结构不同,因此具有不同的化学性质。
二、同分异构体
同分异构体是指在分子式相同的情况下,由于原子间键合方式或立体
构型不同而产生性质上差异的化合物。
例如,正丁烷和异丁烷就是一
对典型的同分异构体。
它们都由四个碳原子和十个氢原子组成,但它
们之间存在着碳链长度、立体异构等差异。
三、两者区别
1. 分子结构:同系物指具有相似基本结构但某些部位上存在差异;而
同分异构体则指具有相似化学式但在分子结构上存在差异。
2. 化学性质:同系物因为某些部位的差异,其化学性质也会有所不同;而同分异构体则因为分子结构的不同,其化学性质也会有所不同。
3. 举例:同系物的典型代表是苯乙烯和丙烯醛;而同分异构体的典型代表是正丁烷和异丁烷。
总之,同系物和同分异构体是有机化合物中常见的两个概念。
它们在
分子结构和化学性质上都存在着一定的差异。
在实际应用中,对于这
两种化合物需要进行深入了解和认识,以便更好地进行相关实验及工作。
同系物及同分异构体教学目标知识技能:通过同系物和同分异构体的专题复习,巩固同系物和同分异构体的概念、书写、判断、确定等;了解同系物化学性质的相似性及物理性质的递变性,了解同分异构体的较常见的题型。
能力培养:培养学生认真审题、有序思维、准确判断推理的能力,培养学生对“信息知识”的自学能力。
科学思想:学会多层面、多角度地分析和看待问题;形成尊重事实、尊重科学的学风。
科学品质:对学生进行严谨求实、认真仔细的科学态度教育;强化参与活动的乐趣及获得成功的体验。
科学方法:感性认识与理性认识相互转化,透过现象抓本质的方法。
重点、难点同系物判断,同分异构体的辨析能力。
教学过程设计教师活动引言】本节课我们重点复习有机化学的同系物、同分异构体的有关内容。
板书】有机化学同系物、同分异构体专题复习一、同系物、同分异构体的概念第1 页共24 页【设问】1.中学阶段我们已学习过的涉及“同”字的概念主要有哪几个?2 •同学们能否设计一个表格或方案将这几个概念所涉及的有关内容进行比较?请同学们思考并设计。
学生活动明确复习重点。
做笔记、思考。
回忆、思考、发言。
含“同”的概念主要有四个:同位素、同素异形体、同系物、〉.丿 A A、 方案之一:指导学生:1 .用实物投影仪展示学生们的设计方案。
2 .展示经大家补充修改的方案。
【讲述】同学们根据方案的要求将表格中的各项内容自己整理进行复习。
【提示】这部分内容课前已布置预习作业。
回答:(1) 同分异构体。
指导学生:1.完成表格中的各项内容达到复习巩固的目的。
2 .及时订正学生回答中的不准确内容,或找学生评价或订正相关内容。
【讲述】本节课的复习重点是同系物和同分异构体, 进行讨论。
【讲述】首先我们就“同系物”的有关内容讨论下列问题。
并推荐代表发言。
现就这两个概念我们进一步深入请同学们分小组讨论5min【投影】讨论题:1.同系物是否必须符合同一通式?举例说明。
2 .通式相同组成上相差若干个Ch2原子团是否一定是同系物?3. CHCHBr与CHCHCHCI都是卤代烃,且结构相差一个CH原子团是否是同系物?为什么?CH?4. CHCHCH和CH?—C—CH』,前者无支链,后者有支链能否互称同系C%物?5 .请你概括总结判断同系物的要点。
中职化学同分异构体与同系物的概念解析摘要:在中职化学教学中,同分异构体和同系物的概念是有机化学中较难理解并较易混淆的一组概念,给学生系统学习有机化学带来了困惑,也是中职化学教学过程中的重点和难点。
本文通过对同分异构体和同系物的概念剖析,教会学生准确把握这组概念,促进学生构建自己的知识体系,使学生增强学习有机化学的兴趣。
关键词:同分异构体构造异构同系物一、同分异构体的概念同分异构体是指分子组成上相同,但结构不同的化合物。
如C2H4和CO具有相同的相对分子质量,但分子式截然不同,不属于同分异构体。
C2H2和C6H6的最简式相同,但在组成原子数量上不同即分子式不同,不属于同分异构体。
再比如多糖化合物:淀粉[n]、纤维素[n]以及糖原[n],三者之�g通式相同,但当n值不同时,分子式就不同,也不是同分异构体关系。
除上述对基本概念的解析外,还需明确同分异构体的存在大多数是有机物之间,在无机物之间也可以存在这样的关系,但有机物与无机物之间一般不存在同分异构体的关系。
如无机物中的雷酸银AgONC和氰酸银AgCNO ;雷酸HONC和氰酸HOCN以及异氰酸HNCO 都是互为同分异构体的关系。
同分异构体的现象很多,一般可分为构造异构和立体异构两大类。
其中构造异构分为碳链异构,位置异构,类别异构;立体异构又分为顺反异构、光学异构、对映异构、构象异构等。
在中职医学、药学或卫生学校的教材、教参中一般其中涉及的同分异构现象主要是构造异构,下面就重点解释构造异构的知识体系。
1.碳链异构指结构中碳原子的排列顺序不同而产生的同分异构现象,具有同分异构现象的物质称为同分异构体。
这里介绍一种常见且有效的书写碳链异构的方法为“逐级减碳法”,书写步骤如下:首先根据分子式写出主链最长的直链结构式,没有分支;然后写出主链上少一个碳原子的直链式结构,把余下的一个碳原子当做取代基加在主链的碳原子上,并依次变动取代基的位置;再写出主链少两个碳原子的直链式结构,把剩余的两个碳作为支链加在主链的碳原子上;依次递减,递减过程中注意主链肯定是最长的碳链,不能因为主链碳原子的递减、支链的增多而本末倒置。
有机物单元复习 同分异构体、同系物一. 本周教学内容有机物单元复习 同分异构体、同系物 二. 教学要求1. 有机物同分异构体,同系物的判断。
2. 同分异构体的书写,数目的确定。
三. 知识分析1. 同系物和同系列结构上相似,组成上相差一个或若干个2CH原子团的有机物,按碳原子数递增的顺序所排成的系列叫同系列。
同系列中的各有机物互称同系物。
说明:(1)同系物的一些物理性质,随分子中碳原子数的递增而呈现出规律性的变化。
(2)由于同系物具有相似的结构,所以它们在化学性质上也相应地表现出某种相似性。
2. 同分异构现象和同分异构化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。
具有同分异构现象的化合物叫做同分异构体。
同分异构现象是有机物种类繁多的重要原因。
在高中阶段,同分异构中的“分子结构不同”主要有三种类型: (1)碳链异构:由分子内碳原子的排列顺序不同所引起的。
(2)位置异构:由官能团在碳链上的位置不同或取代基在苯环上的位置不同引起的异构。
(3)类别(跨类)异构:不同系列的物质之间,即官能团不同引起的异构。
这部分内容几乎年年考,考查内容有: ① 同系列和同分异构体数目的确定。
② 列举同分异构体的结构。
③ 判断几种结构是否相同。
④ 学会变通。
随着科学技术的飞速发展,分子生物技术的日臻成熟,新材料、新药物不断被发现和合成,要求人们对其结构和性质有一定的了解。
可以预见这部分知识仍将是新高考中“x ”的一个热点。
【典型例题】[例1] 式量100的烃,主链中含5个碳原子的可能结构有5种。
试写出它们的结构简式,并用系统命名法命名。
解析:由已知烃的式量确定分子式是解此类题的突破口,其确定方法有如下2种: 解法1:通式法:设烃分子式为xn n H C +2(2=x ,0,2-, 4-)则x n +=14100 14/)100(x n -=讨论:2=x 时,7=n 为167H C 0≤x 时,n 值均不合理 解法2:商余法用式量除以12(C 的原子量),所得商为烃所含碳原子的最大数目,而余数就是H 原子的最小数目。
专题三同系物和同分异构体考纲要求:1、了解同分异构现象普遍存在的本质原因。
2、掌握同分异构和同系物的概念,会辨认同系物和列举同分异构体。
知识点:一、同系物:1、定义:2、同系物的判断规律(1)一差(分子组成差一个或若干个CH2);(2)二同(同通式,同结构);(3)三注意:①必为同一类物质②结构相似(有相似的原子连接方式或相同的官能团种类和数目)③同系物间物理性质不同,化学性质相似,因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。
二、同分异构体1 概念辩析(同分异构、同一种物质、同系物)同分异构:化合物具有相同的分子式,但结构不同的现象称为同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
在中学阶段,引起同分异构的原因主要有三种:碳架异构、位置异构和官能团异构。
识别两者是否是同分异构体,首先要查碳原子数,判别分子式是否相同,然后再看结构式。
在分子式相同的情况下,若结构不同,则两者必为同分异构体。
同一种物质:两者不仅分子式相同,而且结构也完全相同,则为同一种物质。
同一种物质应具有相同的物理参数,如有相同的熔沸点。
判断两结构是否相同方法有二:(1)将分子整体翻转或沿对称要素(面、线)旋转后能“重合”者;(2)用系统命名法命名,所得名称相同者。
同系物:结构相似,在分子组成上相差一个或几个CH2原子团的物质互称同系物。
结构相似是指分子中含有官能团的种类和数目都要相同。
如乙醇与丙醇为同系物,但乙二醇与丙三醇就不属同系物了。
若已知两结构式要判断它们是否具有相同的分子式,数不饱和度要比数氢原子数目快捷得多。
在C、O、N、Cl等原子数对应相同的前提下,不饱和度相同的,分子式一定相同。
如:ClHOCl O两者C、O、Cl原子数相同,不饱度都是4,所以两结构式具有相同的分子式。
而结构显然不同,因此两者应为同分异构体。
对于稠环芳香烃利用公用边数目来确定两个已知结构式的关系则很方便。
在苯环数相同的前提下,若公用边数相同,且各苯环排列顺序又相同,则两者表示的是同一种物质;若公用边数相同,且各苯环排列顺序不相同,则两者表示的是同分异构体;若公用边数不同,则两者即不是同分异构体,也不是同一物物质。
[练1-1]下列4式表示的是棉子象鼻虫的四种的信息素的结构简式,其中互为同分异构体是(③④)解析:②中含10个碳原子,①③④都有11个碳原子,③含一个-CH2OH,比①式(含一个-CHO)多二个氢,故①③不是同分异构体。
③④分子式相同,但③式是一个六元环,④式是一个四元环,两者结构不同,故互为同分异构体。
[练1-2] 下列各组物质中属于同分异构体的是⑴⑶,属于同系物的是⑵,既不是同系物又不同分异构体的是⑷,属于同一种物质的是⑸。
①⑤②乙酸和硬脂酸③硝酸乙烷和氨基乙酸④苯甲酸和对苯二甲酸解析:①组属于同分异构体,分子式都是C7H8O,但前者属芳香醇,后者属酚;②组属同系物,同属一元脂肪酸系列,分子组成相差16个CH2;③是同分异构体,要掌握同碳数的硝基烷和氨基酸是互为类别异构;④组两者含碳数不同,不是同分异构体,两者虽都有含羧基-COOH,但含有羧基数不同,也不属同系物。
⑤组要注意到C-C单键可绕键轴旋转,故两结构式是相同,表示的是同一种物质。
[练1-3] 萘分子的结构可以表示为或,两者是等同的。
苯并[α]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧的烟雾和内燃机的尾气中)。
它的分子由5个苯环并合而成,其结构式可以表示为(Ⅰ)或(Ⅱ)式:(Ⅰ)(Ⅱ)这两者也是等同的。
现有结构式A、B、C、D:A B C D其中:与(Ⅰ)、(Ⅱ)式等同的结构式是( );与(Ⅰ)、(Ⅱ)式同分异构体的是( )。
[解析] 以(Ⅰ)式为基准,图形从纸面上取出向右翻转180°后再贴回纸面即得D式,将D式在纸面上逆时针旋转45°即得A式。
因此,A、D都与(Ⅰ)、(Ⅱ)式等同。
也可以(Ⅱ)式为基准,将(Ⅱ)式图形在纸面上反时针旋转180°即得A式,(Ⅱ)式在纸面上逆时针旋转135°即得D式。
从分子组成来看,(Ⅰ)式是C20H12,B式也是C20H12,而C式是C19H12,所以B是Ⅰ、Ⅱ的同分异构体,而C式不是。
稠环芳烃共用边数法A与D 两式共用边都是6条,且五个苯环的排列顺序实质是一样的,所以两式表示的是同一种物质。
A 与B(或D与B )五个苯环都共用6条边,但苯环的排列顺序不一样,所以它们互为同分异构体。
而C式五个苯环共用的是7条边,因此 C 与其它三式即不是同分异构体,也不是同一种物质。
答案是(1)AD;(2)B。
2 烃的异构2.1 烷烃的异构(碳架的异构)熟记C1-C6的碳链异构: CH4、C2H6、C3H8无异构体;C4H10 2种、C5H12 3种、C6H14 5种。
2.2 烯炔的异构(碳架的异构和碳碳双键或叁键官能团的位置异构)如丁烯C4H8有两种碳链,形成3种异构体:2.3 苯同系物的异构(侧链碳架异构及侧链位置的异构) 如C9H12有8种异构体:3 烃的一元取代物的异构(取代等效氢法)卤代烃、醇、醛、羧酸都可看着烃的一元取代物。
确定它们异构体可用取代等效氢法。
等效氢概念有机物分子中位置等同的氢叫等效氢,分子中等效氢原子有如下情况:①分子中同一个碳原子上连接的氢原子等效。
②同一个碳原子上所连接的甲基上的氢原子等效。
如新戊烷(可以看作四个甲基取代了甲烷分子中的四个氢原子而得),其四个甲基等效,各甲基上的氢原子完全等效,也就是说新戊烷分子中的12个H原子是等效的。
③分子中处于镜面对称位置(相当于平面镜成像时,物与像的关系)上的氢原子是等效的。
如分子中的18个H原子是等效的。
取代等效氢法要领利用等效氢原子关系,可以很容易判断出有机物的一元取代物异构体数目。
其方法是先写出烃(碳架)的异构体,观察分子中互不等效的氢原子有多少种,则一元取代物的结构就有多少种。
C3H7X 一种碳链,共有2 种异构体C4H9X 二种碳链,共有4 种异构体C5H11X 3种碳链,共有8 种异构体这里的一元取代基X,可以是原子,如卤原子,也可以是原子团,如-OH、-CHO、-COOH、HCOO-等。
因此,已知丁基-C4H9有四种,则可断定丁醇、戊醛、戊酸以及甲酸丁酯都有4种异构体。
观察并找出分子结构中的对称要素是取代等效氢法的关键例:菲和蒽互为同分异构体,菲的结构简式为从菲的结构简式分析,菲的一氯取代物共有(B)A.4种 B.5种C.10种D.14种提示:找出菲结构的对称轴,则答案显见。
[练3-1] 分子式为C 11H 16的一烷基取代苯的同分异体共有 8 种[解析] 一烷基取代苯[C 6H 5-C 5H 11]可看作苯基取代戊烷中的一个氢,而戊基有8种异构体,所以C 11H 16共有8 种一烷基取代苯的同分异构体。
[练3-2]蓝烷分子结构如,试写出蓝烷分子式:C 10H 10,它的一氯代物共有 4 种。
{说明}常可根据某些烃存在的一元取代物数目,反推原烃分子结构式。
如含碳原数少于10的烷烃中,其中一卤代物不存在异构体的有 4 种。
又如,已知烯烃C 6H 12的一氯代物只有一种,则可断定该烯烃的分子结构为4 烃的二元(或三元)取代物的异构4.1 有序法(定一移一)有序法要求解决问题时遵循一定的特定线索和步骤去探索的一种思维方法。
应用有序法解决烃的多元取代物异构体问题的步骤顺序是:先写出碳架异构,再在各碳架上依次先定一个官能团,接着在此基础上移动第二个官能团,依此类推,即定一移一。
[例] 二氯丙烷有 4 种异构体,它们的结构简式是[解析]三个碳,碳链只有一种(不包括环)。
先定一个氯原子在1号碳上,然后把第二个氯原子分别移到1、2、3 号碳上,得三种异构体;接着将一个氯定在2号碳上,此时第2个氯就只以能接在2号碳上,因此共得到4种异构体。
解题中要注意判断排除重复的结构。
[练将-Ф、NH 2、-OH 在碳链上的位置作变换,还可以写出其它 8 种异构体(不包括-OH 和-NH 2连在同一碳原子的异构体。
试写出包括PPA 自身在内的这些异构体的结构简式。
[解析] 有序思维推导过程如下:第一步:先定位-Ф苯基,苯基在碳链上只有两种连接;第二步:在定位了-Ф苯基所得到的二式中,分别变换-OH 在碳链上的位置,得①-⑤H 3C CH 3 C==C H 3C CH 3 Ф-CH-CH-CH 3 其中-Ф代表苯基HO NH 2第三步:在定位了-Ф、-OH的上述①-⑤五个式中分别变换-NH2,共得到9种异构体。
(注意按题意-NH2不能与-OH接在同一碳原子上)由①式得由②式得由③式得由④式得由⑤式得[练4-2] 蒽的结构式为它的一氯代物有3 种,二氯代物有15 种。
[解析] 蒽分子结构中有三种位置不同的氢,即有三种不同的等效氢,因此它的一氯取代产物有3种;二氯代物数推异的思路是:先写出三种一氯代物结构,再遂一分析各一氯代物又能衍生出几种二氯代物,要注意剔除重复的结构.4.2 换元法[例] 已知C6H4Cl2有三种异构体,则C6H2Cl4有三种异构体。
(将H代替Cl)[练4-3]已知A的结构为A的n溴代物与m溴代物的异构体数目相同,则n和m必满足关系式m+n=65 酯的异构5.1 插入法将酯基插入烃的碳链中则为酯,此法也适用于醚和酮等。
解法步骤:第一步:先写去掉酯基余下组成(烃)的各可能的碳链结构;第二步:将酯基以两种不同的方向(正向-COO-反向-OOC-分别插入第一步写出的各式的C—C键中;第三步:将酯基以反向分别插入第一步写出的各式的C—H键中(若以正向插入则得羧酸)。
[例] 写出分子式为C5H10O2且属于酯的的各种同分异构体的结构简式[解析] C4 只有两种碳链,将酯基按正反两种方向分别插入C—C键中,得5种酯(如下图所示);再将酯基按反向插入这两种碳架不同的C—H键中,则得到4种甲酸酯。
因此C5H10O2酯的异构体共有9 种。
5.2 拆分法酯可拆分为合成它的羧酸和醇(酚)。
若已知酸有m种异构体,醇有n种异构体,则该酯的同分异构体有m×n种。
而羧酸和醇的异构体可用取代有效氢法确定。
以C5H10O2为例推异其属于酯的异构体数目及结构简式:[解析] 甲酸丁酯HCOOC4H9 异构体数为1×4=4 种乙酸丙酯CH3COOC3H7异构体数为1×2=2 种丙酸乙酯C2H5COOC2H5 异构体数为1×1=1 种丁酸甲酯C3H7COOCH3异构体数为2×1=2 种因此,分子式为C5H10O2其属于酯的异构体共有9 种。
同理可知,C3H7COOC4H9其中属于酯的同分异构体共有2×4=8 种。
[练5-1] 分子式为C8H8O2 的异构体很多:(1)其中属于羧酸类,且结构中含有苯环的异构体的结构简式(共有4种)。