最新亚铁离子与铁离子的检验57808
- 格式:ppt
- 大小:1.15 MB
- 文档页数:5


铁离子和亚铁离子的检验
目的:认识检验铁离子和亚铁离子的一般方法。
用品:试管、试管架、试管夹、量筒、滴管。
三氯化铁、硫酸亚铁、硫氰酸钾、亚铁氰化钾、铁氰化钾。
原理:铁离子和亚铁离子跟某些化合物反应能生成不同的络合物,从这些络合物的颜色可以鉴别铁离子和亚铁离子。
操作:
1.跟硫氰酸钾溶液的反应取两支试管,一盛0.1 摩/升FeCl3 溶液2 毫升,另一盛新制备的0.1 摩/升FeSO4 溶液2 毫升,各滴入1~2 滴硫氰酸钾溶液,前者呈现红色,后者不显红色。
这是因为Fe3+跟SCN-能生成配位数从1~6 的一系列红色的硫氰酸铁络离子的缘故。
2.跟亚铁氰化钾和铁氰化钾的反应在两支试管里分别盛0.1 摩/升FeCl3溶液和新制备的0.1 摩/升FeSO4 溶液各2 毫升,各加入几滴亚铁氰化钾溶液,在三氯化铁溶液里有蓝色普鲁士蓝沉淀生成。
用铁氰化钾代替亚铁氰化钾做同样的实验,在硫酸亚铁溶液里有深蓝色的滕氏蓝沉淀和亚铁氰化铁钾生成。
在三氯化铁溶液里不产生沉淀,只是溶液的颜色变成棕色。
普鲁士蓝和滕氏蓝两种沉淀都显深蓝色,现已证明这二者是相同的物质,近似组成是KFe[Fe(CN)6]·6H2O。

亚铁离子的检验方法亚铁离子是一种重要的化学物质,它在生活和工业中都有着广泛的应用。
因此,对亚铁离子的检验方法具有重要的意义。
下面将介绍几种常用的亚铁离子检验方法。
首先,最常见的亚铁离子检验方法之一是硫氰化钠法。
该方法是利用硫氰化钠与亚铁离子在酸性条件下生成深红色络合物的特性进行检验。
具体操作步骤为,取少量待测溶液,加入硫氰化钠溶液,轻轻摇匀,然后加入少量稀盐酸,若生成深红色沉淀则表示存在亚铁离子。
这种方法简单易行,且具有较高的灵敏度,因此被广泛应用于实验室中。
其次,还有一种常用的亚铁离子检验方法是邻苯二甲酸法。
该方法是利用邻苯二甲酸与亚铁离子在酸性条件下生成蓝色络合物的特性进行检验。
具体操作步骤为,取少量待测溶液,加入邻苯二甲酸溶液,轻轻摇匀,然后加入少量稀盐酸,若生成蓝色沉淀则表示存在亚铁离子。
这种方法同样简单易行,且对其他离子的干扰较小,因此也被广泛应用于实验室中。
此外,还有一种常用的亚铁离子检验方法是硫酸亚铁法。
该方法是利用硫酸亚铁与亚铁离子在酸性条件下生成蓝色络合物的特性进行检验。
具体操作步骤为,取少量待测溶液,加入硫酸亚铁溶液,轻轻摇匀,然后加入少量稀盐酸,若生成蓝色沉淀则表示存在亚铁离子。
这种方法同样简单易行,且对其他离子的干扰较小,因此也被广泛应用于实验室中。
综上所述,亚铁离子的检验方法有多种,其中硫氰化钠法、邻苯二甲酸法和硫酸亚铁法是比较常用的几种方法。
这些方法操作简单,结果准确,因此在实际应用中具有较高的价值。
当然,在进行亚铁离子检验时,我们还应该根据实际情况选择合适的方法,并且在操作过程中要严格控制条件,以确保检验结果的准确性和可靠性。
希望本文介绍的亚铁离子检验方法对大家有所帮助。

亚铁离子的检验方法
亚铁离子的检验方法有以下几种:
1. 基于鉄离子和亚铁离子的颜色反应:将试液加入一定量稀硝酸或氯化钠,在加入明矾和硫酸后观察变色现象。
鉄离子呈红色,亚铁离子呈蓝色或绿色。
2. 基于亚铁离子和二价铜离子的还原反应:将试液加入氰化钠和碱液,再加入硫脲、氯化铜溶液,在加热的条件下观察是否产生红色沉淀。
若有红色沉淀,则表示存在亚铁离子。
3. 基于亚铁离子和铬酸钾的氧化反应:将试液加入硫酸和铬酸钾,加热后观察是否出现蓝色或蓝紫色。
若出现该颜色,则表示存在亚铁离子。
4. 基于亚铁离子和沉淀反应:将试液加入硫酸和硫酸钠,再加入硫酸锌,观察是否产生白色沉淀。
若有白色沉淀,则表示存在亚铁离子。

铁离子的检验方法1.硫氰化钾+氧化剂法,观察反应:两种溶液各取少量,滴入硫氰酸钾溶液(或硫氰酸钠、硫氰酸铵等)中。
)中,并在不变色的溶液中加入少量氯水。
变成血红色的原液含有亚铁离子。
如果亚铁离子中含有铁离子,加入硫氰酸根离子后溶液会立即变红,导致后续变色不明显,所以这种方法只能用于鉴别不含铁离子的溶液中的亚铁离子。
2.加入氢氧化钠,观察反应:加入氢氧化钠溶液,生成白色沉淀,迅速变成灰绿色,最后变成红棕色。
这证明有铁离子。
3.加入酸性高锰酸钾,观察反应:两种溶液各取少量,加入酸性高锰酸钾,溶液中加入酸性高锰酸钾。
褪色的话会有亚铁离子,不褪色的话证明没有亚铁离子。
2、三价铁离子的检验方法1.三价铁离子溶液呈棕黄色2.加苯酚显紫红色(络合物)Fe3+ + 6C6H5OH =[Fe(C6H5O)6]3- + 6H+。
3.加SCN-(离子) 显血红色 (络合物)Fe3+ + 3SCN- ==Fe(SCN)3(络合反应,是可逆的,两种离子结合的比例不唯一,是检验三价铁的特征反应,二价铁无此特性)4.加氢氧化钠有红褐色沉淀从开始沉淀到沉淀完全时溶液的pH(常温下):2.3.75.NH4SCN试法:Fe3+与SCN-生成血红色具有不同组成的络离子.碱能分解络合物,生成Fe(OH)3沉淀,故反应需要在酸性溶液中进行.HNO3有氧化性,可使SCN-受到破坏,故应用稀HCL溶液酸化试液.其他离子在一般含量时无严重干扰。
6.K4Fe(CN)6试法:Fe3+在酸性溶液中与K4Fe(CN)6生成蓝色沉淀(以前为普鲁土蓝),但实际上它与前述滕氏蓝系同一物质.其他阳离子在一般含量时不干扰鉴定.Co2+、Ni2+等与试剂生成淡蓝色至绿色沉淀,不要误认为是Fe3+。
3、同时含有二价和三价铁离子的溶液如何检验Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪色说明含有Fe2+。

检验铁离子的方法铁离子是一种常见的金属离子,它在生活和工业中都有着广泛的应用。
检验铁离子的方法有很多种,可以通过化学反应、仪器分析等手段进行检测。
下面将介绍几种常见的检验铁离子的方法。
一、化学法。
1. 硫氰化钾法。
将待检样品溶液加入硫氰化钾溶液中,若生成深红色沉淀,则表示样品中含有铁离子。
这是因为硫氰化钾与铁离子生成深红色的硫氰化铁沉淀。
2. 硫酸亚铁法。
将待检样品溶液加入硫酸亚铁溶液中,若生成蓝色沉淀,则表示样品中含有铁离子。
这是因为硫酸亚铁与铁离子生成蓝色的硫酸铁沉淀。
3. 酚酞指示法。
将待检样品溶液加入酚酞溶液中,若生成酚酞红色溶液,则表示样品中含有铁离子。
这是因为酚酞与铁离子生成酚酞铁络合物,呈现出红色。
二、仪器分析法。
1. 原子吸收光谱法。
原子吸收光谱法是一种常用的仪器分析方法,可以准确测定样品中的铁离子含量。
通过测量样品溶液对特定波长的光的吸收情况,可以确定样品中铁离子的浓度。
2. X射线荧光光谱法。
X射线荧光光谱法是一种非破坏性的分析方法,可以对样品进行快速分析,得到样品中铁离子的含量和分布情况。
以上介绍的方法只是检验铁离子的其中几种常见方法,实际上还有很多其他方法,如电化学法、光谱法、色谱法等。
选择合适的检验方法需要根据具体的实验要求和条件来确定。
在进行铁离子检验时,需要注意样品的处理和实验操作的规范,确保实验结果的准确性和可靠性。
另外,不同的检验方法可能对样品的要求不同,需要根据实际情况进行选择。
总之,检验铁离子的方法有很多种,每种方法都有其适用的场合和特点。
通过合理选择和运用这些方法,可以准确、快速地检验样品中铁离子的含量,为相关领域的研究和应用提供有力的支持。

检验亚铁离子的方法
亚铁离子是指铁离子的氧化态为+2的离子,常见的化学式为
Fe2+。
以下是检验亚铁离子的几种常用方法:
1. 硬质胶体法:将含有亚铁离子的溶液与硫氰酸钾溶液混合,之后滴加硬脂酸胶体溶液。
如果出现红棕色沉淀,则可判断有亚铁离子存在。
2. 硫代硫酸盐法:将含有亚铁离子的溶液与硫代硫酸钠溶液混合,加热至沸腾。
此时如有亚铁离子存在,则会生成黑色沉淀。
3. 氰化物法:将含有亚铁离子的溶液与氰化钾溶液混合,加入盐酸进行酸化。
若出现深蓝色沉淀,则可证明有亚铁离子存在。
以上是几种常见的检验亚铁离子的方法,它们都基于亚铁离子与特定试剂之间的化学反应产生可见的观察结果来判断其存在与否。

亚铁离子的检验方法亚铁离子是指铁的氧化态为+2的离子,它在水质分析、环境监测、食品加工等领域中具有重要的应用价值。
因此,准确、快速地检验亚铁离子的方法对于相关领域的研究和实践具有重要意义。
本文将介绍几种常用的亚铁离子检验方法。
一、巴西三氮试剂法。
巴西三氮试剂法是一种常用的亚铁离子检验方法。
其原理是利用巴西三氮试剂与亚铁离子在酸性条件下生成的蓝色络合物来进行检验。
具体操作步骤为,将水样加入试剂中,经过搅拌后,观察生成的蓝色络合物的颜色深浅来判断亚铁离子的含量。
二、光度法。
光度法是利用溶液对特定波长的光的吸收或透射来测定其中物质浓度的方法。
对于亚铁离子的检验,可以利用分光光度计来测定其在特定波长下的吸光度,通过吸光度与亚铁离子浓度的关系来进行定量分析。
三、电化学法。
电化学法是利用电化学原理来检验亚铁离子的方法。
常用的电化学方法包括循环伏安法、方波伏安法等。
通过在特定电极上施加电压,观察电流响应来判断亚铁离子的存在和含量。
四、原子吸收光谱法。
原子吸收光谱法是一种高灵敏度的分析方法,可以用于亚铁离子的检验。
其原理是利用原子吸收光谱仪测定样品中亚铁离子对特定波长的吸收情况,从而确定其含量。
五、离子色谱法。
离子色谱法是利用离子交换柱分离和检测样品中的离子成分的方法。
通过选择合适的离子交换柱和检测条件,可以对亚铁离子进行准确的检验和分析。
综上所述,针对亚铁离子的检验方法有多种选择,可以根据实际需要和条件选择合适的方法进行检验。
在实际操作中,需要严格按照操作规程进行,确保检验结果的准确性和可靠性。
希望本文介绍的方法对相关领域的研究和实践有所帮助。

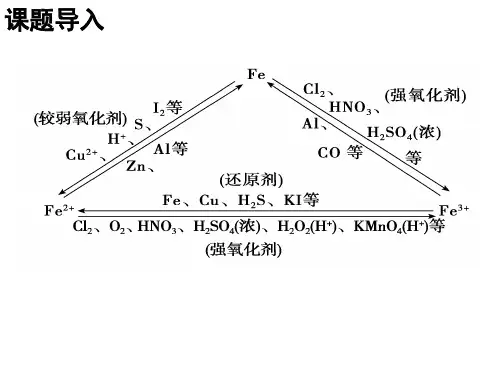
铁离子和亚铁离子的检验方法与化学实验注意事项【要点解读】特别提醒检验Fe2+的注意事项(1)只含Fe2+的溶液:检验Fe2+加入试剂的顺序①加KSCN溶液前,防止加入氧化性的物质,使Fe2+氧化。
②氧化剂不能选用酸性KMnO4溶液,原因:酸性KMnO 4溶液本身显紫红色,对Fe(SCN) 3红色有干扰;酸性KMnO 4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe 2+。
(2)同时含有Fe 2+和Fe 3+的溶液Fe2+对检验Fe 3+无干扰,可以滴加KSCN溶液检验Fe 3+;Fe 3+对检验Fe 2+有干扰,不能采用加KSCN溶液检验Fe 2+,通常向溶液中滴加适量酸性KMnO 4溶液,溶液紫红色褪色说明含有Fe 2+。
(3)检验铁的氧化物中是否有+2价铁时,正确的思路为①步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化盐酸。
②步骤a中,不能选用稀HNO3,原因是稀HNO 3可以将Fe 2+氧化为Fe 3+。
【名师点睛】注意亚铁离子与铁离子性质的区别,检验时必须有明显不同的现象,要排除Fe3+的干扰,利用两离子的性质差异,即亚铁离子具有还原性,可与氯水、高锰酸钾等氧化剂反应,以此解答该题。
【重难点点睛】通常检验三价铁离子的检验方法有:取待测液于试管中,向待测溶液中加入KSCN溶液,溶液马上变成红色说明溶液中有Fe3+,即Fe3++3SCN-=Fe(SCN)3;也可以所以苯酚,铁离子与苯酚发生颜色反应;还可以根据与碱溶液生成红褐色沉淀,判断溶液中存在铁离子。
【名师点睛】先根据Fe3+的特征反应判断溶液不含Fe3+;然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在。
化学实验注意事项1.实验基本技能(1) 固体粉末装入试管的操作,将固体粉末放入纸槽( 或药匙),然后将试管平放,将纸槽(或药匙)送入试管,慢慢直立,取出纸槽(或药匙)即可。