第一章蛋白质化学
- 格式:ppt
- 大小:3.45 MB
- 文档页数:58

羧基与另一个氨基脱水缩合而形成的化学由许多氨基酸借助肽键连接 肽键中的C-N 键具有部分不能旋转,因此,肽键中的C 、O 、N、H 四个原子处于一个平是指构成蛋称pH 值溶液荷相等的兼性离子,即蛋白质分子的净电荷等于零,此时溶液的PH 值称为该蛋白的等电位。
双螺旋解开,变成无规则的线团,此种作用称核酸的DNA 在适链又可重新通过氨键连接,形成原来的双螺旋结构,并恢复其原有的理化性DNA 的复性。
DNA ,DNA ,一条RNA ,只是它们有大部分互补的碱基顺序,也可以复此过程称杂交。
DNA变性时,A 260 DNA 热变性时,通常将%时的温度叫融解温度,DNA 链中,排列顺序和连接方式。
辅基,与酶蛋白的结合比较牢固,不易于酶的必需基团空间结构,直接参与了将作用物转变为产物的反应过程,这个区域较酶的活性理化性质及免疫学丧失,但可用透析、超滤等方法将抑制去抑制剂,故酶活力难以恢复。
是指糖原或葡萄糖在缺氧条是指由糖原分解为葡萄糖又叫Cori 循环。
肌肉糖酵解产生乳酸入血,再至肝合成肝糖原,肝糖原分解成葡萄糖入血到肌肉,再酵解成乳酸,此反应循环进行,叫乳酸循是指由非糖物质转变成葡萄 第五章 脂类代谢是脂类在血液中的运输形式, 连同合成及吸收的磷脂,胆固醇,加上载体蛋白等形成乳糜微粒(CM ),CM 入血后,因其直径大,因其血浆混浊,但数小时后便有澄清,这种现象称为脂肪的廓清。
这是因为CM 在组织毛细血管内皮细胞表面脂蛋白脂肪酶(LPL )的催化下,使CM 中的甘油三酯逐步水解, CM 颗粒逐渐变小。
人们称LPL逐步水解为脂肪酸和甘油,以供其他组织利用,此过程称为脂脂肪酸在肝脏可分解并生成酮只能将酮体经血循环运至肝外组织利用。
在糖尿病等病理情况下,体内大量幼用脂肪,酮体的生成量超过肝外组织利用量时,可引起酮症。
此时血中酮体升高,是指体内需要而又不能目前认为必需脂肪酸有三种,即亚油酸,亚麻酸及脂类是脂肪与类脂的总类脂:是一类物理性质与脂肪相似的物质,主要有磷脂、糖脂、胆固醇及胆固醇脂等,是细胞的膜结构重要组分。

(一)名词解释1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
2.必需氨基酸:指人体(和其它哺乳动物)自身不能合成,机体又必需,需要从饮食中获得的氨基酸。
3. 氨基酸的等电点:指氨基酸的正离子浓度和负离子浓度相等时的pH值,用符号pI表示。
6.构型:指在立体异构体中不对称碳原子上相连的各原子或取代基团的空间排布。
构型的转变伴随着共价键的断裂和重新形成。
7.蛋白质的一级结构:指蛋白质多肽链中氨基酸的排列顺序,以及二硫键的位置。
8.构象:指有机分子中,不改变共价键结构,仅单键周围的原子旋转所产生的原子的空间排布。
一种构象改变为另一种构象时,不涉及共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
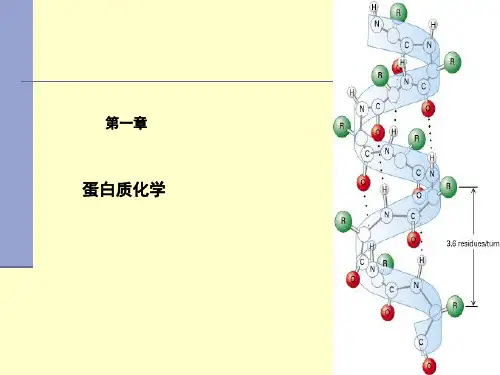
9.蛋白质的二级结构:指在蛋白质分子中的局部区域内,多肽链沿一定方向盘绕和折叠的方式。
10.结构域:指蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。
11.蛋白质的三级结构:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。
13.蛋白质的四级结构:指多亚基蛋白质分子中各个具有三级结构的多肽链以适当方式聚合所呈现的三维结构。
15.超二级结构:指蛋白质分子中相邻的二级结构单位组合在一起所形成的有规则的、在空间上能辨认的二级结构组合体。
17.范德华力:中性原子之间通过瞬间静电相互作用产生的一种弱的分子间的力。
当两个原子之间的距离为它们的范德华半径之和时,范德华力最强。
18.盐析:在蛋白质溶液中加入一定量的高浓度中性盐(如硫酸氨),使蛋白质溶解度降低并沉淀析出的现象称为盐析。
19.盐溶:在蛋白质溶液中加入少量中性盐使蛋白质溶解度增加的现象。
20.蛋白质的变性作用:蛋白质分子的天然构象遭到破坏导致其生物活性丧失的现象。
蛋白质在受到光照、热、有机溶剂以及一些变性剂的作用时,次级键遭到破坏导致天然构象的破坏,但其一级结构不发生改变。

(一)名词解释1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
2.必需氨基酸:指人体(和其它哺乳动物)自身不能合成,机体又必需,需要从饮食中获得的氨基酸。
3. 氨基酸的等电点:指氨基酸的正离子浓度和负离子浓度相等时的pH值,用符号pI表示。
6.构型:指在立体异构体中不对称碳原子上相连的各原子或取代基团的空间排布。
构型的转变伴随着共价键的断裂和重新形成。
7.蛋白质的一级结构:指蛋白质多肽链中氨基酸的排列顺序,以及二硫键的位置。
8.构象:指有机分子中,不改变共价键结构,仅单键周围的原子旋转所产生的原子的空间排布。
一种构象改变为另一种构象时,不涉及共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
9.蛋白质的二级结构:指在蛋白质分子中的局部区域内,多肽链沿一定方向盘绕和折叠的方式。
10.结构域:指蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。
11.蛋白质的三级结构:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。
13.蛋白质的四级结构:指多亚基蛋白质分子中各个具有三级结构的多肽链以适当方式聚合所呈现的三维结构。
15.超二级结构:指蛋白质分子中相邻的二级结构单位组合在一起所形成的有规则的、在空间上能辨认的二级结构组合体。
17.范德华力:中性原子之间通过瞬间静电相互作用产生的一种弱的分子间的力。
当两个原子之间的距离为它们的范德华半径之和时,范德华力最强。
18.盐析:在蛋白质溶液中加入一定量的高浓度中性盐(如硫酸氨),使蛋白质溶解度降低并沉淀析出的现象称为盐析。
19.盐溶:在蛋白质溶液中加入少量中性盐使蛋白质溶解度增加的现象。
20.蛋白质的变性作用:蛋白质分子的天然构象遭到破坏导致其生物活性丧失的现象。
蛋白质在受到光照、热、有机溶剂以及一些变性剂的作用时,次级键遭到破坏导致天然构象的破坏,但其一级结构不发生改变。

第一章蛋白质化学一、填空题1.根据R基团对水分子的亲和性,氨基酸可分成和;根据对动物的营养价值,氨基酸又可分成和。
疏水性氨基酸亲水性氨基酸必需氨基酸非必需氨基酸2.测定一级结构需要的蛋白质的样品纯度不低于。
如果一种蛋白质分子含有二硫键,可使用电泳法对二硫键进行准确定位。
97% 对角线3.目前已发现的蛋白质氨基酸有种,其中2种罕见的氨基酸是和,它们分别由和密码子编码。
22 硒半胱氨酸吡咯赖氨酸UGA UAG4.蛋白质紫外吸收是由三种氨基酸造成的,最大吸收峰在nm。
蛋白质的pI可使用的方法测定,pI处蛋白质的溶解度。
芳香族280 等电聚焦最小5.蛋白质的功能主要由其特定的结构决定。
蛋白质的一级结构决定其高级结构和功能。
α-角蛋白的主要二级结构是,β-角蛋白的二级结构主要是。
三维α-螺旋β-折叠6.蛋白质变性是指蛋白质受到某些理化因素的作用,其结构被破坏、随之丧失的现象。
高级生物功能7.氨基酸与的反应可用于Van Slyke定氮,试剂或可用来测定N端氨基酸。
在蛋白质氨基酸中,只有与茚三酮反应产生黄色物质,其余氨基酸生成物质。
亚硝酸Sanger 丹磺酰氯脯氨酸蓝紫色8.蛋白质的结构一般包括个层次的结构,但肌红蛋白的结构层次只有个。
一种蛋白质的全部三维结构一般称为它的构象。
二级结构是指,它是由氨基酸残基的氢键决定的。
最常见的二级结构由、、和,其中能改变肽链走向的二级结构是。
4 3多肽链的主链骨架本身在空间上有规律的折叠和盘绕非侧链基团α-螺旋β-折叠β-转角无规卷曲β-转角二、是非题1.氨基酸可分为亲水氨基酸和疏水氨基酸,其中亲水氨基酸溶于水,疏水氨基酸一般不溶于水。
错2.到目前为止,已在蛋白质分子中发现22种L型氨基酸。
错3.可使用双缩脲反应区分二肽和氨基酸。
错4.一种特定的氨基酸序列通常能决定几种不同的稳定的特定三维结构。
错5.许多明显不相关的氨基酸序列能产生相同的三维蛋白质折叠。
正确6.吡咯赖氨酸和羟赖氨酸都属于蛋白质翻译好后的赖氨酸残基的修饰产物。

第一章蛋白质化学一、填空题1.根据R基团对水分子的亲和性,氨基酸可分成和;根据对动物的营养价值,氨基酸又可分成和。
疏水性氨基酸亲水性氨基酸必需氨基酸非必需氨基酸2.测定一级结构需要的蛋白质的样品纯度不低于。
如果一种蛋白质分子含有二硫键,可使用电泳法对二硫键进行准确定位。
97% 对角线3.目前已发现的蛋白质氨基酸有种,其中2种罕见的氨基酸是和,它们分别由和密码子编码。
22 硒半胱氨酸吡咯赖氨酸UGA UAG4.蛋白质紫外吸收是由三种氨基酸造成的,最大吸收峰在nm。
蛋白质的pI可使用的方法测定,pI处蛋白质的溶解度。
芳香族280 等电聚焦最小5.蛋白质的功能主要由其特定的结构决定。
蛋白质的一级结构决定其高级结构和功能。
α-角蛋白的主要二级结构是,β-角蛋白的二级结构主要是。
三维α-螺旋β-折叠6.蛋白质变性是指蛋白质受到某些理化因素的作用,其结构被破坏、随之丧失的现象。
高级生物功能7.氨基酸与的反应可用于Van Slyke定氮,试剂或可用来测定N端氨基酸。
在蛋白质氨基酸中,只有与茚三酮反应产生黄色物质,其余氨基酸生成物质。
亚硝酸Sanger 丹磺酰氯脯氨酸蓝紫色8.蛋白质的结构一般包括个层次的结构,但肌红蛋白的结构层次只有个。
一种蛋白质的全部三维结构一般称为它的构象。
二级结构是指,它是由氨基酸残基的氢键决定的。
最常见的二级结构由、、和,其中能改变肽链走向的二级结构是。
4 3多肽链的主链骨架本身在空间上有规律的折叠和盘绕非侧链基团α-螺旋β-折叠β-转角无规卷曲β-转角二、是非题1.氨基酸可分为亲水氨基酸和疏水氨基酸,其中亲水氨基酸溶于水,疏水氨基酸一般不溶于水。
错2.到目前为止,已在蛋白质分子中发现22种L型氨基酸。
错3.可使用双缩脲反应区分二肽和氨基酸。
错4.一种特定的氨基酸序列通常能决定几种不同的稳定的特定三维结构。
错5.许多明显不相关的氨基酸序列能产生相同的三维蛋白质折叠。
正确6.吡咯赖氨酸和羟赖氨酸都属于蛋白质翻译好后的赖氨酸残基的修饰产物。





第一章蛋白质化学一、选择题:(一)A型题1.世界上第一个人工合成的蛋白质是一种A.酶B.抗生素C.激素D.抗体E.载体2.关于蛋白质α螺旋的正确描述是:A.蛋白质的二级结构是α螺旋B.每一个螺旋含5.4个氨基酸C.螺距为3.6nmD.α螺旋是左手螺旋E.氨基酸残基侧链的结构影响α螺旋的形成及稳定性3.选出非编码氨基酸.A.甘氨酸;B.胱氨酸;C.赖氨酸;D.缬氨酸;E.组氨酸;4.选出不含硫的氨基酸.A.胱氨酸;B.牛磺酸;C.甲硫氨酸;D.组氨酸;E.苯甲酸;5.能在多肽链之间形成二硫键的氨基酸是A.甘氨酸;B.天冬氨酸;C.酪氨酸;D.丙氨酸;E.半胱氨酸6.泛酸是人体所需的一种维生素,但它本身没有生物活性,而是在人体内与ATP和一种氨基酸合成为辅酶A后才在代谢中发挥作用.这种氨基酸是:A.丝氨酸B.色氨酸C.苯丙氨酸D.半胱氨酸E.谷氨酰胺7.不出现于蛋白质中的氨基酸是:A.半胱氨酸B.甲硫氨酸C.瓜氨酸D.胱氨酸E.丝氨酸8.维系蛋白质分子中α螺旋的化学键是A.肽键B.离子键C.二硫键D.氢键E.疏水键9.从组织提取液中沉淀蛋白质而又不使之变性的方法是加入A.硫酸铵B.三氯醋酸C.氯化汞D.钨酸E.1N盐酸10.指出下列氨基酸中的必需氨基酸A.胱氨酸B.半胱氨酸C.脯氨酸D.丝氨酸E.苏氨酸11.蛋白质变性是由于:A.氨基酸排列顺序的改变B.氨基酸组成的改变C.肽键的断裂D.蛋白质空间构象的破坏E.蛋白质的水解12.盐析法沉淀蛋白质的原理是A.中和电荷、破坏水化膜B.与蛋白质结合成不溶性蛋白盐C.降低蛋白质溶液的介电常数D.改变蛋白质溶液的等电点E.使蛋白质溶液的pH=pI13.完全由氨基酸构成的蛋白质称为单纯蛋白质,在单纯蛋白质分子中含量最少的元素是:A.CB.HC.OD.NE.S14.根据元素组成的区别,从下列氨基酸中排除一种氨基酸:A.组氨酸B.色氨酸C.胱氨酸D.精氨酸E.脯氨酸15.在一个分子结构中,如果存在由两种或两种以上的原子构成的环状结构,我们就说该分子结构中存在杂环结构,下列哪种分子肯定不存在杂环结构?A.单糖类B.类固醇C.氨基酸D.核苷酸E.维生素16.标准氨基酸的分子结构中没有的基团是:A.氨基B.甲基C.羟甲基D.醛基E.羟基17.一个单纯蛋白质分子结构中不一定存在的化学键是:A.疏水键B.肽键C.离子键D.二硫键E.氢键18.一个蛋白质分子结构中含有二硫键,所以该分子结构中一定有:A.甲硫氨酸B.赖氨酸C.半胱氨酸D.色氨酸E.天冬氨酸19.蛋白质的哪种结构不会因氢键的改变而改变:A.一级结构B.二级结构C.三级结构D.四级结构E.以上都会20.根据基团结构,从下列氨基酸中排除一种氨基酸:A.苯丙氨酸B.色氨酸C.脯氨酸D.赖氨酸E.谷氨酸21.下列氨基酸中除哪个以外属于同一类氨基酸?A.甲硫氨酸B.牛磺酸C.丙氨酸D.谷氨酸E.天冬氨酸22.两种蛋白质A和B,现经分析确知A的等电点比B高,所以下面一种氨基酸在A的含量可能比B多,它是:A.苯丙氨酸B.赖氨酸C.天冬氨酸D.甲硫氨酸E.谷氨酸23.一个蛋白质多肽链由100个氨基酸残基构成,它的分子量的可能范围是:A.6 000-8 000B.8 000-10 000C.10 000-12 000D.12 000-14 000E.14 000-16 00024.在只有氨基酸的水溶液中,下列哪种氨基酸的水溶液的pH值最低?A.精氨酸B.赖氨酸C.谷氨酸D.天冬酰胺E.色氨酸25.下列哪个化学反应是氨基酸的呈色反应?A.脱羧基反应B.双缩脲反应C.氧化反应D.茚三酮反应E.合成蛋白质26.请选出分子量较大的氨基酸:A.酪氨酸B.亮氨酸C.色氨酸D.精氨酸E.组氨酸27.下列哪个成份在人体细胞内含量最稳定:A.糖原B.脂肪C.蛋白质D.DNAE.维生素28.蛋白质的主链构象属于:A.一级结构;B.二级结构;C.三级结构;D.四级结构;E.空间结构;29.下列叙述不正确的是:A.蛋白质的结构单位是氨基酸;B.所有的氨基酸都是无色的;C.含两个以上肽键的化合物都能在碱性条件下与氯化铜作用显色;D.变性导致蛋白质沉淀;E.局部改变蛋白质的构象将导致其功能改变;30.下列叙述不正确的是:A.破坏蛋白质的水化膜并中和其所带电荷可以导致蛋白质沉淀;B.变性并没有改变蛋白质的化学结构;C.盐析是用高浓度的盐沉淀水溶液中的蛋白质;D.有四级结构的蛋白质都有两条以上多肽链;E.蛋白质溶液的酸碱度越偏离其等电点越容易沉淀;(二)X型题:31.存在于蛋白质分子中,而无遗传密码的氨基酸有A.羟脯氨酸B.谷氨酰胺C.羟赖氨酸D.胱氨酸E.鸟氨酸32.含硫氨基酸包括A.甲硫氨酸B.苏氨酸C.组氨酸D.半胱氨酸E.牛磺酸33.根据侧链R的结构可将氨基酸分为哪几类:A.脂肪族氨基酸B.酸性氨基酸C.芳香族氨基酸D.杂环族氨基酸E.碱性氨基酸34.关于α-螺旋结构的正确叙述是A.螺旋中每3.6个氨基酸残基为一周B.为右手螺旋结构C.两螺旋之间借二硫键维持其稳定D.氨基酸侧链R基团分布在螺旋外侧E.酸性氨基酸集中区域有利于螺旋形成35.下列具有四级结构的蛋白质有:A.血红蛋白B.肌红蛋白C.清蛋白D.乳酸脱氢酶E.丙酮酸脱氢酶系36.蛋白质分子的亚基之间可能有哪些化学键?A.二硫键B.氢键C.离子键D.疏水键E.范德华力;37.蛋白质与多肽的区别包括哪些方面?A.所含肽链数;B.分子量大小;C.构象的重要性;D.是否含辅基;E.氨基酸组成;38.碱性氨基酸包括A.精氨酸B.组氨酸C.色氨酸D.赖氨酸E.谷氨酸39.人体需要必需氨基酸,是为了:A.合成蛋白质;B.合成维生素;C.合成激素;D.合成谷胱甘肽;E.合成非必需氨基酸;40.下列哪些氨基酸残基的侧链通过形成氢键参与维持蛋白质空间结构?A.半胱氨酸B.天冬氨酸C.苏氨酸D.谷氨酰胺E.赖氨酸41.破坏氢键将改变蛋白质哪些结构A.一级结构B.二级结构C.三级结构D.四级结构E.所有结构42.氨基酸的可电离基团包括:A.氨基B.酰胺基C.羧基D.巯基E.胍基二、名词43.标准氨基酸44.氨基酸的等电点45.肽46.肽键47.肽链主链48.肽链的方向49.蛋白质的一级结构50.蛋白质的二级结构51.蛋白质的三级结构52.蛋白质的四级结构53.蛋白质的亚基54.蛋白质的变性55.蛋白质的等电点56.沉降系数57.透析三、填空58.20种标准氨基酸根据侧链电离性分为三类,其中属于中性氨基酸有种,酸性氨基酸种,碱性氨基酸种。
01第⼀章蛋⽩质化学01 第⼀章蛋⽩质化学第⼀章蛋⽩质化学蛋⽩质是最重要的⽣物⼤分⼦,同时蛋⽩质化学在⽣物化学中也是第⼀重要的部分。
要学好⽣物化学就⼀定要⾸先学好蛋⽩质化学。
蛋⽩质化学这⼀章内容很多,重点是蛋⽩质的结构和功能,其难点是掌握蛋⽩质或氨基酸的两性解离。
为使读者更好地掌握两性解离,本章以氨基酸的两性解离为例进⾏较详细的解释。
当可解离基团HA或A-发⽣解离时:KaKb,,,, HA,,,H,A或A,HO,,,HA,OH2其中Ka与Kb分别为酸式解离常与碱式解离常数:+- Ka=[H]×[A]/[HA]-- Kb=[HA]×[OH]/([A]×[HO]) 2-+-14由于[HO]可近似看作为1,⽽[OH)×[H]=10; 2--14+ [OH]=10/[H]- Kb=[HA]×[OH-]/[A]--14+ =([HA]/[A]×(10/[H])-+-14 =[[HA]/([A]×[H])]10-14 =10 × 1/Ka-14 Ka×Kb=10为了使⽤上的⽅便,我们把X的负对数⽤pX表⽰,把上式两边取负对数: pKa+pKb=14这样我们就可以清楚地看到对于同⼀对解离基团的pKa与pKb之间的关系。
⼀般情况下我们都使⽤pKa,⽽pKb使⽤则较少。
在处理pH值与某⼀可解离基团解离程度之间的关系时,我们就要使⽤Henderson-Hasselbalch⽅程,此⽅程是怎样来的呢,请看:Ka,, HA,,,H,A+-各成分的摩尔浓度为[HA] [H][A]+-+-Ka=([H]×[A]/[HA]=[H]×([A]/[HA])-两边取负对数:pKa=pH-Ig([A]/[HA])-Ph=pKa+1g([A]/[HA])=pKa+1g([碱]/[碱])+-上式即为Hendreson-Hasselbalch⽅程。