必修二有机物化学方程式
- 格式:doc
- 大小:53.50 KB
- 文档页数:7

高中化学全部化学方程式汇总(有机和无机)【注意】以下是有机和无机化学方程式的汇总,请按需使用或参考。
为了排版整洁,请在使用时进行适当的调整和修改。
一、有机化学方程式1. 碳氢化合物反应方程式1.1 烷烃燃烧反应:CnH2n+2 + (n + (n/2 + 1)/2)O2 → nCO2 + (n + (n/2 - 1)/2)H2O1.2 烯烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O1.3 异构烷烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O2. 醇类反应方程式2.1 醇的燃烧反应:CnH2n+1OH + (n + (n+1)/2)O2 → nCO2 + (n+1)H2O2.2 醇的脱水反应:CnH2n+1OH → CnH2n + H2O3. 酚类反应方程式3.1 酚的燃烧反应:C6H6O + 15/2O2 → 6CO2 + 3H2O 3.2 酚的酸碱中和反应:C6H6O + NaOH → C6H5ONa + H2O 4. 酯类反应方程式4.1 酯的酸水解反应:RCOOR' + H2O → RCOOH + R'OH 4.2 酯的碱水解反应:RCOOR' + NaOH → RCOONa + R'OH 5. 醛和酮类反应方程式5.1 氧化性还原反应:RCHO + [O] → RCOOH5.2 醛的酸碱反应:RCHO + NaOH → RCOONa + H2O 6. 醚类反应方程式6.1 醚的加热裂解反应:ROR' → R'H + R'OH6.2 醚的酸水解反应:ROR' + H2O → ROH + R'OH7. 脂肪酸类反应方程式7.1 脂肪酸的酸碱反应:RCOOH + NaOH → RCOONa + H2O7.2 脂肪酸的酯化反应:RCOOH + R'OH → RCOOR' + H2O二、无机化学方程式1. 钠和氧的反应方程式4Na + O2 → 2Na2O2. 钙和水的反应方程式Ca + 2H2O → Ca(OH)2 + H23. 硝酸和铜的反应方程式Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O 4. 二氧化碳和水的反应方程式CO2 + H2O → H2CO35. 硝酸和氢氧化钠的反应方程式2NaOH + HNO3 → NaNO3 + H2O6. 硫化氢和氯的反应方程式H2S + Cl2 → 2HCl + S7. 氧化锌和硫酸的反应方程式ZnO + H2SO4 → ZnSO4 + H2O8. 氯气和钾溶液的反应方程式Cl2 + 2KOH → KCl + KClO + H2O9. 溴和钾的反应方程式2K + Br2 → 2KBr10. 硫和氧的反应方程式S + O2 → SO2以上是高中化学的部分有机和无机方程式的汇总,希望能对你的学习有所帮助。

必修二有机物化学方程式有机物化学方程式1.甲烷燃烧CH+2O→CO+2HO(条件为点燃) 24222.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH→C+2H(条件为高温高压,催化剂)243.甲烷和氯气发生取代反应CH+Cl→CHCl+HCl CHCl+Cl→CHCl+HCl 2324322CHCl+Cl→CHCl+HCl CHCl+Cl→CCl+HCl (条件都为光照。
)42323224.实验室制甲烷CHCOONa+NaOH→NaCO+CH(条件是CaO 加热)42335.乙烯燃烧CH=CH+3O→2CO+2HO(条件为点燃)222226.乙烯和溴水CH=CH+Br→CHBr-CHBr 222227.乙烯和水CH=CH+HO→CH3CH2OH (条件为催化剂)2228.乙烯和氯化氢CH=CH+HCl→CH-CHCl 22329.乙烯和氢气CH=CH+H→CH-CH (条件为催化剂)3223210.乙烯聚合nCH=CH→-[-CH-CH-]n-(条件为催化剂)222211.氯乙烯聚合nCH=CHCl→-[-CH-CHCl-]-(条件为催化剂)n2212.实验室制乙烯CHCHOH→CH=CH↑+HO (条件为加热,浓HSO)422232213.乙炔燃烧CH+3O→2CO+HO (条件为点燃)2222214.乙炔和溴水CH+2Br→CHBr 42222215.乙炔和氯化氢两步反应:CH+HCl→CHCl--------CHCl+HCl→CHCl 2 2232324216.乙炔和氢气两步反应:CH+H→CH →CH+2H→CH (条件为催化6422222222剂)17.实验室制乙炔CaC+2HO→Ca(OH)+CH↑2222218.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO === CaO + CO 2CaO+5C===2CaC+CO 2223CaC+2HO→CH+Ca(OH)C+HO===CO+H-----高温2222222CH+H→CH----乙炔加成生成乙烯CH可聚合42224 2219.苯燃烧2CH+15O→12CO+6HO (条件为点燃)2262620.苯和液溴的取代CH+Br→CHBr+HBr 5666221.苯和浓硫酸浓硝酸CH+HNO→CHNO+HO (条件为浓硫酸)265623622.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H22Ca+H2O )2CH3COOH+CaO→(CH3CH2 乙酸和氧化钙29.30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
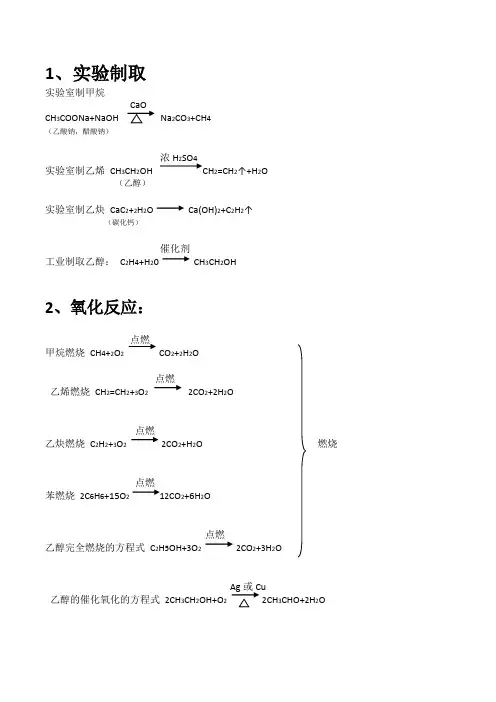
1、实验制取实验室制甲烷CH3COONa+NaOH Na2CO3+CH4(乙酸钠,醋酸钠)浓H2SO4实验室制乙烯CH3CH2OH CH2=CH2↑+H2O(乙醇)实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑(碳化钙)催化剂工业制取乙醇:C2H4+H20 CH3CH2OH2、氧化反应:点燃甲烷燃烧CH4+2O2CO2+2H2O点燃乙烯燃烧CH2=CH2+3O22CO2+2H2O点燃乙炔燃烧C2H2+3O22CO2+H2O 燃烧点燃苯燃烧2C6H6+15O212CO2+6H2O点燃乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O甲烷和氯气发生取代反应光照CH4+Cl2CH3Cl+HCl光照CH3Cl+Cl2CH2Cl2+HCl光照CH2Cl2+Cl2CHCl3+HCl光照CHCl3+Cl2CCl4+HCl(注:反应物是卤素单质的蒸汽)苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O(硝基苯)FeBr3苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr浓硫酸乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)4、加成反应:乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br催化剂乙烯和水CH2=CH2+H20 加热加压CH3CH2OH催化剂乙烯和氯化氢CH2=H2+HCl CH3-CH2Cl乙烯和氢气CH2=CH2+H2CH3-CH3苯和氢气C6H6+3H2C6H12催化剂乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)催化剂氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)6、酯化反应:浓硫酸乙醇乙酸反应的方程式CH3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)(乙酸乙酯)7、补充:乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。

高中化学人教版必修二有机化合物单元知识点总结甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+Na OH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)苯和氢气C6H6+3H2→C6H12 (条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2C H3+H2O (条件为催化剂浓硫酸140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜H CHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)乙炔的实验室制法:CaC2+2H2O→Ca(OH)2+C2H2↑实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4 (条件是CaO 加热)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑工业制取乙醇:C2H4+H20→CH3CH2OH (条件为催化剂)乙醛的制取乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)乙烯氧化法:2 CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热)乙酸的制取乙醛氧化为乙酸:2CH3CHO+O2→2CH3COOH(条件为催化剂和加温)加聚反应:乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)氧化反应:甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)乙醛的催化氧化:CH3CHO+O2→2CH3COOH (条件为催化剂加热)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。

高中必修二化学方程式大全汇总(精华版)方程式是化学学科内容的重中之重。
下面是高中必修二化学方程式,希望对大家有所帮助。
高中必修二化学方程式1必修二各章节化学方程式第一章物质结构元素周期律1、li与o2反应(点燃):4li+o22li2ona与o2反应(点燃):2na+o2na2o2na与h2o反应:2na+2h2o===2naoh+h2↑k与h2o反应:2k+2h2o===2koh+h2↑2、卤素单质f2、cl2、br2、i2与氢气反应:f2+h2===2hfcl2+h2===2hclbr2+h2===2bri2+h2===2hi3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①cl2+2nabr===br2+2nacl②cl2+2nai===i2+2nacl(2)溴水与碘化钠溶液反应:br2+2nai===i2+2nabr4、mg与h2o反应:mg+2h2o===mg(oh)2+h2↑al与hcl反应:2al+6hcl===2alcl3+3h2↑mg与hcl反应:mg+2hcl===mgcl2+h2↑点击查看:高一必修二常用化学方程式总结第二章化学反应与能量1、ba(oh)2?8h2o与nh4cl的反应:ba(oh)2·8h2o+2nh4cl==bacl2+2nh3↑+10h2o2、原电池原理典型的原电池(zn-cu原电池)负极(锌):zn-2e-===zn2+(氧化反应)正极(铜):2h++2e-===h2↑(还原反应)、用电子式表示电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:zn+2h+===zn2++h2↑3、h2o2在催化剂作用下受热分解:2h2o22h2o+o2↑4、na2so4与cacl2反应:na2so4+cacl2===caso4↓+na2co35、高炉炼铁:2c+o2===2cofe2o3+3co==2fe+3co2第三章有机化合物1、甲烷的主要化学性质(1)氧化反应(与o2的反应):ch4(g)+2o2(g)co2(g)+2h2o(l)(2)取代反应(与cl2在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质(1)氧化反应(与o2的反应):c2h4+3o22co2+2h2o(2)加成反应((与br2的反应):(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:ch2=ch2+h2ch3ch3ch2=ch2+hclch3ch2cl(一氯乙烷)ch2=ch2+h2och3ch2oh(乙醇)(4)聚合反应:(乙烯制聚乙烯)(氯乙烯制聚氯乙烯)3、苯的主要化学性质:(1)氧化反应(与o2的反应):2c6h6+15o212co2+6h2o br(2)取代反应:①与br2的反应:+br2+hbr②苯与硝酸(用hono2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
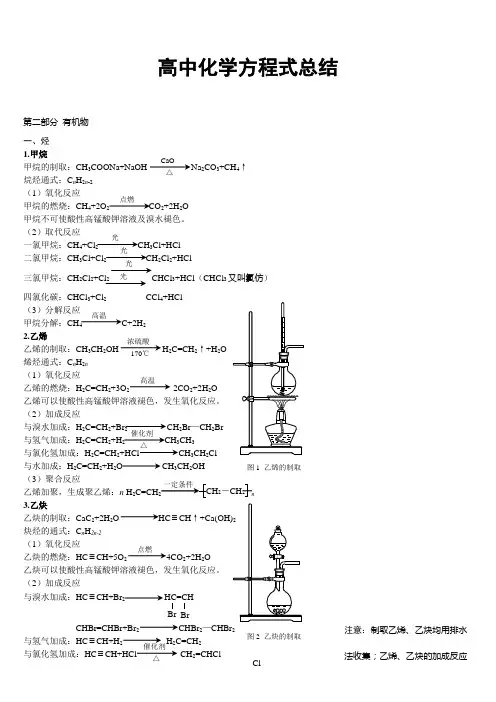

必修二有机化学方程式总结甲烷和Cl2: CH4+Cl2 CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HCl甲烷燃烧: CH4+2O2 点CO2+2H2O甲烷分解: CH4 1000℃C+2H2乙烯燃烧: C2H4 +3O2 点2CO2+2H2O乙烯与Br2: C2H4+ Br2 C2H4Br2乙烯与H2: C2H4+H2 催C2H6乙烯与HX: C2H4+HX 催CH3CH2X乙烯与H2O: C2H4+H2O 催CH3CH2OH乙烯的加聚: nC2H4 催[ CH2-CH2 ] n苯的燃烧: +15O2 点12CO2+6H2O苯的溴代: +Br2 Br苯的硝化: +HNO3 浓硫酸50-60℃NO2 +H2O 苯的磺化: +H2SO4(浓) 70-80℃SO3H +H2O 苯与H2 : +3H2 Ni △乙醇和钠: 2C2H5OH+2Na 2CH3COONa+H2乙醇燃烧: C2H5OH+O2 点2CO2+3H2O乙醇催化氧化: 2C2H5OH+O2 Cu △2CH3CHO+2H2O乙醇分子内脱水: C2H5OH 浓H2SO4 170℃CH2=CH2 +H2O乙醇分子间脱水: 2C2H5OH浓H2SO4 140℃CH3CH2OC2H5+H2O乙醇与HX: C2H5OH+HX C2H5OX+H2O乙酸与钠: 2CH3COOH+Na 2 CH3COONa+H2O乙酸与NaOH: CH3COOH+NaOH CH3COONa+H2O乙酸Na2CO3: CH3COOH+Na2CO3 CH3COONa+H2O+CO2乙醇与乙酸: CH3COOH+ C2H5OH 浓硫酸△CH3COOC2H5+H2O乙酸乙酯水解: CH3COOC2H5+H2O △CH3COOH+ C2H5OH 乙酸乙酯皂化: CH3COOC2H5+NaOH △CH3COONa+ C2H5OH 蔗糖水解: C12H22O11蔗+H2O 稀硫酸C6H10O6葡+ C6H10O6果麦芽糖水解: C12H22O11麦+H2O 催 2 C6H10O6葡纤维素水解: (C6H10O5)n纤+H2O 催n C6H10O6葡淀粉水解: (C6H10O5)n淀+H2O 催 nC6H10O6葡硬脂酸甘油酯: C17H35COOCH2C17H35COOCH2C17H35COOCH2软质酸甘油酯: C15H35COOCH2C15H35COOCH2C15H35COOCH2油酸甘油酯: C17H33COOCH2C17H33COOCH2C17H33COOCH2。
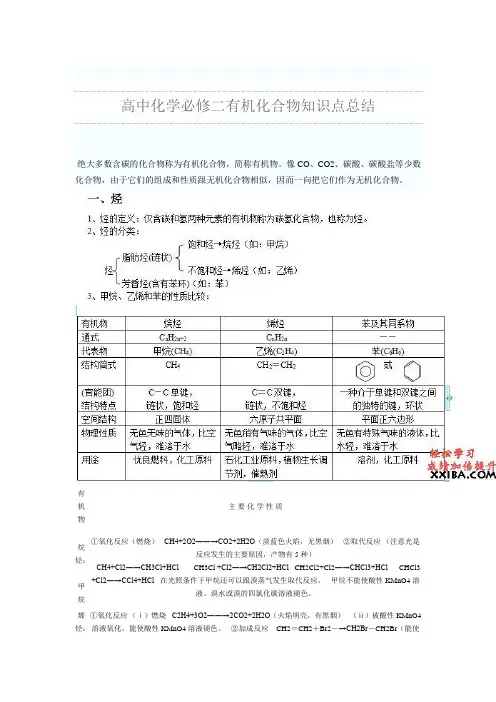
高中化学必修二有机化合物知识点总结绝大多数含碳的化合物称为有机化合物,简称有机物。
像 CO、CO2、碳酸、碳酸盐等少数 化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
有机物烷烃: 甲烷烯烃: 乙烯主要化学性质①氧化反应(燃烧) CH4+2O2――→CO2+2H2O(淡蓝色火焰,无黑烟) ②取代反应 (注意光是反应发生的主要原因,产物有 5 种) CH4+Cl2―→CH3Cl+HCl CH3Cl +Cl2―→CH2Cl2+HCl CH2Cl2+Cl2―→CHCl3+HCl CHCl3+Cl2―→CCl4+HCl在光照条件下甲烷还可以跟溴蒸气发生取代反应, 甲烷不能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。
①氧化反应 (ⅰ)燃烧 C2H4+3O2――→2CO2+2H2O(火焰明亮,有黑烟) (ⅱ)被酸性 KMnO4 溶液氧化,能使酸性 KMnO4 溶液褪色。
②加成反应 CH2=CH2+Br2-→CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)在一定条件下,乙烯还可以与 H2、Cl2、HCl、H2O 等发生加成反应 CH2=CH2+H2――→CH3CH3CH2=CH2+HCl-→CH3CH2Cl(氯乙烷) CH2=CH2+H2O――→CH3CH2OH(制乙醇) ③加聚反应 nCH2=CH2――→-CH2-CH2-n(聚乙烯) 乙烯能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。
常利用该反应鉴别烷烃和烯烃,如鉴别甲烷和乙烯。
①氧化反应(燃烧)2C6H6+15O2―→12CO2+6H2O(火焰明亮,有浓烟)②取代反应苯环上的氢原子被溴原子、硝基取代。
苯+Br2――→ +HBr+HNO3――→ +H2O③加成反应+3H2――→苯不能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。
、同系物、同分异构体、同素异形体、同位素比较。
概念同系物同分异构体同素异形体同位素定义结构相似,在分子组成上 分子式相同而结相差一个或若干个 CH2 原 构式不同的化合子团的物质物的互称质子数相同而中子数不 由同种元素组成的不同的同一元素的不同原 同单质的互称子的互称分子式不同相同元素符号表示相同,分 子式可不同——结构相似不同不同——研究对象化合物化合物单质原子6、烷烃的命名:(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。


光照 光照 光照 高温 CaO △Ni △ 光照 必修2有机化学方程式汇总1. CH 4 + 2O 2 CO 2 + 2H 2O 甲烷的燃烧反应2. CH 4 + Cl 2 CH 3Cl + HCl3. CH 3Cl + Cl 2 CH 2Cl 2 + HCl4. CH 2Cl + Cl 2 CHCl 3 + HCl5. CHCl 3 + Cl 2 CCl 4+ HCl6. CH 4 C +2H 2 甲烷受热分解(隔绝空气)7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 甲烷的实验室制备(了解)8. C 2H 4 + 3O 2 2CO 2 + 2H 2O 乙烯的燃烧反应9. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br10. CH 2 = CH 23CH 2OH11. CH 2 = CH 23—CH 2Br 12. CH 2 = CH 23—CH 3 13. nCH 2 = CH CH 2 ] n 乙烯的加聚反应 14. 2C 6H 6 +15O 2 12CO 2 + 6H 2O 苯的燃烧反应15. + Br 2 苯的卤代反应16. + HO 2 +H 2O 苯的硝化反应17. + HO 3H+H 2O 苯的磺化反应(了解)18. + 3H 2 苯的加成反应 -NO 2 2O 甲苯硝化反应制TNT (了解)20. C 2H 6O+ 3O 2 2CO 2 + 3H 2O 乙醇的燃烧反应21. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 乙醇的置换反应 甲烷的取代反应乙烯的加成反应点燃 点燃 点燃 点燃Cu/Ag △ 浓硫酸 170℃浓硫酸 140℃催化剂 催化剂 催化剂 催化剂 催化剂 △ 22. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 乙醇的催化氧化 23. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 乙醇的消去反应 24. C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 分子间脱水成醚 25. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 26.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑ 27. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑28. CH 3COOH + NaOH CH 3COONa + H 2O 29. 2CH 3COOH + Cu(OH)2 2Cu + 2H 2O 30. CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O 酯化反应31. CH 3COOCH 2CH 33COONa+CH 3CH 2OH 酯的水解32. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 生理氧化反应(有氧呼吸)33. C 6H 12O 6 2CH 3CH 2OH + 2CO 2 发酵生成酒精(无氧呼吸)34. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6 蔗糖 葡萄糖 果糖35. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖 36. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖37. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 乙酸的酸性 双糖和多糖的水解 (实验室制乙烯的原理) (了解)(了解)。
高中化学必修二有机化学方程式篇一:必修2有机化学方程式汇总必修2有机化学方程式汇总1. CH4 + 2O CO2 + 2H2O 甲烷的燃烧反应2. CH4 + Cl2 CH3Cl + HCl3. CH3Cl + Cl2 CH2Cl2 + HCl4. CH2Cl + Cl光照CHCl3 + HCl 光照光照点燃甲烷的取代反应5. CHCl3 + Cl CCl4+ HCl6. CH4C +2H2 甲烷受热分解(隔绝空气)7. CH3COONa + NaOH △CH4↑+ Na2CO3甲烷的实验室制备(了解)8. C2H4 + 3O2 2CO2 + 2H2O乙烯的燃烧反应9. CH2 = CH2 + Br CH2Br—CH2Br10. CH2 = CH23CH2OH11. CH2 = CH2CaO 高温光照点燃3—CH2Br 乙烯的加成反应12. CH2 = CH23—CH313. nCH2 = CHCH2乙烯的加聚反应14. 2C6H6 +15O2 12CO2 + 6H2O苯的燃烧反应15. + Br2 苯的卤代反应16. + HO2 +H2O苯的硝化反应17. + HO3H+H2O苯的磺化反应(了解)18. + 3H2 △苯的加成反应Ni -NO2 2O 甲苯硝化反应制TNT(了解)20. C2H6O+ 3O2 2CO2 + 3H2O乙醇的燃烧反应21. 2CH3CH22CH3CH2ONa + H2↑乙醇的置换反应22. 2CH3CH2OH+O2Cu/Ag 2CH3CHO + 2H2O 乙醇的催化氧化△23. CH3CH2OH 浓硫酸 2 = C H2↑+ H2O 乙醇的消去反应(实验室制乙烯的原理)170℃24. C2H5OH+C2H5140℃C2H5OC2H5+H2O 分子间脱水成醚(了解)25. 2CH3COOH+2Na 2CH3COONa+H2↑26.2CH3COOH+Na2CO2CH3COONa+H2O+CO2↑ 27. CH33 CH3COONa+H2O+CO2↑28. CH3COOH + NaOH CH3COONa + H2O 29. 2CH3COOH + Cu(OH)(CHCOO)2Cu + 2H2O 30. CH3COOH+CH3CH23COOCH2CH3 +H2O 酯化反应31. CH3COOCH2CH33COONa+CH3CH2OH 酯的水解32. C6H12O6 (s) + 6O 6CO2 (g) + 6H2O (l) 生理氧化反应(有氧呼吸)33. C6H12O6 2CH3CH2OH + 2CO2发酵生成酒精34. C12H22O11+H2OC6H12O6+ C6H12O6蔗糖葡萄糖果糖 35. C12H22O11 + H2O 催化剂2C6H12O6麦芽唐葡萄糖催化剂催化剂浓硫酸乙酸的酸性(了解)36. (C6H10O5)n + nH2n C6H12O6淀粉葡萄糖37. (C6H10O5)n + nH2催化剂n C6H12O6 △纤维素葡萄糖催化剂双糖和多糖的水解篇二:必修2有机化学方程式汇总必修2有机化学方程式汇总1. CH4 + 2O CO2 + 2H2O 甲烷的燃烧反应2. CH4 + Cl2CH3Cl + HCl3. CH3Cl + Cl2CH2Cl2 + HCl4. CH2Cl + Cl光照CHCl3 + HCl 光照光照点燃甲烷的取代反应5. CHCl3 + Cl CCl4+ HCl6. CHC +2H2 甲烷受热分解(隔绝空气)7. CH3COONa + NaOH △CH4↑+ Na2CO3甲烷的实验室制备(了解)8. C2H4 + 3O2 点燃2CO2 + 2H2O乙烯的燃烧反应9. CH2 = CH2CH2Br—CH2B(来自: 小龙文档网:高中化学必修二有机化学方程式)r10. CH2 = CH23CH2OH11. CH2 = CH2CH3—CH2Br CaO 高温光照乙烯的加成反应12. CH2 = CH23—CH3 13. nCH2 CH 乙烯的加聚反应14. 2C6H6 +15O2 12CO2 + 6H2O苯的燃烧反应15. + Br2 苯的卤代反应16. NO2 +H2O苯的硝化反应17. 3H+H2O苯的磺化反应(了解)18. + 3H2 △苯的加成反应Ni 点燃-NO2 2O 甲苯硝化反应制TNT(了解)20. C2H6O+ 3O2点燃2CO2 + 3H2O乙醇的燃烧反应21. 2CH3CH2 2CH3CH2ONa + H2↑乙醇的置换反应22. 2CH3CH2OH+O2 Cu/Ag 2CH3CHO + 2H2O 乙醇的催化氧化△CH2 = CH2↑+ H2O 乙醇的消去反应23. CH3CH2OH 浓硫酸(实验室制乙烯的原理)170℃浓硫酸24. C2H5OH+C2H5 C2H5OC2H5+H2O 分子间脱水成醚(了解)140℃25. 2CH3 2CH3COO Na+H2↑26.2CH3COOH+Na232CH3COONa+H2O+CO2↑乙酸的酸性27. CH33 CH3COONa+H2O+CO2↑28. CH3 CH3COONa + H2O29. 2CH33COO)2Cu + 2H2O30. CH3COOH+CH3 CH3COOCH2CH3 +H2O 酯化反应31. CH3COOCH2CH33COONa+CH3CH2OH酯的水解32. C6H12O6 (s) + 6O 6CO2 (g) + 6H2O (l) 生理氧化反应(有氧呼吸)33. C6H12O催化剂6 2CH催化剂3CH 2OH + 2CO2发酵生成酒精(无氧呼吸)34. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖35. C催化剂12H22O11 + H22C6H12O6麦芽唐葡萄糖36. (C催化剂双糖和多糖的水解6H10O5)n + nH2 n C6H12O6淀粉葡萄糖37. (C催化剂6H10O5)n + nH2 △n C6H12O6纤维素葡萄糖(了解)篇三:必修二_有机化学_方程式总结必修二有机化学方程式总结甲烷和Cl2:CH4+Cl2光CH3Cl+HClCH3Cl+Cl2 CH2Cl2+HClCH2Cl2+Cl2 CHCl3+HClCHCl3+Cl2 CCl4+HCl 甲烷燃烧:CH4+2O2 2+2H2O 甲烷分解:CH4C+2H2乙烯燃烧:C2H4 +3O2 2CO2+2H2O 乙烯与Br2:C2H4+ BrC2H4Br2 乙烯与H2:C2H4+H2C2H6 乙烯与HX:C2H4+HX 3CH2X 乙烯与H2O:C2H4+H2O 3CH2OH 乙烯的加聚:nC2H4 2-CH 2 点12CO2+6H2O 3 NO2 +H2O +H2SO4(浓3H +H2O 苯与H2+3H2 Ni 乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2 乙醇燃烧:C2H5OH+O2 2CO2+3H2O 乙醇催化氧化:2C2H5OH+O2CH3CHO+2H2O乙醇分子内脱水:C2H5OH浓H2SO4、170℃CH2=CH22O 乙醇分子间脱水:2C2H5OH浓H2SO4 、140℃CH3CH2OC2H5(乙醚)+H2O 注:一般醚以与氧相连的烃基加醚字命名乙醇与HX:C2H5OH+HX C2H5OX+H2O 乙酸与NaOH: CH3COOH+NaOH CH3COONa+H2O 乙酸Na2CO3:CH3COOH+Na2CO3 CH3COONa+H2O+CO2乙醇与乙酸:CH3COOH+ C2H5OH 浓硫酸、△CH3COOC2H5+H2O 乙酸乙酯水解:CH3COOC2H5+H2O CH3COOH+ C2H5OH乙酸乙酯皂化:CH3COOC2H5+NaO △CH3COONa+ C2H5OH 蔗糖水解:C12H22O11蔗+H2O 稀硫酸C6H10O6葡+ C6H10O6果麦芽糖水解:C12H22O11麦+H2O 催 2 C6H10O6葡纤维素水解:(C6H10O5)n纤+H2O 6H10O6葡淀粉水解:(C6H10O5)n淀+H2O nC6H10O6葡C17H35COOCH2 CH2OH (饱和)C17H352O 17H35COOH+CHOH C17H35COOCH2 CH2OH 软质酸甘油酯:C15H35COOCH2(不饱和)C15H35COOCH2C15H35COOCH2油酸甘油酯:C17H33COOCH2C17H33COOCH2相关热词搜索:有机化学方程式必修高中化学高二有机化学方程式必修5有机化学方程式。
高一化学必修2有机化学方程式汇总在高一化学必修 2 中,有机化学部分是非常重要的内容,而有机化学方程式则是理解和掌握有机化学知识的关键。
下面为大家汇总了这部分的重要有机化学方程式。
一、甲烷1、甲烷的燃烧:CH₄+ 2O₂ → CO₂+ 2H₂O这个方程式是甲烷作为燃料在氧气中燃烧生成二氧化碳和水的反应,是常见的能源利用方式。
2、甲烷与氯气的取代反应:CH₄+ Cl₂ → CH₃Cl + HClCH₃Cl + Cl₂ → CH₂Cl₂+ HClCH₂Cl₂+ Cl₂ → CHCl₃+ HClCHCl₃+ Cl₂ → CCl₄+ HCl这一系列反应展示了甲烷中的氢原子逐步被氯原子取代的过程。
二、乙烯1、乙烯的燃烧:C₂H₄+ 3O₂ → 2CO₂+ 2H₂O乙烯燃烧时产生明亮的火焰和黑烟。
2、乙烯与溴水的加成反应:CH₂=CH₂+ Br₂ → CH₂BrCH₂Br 这个反应可以用于检验乙烯的存在。
3、乙烯与氢气的加成反应:CH₂=CH₂+ H₂ → CH₃CH₃这是工业上制备乙烷的方法之一。
4、乙烯与氯化氢的加成反应:CH₂=CH₂+HCl → CH₃CH₂Cl 此反应常用于制备氯乙烷。
5、乙烯的加聚反应:nCH₂=CH₂ → CH₂CH₂ₙ这是乙烯制备聚乙烯的反应,聚乙烯是常见的塑料。
三、苯1、苯的燃烧:2C₆H₆+ 15O₂ → 12CO₂+ 6H₂O苯燃烧时产生浓烈的黑烟。
2、苯与液溴的取代反应:+ Br₂ → + HBr需要在催化剂 FeBr₃的作用下进行。
3、苯与浓硝酸的取代反应:+ HNO₃ → + H₂O反应条件为浓硫酸加热。
四、乙醇1、乙醇的燃烧:C₂H₅OH + 3O₂ → 2CO₂+ 3H₂O乙醇是常见的燃料。
2、乙醇与钠的反应:2C₂H₅OH +2Na → 2C₂H₅ONa + H₂↑此反应说明乙醇中的羟基能与钠发生置换反应。
3、乙醇的催化氧化:2C₂H₅OH + O₂ → 2CH₃CHO + 2H₂O在铜或银作催化剂的条件下进行。
有机化学方程式总结有机化学是一门研究有机化合物的组成、结构、性质和变化的科学。
在有机化学的学习中,掌握各种有机化合物的化学反应方程式是非常重要的一部分。
下面是对一些常见有机化学反应方程式的总结:1、烷烃的取代反应CH4 + Cl2 → CH3Cl + HCl2、烯烃的加成反应CH2=CH2 + H2 → CH3CH33、炔烃的加成反应CH≡CH + 2H2 → CH3CH34、醇的氧化反应2CH3CH2OH + O2 → 2CH3CHO + 2H2O5、酮的氧化反应2RCOCH3 + O2 → 2RCOCHO + 2H2O6、羧酸的酯化反应CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O7、酯的水解反应CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH8、醛的还原反应R-CHO + H2 → R-CH2OH9、酮的还原反应R-CO-R' + H2 → R-CH2-R' + H2O10、酰胺的水解反应NH2CO-R + H2O → NH3 + R-COOH以上仅是一些常见的有机化学反应方程式,但它们是学习有机化学的基础。
通过理解和记忆这些反应方程式,可以更好地理解有机化学的原理和应用。
对于一些复杂的有机化学反应,需要更加深入的学习和理解。
真空泄污系统自控系统是一种高效、环保的自动化设备,专门设计用于处理和减少废物排放。
此系统利用真空技术,自动抽取和处理废气、废液等污染物,达到国家环保排放标准。
真空泵:用于产生负压,从污染源抽取污染物。
传感器:检测污染物的种类和浓度,以便控制系统能够做出相应的调整。
控制系统:根据污染物的种类和浓度,自动调整真空泵的工作状态和净化设备的运行。
净化设备:对抽取的污染物进行过滤、吸附、化学反应等处理,降低或消除污染。
排放系统:经过处理的污染物被安全地排放到大气中。
自动检测:系统自动检测污染物的种类和浓度,实时调整处理策略。