碱金属和碱土金属教案资料
- 格式:ppt
- 大小:1.41 MB
- 文档页数:25

无机化学实验实验二十二碱金属和碱土金属[实验目的]比较碱金属、碱土金属的活泼性。
试验并比较碱土金属氢氧化物和盐类的溶解性。
练习焰色反应并熟悉使用金属钾、钠的安全措施。
[实验用品]仪器:烧杯、试管、小刀、镊子、坩埚、坩埚钳、离心机固体药品:钠、钾、镁条、醋酸钠液体药品:汞、NaCl(1mol·L-1)、KCl(lmol·L-1)、MgC12(0.5mol·L-1)、CaC12(0.5mol·L-1)、BaC12(0.5mol·L-1)、新配制的NaOH(2mol·L-1)、氨水(6mol·L-1)、NH4Cl(饱和)、Na2CO3(0.5mol·L-1、饱和)、HCl(2mol·L-1)、HAc(2mol·L-1、6mol·L-1)、HNO3(浓)、Na2SO4(0.5mol·L-1)、CaSO4(饱和)、K2CrO4(0.5mol·L-1)、KSb(OH)6(饱和)、(NH4)2C2O4(饱和)、NaHC4H4O6(饱和)、AlCl3(0.5mol·L-1)材料:铂丝(或镍铬丝)、pH试纸、钴玻璃、滤纸[实验内容]一、钠、钾、镁的性质1.钠与空气中氧的作用用镊子取一小块金属钠(绿豆大),用滤纸吸干其表面的煤油,切去表面的氧化膜,立即置于坩埚中加热。
当钠开始燃烧时,停止加热。
观察反应情况和产物的颜色、状态。
冷却后,往坩埚中加入2ml蒸馏水使产物溶解,然后把溶液转移到一支试管中,用pH试纸测定溶液的酸碱性。
再用2mol·L-1H2SO4酸化,滴加1~2滴0.01mol·L-1KMnO4溶液。
观察紫色是否褪去。
由此说明水溶液是有H2O2,从而推知钠在空气中燃烧是否有Na2O2生成。
写出以上有关反应方程式。
现象和解释2Na + O2Na2O2黄色粉末Na2O2 + 2H2O == H2O2++ 2NaOH5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O22、钠、钾、镁与水的作用用镊子取一小块金属钾和金属钠,用滤纸吸干其表面的煤油,切去表面的氧化膜,立即将它们分别放入盛水的烧杯中。




第二十章碱金属碱土金属之教案20-1.1: 定性解释碱金属和碱土金属从上到下和从左到右的金属活泼性变化规律(C级重点掌握)解:同族从上到下金属活泼性增强的原因是从上到下金属的原子半径依次增大,有效核电荷减小,对最外层电子的吸引力依次减小,所以更易失去电子,金属活泼性依次增强,第一电离势从上到下依次减小.同理从左到右金属活泼性减弱也是因为原子半径减小,有效核电荷增大,对最外层电子的吸引力增大,电子难失去,金属活泼性减弱.二:Li和Be的特殊性(C级了解)由于锂和铍分别是ⅠA和ⅡA中原子半径最小的,所以它们的性质与本族其它金属差别较大,表现出特殊。
事实上,锂的性质与周期表中它右下角元素镁有很多相似之处,同样铍与周期表中它右下角的铝性质也相似。
20-1.2: 请从理论上解释锂和铍为什么出现以上的特殊性质?(C级掌握)解:对于锂:单质熔沸点高,硬度大是因为原子半径小,金属键强导致;电极电势反常的低是因为Li+半径特别小,水合能突出的大,虽然锂的升华热和电离势比较大,但整个电极反应过程所需的能量较小,所以电极电势负值较大;Li+水合能较大,易形成含水化合物是因为离子的Z/r值越大,则水合能就越大;其化合物的共价倾向比较显著,溶解度小,且热稳定性差是因为Li+的Z/r值大,离子极化能力强,导致化合物的共价倾向明显增大,溶解度减小,稳定性减弱.对于铍:电离势高是因为其原子半径小,有效核电荷大导致;形成共价键的倾向比较显著,化合物熔点都较低是因为Be2+的Z/r值大,离子极化能力强,导致化合物的共价倾向显著增大,化合物熔点降低;铍盐最易溶于水,且极易水解是由于Be2+的离子Z/r值大,水合能大导致;毒性极高是因为有极高溶解度和容易生成配合物;铍为两性金属是因对角线规则,性质与金属Al相似.20-1.3: Li、Mg为对角元素,Li+、Mg2+半径十分接近,但它们的碳酸盐分解成氧化物的温度却相差悬殊.在没有热力学数据的条件下,你能作出谁高谁低的判断吗?(B级掌握)解:对于分解反应:Li2CO3 == Li2O + CO2MgCO3 == MgO + CO2虽Li+和Mg2+半径接近,但+2价的Mg2+离子势(Z/r)大,对CO32-的极化作用大,盐的稳定性就会减小,所以MgCO3分解温度更低.20-2 碱金属和碱土金属的单质20-2-1 单质的性质和用途一:性质:1。

第17章碱金属与碱土金属教学要求1.掌握碱金属和碱土金属的存在、性质、制备和用途;2.了解碱金属和碱土金属氧化物的性质和类型以及氢化物性质;3.掌握碱金属和碱土金属氢氧化物的溶解性、碱性及其变化规律;4.掌握碱金属和碱土金属重要盐类的溶解性、热稳定性等性质及其变化规律。
教学时数 2 学时重点:碱金属和碱土金属单质及氢氧化物的溶解性、碱性和盐类溶解性、热稳定性的变化规律。
难点:碱金属和碱土金属酸碱性、溶解性、热稳定性等性质变化规律的理论解释。
本章预习与问题思考:1. 碱金属和碱土金属有哪些主要化学性质?碱金属和钡在过量氧中燃烧的产物是什么?他们与水反应的情况如何?2. 碱金属和碱土金属在自然界主要以哪些矿物质形式存在?写出这些矿物的名称(俗名)及对应的化学式。
3.为什么过氧化钠能做潜水密舱中的供氧剂?而氢化钙却可做野外氢气发生剂?如何检验和除去商品氢氧化钠中的杂质碳酸钠?如何将粗盐中的杂质Ca2+、Mg2+、SO42-除去精制食盐?4.如何鉴别碱金属和碱土金属离子?教学内容:本章共有5节内容,第17-3为学习重点。
本章主要根据教学重、难点要求,通过课堂引导、学生自学和归纳总结的形式完成。
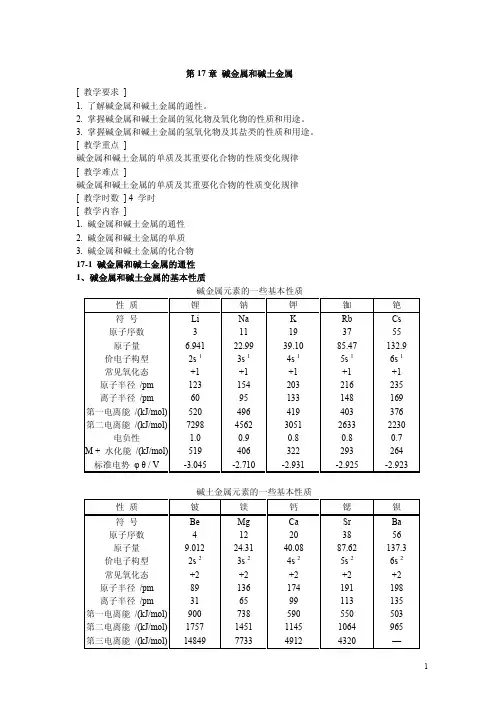
17-1 碱金属和碱土金属的通性(自学)碱金属元素原子的价电子层结构为ns1,只有+1氧化态。
碱金属原子最外层只有1个电子,次外层为8个电子(Li为2电子),对核电荷的屏蔽效应较强,所以该价电子离核校远,特别容易失去,因此,各周期元素的第一电离能以碱金属为最低。
与同周期的元素比较,碱金属原子体积最大,在固体中原子间的引力较小,所以它们的熔点、沸点、硬度、升华热都很低,并随着Li一Na—K一Rb一Cs的顺序而下降。
随着原子量的增加(即原子半径增加),电离能和电负性也依次降低(见P.647表20-1)。
碱金属性质的变化一般很有规律,但由于锂原子最小,所以有些性质表现特殊。
事实上,除了它们的氧化态以外,锂及其化合物的性质与本族其它碱金属差别较大,而与周期表中锂的右下角元素镁有很多相似之处。



新乡医学院无机化学实验课教案首页授课教师姓名及职称:新乡医学院化学教研室年月日实验碱金属和碱土金属(I-II)一、实验目的1.了解金属镁和氢氧化镁的性质;2.比较镁、钙、钡难溶盐的生成和性质;3.掌握钠、钾的鉴定方法。
二、实验原理周期系第ⅠA族元素称为碱金属元素,价电子层结构为ns1;周期系第ⅡA族元素称为碱土金属元素,价电子层结构为ns2。
这两族元素是周期系中最典型的金属元素,化学性质非常活泼,其单质都是强还原剂。
除LiOH为中强碱外,碱金属氢氧化物都是易溶的强碱。
碱土金属氢氧化物的碱性小于碱金属氢氧化物,在水中的溶解度也较小,都能从溶液中沉淀析出。
碱金属盐多数易溶于水,只有少数几种盐难溶(如醋酸铀酰锌钠、四苯硼酸钠等),可利用它们的难溶性来鉴定Na+、K+离子。
在碱土金属盐中,硝酸盐、卤化物(氟化物除外)、醋酸盐易溶于水;碳酸盐、硫酸盐、草酸盐、磷酸盐等难溶。
可利用难溶盐的生成和溶解性的差异来鉴定Mg2+、Ca2+、Ba2+离子。
三、实验用品(略)四、实验内容(一)金属镁和氢氧化镁的性质1.在2支试管中分别加入少量镁粉及蒸馏水约2mL,加热其中一支试管2~3min再分别加入酚酞指示剂1滴,观察溶液颜色变化,解释原因并写出反应式。
2.在2支试管中各加入0.1mol·L-1MgSO4溶液5滴,再分别滴加2mol·L-1NaOH溶液2~3滴,观察现象。
然后在两试管中分别加入3mol·L-1NH4Cl溶液和2mol·L-1HCl数滴,观察现象并写出反应式。
(二)镁、钙、钡难溶盐的生成和性质1.硫酸盐溶解度的比较在3支试管中分别加入5滴0.1mol·L-1MgCl2、0.1mol·L-1CaCl2、0.1mol·L-1 BaCl2,然后各加入5滴0.1mol·L-1Na2SO4溶液,观察反应产物的状态和颜色。
分别检验沉淀与浓HNO3的作用,写出反应式。

第二十章碱金属碱土金属之教案第二十章碱金属碱土金属之教案20-1.1: 定性解释碱金属和碱土金属从上到下和从左到右的金属活泼性变化规律(C级重点掌握)解:同族从上到下金属活泼性增强的原因是从上到下金属的原子半径依次增大,有效核电荷减小,对最外层电子的吸引力依次减小,所以更易失去电子,金属活泼性依次增强,第一电离势从上到下依次减小.同理从左到右金属活泼性减弱也是因为原子半径减小,有效核电荷增大,对最外层电子的吸引力增大,电子难失去,金属活泼性减弱.二:Li和Be的特殊性(C级了解)由于锂和铍分别是ⅠA和ⅡA中原子半径最小的,所以它们的性质与本族其它金属差别较大,表现出特殊。
事实上,锂的性质与周期表中它右下角元素镁有很多相似之处,同样铍与周期表中它右下角的铝性质也相似。
20-1.2: 请从理论上解释锂和铍为什么出现以上的特殊性质?(C级掌握)解:对于锂:单质熔沸点高,硬度大是因为原子半径小,金属键强导致;电极电势反常的低是因为Li+半径特别小,水合能突出的大,虽然锂的升华热和电离势比较大,但整个电极反应过程所需的能量较小,所以电极电势负值较大;Li+水合能较大,易形成含水化合物是因为离子的Z/r值越大,则水合能就越大;其化合物的共价倾向比较显著,溶解度小,且热稳定性差是因为Li+的Z/r值大,离子极化能力强,导致化合物的共价倾向明显增大,溶解度减小,稳定性减弱.对于铍:电离势高是因为其原子半径小,有效核电荷大导致;形成共价键的倾向比较显著,化合物熔点都较低是因为Be2+的Z/r值大,离子极化能力强,导致化合物的共价倾向显著增大,化合物熔点降低;铍盐最易溶于水,且极易水解是由于Be2+的离子Z/r值大,水合能大导致;毒性极高是因为有极高溶解度和容易生成配合物;铍为两性金属是因对角线规则,性质与金属Al相似.20-1.3: Li、Mg为对角元素,Li+、Mg2+半径十分接近,但它们的碳酸盐分解成氧化物的温度却相差悬殊.在没有热力学数据的条件下,你能作出谁高谁低的判断吗?(B级掌握)解:对于分解反应:Li2CO3 == Li2O + CO2MgCO3 == MgO + CO2虽Li+和Mg2+半径接近,但+2价的Mg2+离子势(Z/r)大,对CO32-的极化作用大,盐的稳定性就会减小,所以MgCO3分解温度更低.20-2 碱金属和碱土金属的单质20-2-1 单质的性质和用途一:性质:1。
第十一章 碱金属和碱土金属Chapter 11 Alkali and Alkali-earth Metals[教学要求]1、掌握碱金属和碱土金属的性质与结构、性质与存在、制备、用途之间的关系。
2、掌握碱金属和碱土金属氧化物的性质和类型以及氢化物的性质。
3、掌握碱金属和碱土金属氢氧化物的溶解度和碱性以及盐类溶解度,热稳定性等性质的变化规律。
4、一般掌握锂铍的特征,对比和镁的相似性等了解对角线规则。
[教学重点]1.碱金属、碱土金属的单质、氧化物、氢氧化物、重要盐类的性质。
2.碱金属、碱土金属性质递变的规律。
[教学难点]碱金属、碱土金属的氢氧化物性质递变规律。
[教学时数] 4学时 [教学内容]§11-1 碱金属元素及其化合物 Alkali Metals and their CompoundsLithium (Li) Sodium (Na) Potassium (K)Rubidium (Rb) Cesium (Cs) Francium (Fr)它们之所以有碱金属元素之称,是由于它们的氢氧化物都易溶于水(除了LiOH 的溶解度较小之外)的强碱。
一、General Properties1.Valence electron of alkali metals:(1) 其氧化数为+1,不会有其它正氧化态。
因为碱金属的第二电离势特别大,有可能出现-1氧化态。
即-→+M e M 。
在无水、无氧条件下,可以制得低氧化态的非寻常化合物,如钠化物。
钠在乙二胺和甲胺中所形成的溶液具有导电性,可以观察到Na -的光谱带,说明主要的导电体应是钠电离出的Na + 和Na -,即-+++−−−−→−Na Na Na 223NH CH en 2Na(s) + C 20H 36O 6[Na(C 20H 36O 6)]+·Na-(2) 由于价电子数少,所以碱金属原子之间的作用力比绝大多数其他金属原子之间的作用力要小,因此碱金属很软,低熔、沸点,且半径大、密度小。
第二十章碱金属碱土金属之教案第二十章:碱金属和碱土金属教案1.教学目标-了解碱金属和碱土金属的性质和特点;-掌握碱金属和碱土金属的反应性;-了解碱金属和碱土金属的应用。
2.教学准备-教材:化学教科书、实验指导书;-实验器材:碱金属和碱土金属样品、溶液、试管、试剂瓶等;-实验室设备:天平、移液管、试剂瓶、导线等。
3.教学过程-导入:通过回顾上一章节的内容,引导学生认识到金属与非金属的区别,并了解到碱金属和碱土金属是金属中的两个重要类别。
-理论讲解:通过讲解碱金属和碱土金属的定义、周期表中的位置以及它们的共同特点等,让学生对碱金属和碱土金属有一个基本的了解。
(1)碱金属:包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)等,它们位于周期表的第一族,具有非常活泼的化学性质,常存于自然界中的化合物形态。
(2)碱土金属:包括铍(Be)、镁(Mg)、钡(Ba)、锶(Sr)和钙(Ca)等,它们位于周期表的第二族,性质相对稳定,不像碱金属那样活泼。
-实验演示:为了更好地让学生了解碱金属和碱土金属的性质,进行一些实验演示。
(1)实验一:将锂、钠和钾等碱金属放入水中,观察其反应现象以及产生的气体发生燃烧的现象。
(2)实验二:将镁、钙和钡等碱土金属放入酸溶液中,观察其反应现象以及产生的气体的性质。
-实验操作:学生分组进行实验操作,实验内容可以包括:(1)利用锂和水反应制氢气;(2)利用镁和盐酸反应制氢气;(3)钠与水的反应实验;(4)钙与盐酸的反应实验。
-理论总结:让学生完成一份关于碱金属和碱土金属性质、应用以及安全注意事项的小结,以巩固所学内容。
4.课堂讨论-引导学生参与课堂讨论,分享他们在实验中观察到的现象和实验结果。
-讨论碱金属和碱土金属在生活中的应用和重要性。
-讨论碱金属和碱土金属的安全注意事项,并总结出一份安全操作指南。
5.课后作业-阅读相关的教材内容,进一步了解碱金属和碱土金属的物理和化学性质;-搜集碱金属和碱土金属在实际应用中的案例,并进行分析和总结。
碱金属和碱土金属专业化教班级化学0901 姓名实验日期2012-4-22一、实验目的1.试验金属钠、镁的重要性质;2.试验并掌握碱金属和碱土金属一些难溶盐的生成及其应用;3.了解锂盐与镁盐的相似性;4.练习焰色反应的操作并熟悉使用纳,汞等的安全措施。
二、实验原理周期系第ⅠA族元素称为碱金属,价电子层结构为ns1;周期系第ⅡA族元素称为碱土金属,价电子层结构为ns2.这两组元素系周期系中最典型的金属元素,化学性质非常活泼,其单质都是强还原剂。
碱金属盐多数易溶于水,只有少数几种盐难溶,可利用它们的难溶性来鉴定K+、Na+离子。
在碱土金属盐中,硝酸盐、卤化物、出酸盐易溶于水;碳酸盐、草酸盐等难溶。
可利用难溶盐的生成和溶解性差异来鉴定Mg2+、Ca2+离子。
三、实验内容1.金属镁的性质实验项目现象解释或反应方程式结论除去氧化膜的镁条+水(冷)+1d酚酞首先没有变化,放置一段时间后溶液颜色变红Mg + 2H2O === Mg(OH)2 + H2↑有气体放出镁与冷水反应缓慢几乎不反应,反应需要很长的时间除去氧化膜的镁条+水(近沸)+1d酚酞颜色缓缓变红,并有少量气泡生成Mg + 2H2O === Mg(OH)2 + H2↑有气体放出镁与热水反应比冷水剧烈,并能观察到气体2.碱金属的难溶盐实验项目现象解释或反应方程式结论1mol/l氯化钾+饱和酒石酸氢钠有白色沉淀生成KCl + C4H5NaO6 = KHC4H4O6↓ +NaCl酒石酸氢钠溶于水,而酒石酸氢钾溶于水(但溶解度不大),这个反应就是利用溶解度的差异来反应的1mol/l氯化钾+钴亚硝酸钠黄色沉淀生成 2K+ +Na+ +[Co(NO2)6]3-=K2Na [Co(NO2)6]↓用来鉴别钾离子3.碱土金属的难溶盐实验项目现象解释或反应方程式结论(数滴)0.1mol/L氯化镁+(1d)1mol/L碳酸钠有白色沉淀生成CO32-+Mg2+====MgCO3 镁离子与碳酸根生成白色不溶于水的沉淀(数滴)0.1mol/L氯化钙+(1d)1mol/L碳酸钠+6mol/L醋酸先有白色沉淀生成,加入醋酸后沉淀溶解CaCl2+Na2CO3=CaCO3↓+2NaClCaCO3 + 2CH3COOH ===2CH3COO-+ Ca2+ + H2O +CO2↑钙离子与碳酸根生成白色沉淀,其不溶于水但溶于醋酸0.1mol/L氯化镁+饱和草酸铵无现象不反应镁离子与草酸铵不反应0.1mol/L氯化钙+饱和草酸铵+6mol/L醋酸+2mol/L盐酸先产生白色沉淀,加入醋酸后沉淀不溶,加盐酸后溶解Ca2+ + (NH4)2C2O4 →CaC2O4↓(白色)+ 2 NH4+CaC2O4 + 2 HCl→CaCl2 +HOOC-COOH草酸钙难溶于水酸性:醋酸<草酸<盐酸0.1mol/L氯化钡+饱和草酸铵+6mol/L醋酸+2mol/L盐酸有白色沉淀生成,加入醋酸后沉淀不溶,加盐酸后溶解BaCl2+(NH4)2C2O4====BaC2O4+2NH4ClBaC2O4+2H+==Ba2+ +H2C2O4草酸钡难溶于水酸性:醋酸<草酸<盐酸0.1mol/L氯化钙+0.5mol/L铬酸钾+6mol/L 醋酸+2mol/L盐酸有黄色沉淀生成,加醋酸后溶解CaCl2+K2CrO4=2KCl+CaCrO4↓沉淀难溶于水,溶于稀酸0.1mol/L氯化锶+0.5mol/L铬酸钾+6mol/L 醋酸+2mol/L盐酸溶液变浑浊,加酸后变澄清SrCl2+K2CrO4=2KCl+SrCrO4↓沉淀溶与醋酸,微溶与水0.1mol/L氯化钡+0.5mol/L铬酸钾+6mol/L 醋酸+2mol/L盐酸有黄色沉淀生成,加醋酸后不溶,加盐酸后溶解BaCl2+K2CrO4=2KCl+BaCrO4↓沉淀不溶于水,溶于盐酸和硝酸0.1mol/L氯化镁+1mol/L硫酸钠无现象不反应氯化镁与硫酸钠不反应0.1mol/L氯化钙+1mol/L硫酸钠+浓硝酸有少量白色沉淀析出,加酸后部分溶解Na2SO4+CaCl2=CaSO4↓+2NaCl 硫酸钙微溶,硫酸钙不与浓硝酸反应,也是微溶于酸0.1mol/L氯化钡+1mol/L硫酸钠+浓硝酸产生白色沉淀,加酸后不溶解BaCl2+Na2SO4==2NaCl+BaSO4↓硫酸钡难溶于水和酸,且不与它们反应4.锂盐和镁盐的相似性实验项目现象解释或反应方程式结论1mol/l氯化锂+1mol/l氟化铵有白色沉淀生成Li+ +F- =LiF↓氟化锂难溶于水0.1mol/l氯化镁+1mol/l氟化铵有白色沉淀生成Mg2+ +2F- =MgF2↓氟化镁极微溶于水1mol/l氯化锂+少量1mol/l碳酸铵,微热有白色沉淀生成2Li+ +CO3 2- =Li2CO3↓碳酸锂微溶于水,在冷水中溶解度较热水下大0.1mol/l氯化镁+少量1mol/l碳酸氢铵有白色沉淀生成Mg2+ +CO3 2- =MgCO3↓碳酸镁微溶于水1mol/l氯化锂+少量0.1mol/l磷酸一氢钠,加热有白色沉淀生成3Li+ +PO4 3- =Li3PO4↓微溶于水0.1mol/l氯化镁+少量0.1mol/l磷酸一氢钠有白色沉淀生成3Mg2+ +2PO4 3- =Mg3(PO4)2↓几乎不溶于冷水5.钠离子,镁离子,钙离子,钡离子混合分析取钠离子,镁离子,钙离子,钡离子试液个三滴,混合均匀。