3-崩解时限检查法检验标准操作规程
- 格式:doc
- 大小:34.50 KB
- 文档页数:2

目的:规范空心胶囊检验的操作。
适用范围:空心胶囊的检验。
责任:检验室主任及检验人员。
程序:本品系由胶囊用明胶加辅料制成。
1.性状:本品呈圆筒状,系由帽和体两节套合的质硬且具有弹性的空囊,囊体应光洁,色泽均匀,切口平整,无变形,无异臭。
本品分透明、半透明、不透明三种。
2.鉴别2.1仪器及用具:分析天平、电炉、试管、刻度吸管、移液管。
2.2试剂及试液:蒸馏水、重铬酸钾试液-稀盐酸(4:1)、酸试液、钠石灰、红色石蕊试纸。
2.3测定法2.3.1 鉴别(1)取本品0.25g,加水50ml,加热使溶化,放冷,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)的混合液数滴,即生成橙黄色絮状沉淀。
2.3.2 鉴别(2)取鉴别(1)下剩余的溶液1ml,加水50ml,摇匀,加鞣酸试液数滴,即发生浑浊。
2.3.3 鉴别(3)取本品约0.3g,置试管中,加钠石灰少许,加热,产生的气体能使湿润的红色石蕊试纸变蓝色。
3.检查4.3.1仪器及用具:气相色谱仪、分析天平、干燥箱、崩解仪、马弗炉、平氏黏度计、卡颈圆底烧瓶、冷凝管、电炉、水浴锅、烧杯、分液漏斗、其塞锥形瓶、木板(厚2cm)表面器、干燥器、玻璃管(内径为24mm,长为200mm)圆柱形砝码(材质为聚四氟乙烯,直径为φ22mm,重20g±0.1g),蒸发器,15%聚乙二醇-150(或10%聚乙二醇-20M)柱、称量瓶、量筒、量瓶。
4.3.2试剂及试液:滑石粉、硝酸镁饱和溶液、磷酸、碳酸氢钠、0.1mol/L碘溶液、标准硫酸钾溶液、25%氯化钠溶液、氯乙醇、正己烷、硫酸、硝酸氨试液、酚酞指示液、醋酸盐缓冲液(PH3.5)、标准铅溶液、蒸馏水、硫代乙酰胺试液。
3.3测定法3.3.1松紧度:取本品10粒,用拇指和食指轻捏胶囊两端,旋转拔开,不得有粘结,变形或破裂,然后装满滑石粉,将帽、体套合,逐粒在1m的高度处直坠于厚度为2cm的木板上,应于漏粉,如有少量漏粉,不得超过2粒。

1.主题内容:建立有崩解时限检查法操作方法。
2.适用范围:本规程适用于检查药物在生产过程中的崩解时限检查法的操作。
3.引用标准:《中国药典2010版二部》
4.责任:化验员、QC主管。
5. 用途:化验室
6.内容:本法系用于检查口服固体制剂在规定条件下的崩解情况。
崩解系指口服固体制剂在规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。
如有少量不能通过筛网,但已软化或软质上漂且无荧心者,可做符合规定论。
凡规定检查溶出度、释放度、融变时限或分散均匀性的制剂,不再进行崩解时限检查
6.1片剂
仪器装置:采用升降式崩解仪,主要疾结构为—能升降的金属支架与下端镶有筛网的吊蓝,并附有挡板。


崩解时限检查法标准操作规程目的:制订崩解时限检查法标准操作规程。
适用范围:崩解时限检查。
责任:检验室检验人员按本规程操作,检验室主任监督本规程的实施。
程序:1. 简述1.1 本法(中国药典2000年版二部附录X A)适用于片剂(包括普通片、薄膜衣片、糖衣片、肠溶衣片及泡腾片)、胶囊剂(包括硬胶囊剂、软胶囊剂及肠溶胶囊剂),以及丸剂的溶散时限检查。
凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。
1.2 片剂口服后,需经崩散、溶解,才能为机体吸收而达到治疗目的;胶囊剂的崩解是药物溶出及被人体吸收的前提,而囊壳常因所用囊材的质量,久贮或与药物接触等原因,影响溶胀或崩解;丸剂中不含有崩解剂,故在水中不是崩解而是逐渐溶散,且基质的种类与丸剂的溶解性能有密切关系,为控制产品质量,保证疗效,药典规定本检查项目。
1.3 本检查法中所称“崩解”,系指固体制剂于规定条件下在检查时限内全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应通过筛网。
2.仪器与用具2.1 崩解仪(见中国药典2000年版二部附录X A的仪器装置)2.2 滴丸剂专用吊篮按2.1项下所述仪器装置,但不锈钢丝筛网的筛孔内径改为0.425mm.2.3 烧杯1000ml2.4 温度计分度值1℃3. 试药与试液3.1 人工胃液(供软胶囊剂和以明胶为基质的滴丸剂检查用)取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释成1000ml,即得。
临用前制备。
3.2 人工肠液(供肠溶胶囊剂检查用)取磷酸二氢钾6.8g,加水500ml使溶液解,用0.4%氢氧化钠溶液调节PH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释成1000ml,即得。
临用前制备。
4. 操作方法4.1 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37±1℃的水(或规定的溶液),调节液面高度使吊篮上升时筛网在液面下15mm处。

胶囊剂的崩解时限测定方法
胶囊剂的崩解时限是指在特定条件下,胶囊剂中的活性成分
能够完全释放出来所需要的时间。
崩解时限的测定方法可以使
用以下步骤:
1.准备样品:从所研究的胶囊剂样品中随机取出一定数量的
胶囊剂,并将其粉碎以获得粉末状样品。
2.准备崩解液:根据所测定的条件,准备适当的崩解液。
崩
解液的选择应与胶囊剂中的活性成分相容,并能够模拟胃肠道
的生理环境。
3.设置实验条件:根据药品注册文件或国际药典的要求,设
定合适的温度和搅拌速度。
通常,崩解实验会以37℃为温度,
以模拟人体体温。
4.进行崩解实验:将准备好的胶囊剂样品放入崩解仪器中,
开始崩解实验。
根据设定的条件,使用适当的搅拌速度和温度,确保崩解液持续搅拌。
5.取样测试:在设定的时间点,取出一定量的崩解液样品,
并对其进行适当的分析。
常用的方法包括使用紫外分光光度法
或高效液相色谱法测定活性成分的释放量。
6.分析结果:根据所测定的释放量,判断胶囊剂崩解的时间。
通常胶囊剂的崩解时限被定义为胶囊剂中95%的活性成分在一
定时间内释放出来的时间。
需要注意的是,崩解时限的测定方法可能因药物的特性而有
所不同,所以建议根据具体的胶囊剂和要求进行相应的分析方
法的选择和优化。
此外,为了保证实验结果的准确性和可靠性,建议进行一定数量的重复实验,并对实验数据进行统计分析。

目的:为检验土霉素片中间产品规定一个标准的程序,以便获得准确的实验数据。
范围:适用于土霉素片中间产品的检验。
职责:检验员、检验室主任对本规程实施负责。
规程:1 性状:本品为淡黄色片。
2 鉴别2.1 试剂与仪器2.1.1 乙醇 2.1.2 烧杯2.1.3 水浴锅 2.1.4 量杯2.1.5 电子天平(万分之一克) 2.1.6 电炉2.1.7 漏斗2.2 项目与步骤2.2.1 取本品细粉适量(约相当于土霉素25mg),加乙醇25ml,浸渍20分钟,滤过,滤液置水浴上蒸干,残渣照土霉素的鉴别法(1)项试验,显相同的反应为符合规定。
3 检查3.1 试剂与仪器3.1.1 电子天平(万分之一克) 3.1.2 AB-2片剂脆碎度仪3.1.3 BJ2A片剂崩解仪3.2 项目与步骤3.2.1 重量差异:照片剂重量差异检查法(SOP-QC-334-00)检查,±7.5% 重量差异限度为符合规定。
3.2.2 崩解时限:取本品6片,按崩解时限检查法(SOP-QC-330-00)检查,各片应在15分钟内全部崩解,如有1片崩解不完全,应另取6片按同样方法复试,全部崩解完全均为符合规定。
3.2.3 脆碎度:取本品约25片,用吹风机吹去脱落的粉末,精密称重,按脆碎度检查法 (SOP-QC-333-00)检查,减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片。
如减失重量超过1%时,可复检2次,3次的平均减失重量不得过1%,并不得检出断裂、龟裂及粉碎的片,为符合规定。
4 含量测定:取本品10片,精密称定,研细,精密称出适量(约相当于土霉素0.25g),置250ml量瓶中,加盐酸(0.1mol/L)50ml,振摇,使土霉素溶解后,再加灭菌水稀释至每1ml 中约含1,000单位的悬浮液;摇匀,静置,精密量取悬浮液适量,照抗生素微生物检定法(SOP-QC-339-00)操作。
4.1 试剂与仪器4.1.1 抗生素检定培养基Ⅱ(6.5~6.6) 4.1.2 磷酸盐缓冲液(PH6.0)4.1.3 藤黄微球菌悬液 4.1.4 土霉素标准品4.1.5 容量瓶(50ml,100ml) 4.1.6 灭菌刻度吸管,滴管4.1.7 双碟 4.1.8 陶瓦盖4.1.9 钢管放置器 4.1.10 电热隔水培养箱4.1.11 称量瓶 4.1.12 CHB-1抗生素效价测量仪4.1.13 电子天平(万分这一克) 4.1.14 超净工作台4.1.15 酒精灯 4.1.16 三角烧瓶(50ml,150ml)4.1.17 量筒(100ml) 4.1.18 镊子,接种棒4.2 检验步骤4.2.1 培养基的制备:称取抗生素检定培养基Ⅱ(PH6.5~6.6)28.5g,加水1000ml,加热溶解,分装,121℃高压灭菌30分钟,备用。

1.目的建立舒筋活血片检验操作规程。
2.范围本规程适用于舒筋活血片的全项检验。
3.责任 QC检验员、QC主管、QA主管。
4.标准《舒筋活血质量标准》
5.内容
5.1 性状本品为黄褐色的片;味苦。
5.2 鉴别取本品,置显微镜下观察:花冠碎片黄色,有红棕色或黄棕色分泌管,
分泌细胞类圆形,含淡黄棕色至红棕色分泌物,其周围细胞作放射状排
列。
梯纹管片淡黄色至金黄色,纹孔排列整齐。
5.3 检查应符合片剂项下有关的各项规定(附录ⅠD)。
5.3.1重量差异:操作方法见重量差异检查法。
5.3.2水分:水分测定法。
5.3.3崩解时限:操作方法见崩解时限检查法。
5.3.4微生物限度:操作方法见微生物限度检查法。
5.5检验依据:部颁标准中药成方制剂第十三册202页WS3-B-2624-97。
标题:崩解时限检验规程分发部门:总经理室、质量技术部,行政部(存档)崩解时限检验规程1 概述本法适用于软胶丸的崩解时限检查。
崩解是药物吸收及被人体吸收的前提,而丸壳常因丸材的质量、久储或与药物接触等原因,影响溶胀和崩解,故应控制软胶丸的崩解时限。
凡规定检查溶出度的胶丸剂,不再进行崩解时限的检查。
2 仪器2.1 LB——2B型崩解时限测定仪2.2 烧杯1000ml3 试剂人工胃液:取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释成1000ml,即得。
4 操作方法4.1 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37±1℃的水或规定的介质,调节水位高低使吊篮上升时筛网在水面上15mm外。
4.2除另外规定外,取软胶丸6粒,分别置吊篮的玻管中(如胶丸漂浮于液面可加档板)。
启动崩解仪进行检查,软胶丸应在1小时内全部崩解并通过筛网(破碎的胶丸壳除外),如有1粒不能完全崩解,应另取6粒在人工胃液中复试,均液应符合规定。
5 记录记录测试条件(包括介质及是否加挡板)、崩解时间及现象。
初试不符合规定者,应记录不符合规定的粒数、现象及复试结果。
2/2 崩解时限检验规程QC-O-034 6 结果判定6.1 供试品6粒均能在规定时限内崩解并通过筛网者,判为符合规定。
6.2 初试结果,不能崩解并通过筛网的胶丸超过1粒时,即判为不符合规定,不再复试。
6.3 初试结果如有1粒不能全通过筛网,另取6粒复试,各粒在规定时限内均崩解并通过筛网者,判为符合规定。
6.4 复试结果如有1 粒或1粒以上不能全部通过筛网,即判为不符合规定。
7 注意事项7.1 在测试过程中,烧杯内的水温(或介质温度)应保持在37±1℃。
7.2 每测一次后,应清洗玻璃管内壁及筛网,并重新更换水或介质。
重庆陪都药业股份有限公司1.目的:片剂口服后,需经崩散、溶解,才能为机体吸收而达到治疗目的;胶囊剂的崩解是药物溶出及被人体吸收的前提,而囊壳常因所用囊材的质量,久贮或与药物接解等原因,影响溶胀或崩解,丸剂中不含有崩解剂,故在水中不是崩解而是逐渐熔散,且基质的种类与丸剂的溶解性能有密切关系,为控制产品质量,保证疗效,药典规定本检查项目。
2.适用范围:适用于片剂(包括普通片、薄膜衣片、糖衣片、肠溶衣片及泡腾片)、胶囊剂(包括硬胶囊剂、软胶囊剂及肠溶胶囊剂),以及丸剂的崩解时限检查。
凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。
3.责任人:质量管理部部长、化验人员等对本规程的实施负责。
4.编制依据:《中国药典》2000年版及其20002年增补本。
5.仪器与用具:5.1 崩解仪。
5.2 滴丸剂专用吊篮(不锈钢丝筛网的筛孔内径改为0.425mm)。
5.3 烧杯1000ml、量杯20ml、500ml、1000ml,分析天平。
5.4 温度计:分度值1℃。
6.试药与试液:6.1 人工胃液(供较胶囊剂和以明胶为基质的滴丸剂检查用),取稀盐酸16.4ml,加水约800ml与胃蛋白酶100mg,摇匀后,加水稀释成1000ml,即得。
临用前制备。
6.2 人工肠液(供肠溶胶囊剂检查用):取磷酸二氢钾6.8g,加水500ml使溶解,用0.4%氢氧化钠溶液调节pH值6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释成1000ml,即得。
临用前制备。
7.操作方法:7.1 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度37±1℃的水(或规定的溶液),调节液面高度使吊篮上升时筛网在液面下15mm 处。
除另有规定外,取药片6片,分别置上述吊篮的玻璃管中,每管各加1片,立即启动崩解仪进行检查。
7.2 片剂:7.2.1 普通片:按7.1项下方法检查,各片均应在15分钟内全部崩解。
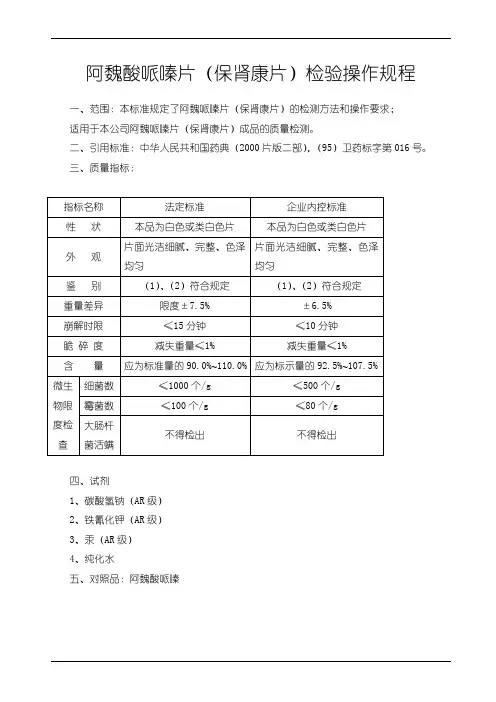
阿魏酸哌嗪片(保肾康片)检验操作规程一、范围:本标准规定了阿魏哌嗪片(保肾康片)的检测方法和操作要求;适用于本公司阿魏哌嗪片(保肾康片)成品的质量检测。
二、引用标准:中华人民共和国药典(2000片版二部),(95)卫药标字第016号。
三、质量指标:四、试剂1、碳酸氢钠(AR级)2、铁氰化钾(AR级)3、汞(AR级)4、纯化水五、对照品:阿魏酸哌嗪六、仪器与用具1、紫外分光光度仪2、棕色容量瓶(250ml,100ml)3、移液管(5ml)4、研钵5、滤纸七、操作步骤:1、外观:目测片面光洁、完整,不得有粘冲,松片或裂片现象;2、性状:本品为白色或类白色片;3、鉴别:3.1 取本品的细粉约0.25g(相当于阿魏酸哌嗪0.1g),加碳酸氢钠0.9g,与水 5ml 使溶解,滤过,滤液加铁氰化钾试液0.5ml与汞1滴,强力振摇1分钟,放置约20分钟,即缓缓显红色;3.2 取含量测定项下的溶液,照分光光度法(见紫外分光光度法检验操作规程)测定,在287±2nm和310±2nm的波长处有最大吸收,在254±2nm的波长处有最小吸收。
4、重量差异限度:见重量差异检查操作规程。
5、崩解时限:见崩解时限检查操作规程。
6、脆碎度:见片剂脆碎度检查操作规程。
7、含量测定:(避光操作,用棕色容量瓶)。
7.1 原理:本品为芳香族具有不饱和结构的化合物,310±2nm的波长处有最大吸收,故可用紫外分光光度法测定其含量。
7.2 对照品溶液的制备:取经80℃干燥至直恒重的阿魏酸哌嗪对照品约30mg,精密称定,量250ml容量瓶中,加水溶解并稀释至刻度,摇匀,即得。
(每1ml中,含有阿魏酸哌嗪0.12mg);7.3 供试品溶液的制备:取本品20片,精密称量,研细,精密称取约65mg(相当于阿魏酸哌嗪30mg),量250ml容量瓶中,加水在温水浴上溶解,并稀释至刻度,摇匀,滤过,弃去初滤液,取续滤液作为供试品溶液。

崩解时限检查法的操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!崩解时限检查法的操作流程一、准备工作阶段。
在进行崩解时限检查之前,需要做好充分的准备工作。
3-崩解时限检查法检验标准操作规程⽬的:建⽴崩解时限检查法检验操作规程,保证操作正确,确保检品质量。
范围:本标准规定了崩解时限的检查⽅法和操作要求;适⽤于本公司检品的崩解时限检查。
职责:QC执⾏,QC主任、质量部经理监督执⾏。
内容:⼀、仪器与⽤具1、升降式崩解仪:主要结构为⼀能升降的⾦属⽀架与下端镶有筛⽹的吊篮,并附有档板。
升降的⾦属⽀架上下移动距离为55mm±2mm,往返频率为30-32次/分钟。
2、吊篮:玻璃管6根,管长77.5mm±2.5mm,内径21.5mm,壁厚2mm;透明塑料板2块,直径90mm,厚6mm,板⾯有6个孔,孔径26mm,不锈钢板1块(放在上⾯⼀块塑料板上),直径90mm,厚1mm,板⾯有6个孔,孔径22mm;以及不锈钢丝筛⽹⼀张(放在下⾯的⼀块塑料板下),直径90mm,筛孔内径2.0mm;以及不锈钢轴1根(固定在上⾯⼀块塑料板与不锈钢板上),长80mm。
将上述玻璃管6根垂直于2块塑料板的孔中,并⽤3只螺丝将不锈钢板,塑料板和不锈钢丝筛⽹固定,即得。
3、档板:为⼀平整光滑的透明塑料块,相对密度1.18-1.20,直径20.7mm±0.15mm,厚9.5mm±0.15mm;挡板共有5个孔,孔径为2mm,中央1个孔,其余4个孔距中⼼6mm,各孔间距相等;档板侧边有4个等距离的V形槽,V形槽上端宽9.5mm,深2.55mm,底部开⼝处的宽与深度均为1.6mm。
4、平底烧杯:(1000ml)5、温度计:分度值1℃。
⼆、定义:崩解系指固体制剂在检查时限内全部崩解溶散或成碎粒,除不溶性包⾐材料或破碎的胶囊壳外,应通过筛⽹,全部崩解所需的最长时间为崩解时限。
三、操作⽅法1、将吊篮通过上端的不锈钢轴悬挂于⾦属⽀架上,浸⼊1000ml烧杯中,并调节吊篮位置使其下降时筛⽹距烧杯底部25mm,烧杯内盛有温度为37±1℃的⽔。
调节⽔位⾼度使吊篮上升时筛⽹在⽔⾯下25mm处。
标题:空心胶囊检验规程
分发部门:总经理室、质量技术部,行政部(存档)
空心胶囊检验规程
1 范围
本标准规定了胶囊的检测方法和操作要求;适用于胶囊的质量检测。
2 引用标准
《中华人民共和国药典》2000年版。
3 检测方法
3.1 感官检测
打开产品包装,通过外观检查判定:本品为不透明圆筒状胶囊,具有弹性,囊体应光洁,切口平整,无变形,无异臭,无砂眼,缺裂;无明显的瘪头薄头和皱纹,不允许有插劈、油污。
4.2 崩解时限检查法
按照公司制定的《崩解时限检验规程》(QC-O-034)规定的方法测定
4.3 干燥失重
应按照公司制定的《干燥失重测定法》(QC-O-037)规定的方法测定。
4.4 微生物限度
按照公司制定的《食品微生物检测方法》(QC-O-032)的方法测定。
目的:建立崩解时限检查法检验操作规程,保证操作正确,确保检品质量。
范围:本标准规定了崩解时限的检查方法和操作要求;适用于本公司检品的崩解时限检查。
职责:QC执行,QC主任、质量部经理监督执行。
内容:
一、仪器与用具
1、升降式崩解仪:主要结构为一能升降的金属支架与下端镶有筛网的吊篮,并附有档板。
升降的金属支架上下移动距离为55mm±2mm,往返频率为30-32次/分钟。
2、吊篮:玻璃管6根,管长77.5mm±2.5mm,内径21.5mm,壁厚2mm;透明塑料板2块,直径90mm,厚6mm,板面有6个孔,孔径26mm,不锈钢板1块(放在上面一块塑料板上),直径90mm,厚1mm,板面有6个孔,孔径22mm;以及不锈钢丝筛网一张(放在下面的一块塑料板下),直径90mm,筛孔内径2.0mm;以及不锈钢轴1根(固定在上面一块塑料板与不锈钢板上),长80mm。
将上述玻璃管6根垂直于2块塑料板的孔中,并用3只螺丝将不锈钢板,塑料板和不锈钢丝筛网固定,即得。
3、档板:为一平整光滑的透明塑料块,相对密度1.18-1.20,直径20.7mm±0.15mm,厚9.5mm±0.15mm;挡板共有5个孔,孔径为2mm,中央1个孔,其余4个孔距中心6mm,各孔间距相等;档板侧边有4个等距离的V形槽,V形槽上端宽9.5mm,深2.55mm,底部开口处的宽与深度均为1.6mm。
4、平底烧杯:(1000ml)
5、温度计:分度值1℃。
二、定义:
崩解系指固体制剂在检查时限内全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应通过筛网,全部崩解所需的最长时间为崩解时限。
三、操作方法
1、将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37±1℃的水。
调节水位高度使吊篮上升时筛网在水面下25mm处。
2、除另有规定外,取供试品6片,分别置上述吊篮的玻璃管中,加档板,启动崩解仪时进行检查,药材原粉片各片均应在30分钟内全部崩解;浸膏(半浸膏)片、糖衣片
第 1 页共 2 页
G Z Z L30301
各片均应1小时内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
如果供试品黏附挡板,应另取6片,不加挡板按上述方法检查,应符合规定。
3、薄膜衣片按上述装置与方法检查,可改正在盐酸溶液(9→1000)中进行检查,应在1小时内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
4、硬胶囊剂,除另有规定外,取供试品6粒,按上述装置与方法,加档板进行检查。
硬胶囊剂应在30分钟内。
五、记录
记录应包括仪器型号、制剂类型及测试条件(如包衣、薄膜衣、硬或软胶囊、介质等),崩解或溶散时间及现象,胶囊则应记录在盐酸溶液中无裂缝,崩解或软化现象等。
初试不符合规定的,应记录不符合规定的片(粒)数及现象,复试结果等。
六、注意事项
1、在测试过程中,烧杯内的水温(或介质温度)应保持37±1℃。
2、每测试一次后,应清洗吊篮的玻璃管内壁及筛网,挡板等,并重新更换水或规定的溶液。
第 2 页共 2 页。