基本仪器讲义和基本操作
- 格式:ppt
- 大小:6.15 MB
- 文档页数:94

TI-nspire计算器简介及基本操作主讲人:王中伟(湖南交通职业技术学院)【课程目的】1.了解TI-nspire计算器的类型和区别;2.了解TI-nspire计算器的基本功能;3.熟悉TI-nspire计算器的按键功能;4.初步掌握TI-nspire计算器的代数计算功能;5.熟悉TI-nspire计算器的文档操作;6.掌握利用TI-Nspire Computer Link软件进行文档的传输和屏幕截图。
一、TI-nspire系列计算器简介TI-Nspire系列计算器是美国德州仪器公司(Texas Instruments,简称TI)的产品,目前主要有五种类型,其型号名称和主要参数如表1所示。
表1 TI-nspire系列计算器型号与主要参数型号TI-nsprie CAS(大黑)TI-nspire CM-C(小白)TI-nspire CM-CCASTI-nspire CX-CTI-nspire CX-CCAS外形图片CAS 是否是否是内存20MB储存内存/16MB 运算内存128 MB储存内存/ 32MB运行内存128 MB储存内存/ 64MB运行内存显示320*240像素分辨率:115 DPI16级灰阶320*240像素,分辨率125 dpi,16位彩色电源4节7号/亦可选用配套的充电电池TI-Nspire充电电池(内置)TI-Nspire系列计算器型号中,我们发现有两条纵向的型号类型,一类是带CAS,另一类则不带CAS,那么,CAS是什么呢?CAS是计算机代数系统(Computer Algebra System)的英文简称,计算机代数系统的标志是能够以字符串作为运算单位。
科学计算可分为两类:一类是纯数值的计算,例如求函数的值,方程的数值解;另一类计算是符号计算,又称代数运算,这是一种智能化的计算,处理的基本单位是字符串。
人们在数学的教学和研究中用笔和纸进行的数学运算多为符号运算。
计算机代数系统CAS的优越性主要在于它能够进行大规模的代数运算。

仪器分析讲义绪论(Introduction)仪器分析是化学类专业必修的基础课程之一。
通过本课程的学习,要求学生把握经常使用仪器分析方式的原理和仪器的简单结构;要求学生初步具有依照分析的目的,结合学到的各类仪器分析方式的特点、应用范围,选择适宜的分析方式的能力。
分析化学是研究物质的组成、状态和结构的科学。
它包括化学分析和仪器分析两大部份。
化学分析是指利用化学反映和它的计量关系来确信被测物质的组成和含量的一类分析方式。
测按时需利用化学试剂、天平和一些玻璃器皿。
它是分析化学的基础。
仪器分析是以物质的物理和物理化学性质为基础成立起来的一种分析方式,测按时,常常需要利用比较复杂的仪器。
它是分析化学的进展方向。
仪器分析与化学分析不同,具有如下特点:(1)灵敏度高,检出限量可降低。
如样品用量由化学分析的ml、mg级降低到仪器分析的µL、µg级,乃至更低。
它比较适用于微量、痕量和超痕量成份的测定。
(2)选择性好。
很多仪器分析方式能够通过选择或调整测定的条件,使共存的组分测按时,彼其间不产生干扰。
(3)操作简便、分析速度决,易于实现自动化。
(4)相对误差较大。
化学分析一样可用于常量和高含量成份的分析,准确度较高,误差小于千分之儿。
多数仪器分析相对误差较大,一样为5%,不适于常量和高含量成份的测定。
(5)需要价钱比较昂贵的专用仪器。
§1-1.仪器分析方式的内容和分类(Classification of Instrumental Analysis)分类:1.光学分析法以物质的光学性质为基础的分析方式(1) 分子光谱: 红外吸收可见和紫外分子荧光拉曼光谱(2) 原子光谱: 原子发射AES 原子吸收AAS 原子荧光AFS(3) X射线荧光: 发射吸收衍射荧光电子探针(4) 核磁共振顺磁共振2.电化学分析法溶液的电化学性质用于确信物质化学成份的方式(1)电导法:电导分析法电导确信物质的含量电导滴定法溶液的电导转变确信容量分析的滴定终点。


苏一光全站仪操作细部步骤一、距离测量步骤1:将全站仪架设于测站点已知点O上、对中、调平全站仪。
步骤2:将棱镜架设到待测点A,调平,反光棱镜朝向全站仪。
步骤3:打开仪器,出现画面步骤4:用全站仪对准反光棱镜十字丝中心,按DIST键。
二、坐标测量每个小组选取两个已知点0点和A点,一个待测点B点,并做好标记。
设0点的坐标为(0,0),A点的坐标(10,0),测量待测点B 的坐标。
步骤1:将全站仪架设于测站点O点上,对中整平。
将对中杆棱镜架设后视点A上,将反光棱镜朝向全站仪。
步骤2:打开全站仪电源,按CORD键进入坐标测量,出现如下画面再按F4切换键,步骤三:按F3键,切换到以下画面步骤四:按F1键,出现如下画面步骤六:点F3切换到字母键,点名设置为O。
输入O点坐标(0,0),步骤五:点F3切换到字母键,点名设置为O。
输入O点坐标(0,0),完成后按ENT键结束。
步骤六:按F2键进入如下界面步骤七:按F1输入后视点,出现如下画面,输入后视点坐标,按ENT 键结束。
步骤八:按ENT键保存步骤九:按ENT键保存后出现如下画面,对准反光棱镜,按ENT键,坐标系建立。
步骤10:将反光棱镜移至B点,对中调平,反光棱镜朝向全站仪。
将照准部对准反光棱镜中心,出现如下画面,B点坐标(3.87,0.192)三、坐标放样(应该说明任务才对)步骤1:按MENU菜单键,出现如下画面步骤3:先设置测站点O(仪器架设点)的坐标。
将(0,0)一次输入,高程Z 略过。
N与E坐标输入之间切换按F4确认键,输入完毕后点ENT键结束后视点坐标输入。
步骤4:选择设置后视点,按ENT键进入。
如测站点坐标输入一样,一次输入后视点坐标,出现如下画面,完成输入后按ENT结束。
步骤5:将对中杆放置于后视点(0,10),气泡居中调平,全站仪照准部对准反光棱镜中心后按ENT键,此时,坐标系建立。
选中放样,按ENT键出现如下画面步骤6:依次输入放样点坐标(10,10),然后按ENT键结束放样点坐标输入,出现画面,选择测距后出现如下画面按F1距离键,出现如下画面步骤7:松开水平制动螺旋,,转动照准部,将dHR调为0.00.00,这时,待测点就在视准轴上。
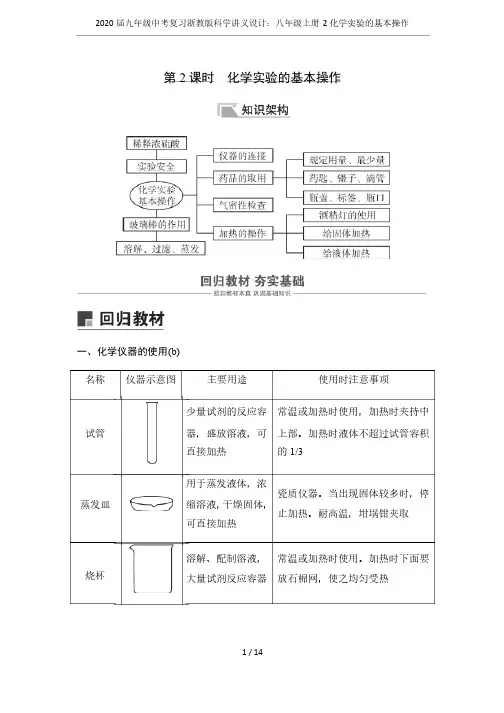
第2课时 化学实验的基本操作一、化学仪器的使用(b)名称名称 仪器示意图仪器示意图 主要用途主要用途 使用时注意事项使用时注意事项试管试管 少量试剂的反应容器,盛放溶液,可直接加热直接加热常温或加热时使用,加热时夹持中上部。
加热时液体不超过试管容积的1/3 蒸发皿蒸发皿 用于蒸发液体,浓缩溶液,干燥固体,可直接加热可直接加热瓷质仪器。
当出现固体较多时,停止加热。
耐高温,坩埚钳夹取止加热。
耐高温,坩埚钳夹取 烧杯烧杯溶解、配制溶液,大量试剂反应容器大量试剂反应容器 常温或加热时使用。
加热时下面要放石棉网,使之均匀受热放石棉网,使之均匀受热烧瓶烧瓶分平底和圆底两种,用作反应物较多且加热时间较长的反应容器的反应容器加热时固定在铁架台上,下面放石棉网,平底的一般不用于加热。
加热时液体不超过烧瓶容积的1/2 量筒量筒用于量取一定体积的液体(不可加热,不能用作反应容器) 不能用作反应容器,不能加热。
量取液体时应竖直放置,使视线与凹液面的最低处保持水平,读数取凹液面最低点刻度液面最低点刻度铁架台(带铁夹、铁圈) 固定各种反应容器和其他仪器和其他仪器酒精灯酒精灯用于加热,酒精量1/4~2/3,外焰温度最高最高 加热时使用外焰。
不可用燃着的酒精灯去点燃另一酒精灯;不可向燃着的酒精灯中添加酒精;使用完毕用灯帽盖灭,不可用嘴吹灭用灯帽盖灭,不可用嘴吹灭漏斗漏斗过滤过滤集气瓶集气瓶收集、贮存少量气体,组装少量气体发生装置发生装置不能加热。
收集气体时,应用玻璃片盖住瓶口片盖住瓶口 试剂瓶试剂瓶 广口瓶用于盛放固体,细口瓶用于盛放液体放液体燃烧匙燃烧匙 用于盛放固体物质在气体中燃烧在气体中燃烧胶头滴管胶头滴管用于吸取或滴加少量液体量液体滴加液体时,滴管不可插入或接触容器口及内壁容器口及内壁 锥形瓶锥形瓶用作反应容器,易使反应物摇匀使反应物摇匀加热时必须垫石棉网加热时必须垫石棉网 试管夹试管夹用来夹持试管用来夹持试管 试管夹从试管底部往上套,夹在试管的中上部,加热时用手握住试管夹的长柄,不要把拇指按在短柄上夹的长柄,不要把拇指按在短柄上药匙药匙 取用粉末状或小颗粒状固体药品(药匙的两端是大小不同的两个匙)药匙用过后要立即用干净的纸擦拭干净,以备下次使用干净,以备下次使用 玻璃棒玻璃棒搅拌、过滤或转移液体时引流液体时引流二、化学药品的取用(b)1.实验室药品取用规则(1)三不原则:不能用手接触药品;不要把鼻孔凑到容器口去闻药品的气味;不得尝任何药品的味道。

仪器分析实验实验1 邻二氮菲分光光度法测定铁一、实验原理邻二氮菲(phen)和Fe2+在pH3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen)32+,其lgK=21.3,κ508=1。
1 × 104L·mol—1·cm—1,铁含量在0.1~6μg·mL—1范围内遵守比尔定律。
其吸收曲线如图1-1所示。
显色前需用盐酸羟胺或抗坏血酸将Fe3+全部还原为Fe2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。
有关反应如下:2Fe3++2NH2OH·HC1=2Fe2++N2↑+2H2O+4H++2C1-图1—1 邻二氮菲一铁(Ⅱ)的吸收曲线用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度(A),以溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线.在同样实验条件下,测定待测溶液的吸光度,根据测得吸光度值从标准曲线上查出相应的浓度值,即可计算试样中被测物质的质量浓度。
二、仪器和试剂1.仪器 721或722型分光光度计。
2.试剂(1)0。
1 mg·L—1铁标准储备液准确称取0.702 0 g NH4Fe(S04)2·6H20置于烧杯中,加少量水和20 mL 1:1H2S04溶液,溶解后,定量转移到1L容量瓶中,用水稀释至刻度,摇匀。
(2)10—3 moL-1铁标准溶液可用铁储备液稀释配制。
(3)100 g·L-1盐酸羟胺水溶液用时现配.(4)1。
5 g·L—1邻二氮菲水溶液避光保存,溶液颜色变暗时即不能使用。
(5)1。
0 mol·L—1叫乙酸钠溶液。
(6)0.1 mol·L—1氢氧化钠溶液。
三、实验步骤1.显色标准溶液的配制在序号为1~6的6只50 mL容量瓶中,用吸量管分别加入0,0。
20,0.40,0.60,0.80,1。

实验一 仪器认领、洗涤和干燥一、实验目的1.熟悉无机化学实验室规则和要求;2.认领无机化学实验常用仪器,熟悉其名称、规格,了解其使用注意事项;3.学习并练习常用仪器的洗涤和干燥方法。
二、实验用品仪器:试管、烧杯、表面皿、漏斗、量筒、烧瓶、容量瓶等。
材料:洗衣粉、试管刷等。
三、实验内容1.实验目的性、实验室规则和安全守则教育。
2.认领仪器:按仪器清单认领和认识无机化学实验常用仪器。
3.玻璃仪器的一般洗涤方法(1)振荡水洗:注入1/3左右的水,稍用力振荡后把水倒掉,连洗几次。
(2)毛刷刷洗:内壁有不易洗掉的物质,可用毛刷刷洗。
a.倒去试管中的废液;b.注入1/3左右的水;c.选择毛刷;d.来回柔力刷洗。
(3)刷洗后,用水振荡数次,必要时用蒸馏水洗。
4.玻璃仪器的干燥方法(1)晾干:自然挥发;(2)烤干:加热蒸发。
仪器外壁擦干,小火烤干,试管口向下,从底部开始加热,同时要不断移动使其受热均匀;(3)吹干:电吹风、气流烘干器;(4)烘干:烘箱(105 ℃左右);(5)有机溶剂法。
四、注意事项1.如附有不溶于水的碱、碳酸盐、碱性氧化物,可用6mol·L-1HCl 溶解,再用水冲洗。
油脂等污物可用热的纯碱液洗涤;2.口小、管细的仪器,不便用刷子洗,可用少量王水或铬酸洗液洗涤。
五、思考题1.怎样检查玻璃仪器是否已洗涤干净?2.使用铬酸洗液应注意哪些问题?3.容量瓶等计量仪器是否需干燥?若需,则如何干燥?实验二 氯化钠的提纯一、实验目的1.学会用化学方法提纯粗食盐,同时为进一步精制成试剂级纯度的氯化钠提供原料;2.练习台秤的使用以及加热、溶解、常压过滤、减压过滤、蒸发浓缩、结晶、干燥等基本操作;3.学习食盐中Ca2+、Mg2+、SO42-的定性检验方法。
二、实验原理1.在粗盐中滴加BaCl2除去SO42-Ba2+ + SO42- = BaSO4↓2.在滤液中滴加NaOH、Na2CO3除去 Mg2+ 、Ca2+、Ba2+、Fe3+Mg2++2OH- = Mg(OH)2↓ Ca2++CO32- = CaCO3↓Ba2++CO32- = BaCO3↓ Fe3+ + 3OH - = Fe(OH)3↓3.用HCl中和滤液中过量的OH -、CO32-H+ + OH - = H2OCO32- + 2H+ = CO2↑ + H2O[教学重点]常压过滤、减压过滤、蒸发(浓缩)、结晶等操作[教学难点]常压过滤、减压过滤、蒸发(浓缩)、结晶等操作[实验用品]仪器:烧杯、量筒、长颈漏斗、吸滤瓶、布氏漏斗、石棉网、泥三角、蒸发皿、台秤、循环水真空泵药品: 1 mol L-1Na2CO3、2 mol L-1NaOH 、2 mol L-1HCl、1 mol L-1BaCl、2粗食盐材料:定性滤纸(Φ12.5、11、9)、广泛pH试纸[基本操作] 补充内容1.固体溶解2.固液分离(1)倾析法(2)过滤法A常压过滤:滤纸的选择、漏斗、滤纸的折叠、过滤和转移、洗涤B减压过滤:C热过滤(3)离心分离法3.蒸发(浓缩)4.结晶(重结晶)三、实验步骤1.粗食盐的提纯2.产品纯度的检验检验项目检验方法实验现象粗食盐纯NaClSO42-加入BaCl2溶液Ca2+加入(NH4)2C2O4溶液Mg2+加入NaOH溶液和镁试剂3.实验结果产品外观: 产品质量(g): 产率(%):四、注意事项1.常压过滤,注意“一提,二低,三靠”,滤纸的边角撕去一角。

实验一722 型分光光度计的性能检测一、目的1、学会使用分光光度计2、掌握分光光度计的性能检验方法二、提要1、分光光度计的性能好坏,直接影响到测定结果的准确性,因此新购仪器及使用一定时间后,均需进行检验调整。
2、利用KMnO4溶液的最大吸收峰值来检验波长的精度。
3、用同种厚度的比色皿,由于材料及工艺等原因,往往造成透光率的不一致,从而影响测定结果,故在使用时须加以选择配对。
三、仪器与试剂1、722 型分光光度计;2、小烧杯;3、坐标纸;4、滴管;5、擦镜纸;6、KMnO4溶液;四、操作步骤1、吸收池透光率的检查(测定透光率)吸收池透光面玻璃应无色透明,并应无水、干燥。
检查方法如下:以空气的透光率为100%,则比色皿的透光率应不低于84%,同时在450nm、650nm 处测其透光率,各透吸收池透光率差值应小于5%。
2、吸收池的配对性(测定透光率)同种厚度的吸收池之间,透光率误差应小于0.5%。
检查方法如下:将蒸馏水分别注入厚度相同的几个吸收池中。
以其中任一个比色皿的溶液做空白,在440nm 波长处分别测定其它各比色皿中溶液的透光率,然后选择相差小于0.5% 的吸收池使用。
3、重现性(光度重复性)(测定透光率)仪器在同一工作条件下,用同种溶液连续测定7 次,其透光率最大读数与最小读数之差(极差)应小于0.5%。
检查方法如下:以蒸馏水的透光率为100%,用同一KMnO4溶液连续测定7 次,求出极差,如小于0.5%,则符合要求。
4、波长精度的检查(测定A)为了检查分光系统的质量,可用KMnO4溶液的最大吸收波长525nm 为标准,在待检查仪器上测绘KMnO4溶液的吸收曲线。
检查方法如下:取3.0×10-5mol/L 的KMnO4溶液,以蒸馏水为空白,在460nm~580nm 范围内,分别测定460、480、500、510、520、522、524、525、526、528、530、540、550、560、570、580nm 波长处的吸光度,在坐标纸上绘出吸收曲线。

实验1 邻二氮菲分光光度法测定铁条件的研究及微量铁测定一、实验目的1.通过本实验学会分光光度法测定条件的选择方法2.联系分光光度计的使用方法二、实验原理应用分光光度法进行定量分析时,通常要经过称样、溶解、显色及测量等步骤,其中显色反应条件是影响测定灵敏度和准确度的主要因素。
显色反应条件包括显色剂用量、溶液酸度、显色反应时间和温度、试剂加入顺序及干扰物质的影响等,均需一一加以研究,以便拟定出最佳分析方案,使测定既准确又快速。
本实验通过对Fe(Ⅱ)-邻二氮菲显色反应条件的研究,初步了解拟定分光光度法测定条件的方法。
邻二氮菲是测定微量铁的高灵敏性、高选择性试剂,邻二氮菲分光光度法是化工产品中微量铁测定的通用方法。
在酸度为pH 2~9的溶液中,邻二氮菲和Fe2+生成橘红色配合物:该化合物的lgK稳= 21.3(20℃),在510 nm 处有最大吸收,摩尔吸收系数ε510 = 1.1×104L•mol-1•cm-1。
三、试剂和仪器100 μg/mL铁标准溶液:准确称取0.8634 g NH4Fe(SO4)2.12H2O于100 mL烧杯中,加入20 mL盐酸(6.0 mol/L)及少量水溶解,移入1L容量瓶中,用水稀释至刻度,摇匀。
作为储备液。
用时稀释成10.0μg/mL的工作液。
1.0 mol/L pH 5.0 NaAc-HAc缓冲溶液:称取分析纯NaAc.3H2O 32 g,溶于适量水中,加入6 mol/L HAc 68 mL, 稀释至500 mL。
1.0 mol/L HCl 溶液;0.4 mol/L NaOH 溶液;10% 盐酸羟胺溶液(新鲜配制);0.12%邻二氮菲水溶液(新鲜配制)。
紫外—可见分光光度计,酸度计。
四、实验步骤(一)测定条件的研究(1)吸收曲线的绘制吸取分别取铁工作液(0.0010 mol/L)3.0 mL于50 mL 容量瓶中,加入1 mL的10% 盐酸羟胺溶液;振荡后,放置2 min。

化验仪器设备操作培训一、前言化验仪器设备是现代实验室必备的重要工具,它们在分析化学、生物化学、材料科学等领域发挥着重要作用。
然而,不正确的操作和使用方式可能导致误差增大、结果不准确,甚至造成设备损坏。
因此,为确保实验结果的准确性并延长仪器设备的使用寿命,我们有必要对其进行操作培训。
二、常见化验仪器设备及其操作2.1电子天平2.1.1打开天平电源,并按照设备说明书上的指示进行预热。
2.1.2将待测物与指定的容器放置在天平的秤盘上。
2.1.3关闭天平风扇,并等待显示屏上的数值稳定。
2.1.4读取并记录测得的质量值。
2.1.5关闭天平电源,并将待测物和容器取下。
2.1.6清理天平,定期校准。
2.2pH计2.2.1将电极放入去离子水中,按下开关。
2.2.2使用调节钮将电极放入待测溶液中。
2.2.3等待pH计显示屏上的数值稳定。
2.2.4读取并记录测得的pH值。
2.2.5关闭pH计,并用去离子水冲洗电极。
2.2.6定期校准pH计。
三、常见问题及解决方法3.1天平称量值不准确可能原因:秤盘上有灰尘或物质残留,电子天平未进行定期校准。
解决方法:用纯净水清洁秤盘,并进行定期校准。
3.2pH值读数不稳定可能原因:电极受到污染或老化,待测溶液不均匀,pH计未进行定期校准。
解决方法:用去离子水冲洗电极,定期更换电极,并进行定期校准。
3.3仪器设备故障可能原因:电源供应不稳定,仪器配置错误。
解决方法:检查电源供应稳定性,并根据设备说明书确保正确配置。
四、仪器维护与保养4.1定期检查设备电源供应是否稳定,确保电源线未受损。
4.2定期校准仪器,以保证测量结果的准确性。
4.3仪器设备摆放整齐,避免日常使用中的碰撞和摩擦。
4.4根据设备说明书进行清洁,不要使用腐蚀性或磨损性较大的清洁剂。
五、结束语通过对化验仪器设备操作的培训,我们可以更好地了解和掌握正确的使用和维护方法。
正确操作不仅可以确保实验结果的准确性,还能延长仪器设备的使用寿命,提高实验效率。

实验室常用仪器操作在科学研究和实验中,仪器是不可或缺的工具之一。
它们能够帮助科学家进行精确测量、收集数据并验证实验结果。
本文将重点介绍实验室中常用的仪器以及其操作方法。
一、显微镜显微镜是一种使用光学原理观察微小物体的仪器。
操作显微镜时,首先要调整光源以确保适当的照明。
然后,将待观察的样品放置在显微镜的玻璃载物台上,并通过旋转物镜调节样品与物镜的距离。
随后,用调焦轮调整目镜使图像清晰可见。
最后,使用显微镜的移物台或横平竖直调节样品位置,以便观察到样品的不同区域。
二、天平天平是用来测量物体质量的仪器。
使用天平时,首先要确保天平在水平位置上,并将容器放置在称盘上。
将所需物体放置在容器中,等待数秒以稳定读数。
然后,调节天平上的校准旋钮,直到指示器指针或显示屏上的数字显示为零。
最后,读取天平上的质量读数,并记录。
三、pH计pH计是一种用于测量溶液酸碱度的仪器。
在使用pH计之前,需要用干净的水清洗电极,并将其放入要测试的溶液中。
等待电极的读数稳定后,记录pH计上显示的数值。
在使用完毕后,将电极从溶液中取出,并再次用清水清洗干净。
四、离心机离心机是一种用于分离物质混合物的仪器。
在使用离心机之前,首先确定离心机的转速和离心时间。
将待分离的混合物倒入离心管中,并确保每个离心管中的混合物具有相同的体积和质量。
将离心管放入离心机的样品架上,并关闭离心机的盖子。
设置离心机的参数,并启动离心过程。
离心完成后,小心取出离心管,并将上清液和沉淀物分离。
五、分光光度计分光光度计是一种用于测量溶液吸光度的仪器。
使用分光光度计时,首先要设置所需的波长,并进行零点校准。
将待测试的样品放入光度计的样品室中,并关闭盖子。
读取显示屏上的吸光度数值,并记录。
通过以上示例,我们可以看到在实验室中,仪器的正确操作是实验成功的关键。
操作仪器时,应仔细阅读和遵守仪器操作手册,并按照安全操作规程进行操作。
此外,及时维护和保养仪器也是十分重要的,以确保仪器的准确性和可靠性。
高中化学实验复习讲义常用化学仪器规格用途一、常用化学仪器的主要用途、使用方法和注意事项1.容器、反应器⑴ 可以直接加热的仪器有: 试管、蒸发皿、坩埚、燃烧匙。
⑵ 垫石棉网间接加热的仪器有:烧瓶、烧杯、锥形瓶。
⑶ 不能加热的仪器有:集气瓶、启普发生器、洗气瓶、滴瓶等。
2.加热器:常用的加热热源-酒精灯、喷灯。
3.测量器:(1) 量容积:粗量器:量筒(读数保留到0.1mL );精量器:容量瓶(量入式仪器)、滴定管(读数保留到0.01mL ),用于准确量取一定体积液体的仪器。
(2) 量质量:托盘天平(带砝码,精确到0.1g )。
(3) 量温度:水银温度计。
⑷ 量气装置:用于量取产生气体的体积:【知识理解】1滴定管的类型及区别:带玻璃活塞的滴定管为酸式滴定管,带有内装玻璃球的橡皮管的滴定管为碱式滴定管。
2碱式滴定管能盛装:碱性、中性溶液;酸式滴定管能盛装:酸性、中性、强氧化性溶液。
3滴定管中溶液体积大于最大刻度值。
4量筒与滴定管对比【知识巩固】⑴量筒是粗略量取液体体积的仪器,而滴定管是较精密量取液体体积的仪器。
量筒的0刻度 无 ,滴定管的0刻度在 上 方。
看刻度时:对量筒:仰视读数偏 小 ,对滴定管,仰视读数偏 大 。
滴定时,如果先仰视后俯视,所得结果与正确结果比较偏小。
量筒及滴管用蒸馏水洗净后,不能直接量取液体体积,要先__待装液体润洗__,才可用它来量取液体的体积。
⑵欲量取19.00mL 稀硫酸置于锥形瓶中,可选用仪器是_ BA .刻度烧杯B .20mL 酸式滴定管C .50mL 量筒D .25mL 容量瓶⑶右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是B _A .①是量筒,读数为2.5mLB .②是量筒,读数为2.5mLC .③是滴定管,读数为2.5mLD .②是温度计,读数是2.5℃图Ⅰ表示10mL 量筒中液面的位置,A 与B ,B 与C 刻度间相差1mL ,如果刻度A 为4,量筒中液体的体积是____mL 。
仪器分析完整版(详细)第一章绪论1.仪器分析是以物质的物理组成或物理化学性质为基础,探求这些性质在分析过程中所产生分析信号与被分析物质组成的内在关系和规律,进而对其进行定性、定量、进行形态和机构分析的一类测定方法,由于这类方法的测定常用到各种比较贵重、精密的分析仪器,故称为仪器分析。
与化学分析相比,仪器分析具有取样量少、测定是、速度快、灵敏、准确和自动化程度高的显著特点,常用来测定相对含量低于1%的微量、痕量组分,是分析化学的主要发展方向。
2.仪器分析的特点:速度快、灵敏度高、重现性好、样品用量少、选择性高局限性:仪器装置复杂、相对误差较大3.精密度:是指在相同条件下对同一样品进行多次测评,各平行测定结果之间的符合程度。
4、灵敏度:仪器或方法的灵敏度是指被测组分在低浓度区,当浓度改变一个单位时所引起的测定信号的该变量,它受校正曲线的斜率和仪器设备本身精密度的限制。
5.准确度:是多次测定的平均值与真实值相符合的程度,用误差或相对误差来描述,其值越小准确度越高。
6.空白信号:当试样中没有待测组分时,仪器产生的信号。
它是由试样的溶剂、基体材质及共存组分引起的干扰信号,具有恒定性,可以通过空白实验扣除。
7.本底信号:通常将没有试样时,仪器所产生的信号主要是由随机噪声产生的信号。
它是由仪器本身产生的,具有随机性,难以消除,但可以通过增加平行测定次数等方法减小;、8.仪器分析法与化学分析法有何异同:相同点:①都属于分析化学②任务相同:定性和定量分析不同点:①与化学分析相比,仪器分析具有取样量少、测定快速、灵敏、准确和自动化程度高等特点②分析对象不同:化学分析是常量分析,而仪器分析是用来测定相对含量低于1%的微量、衡量组分,是分析化学的主要发展方向9.仪器分析主要有哪些分类:①光分析法:分为非光谱分析法和光谱法两类。
非光谱法:是不涉及物质内部能级跃迁的,通过测量光与物质相互作用时其散射、折射、衍射、干涉和偏振等性质的变化,从而建立起分析方法的一类光学分析法。
第一部分光谱仪的介绍一简介1.产地:美国PPS公司生产()2.型号:unispec-SC(单通道)3.技术规格:4.特点:·高精度光谱仪(无需要标定)·内置光源·重量轻便于野外携带(<2.5kg)·抗震设计·可选的掌上电脑带可替换存储卡5.硬件介绍a.unispec外壳:分光计系统,光源,电池,相关电子设备·分光计:·光源:由7.0W卤灯支持,技术指标:电压:0-5V电流:1.35A色彩温度:2800K使用寿命:<1500小时·电池:铅酸电池(6V,3.4A)充满:运行分光计:达35小时开启光源:使用2~3小时·其他电子设备:保险丝,暗电流分压计b.光纤探头我们主要使用的是反射光纤探头反射光纤探头有两种类型此外,还有吸收/发射光纤探头,吸收/发射潜入式探头。
c.样品固定器/光纤固定器光纤固定器固定光纤探头端部后,使其与叶面成60度夹角·标准夹:用于阔叶,和普通光纤探头配套使用·微型夹:用于针叶,和微型光纤探头配套使用·试验夹:d.外接电源(6V,12A的铅酸电池):为了延长机器野外使用时间,大约与内置电源使用时间相当。
e.计算机:unispec是由一台计算机控制。
任何一台安装windows3.1或以上版本的计算机(包括个人掌上电脑)上都可以运行。
f.此外,还有光纤延长线,视角调制管,参比板等6.应用·植物生理生态分析:光谱反射系数是冠层结构和植物生理的基本参数。
叶绿素和氮含量都是叶生理的指示参数。
新的光谱反射系数能够用做研究光合有效辐射的利用效率和胡萝卜素的含量。
使用独特的微型光纤探头可以探测针形叶的反射系数。
·农作物冠层分析:利用检测光谱反射系数可以研究冠层变化和植物受不同的胁迫情况。
·检测植物状态:可量化检测如色素含量、光合作用的改变、早衰等参数。