新型聚合反应第5章 共轭聚合物合成 化学-2012-6(1)
- 格式:pdf
- 大小:947.07 KB
- 文档页数:98

共轭配位聚合物(Conjugated Coordination Polymers,CCPs)是一种独特的金属有机框架(MOFs),具有独特的结构和优异的性能。
它们是通过金属中心与有机配体之间的配位化学反应形成的。
由于配体和过渡金属离子之间存在有效的π-d杂化,使得电子在整个骨架上以离域的状态存在,因此共轭配位聚合物具有高导电性和良好的稳定性。
这些特性使得共轭配位聚合物在许多领域中都有广泛的应用,包括半导体器件、超导体材料、传感器、电化学催化剂和储能装置等。
然而,共轭配位聚合物的合成过程较为复杂,有机配体和金属中心在反应过程中可能会发生原位氧化/还原反应,导致化学状态和结构的不确定性。
此外,由于合成条件的不可控性和复杂的化学反应,所获得的样品结晶性较低,使得对产物的结构分析变得异常困难。
尽管存在这些挑战,共轭配位聚合物仍具有巨大的应用潜力。
随着研究的深入和技术的发展,我们有望开发出性能更加优异、稳定性更高的共轭配位聚合物材料,进一步推动其在各个领域的应用。

共轭体系的设计与合成共轭体系是一种在有机化学中广泛应用的重要概念。
通过合适的设计与合成,可以构建具有共轭结构的有机分子,从而改变其光电性能,并应用于光电器件、生物传感器等领域。
本文将介绍共轭体系的设计与合成方法,并探讨其在不同应用方面的潜力。
从化学角度来说,共轭体系是指由相邻的π电子系统组成的一系列原子或官能团。
共轭体系的设计与合成是有机化学的重要研究领域,它提供了一种有效的方法来调控化合物的光电性能。
通过在分子中引入共轭结构,可以改变分子的能带结构和电荷分布,从而调节其光吸收、电导率和发光性能。
共轭体系的设计与合成方法有很多种,其中最常见的包括共轭聚合物的合成和有机小分子的修饰。
共轭聚合物是由具有共轭结构的单体通过化学反应而形成的高分子材料。
通过调节聚合物的结构和组成,可以实现对其光电性能的调控。
例如,在聚合物链中引入电子受体和供体单元,可以实现电荷的传输和分离,从而提高光电转换效率。
与聚合物相比,有机小分子的设计与合成更加灵活。
通过在有机小分子中引入共轭结构,可以改变其荧光、吸波和透明性等性质。
例如,通过合成具有共轭结构的有机染料,可以实现对光吸收和发光的调控。
这些有机染料可以应用于光电器件、生物传感器等领域,展示出良好的应用潜力。
除了共轭体系的设计和合成方法,还有一些其他的因素需要考虑。
例如,在设计和合成过程中需要考虑分子的溶解性、稳定性和结构特征等。
这些因素会直接影响分子的应用性能和稳定性。
因此,在共轭体系的设计与合成过程中,需要综合考虑各种因素,以实现对分子性能的调控和优化。
共轭体系的设计与合成不仅在有机光电材料领域有广泛应用,还在生物医学领域展示出了很大的应用潜力。
通过将共轭体系引入到生物分子中,可以实现对其荧光和电荷传输性能的调节,并应用于生物传感器和荧光标记等领域。
这些应用不仅可以提高生物分析的灵敏度和特异性,还可以为生物医学研究提供新的工具和方法。
综上所述,共轭体系的设计与合成是有机化学中的一个重要研究领域。



Vol .30高等学校化学学报No .22009年2月 CHE M I CAL JOURNAL OF CH I N ESE UN I V ERSI TI ES 413~416新型聚苯撑乙烯类阳离子共轭聚合物的合成及其荧光猝灭行为张广维1,2,范曲立2,黄 维2(1.复旦大学先进材料实验室,上海200433;2.南京邮电大学信息材料与纳米技术研究院,南京210046)摘要 通过W ittig 反应合成了新型聚对苯乙烯撑类阳离子共轭聚合物,并进行了相关结构表征和光学性质表征.从1H NMR 谱图分析得知,该聚合物具有一定含量的顺式构型.经过季铵化以后得到相应的阳离子共轭聚合物.荧光猝灭行为研究表明,该阳离子共轭聚合物表现出不完全荧光猝灭.关键词 阳离子共轭聚合物;荧光猝灭;聚苯撑乙烯中图分类号 O631 文献标识码 A 文章编号 025120790(2009)022*******收稿日期:2008205212.基金项目:国家自然科学基金(批准号:20574012,90406021,20774043)和南京邮电大学引进人才科研启动基金项目(批准号:NY207035)资助.联系人简介:黄 维,男,博士,教授,主要从事高分子化学与物理、功能高分子材料和有机/塑料电子学研究.E 2mai:wei 2huang@njup t .edu .cn水溶性离子型共轭聚合物在化学与生物传感器领域具有潜在的应用价值,已引起人们的广泛关注[1].由于静电引力的存在,离子型共轭聚合物与猝灭剂之间的结合相对较强,共轭主链上的能量迁移较容易发生,因此,离子型共轭聚合物的荧光可以被少量的低浓度猝灭剂通过电子或者能量转移猝灭[2],这种荧光猝灭现象可以用于高灵敏度化学与生物检测.离子型共轭聚合物通常通过在共轭聚合物的侧链上引入可溶性离子基团(如铵基、羧基或磺酸基等)得到.目前,含磺酸基侧链的阴离子型共轭聚合物是作为荧光传感材料被研究得最多的一种水溶性共轭聚合物[2~4],这种水溶性聚合物对含阳离子的紫精类化合物或染料具有极高的检测灵敏度.但是迄今为止,关于阳离子型的聚苯撑乙烯(PP V )类衍生物的报道尚不多见[5],这类聚合物可以通过在共轭聚合物的侧链上引入铵根离子、吡啶阳离子和咪唑阳离子等得到.阳离子型共轭聚合物的合成一般有两种路径:先得到中性聚合物再季铵化,或者直接用离子型的单体聚合得到离子型共轭聚合物.用前一种方法得到的产物更容易提纯.本文采用W ittig 反应(如Sche me 1所示)合成了一种阳离子型PP V 类共轭聚合物(P1′),测定了其发光性能,同时还研究了该阳离子共轭聚合物在Fe (CN )4-6存在下的荧光猝灭行为.Sche m e 1 Syn theti c routes of poly m er P1′1 实验部分1.1 试剂与仪器2,52二羟基2对苯二甲酸二乙酯、22氯代三乙胺盐酸盐、溴乙烷、三苯基膦以及猝灭剂K 4Fe (CN )6等均购自A ldrich 试剂公司.二氯亚砜(S OCl 2)(C .P .级)、钠(A.R.级)、氢化锂铝(A.R.级)以及其它常见化学试剂和溶剂均购自中国医药集团(上海)化学品试剂公司.二氯亚砜经蒸馏后使用.核磁共振谱(NMR )在Varian Mercury Plus 400型核磁共振仪上测定,以四甲基硅为内标;紫外2可见吸收光谱(UV 2V is )在Shi m adzu 3150PC 型紫外分光光度计上测定;荧光光谱(P L )在Shi m adzu RF 25301PC 型光谱仪上获得,以氙灯为激发光源;猝灭行为研究主要通过原位比较系列聚合物的荧光强度和猝灭剂浓度关系而实现.所有被猝灭溶液在鼓氮气1m in 后加入化学计量的猝灭剂溶液,然后立即进行吸收和发射光谱测试.单体1参考文献[5]方法合成.中性聚合物的分子量在Agilent1100型凝胶渗透色谱仪上测得,以PS 作为内标,四氢呋喃(T HF )作为流动相;离子聚合物的分子量以PEG 为标样,用Agi 2lent1100水相凝胶色谱仪测定,流动相为012mol/L 的高氯酸锂的甲醇溶液.1.2 实验过程1.2.1 单体2的合成 单体2的合成如Sche me2所示.Sche m e 2 Syn theti c routes of m ono m er 2在10g (39mmol )2,52二羟基2对苯二甲酸二乙酯的丙酮溶液中,加入32g (232mmol )碳酸钾,加热到回流,反应015h,加入1614g 22氯代三乙胺盐酸盐,搅拌下回流72h 后,旋去丙酮,加水溶解并用乙酸乙酯萃取得有机层.在该有机层中加入盐酸(2mol/L )直至水层为酸性为止.去除有机层,向水层中加入饱和碳酸钾溶液至不冒气泡为止,此时pH 值应为中性.再加入乙酸乙酯萃取,所得有机层经水洗、无水硫酸钠干燥得粘稠的棕色液体2119g (化合物1).1H NMR (CDCl 3),δ:7137(s,2H ),4136(q,4H ),4109(t,4H ),2190(t,4H ),2164(q,8H ),1138(t,6H ),1106(t,12H ).在512g 氢化锂铝(137mmol )中加入50mL 四氢呋喃淹没,在冰水浴下将1510g 化合物1溶于200mL 四氢呋喃后慢慢滴入上述体系中,滴加完毕后加热回流2h,冷却至室温后,滴加饱和硫酸钠溶液至不冒气泡为止,过滤所得固体加入200mL 四氢呋喃后加热回流2h,将2次所得滤液合并旋干重结晶,得到白色固体1111g (化合物2).1H NMR (D 2O ),δ:6199(s,2H ),4156(s,4H ),4130(t,4H ),3154(t,4H ),3126(m ,8H ),1125(t,12H ).将3168g (10mmol )化合物2溶于100mL 甲醇,室温下加入氯化氢的甲醇溶液酸化,搅拌30m in 后除去溶剂,重结晶得白色晶体.将此白色晶体加入至50mL 二氯亚砜中,在室温下搅拌72h,除去二氯亚砜后重结晶得到白色晶体.将此白色晶体加入10mL 二氯亚砜,于0℃氮气保护下搅拌10m in .移去冰水浴,将反应混合物在常温下继续搅拌3h .减压蒸馏除去二氯亚砜,加入100mL 丙酮,搅拌2h,过滤,并用丙酮洗涤3次.粗产物用乙醇重结晶得3182g 白色晶体(化合物3),产率80%.1H NMR (CD 3OD ),δ:7122(s,2H ),4175(s,4H ),4143(t,4H ),3169(t,4H ),3142(m ,8H ),1141(t,12H ).单体2的合成:将2139g (5mmol )化合物3以及2189g (11mmol )三苯基膦,加入到10mL N ,N 2二甲基甲酰胺中,于75℃加热搅拌回流24h .过滤得到的沉淀经乙醇重结晶得5115g 白色晶体,产率89%.1H NMR (DMS O ),δ:11114(br,2H ),7188(t,6H ),7163(m ,24H ),6160(s,2H ),5133(d,414高等学校化学学报 Vol .30 4H),2190(d,8H),2173(t,4H),2148(t,4H),1114(t,12H).1.2.2 阳离子共轭聚合物的合成 在50mL圆底烧瓶中加入110g单体2和0187mmol的单体1,用10mL无水乙醇和10mL无水氯仿溶解,充分搅拌,加入01476g无水乙醇钠溶液,混合物搅拌12h倒入200mL甲醇中,将得到的沉淀过滤、水洗后用索氏提取器提取3d后干燥即得到目标聚合物P1. 1H NMR(CDCl3),δ:8100~7130(br,A r—H),7120~6185(br,A r—H,trans2vinyl p r ot ons),6180~6160(br,cis2vinyl p r ot ons),4110~3180(br,—OCH2—in trans2vinyl gr oup s),3170—3150(br,—OCH2—in cis2vinyl gr oup s),2182—2170(m,4H,—OCH2C H2N—),2168~2150(m,8H,—NC H2CH3),1165~1154(br,8H,—OCH2C H2C H2—),1140—1120[br,24H,—(C H2)6CH3],1105—0195(m,12H,—NCH2C H3),[br,6H,—(CH2)6C H3],0191—0179.M n(GPC)=5000;M w/M n=112.在50mL圆底烧瓶中加入014mmol中性聚合物P1,加入20mL四氢呋喃使之溶解,然后加入01436g溴乙烷和5mL二甲亚砜,在50℃下搅拌3d.旋去大部分溴乙烷和四氢呋喃,聚合物用丙酮沉降,离心分离,于50℃下真空干燥即可得到目标聚合物P1′.1H NMR(DMS O),δ:7180—7100(br, A r—H,vinyl p r ot ons),4130—3193(br,—OCH2—,—NCH2—),1150—0180[br,—(CH2)6CH3,—NCH2C H3].M n(GPC)=5900;M w/M n=113.2 结果与讨论2.1 顺反构型比例的估算中性聚合物P1以及季铵化聚合物P1′的1H NMR谱图如图1所示.由图1可以看出,—OCH2—基团的信号分裂成两组,其中低场的吸收对应于反式构型而高场的吸收则对应于顺式构型[6,7].对P1来说,两组信号发生了明显的分离,分别位于4110~3175和3170~3150两个区间,这为顺式构型含量的估算提供了一个方便的途径.因此P1中顺式构型的比例可以通过比较—OCH2—在3170~3150处的顺式积分值与—OCH2—在4110~3150之间的总积分值而算得,约为30%.F i g.1 1H N M R spectra of the poly m ersP1and P1′ F i g.2 UV2V is absorpti on and P L e m issi on spectra ofP1(1125μm ol/L)i n CHC l3and P1′(1125μm ol/L)i n CH3O H2.2 光学性质图2是中性聚合物P1在氯仿中的吸收和发射光谱及季铵化聚合物P1′在甲醇中的吸收和发射光谱.P1′和P1最大吸收峰分别在370和412nm处.季铵化使得P1′的吸收发生了较为明显的蓝移,这是因为苯环侧链上带正电荷的取代基之间的电子相互排斥作用导致了共轭主链的扭曲,从而使得有效共轭度下降,类似的现象在其它的季铵化体系也曾见到[5,8~10].但是,季铵化以后发射光谱却呈现2个发射峰,结合吸收光谱分析可知,其中490nm附近小峰归属于有效共轭度较低的链段的发射,而552nm附近的发射峰,较季铵化前发生了较大的红移,这可能是由于链间聚集所致[11].2.3 荧光猝灭行为图3为P1′在甲醇中与Fe(CN)4-6的猝灭曲线,沿着箭头所示方向猝灭剂量逐渐增加乃至大大过量为止.其中插图为Stern2Vol m er曲线[12],为线性下偏型曲线.荧光猝灭包括静态猝灭和动态猝灭,采用Stern2Vol m er经验方程[15]:F0/F=1+K sv[Q]估算.式中,F0为无猝灭剂时的荧光强度,F为加猝514 No.2 张广维等:新型聚苯撑乙烯类阳离子共轭聚合物的合成及其荧光猝灭行为 F i g .3 P L e m issi on spectra of P1′(1125μm ol/L )i nthe presence of Fe(CN)4-6w ith d i fferen t con 2cen tra ti on sI nset:Stern 2Vol m er p l ot of P1′1125μmol/L )quenched by Fe (CN )4-6in methanol .灭剂后的荧光强度,[Q ]为猝灭剂的浓度,K sv 为对应的动态或静态Stern 2Vol m er 猝灭常数.通常线性下偏型曲线可以解释为体系中存在两种发色团,其中一种为猝灭剂所不能碰触到的.当引入猝灭剂时,只有那些猝灭剂能碰触到的发色团荧光可以被猝灭,而猝灭剂所不能碰触到的发色团仍然保持发光[12].从猝灭曲线上可以很直观地看到,在猝灭剂大大过量的情况下,荧光并没有被完全猝灭.因此,P1′分子链中大体积苯取代基及其顺式构型的存在对荧光猝灭行为存在直接的位阻效应,阻止了发色团与猝灭剂之间的静电相互作用,在一定程度上影响了其荧光猝灭行为[5].由于在W ittig 反应中分子侧链中取代基的体积对于顺式构型具有一定影响[13],因此上述荧光猝灭本质可以归因于其分子链上芳香取代基性质的不同,亦即分子结构的不同.参 考 文 献[1] Achyuthan K .E .,Bergstedt T .S .,Chen L.,et al ..J.Mater .Che m.[J ],2005,15(27/28):2648—2656[2] Chen L.H.,Mcbranch D.W.,W ang H.L.,et al ..Pr oc .Natl .Acad .Sci .US A.[J ],1999,96(22):12287—12292[3] ZHANG Tao (张涛),F AN Hong 2L iang (范宏亮),ZHOU Jian 2Guang (周建光),et al ..Che m.J.Chinese Universities (高等学校化学学报)[J ],2006,27(5):853—855[4] Xie B.H.,BaguiM.H.,Guo R.R.,et al ..J.Poly m.Sci .,Part A:Poly m.Che m.[J ],2007,45(22):5123—5135[5] Fan Q.L.,Lu S .,Lai Y .H.,et al ..Macr omolecules[J ],2003,36:6976—6984[6] L iao L.,Pang Y .,D ing L.,et al ..Macr omolecules[J ],2001,34:6756—6760[7] L iao L.,Pang Y .,D ing L.,et al ..Macr omolecules[J ],2001,34:7300—7305[8] Balanda P . B.,Ra meyM. B.,Reynolds J.R..Macr omolecules[J ],1999,32:3970—3978[9] L iu B.,Yu W.L.,Lai Y .H.,et al ..Macr omolecules[J ],2002,35:4975—4982[10] Fan Q.L.,Zhou Y .,Lu X .M.,et al ..Macr omolecules[J ],2005,38:2927—2936[11] A rr oyo 2V illan M.I .,D iaz 2Quijada G . A.,Abdou M.S . A.,et al ..Macr omolecules[J ],1995,28:975—984[12] Lakowicz J.R..Princi p les of Fluorescence Spectr oscopy,2nd Ed .[M ],Ne w York:Plenum Press,1999:238—240[13] Maryanoff B.E .,Reitz A. B..Che m.Rev .[J ],1989,89:863—927Syn thesis and Quench i n g Behav i or of a Novel Ca ti on i cPoly(p 2phenylenev i n ylene)Rel a ted Copoly m erZ HANG Guang 2W ei 1,2,F AN Qu 2L i 2,HUANG W ei 23(1.L aboratory of A dvanced M aterials,Fudan U niversity,Shanghai 200433,China;2.Institute of Infor m ation M aterial and N ano Technology,N anjing U niversity of Posts andTeleco mm unications,N anjing 210046,China )Abstract A novel poly (p 2phenylenevinylene )related copoly mer was synthesized byW ittig reacti on .The cor 2res ponding cati onic conjugated poly mer was successfully obtained via a post 2poly merizati on app r oach .On the basis of 1H NMR s pectra,it was f ound that this phenyl 2substituted PP V related copoly mer is of 30%cis 2vinyliclinkage .The quenching effect of Fe (CN )4-6on the cati onic PP V derivative was studied,and a downwardStern 2Vol m er curve was f ound .Keywords Conjugated polyelectr olytes;Quenching effect;Poly (p 2phenylenevinylene )(Ed .:D,Z )614高等学校化学学报 Vol .30 。

合成共轭聚合物是一种重要的有机材料,具有良好的电子传输性能和光电特性,在有机电子器件和太阳能电池等领域有广泛应用。
以下是一些新的方法用于合成共轭聚合物的示例:1.聚合物化学反应:聚合物化学反应是合成共轭聚合物的常用方法。
例如,苯并噻吩
(P3HT)等共轭聚合物可以通过Grignard金属试剂和卤代单体进行聚合反应合成。
2.交叉偶联聚合法:这是一种通过交叉偶联反应将不同的单体连接起来合成共轭聚合物
的方法。
常见的交叉偶联反应有Stille偶联、Suzuki偶联、Sonogashira偶联等。
3.多元官能团反应:利用多元官能团反应可以在一个反应中连接多个单体,形成具有高
度共轭结构的聚合物。
例如,Knoevenagel缩合反应可以合成共轭聚合物。
4.有机催化聚合:近年来,有机催化聚合成为一种受欢迎的方法,通过有机小分子催化
剂引发聚合反应,避免了传统金属催化剂的毒性和残留问题。
5.自由基聚合:自由基聚合是一种常用的方法,通过引发剂引发自由基反应,合成具有
共轭结构的聚合物。
6.电化学聚合:电化学聚合是一种通过电化学方法合成共轭聚合物的方法,可以在无溶
剂条件下进行,有助于减少环境影响。
7.原子转移自由基聚合:这是一种控制聚合物分子量和结构的方法,通过原子转移自由
基聚合反应,可以实现精确的聚合物合成。
需要注意的是,合成共轭聚合物需要根据所需的性质和应用选择适合的方法,并进行适当的优化和调整。
不同的方法可能适用于不同类型的共轭聚合物,具体的合成方案需要根据研究目标进行设计和优化。

高分子化学(2012)习题(定稿)第一章诸论习题1.与低分子化合物相比,高分子化合物有什么特征。
随着高分子的发展,高分子概念的外延进一步扩大,请举例说明。
2.说明下列名词和术语的概念:(1)单体,聚合物,高分子,高聚物(2)碳链聚合物,杂链聚合物,元素有机聚合物,无机高分子(3)主链,侧链,侧基,端基(4)结构单元,单体单元,重复单元,链节(5)聚合度,相对分子质量,相对分子质量分布(6)连锁聚合,逐步聚合,加聚反应,缩聚反应(7)加聚物,缩聚物,低聚物3. 写出下列单体得到的聚合物的名称、分子式,注明聚合物的结构单元和重复单元。
(1)甲基丙烯酸甲酯(2)偏二氯乙烯(3)丙烯酰胺(4)α-甲基苯乙烯(5)α-氰基丙烯酸甲酯(6)对苯二甲酸+ 丁二醇(7)己二酸+ 己二胺(8)4,4′ - 二苯基甲烷二异氰酸酯+ 乙二醇4.写出下列聚合物中文名称(用来源基础命名法)和分子式,注明结构单元和重复单元。
(1)PS(2)PVC(3)PP(4)PMMA(5)PAN(6)PET(7)PC(8)尼龙-665. 根据大分子链结构特征命名法对下述聚合物进行命名(1)聚甲醛(2)环氧树脂(3)涤纶(4)聚碳酸酯(5)尼龙6(6)~~~~ O (CH2)2O-CONH (CH2)6NHCO ~~~~(7)~~~~ HN(CH2)6NH-CONH(CH2)6NHCO ~~~~(8)~~~~ NHCONH-CH2 ~~~~6.用本章所介绍的各种命名法对下列单体合成的聚合物进行命名(1)氯乙烯 (2)丁二烯(3)对苯二甲酸+乙二醇7.写出下列聚合物的分子式,求出n ,n X ,DP 。
(1)聚乙烯,相对分子质量为28万。
(2)尼龙66,相对分子质量为1.13万。
8.写出下列单体的聚合反应式、单体和聚合物的名称 (1)CH 2=CHF(2)CH 2=CH(CH 3)2(3)H 2CC OCO CH 3CH 3(4)HO-( CH 2)5-COOH(5)H 2H 2CCH 2O(6)CH 3NCONCO+HO(CH 2)2OH(7)COClCO Cl+ NH 2H 2N9.举例说明链式聚合与加聚反应,逐步聚合与缩聚反应的关系与区别。

课后训练基础巩固1.下列关于有机高分子化合物的说法中不正确的是( )A.有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由低分子化合物通过聚合而制得的B.有机高分子化合物的相对分子质量很大,因而其结构复杂C.对于一种高分子材料,n是一个整数,因而它的相对分子质量是确定的D.高分子材料可分为天然高分子材料和合成高分子材料2.聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好、不易老化、耐擦洗、色彩亮丽等优点。
聚丙烯酸酯的结构简式为,它属于()①无机化合物②有机化合物③高分子化合物④离子化合物⑤共价化合物A.①③④ B.①③⑤ C.②③⑤D.②③④3.关于CH2—CH2与的说法不正确的是( )A.二者相对分子质量大小不能确定B.二者形成的物质均为混合物C.合成二者的反应类型相同D.二者的性质不相同4.下列物质中,能发生加成、加聚、缩聚反应的是()A.B.CH2===CHCH(OH)CH2COOHC.CH2===CHCOOHD.HO—CH2-CH===CH—CH2—O—CH35.下列合成有机高分子化合物的反应中,属于加聚反应的是()B.n HCHO错误!CH2—O能力提升6.(2012嘉兴高二检测)下列高分子化合物都是通过加聚反应或缩聚反应形成的,试确定其单体。
(1)(ABS树脂)________.(2)(涤纶,又称的确良)________.(3)CF2—CF2(塑料王)________。
参考答案1.答案:BC 点拨:高分子材料按其来源可分为天然高分子材料和合成高分子材料两大类;有机高分子化合物的合成主要是通过聚合反应进行的;对于高分子化合物来说,尽管相对分子质量较大,但它们的结构均由若干链节组成,因聚合度n为不确定值,所以没有确定的相对分子质量,只有一个范围。
2.答案:C 点拨:聚丙烯酸酯是由丙烯酸酯通过加聚反应得到的,它属于有机高分子化合物,并且是共价化合物。
3.答案:C 点拨:二者都是有机高分子化合物,聚合度n不确定,二者相对分子质量大小不能确定;二者形成的物质均为混合物;不同物质当然性质不相同;前者是通过加聚反应制得,后者是通过缩聚反应制得,反应类型不同,C错。

聚合物合成反应的机理和研究方法聚合物是由不同的小分子单元通过化学键结合而形成的高分子化合物,它广泛应用于医学、化工、材料科学等领域。
在聚合物的制备过程中,聚合物合成反应是非常重要的一步。
本文将探讨聚合物合成反应的机理以及研究方法。
一、聚合物合成反应的机理聚合物合成反应是指将单体分子缩合成链状高分子化合物的反应过程,其机理包括自由基聚合、离子聚合、羰基聚合、酰胺聚合等。
1.自由基聚合自由基聚合是最常见的聚合物合成反应,其机理是在反应中发生自由基的链式反应。
首先,引发剂(如温度、光或化学物质)会将单体分子中的一个或多个电子从共价键中打出,形成自由基。
接着,自由基与另一个单体分子的双键结合,形成一个新的自由基。
这种机理将循环重复,直到形成长链状的高分子化合物。
2.离子聚合离子聚合是将离子性单体分子缩合成离子链的反应。
这种机理主要有阴离子聚合和阳离子聚合两种。
在阴离子聚合中,引发剂引发了阴离子的形成,这些离子与单体分子结合并释放出负离子,形成更多的阴离子并最终生成一个长链状的高分子化合物。
而在阳离子聚合中,正离子与单体分子结合进一步释放出正离子,周而复始直到形成长链状高分子化合物。
3.羰基聚合羰基聚合是一种重要的聚合物合成反应,其机理是在酰基或酯基的存在下,通过核酸加成,使单体中的羰基上的氧原子与其他单体缩合,依次形成长链状的高分子化合物。
此外,还可以在氰基聚合中使用氰基作为单体。
4.酰胺聚合酰胺聚合是通过在酰胺键的存在下,将含有官能基的单体与偶联剂结合形成长链状高分子化合物的反应。
此外,还可以通过其他官能基的反应,如酯化、亲核取代等反应实现聚合物的制备。
二、聚合物合成反应的研究方法1.光谱分析光谱分析是一种无损检测技术,被广泛应用于聚合物合成反应的机制研究中。
例如,利用红外光谱、核磁共振等分析方法,可以对反应物在反应过程中发生的化学变化进行跟踪,帮助确认反应物种类、反应程度、质量分数等信息。
2.热分析热分析是聚合物反应机制研究的另一种常见方法。

139科技创新导报 Science and Technology Innovation Herald 化学工业1 有机共轭聚合物的功能特性有机共轭聚合物作为一种新型的功能材料,人们已逐渐认识到其丰富的功能特性。
从小分子到高分子,其电磁光等特性越来越明显。
早在20世纪70年代初,Heeger,Macdiamid及Shirakawa等人发现通过对绝缘材料聚乙炔进行掺杂,其电导率急剧提高,可增加几个甚至十几个数量级。
某些聚合物的电导率接近甚至超过金属铜(铜的电导率为6 105 1Ωcm )。
还有些聚合物材料如(SN)x在极低的温度(Tc=0.15K)下具有超导电性。
有特殊结构的有机半导体可能具有磁性,如高分子-金属配合物、分子内含氮氧稳定自由基团结构的有机化合物、平面大π键结构的有机物以及电子转移复合物等。
有机发光二极管(OLEDs)是有机分子材料的一个重要应用,目前以小分子合成的发光器件已经实用化,高分子有机发光二极管也达到实用标准。
总之,有机共轭聚合物由于其丰富的电、磁、光等功能特性,现已在有机发光、有机场效应管、塑料电子学、有机铁磁体和分子电子学等多个领域得到了广泛的应用和研究。
有机共轭聚合物是软凝聚态物质的典型代表,也是理解有机体、生物物质的基础。
有机半导体(O S E s )由于它的特殊性(“软”性),可和磁性层形成一个良好的接触,且由于其弱的自旋-轨道耦合和超精细相互作用,相应的自旋扩散长度比较长,因而是实现自旋极化输运理想的候选材料。
目前有机共轭聚合物在自旋电子学中的研究也已逐步展开。
2 有机共轭聚合物中的元激发有机材料与通常的无机半导体材料相比有本质的不同。
有机材料由于强的电子-晶格相互作用,有结构上的“软”性,任何电荷密度的改变都可能导致系统结构的再构。
它的载流子不是通常意义上的电子或空穴,也不是以扩展态的形式存在,而是形成所谓的“自陷态”或“局域元激发”,如孤子,极化子或双极化子。
共轭聚合物复合材料的结构和性能一、共轭聚合物的概念和特点1.1 共轭聚合物的概念共轭聚合物是一种由透明、高分子量的物质构成的高分子聚合物。
它的共轭结构决定了它在化学、物理和电学上的独特性质。
由于具有高导电性、光电性质,共轭聚合物广泛应用于电子器件、光电器件等领域。
1.2 共轭聚合物的特点共轭聚合物通常具有下列特点: * 具有π电子的共轭结构,有很强的电子云共振现象; * 拓扑构型复杂,通常呈现出无规则、扭曲的形状; * 具有分子内的有序结构; * 具有许多不饱和键。
二、共轭聚合物复合材料的特点2.1 复合材料的定义复合材料是将两种或两种以上的性质不同的材料,通过某种方法,使它们在微观和宏观上有机地结合在一起,形成新的具有优异性能的材料。
2.2 共轭聚合物复合材料的特点共轭聚合物与复合材料的结合,可以形成共轭聚合物复合材料。
共轭聚合物复合材料具有以下特点: * 具有优异的导电性; * 可以改善材料的强度和刚性; * 具有优异的耐热性,能够在高温下工作; * 具有优异的疲劳性能,不易变形和劣化。
三、共轭聚合物复合材料的制备3.1 制备方法制备共轭聚合物复合材料的方法很多,常见有: * 加热挤压法 * 溶胶-凝胶法 *溶剂挥发法 * 压载法 * 喷涂法3.2 制备过程以溶胶-凝胶法为例,其制备过程如下: 1. 制备聚合物溶液与纳米材料混合物;2. 在搅拌条件下,将混合物静置一段时间,形成溶胶;3. 将溶胶置于烤箱中,经过一定温度和时间的处理后,它会凝胶成形; 4. 经过处理后的凝胶进行电子显微镜观察,确定结构和成分是否稳定; 5. 最后,将凝胶样品切割成形,进行结构和性能的测试。
四、共轭聚合物复合材料的应用4.1 在电子领域的应用由于共轭聚合物复合材料具有优异的导电性和光学特性,因此已被广泛用于电子领域,如: * 有机薄膜太阳能电池; * 有机发光二极管; * 有机场效应晶体管。
4.2 在材料领域的应用共轭聚合物复合材料还可以应用于材料领域,如: * 智能高分子材料; * 能量储存器材料; * 生物材料。
共轭微孔聚合物的设计与合成许彦红;姚婵【摘要】Conjugated microporous polymers( CMPs)are a class of organic porous polymers that combine π-conjugated skeletons with permanent nanopores. It has attracted intensive attention due to well-controlled structure ,high surface areas,and good physical and chemical stability. This article focuses on the CMPs molecular design principles and methods of preparation.%共轭微孔聚合物(Conjugated Microporous Polymers,CMPs)是一类结合π-共轭骨架和永久性的纳米多孔结构的有机多孔聚合物,由于其结构可控,高的比表面积和良好的物理化学稳定性而日益受到人们的重视。
这篇文章重点介绍了CMPs的分子设计原则和制备方法。
【期刊名称】《吉林师范大学学报(自然科学版)》【年(卷),期】2015(000)004【总页数】6页(P5-9,13)【关键词】共轭微孔聚合物;分子设计;制备方法【作者】许彦红;姚婵【作者单位】吉林师范大学化学学院,吉林四平136000;吉林师范大学化学学院,吉林四平136000【正文语种】中文【中图分类】O632.1共轭微孔聚合物(Conjugated Microporous Polymers,CMPs)是一类结合π-共轭骨架和永久性的纳米多孔结构的有机多孔聚合物.作为一类新兴材料平台,在共轭骨架和孔结构的分子设计方面,CMPs展示了高度可协调性.不同的化学反应,构建单元和合成方法已经被用来发展各种各样不同结构和特殊性质的CMPs,促进了该领域的快速发展.多孔材料在诸多领域中都发挥着重要作用,并作为一个优秀的功能材料平台而备受关注.从历史角度来看,多孔材料的骨架结构显然已从沸石和介孔硅的时代过渡[1-3]到了金属有机框架或多孔配位聚合物(PCPS)[4-6]和有机多孔材料[7-21] 时代.有机多孔材料可以通过非共价键和共价键两种构建方法合成.通过非共价键形成的有机笼状结晶聚合物是一类代表性的多孔材料[7-9].相反,有机多孔聚合物(POPs)[10-12],超交联聚合物(HCPs)[13-15],自聚微孔聚合物(PIMs)[16-18],共价有机骨架(COFs)[19-21]和共轭微孔聚合物(CMPs)[22,23]构成共价键连接的有机多孔材料,具有高孔隙率,轻质量和强共价键的特征.在这些共价键连接的有机多孔材料中,CMPs是一类非结晶性材料,允许构建单元以π-共轭形式连接进而形成三维网络结构.这些独特的结构特征是其它的多孔材料所不具备的.自从Cooper小组首次发现CMP以来[24],越来越多的化学家和材料学家加入到这一领域的研究,促进了该领域的快速增长.从分子设计的角度来看,CMPs的最大特点是构建单元π-共轭结构的多样性.构建单元从简单的苯基单元扩展到芳烃,杂环芳香族和大环,这些建筑块已成功运用到CMPs的合成.由于建筑块的尺寸、几何构型和官能团的限制性较少,因此可以系统地调节CMPs的多孔性,进而优化其结构.从合成的角度来看,线性共轭聚合物的合成方法可以有效地用于CMPs的制备,如 Suzuki 耦合反应,Yamamoto 反应[25-28],Sonogashira耦合反应[29],氧化耦合反应[30-31],希夫碱反应[32-33],环缩合反应[34-35],吩嗪环融合反应和Friedel-Crafts烷基化反应[36-37].构建单元的多样性,再加上反应类型的广泛性,使CMPs成为了发展新型有机多孔材料的一个宝贵平台.(1)几何要求.CMPs的网络骨架需要建筑块至少有两个活性基团.构建多孔结构的必要条件是不同几何构型的建筑块需要通过交叉耦合来实现三维网络结构,而自缩合反应对于建筑块的单独耦合是十分有用的.为清晰起见,建筑块的几何形状可分为C2,C3,C4和C6(图1).自缩合如C2+C2+C2[38-39]、C3+C3[40,41]或C4+C4[42,43]均可构成三维网络.相比之下,交叉耦合反应通常使用C2+C3[24,44]、C2+ C4[45,46]、C2+C6[47]、C3+C4、C3+C6或 C4+ C6[48]这样的组合.在这两种情况下,在三维网络中通过共价键形成的纳米孔在结果CMPs中留下了永久的孔隙度.(2)活性基团的多样性.各种π-单元,如芳香烃、芳香环、苯乙烯衍生物、杂环单元和大环系统,已成功发展为构筑CMPs的建筑块(图1).活性基团,如溴代芳烃、碘代芳烃、芳烃硼酸、氰基取代的芳烃、芳香醛、乙炔基取代的芳烃和氨基取代的芳烃,被广泛用于CMPs的合成.建筑块的多样性和活性基团的广泛性赋予了CMPs 不同的化学结构和不同的功能性.为了构建一个共轭的骨架,聚合物的合成反应必须共价地连接具有π-共轭键的建筑块.线性共轭聚合物的制备方法可有效地用于合成CMPs.Suzuki交叉耦合反应[45-46],Yamamoto 反应[42,43],Sonogashira反应[24,44],氧化耦合反应[40,49-50],希夫碱反应[51-53],Friedel-Crafts烷基化反应[54],吩嗪环融合反应[48]和环三聚反应[38-39]已被用于CMPs的合成(图2).建筑块具有不同的几何形状、活性基团和π-系统,这种结构的多样性可显著提高CMPs骨架和孔隙的设计灵活性.在一般合成方案中,单体、催化剂和溶剂的混合物在惰性气氛下搅拌,在指定的温度下反应一段时间,收集沉淀,用溶剂洗涤除去催化剂和未反应单体,真空干燥,从孔隙中除去溶剂分子,形成CMP.在替代方法中,已经开发了微波方法用于合成CMPs[55-57].微波方法的优点是缩短反应时间同时提高孔隙率.与此相反,在高温下使用金属卤化物作为熔融介质的离子热反应,已经用于三嗪[58-62]和吩嗪CMPs的高效合成[48](图3).CMPs的π-共轭骨架允许合成后修饰.例如,自由基硫醇炔反应已被应用到苯乙烯基的CMP63(图4).硫醇—炔比率可调谐官能化程度,并同时调节微孔结构.同样地,乙炔基与锂金属反应,然后用二氧化碳处理,改性成具有羧酸性能的苯乙烯CMP64已成功合成.通常得到的CMPs是不溶性粉末,难以通过溶液进行处理形成薄膜.Cooper小组合成了一个可溶性的CMP(SCMP1).他们采用的方法是引入大体积的有机单元,如叔丁基进入CMPs的周边,该过程是通过两步Suzuki交叉耦合反应完成的(图5)[45].所得芘基SCMP1呈现微孔特性,并且具有505 m2·g-1的比表面积.SCMP1显著特点之一是它允许溶液加工膜制备.虽然该膜的孔隙率还有待提高,但是从应用程序的角度来看,SCMP1的这种成膜方法是有重要意义的.CMPs 是一类新型微孔材料,具有多孔性、高比表面积、结构可调性和合成方法多样性等诸多优越的性能.目前CMPs的研究还在刚刚起步阶段,面临着许多问题,如大部分CMPs的合成是通过贵金属Pd催化得到的,存在着成本高和生成的聚合物中会有少量剩余Pd影响CMPs的本征性质.因此,如何减低成本,开发新方法,合成CMPs是将来新型微孔聚合物的研究热点之一.【相关文献】[1]R.M.Barrer.Zeolites and their synthesis[J].Zeolites,1981,1(3):130~140.[2]R.Fricke,H.Kosslick,G.Lischke,et al.Incorporation of gallium into zeolites:?syntheses,properties and catalytic application[J].Chem.Rev.,2000,100(6):2303~2406.[3]Z.Alothman.A Review:Fundamental aspects of silicate mesoporousmaterials[J].Materials,2012,5(12):2874~2902.[4]J.R.Long,O.M.Yaghi.The pervasive chemistry of metal-organicframeworks[J].Chem.Soc.Rev.,2009,38:1213~1214.[5]M.O'Keeffe.Design of MOFs and intellectual content in reticular chemistry:a personal view[J].Chem.Soc.Rev.,2009,38:1215~1217.[6]J.J.P.IV,J.A.Perman,M.J.Zaworotko.Design and synthesis of metal-organic frameworks using metal-organic polyhedra as supermolecular buildingblocks[J].Chem.Soc.Rev.,2009,38:1400~1417.[7]J.R.Holst,A.Trewin,A.I.Cooper.Porous organic molecules[J].Nat.Chem.,2010,2:915~920.[8]J.X.Jiang,A.I.Cooper.Microporous organic polymers:design,synthesis and function[J].Top Curr Chem.,2009,293:1~33.[9]J.T.A.Jones,T.Hasell,X.Wu,et al.Modular and predictable assembly of porous organic molecular crystals[J].Nature,2011,474:367~371.[10]D.C.Wu,F.Xu,B.Sun,et al.Design and preparation of porouspolymers[J].Chem.Rev.,2012,112(7):3959~4015.[11]P.kaur,J.T.Hupp,S.T.Nguyen.Porous organic polymers (POPs) in catalysis-opportunities and challenges[J].ACS Catal.,2011,1:819~835.[12]Z.H.Xiang,D.P.Cao.Porous covalent-organic materials:synthesis,clean energy application and design[J].J.Mater.Chem.A,2013,1:2691~2718.[13]M.P.Tsyurupa,V.A.Davankov.Porous structure of hypercrosslinked polystyrene:State-of-the-art mini-review[J].React.& Funct.Polym.,2006,66(7):768~779.[14]T.A.Makal,J.R.Li,W.G.Lu,et al.Methane storage in advanced porousmaterials[J].Chem.Soc.Rev.,2012,41:7761~7779.[15]Y.Zhang,S.N.Riduan.Functional porous organic polymers for heterogeneous catalysis[J].Chem.Soc.Rev.,2012,41:2083~2094.[16]N.B.McKeown,P.M.Budd.Polymers of intrinsic microporosity (PIMs):organic materials for membrane separations,heterogeneous catalysis and hydrogenstorage[J].Chem.Soc.Rev.,2006,35:675~683.[17]P.M.Budd,B.S.Ghanem,S.Makhseed,et al.Polymers of intrinsic microporosity (PIMs):robust,solution-processable,organic nanoporousmaterials[J]mun.,2004,230~231.[18]N.B.McKeown,P.M.Budd.Exploitation of intrinsic microporosity in polymer-based materials[J].Macromolecules,2010,43(12):5163~5176.[19]X.Feng,X.Ding,D.Jiang.Covalent organic frameworks[J].Chem.Soc.Rev.,2012,41:6010~6022.[20]S.Y.Ding,W.Wang.Covalent organic frameworks (COFs):from design toapplications[J].Chem.Soc.Rev.,2013,42:548~568.[21]A.P.Cté,A.I.Benin,N.W.Ockwig,et al.Porous,crystalline,covalent organicframeworks[J].Science,2005,310:1166~1170.[22]R.Dawson,A.I.Cooper,D.J.Adams.Nanoporous organic polymernetworks[J].Prog.Polym.Sci.,2012,37:530~563.[23]A.I.Cooper.Conjugated microporous polymers[J].Adv.Mater.,2009,21(12):1291~1295.[24]J.X.Jiang,F.B.Su,A.Trewin,et al.Cooper.Conjugated microporous poly(aryleneethynylene) networks[J].Angew.Chem.Int.Ed.,2007,46(45):8574~8578.[25]A.Suzuki.Carbon-carbon bonding made easy[J]mun.,2005,38:4759~4763.[26]A.Suzuki.Cross-Coupling Reactions Of Organoboranes:An easy way to construct C-C bonds (nobel lecture)[J].Angew.Chem.Int.Ed.,2011,50(30):6722~6737.[27]S.H.Chen,R.F.Horvath,J.Joglar,et al.Application of the Ibuka-Yamamoto reaction to a problem in stereochemical communication:a strategy for the stereospecific synthesis and stabilization of the triene substructure of rapamycin through sulfonesubstitution[J].Chem.,1991,56(20):5834~5845.[28]ngecker,M.Rehahn.Iridium-functionalized polyfluorenes:advantages and limitations of the suzuki and yamamotoapproaches[J].Macromol.Chem.Phys.,2008,209(3):258~271.[29]R.Chinchilla,C.Nájera.Recent advances in sonogashirareactions[J].Chem.Soc.Rev.,2011,40:5084~5121.[30]C.Liu,H.Zhang,W.Shi,A.W.Lei.Bond Formations between Two nucleophiles:transition metal catalyzed oxidative cross-coupling reactions[J].Chem.Rev.,2011,111(3):1780~1824.[31]W.Shi,C.Liu,A.Lei.Transition-metal catalyzed oxidative cross-coupling reactions to form C-C bonds involving organometallic reagents asnucleophiles[J].Chem.Soc.Rev.,2011,40:2761~2776.[32]Y.H.Jin,Y.L.Zhu,W.Zhang.Development of organic porous materials through Schiff-base chemistry[J].CrystEngComm,2013,15:1484~1499.[33]E.H.Cordes,W.P.Jencks.On the mechanism of schiff base formation andhydrolysis[J].J.Am.Chem.Soc.,1962,84(5):832~837.[34]S.Kotha,E.Brahmachary,hiri.Transition metal catalyzed[2+2+2]cycloaddition and application in organic synthesis[J].Chem.,2005,2005( 22):4741~4767.[35]V.Gevorgyan,Y.Yamamoto.Palladium-catalyzed enyne-yne[4+2] benzannulation as a new and general approach to polysubstitutedbenzenes[J]anomet.Chem.,1999,576(1-2):232~247.[36]J.A.McCubbin,anocatalyzed friedel-crafts arylation of benzylic alcohols[J].Tetrahedron Lett.,2010,51(18):2447~2449.[37]M.Hayashi,S.Z.Nakayama,H.Kawabata.HF-pyridine promoted friedel-crafts typearylation of 2-acetoxy-D-glucal.stereoselective synthesis of 1-arylhex-3-enopyranosiduloses[J]mun.,2000,1329~1330.[38]S.W.Yuan,B.Dorney,D.White,et al.Microporous polyphenylenes with tunable pore size for hydrogen storage[J]mun.,2010,46:4547~4549.[39]P.Kuhn,M.Antonietti,A.Thomas.Porous,covalent triazine-based frameworks prepared by ionothermal synthesis[J].Angew.Chem.Int.Ed.,2008,47(18):3450~3453.[40]J.X.Jiang,F.Su,H.Niu,et al.Conjugated microporous poly(phenylene butadiynylene)s[J]mun.,2008,486~488.[41]J.Schmidt,M.Werner,A.Thomas.Conjugated Microporous Polymer networks via yamamoto polymerization[J].Macromolecules,2009,42(13):4426~4429.[42]J.X.Jiang,A.Trewin,D.J.Adams,et al.Band gap engineering in fluorescent conjugated microporous polymers[J].Chem.Sci.,2011,2:1777~1781.[43]Y.H.Xu,L.Chen,Z.Q.Guo,et al.Jiang.Light-emitting conjugated polymers with microporous network architecture:interweaving scaffold promotes electronic conjugation,facilitates exciton migration,and improvesluminescence[J].J.Am.Chem.Soc.,2011,133(44):17622~17625.[44]J.X.Jiang,F.B.Su,A.Trewin,et al.Synthetic control of pore dimension and surface area in conjugated microporous polymer and copolymernetworks[J].J.Am.Chem.Soc.,2008,130(24):7710~7720.[45]G.Cheng,T.Hasell,A.Trewin,et al.Cooper.Soluble conjugated microporouspolymers[J].Angew.Chem.Int.Ed.,2012,51(51):12727~12731.[46]L.Chen,Y.Honsho,S.Seki,et al.Light-harvesting conjugated microporous polymers:rapid and highly efficient flow of light energy with a porous polyphenylene framework as antenna[J].J.Am.Chem.Soc.,2010,132(19):6742~6748.[47]Q.Chen,M.Luo,T.Wang,et al.Porous organic polymers based on propeller-like hexaphenylbenzene building units[J].Macromolecules,2011,44(14):5573~5577.[48]Y.Kou,Y.Xu,Z.Guo,et al.Supercapacitive energy storage and electric power supply using an aza-fused p-conjugated microporousframework[J].Angew.Chem.Int.Ed.,2011,50(37):8753~8757.[49]A.Li,R.F.Lu,Y.Wang,et al.Lithium-doped conjugated microporous polymers for reversible hydrogen storage[J].Angew.Chem.Int.Ed.,2010,49(19):3330~3333.[50]A.Li,H.X.Sun,D.Z.Tan,et al.Deng.Superhydrophobic conjugated microporous polymers for separation and adsorption[J].Energy Environ.Sci.,2011,4:2062~2065.[51]C.Xu and N.Hedin.Synthesis of microporous organic polymers with high CO2-over-N2 selectivity and CO2 adsorption[J].J.Mater.Chem.A,2013,1:3406~3414.[52]P.Pandey,A.P.Katsoulidis,I.Eryazici,et al.Imine-linked microporous polymer organic frameworks[J].Chem.Mater.,2010,22(17):4974~4979.[53]M.G.Rabbani,A.K.Sekizkardes,O.M.El-Kadri,et al.Pyrene-directed growth of nanoporous benzimidazole-linked nanofibers and their application to selective CO2 capture and separation[J].J.Mater.Chem.,2012,22:25409~25417.[54]Q.Chen,J.X.Wang,F.Yang,et al.Tetraphenylethylene-based fluorescent porous organic polymers:preparation,gas sorption properties and photoluminescenceproperties[J].J.Mater.Chem.,2011,21:13554~13560.[55]S.J.Ren,M.J.Bojdys,R.Dawson,et al.Porous,fluorescent,covalent triazine-based frameworks via room-temperature and microwave-assistedsynthesis[J].Adv.Mater.,2012,24:2357~2361.[56]W.Zhang,C.Li,Y.P.Yuan,et al.Highly energy- and time-efficient synthesis of porous triazine-based framework:microwave-enhanced ionothermal polymerization and hydrogen uptake[J].J.Mater.Chem.,2010,20:6413~6415.[57]W.Zhang,F.Liang,C.Li,et al.Microwave-enhanced synthesis of magnetic porous covalent triazine-based framework composites for fast separation of organic dye from aqueous solution[J].J.Haz.Mater.,2011,186(2-3):984~990.[58]P.Kuhn,A.Forget,D.Su,et al.From microporous regular frameworks to mesoporous materials with ultrahigh surface area:dynamic reorganization of porous polymer networks[J].J.Am.Chem.Soc.,2008,130(40):13333~13337.[59]R.Palkovits,M.Antonietti,P.Kuhn,et al.Solid catalysts for the selective low-temperature oxidation of methane to methanol[J].Angew.Chem.Int.Ed.,2009,48(37):6909~6912. [60]P.Kuhn,A.Thomas,M.Antonietti.Toward tailorable porous organic polymer networks:a high-temperature dynamic polymerization scheme based on aromaticnitriles[J].Macromolecules,2009,42(1):319~326.[61]X.Liu,H.Li,Y.Zhang,et al.Enhanced carbon dioxide uptake by metalloporphyrin-based microporous covalent triazine framework[J].Polym.Chem.,2013,4:2445~2448.[62]A.Bhunia,V.Vasylyeva and C.Janiak.From a supramolecular tetranitrile to a porous covalent triazine-based framework with high gas uptakecapacities[J]mun.,2013,49:3961~3963.[63]B.Kiskan,J.Weber.Versatile postmodification of conjugated microporous polymers using thiol-yne chemistry[J].ACS.Macro.Lett.,2012,1(1):37~40.[64]Z.H.Xiang,D.P.Cao,W.C.Wang,et al.Postsynthetic lithium modification of covalent-organic polymers for enhancing hydrogen and carbon dioxidestorage[J].J.Phys.Chem.C,2012,116(9):5974~5980.。
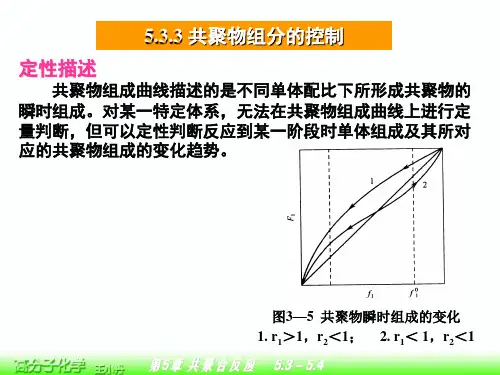
第5章目录5.1 非金属元素的结构化学:8-N法则5.2 非共轭分子几何构型与VSEPR规则5.3 分子几何构型与Walsh规则5.4 共轭分子与SHMO法5.4.1 丁二烯离域大π键的SHMO处理5.4.2 简并轨道的求解与等贡献规则5.4.3 直链和单环共轭体系本征值的图解法5.4.4 分子图:π电子密度、π键级、自由价5.4.5 共轭效应5.4.6 共轭分子在现代科技中的应用5.4.7 超共轭效应5.5 饱和分子的正则轨道与定域轨道5.6 缺电子分子的结构5.6.1 缺电子原子化合物的三种类型5.6.2 硼烷中的多中心键5.6.3 金属烷基化合物中的多中心键5.7 等瓣类似性关系5.7.1 等瓣类似性概念5.7.2 八面体构型金属-配体碎片与有机碎片的等瓣类似性5.7.3 其他构型的金属-配体碎片与有机碎片的等瓣类似性5.7.4 各种配位的分子碎片的等瓣类似关系小结5.7.5 等瓣类似性原理的应用实例5.8 多原子分子的谱项5.8.1 电子组态与分子谱项5.8.2 荧光与磷光5.9 配位场理论5.9.1 晶体场理论(CFT)5.9.2 配位场理论(LFT)5.9.3 T-S图与电子光谱5.10 分子轨道对称性守恒原理5.10.1 前线轨道理论5.10.2 相关图理论与金属相比, 非金属的数量要少得多。
目前在元素周期表中有110多种元素,非金属元素只占20余种, 分布在p 区(除H 的位置有不同看法外)。
在p 区中,整个一列稀有气体都是非金属元素,其余非金属元素很有规律地占据了右上角区域。
非金属元素数量虽少,但成键规律、结构特征都与金属元素有所不同。
非金属单质中定域共价键占主导地位,与金属单质中金属键占主导地位形成鲜明的对照。
金属键没有饱和性和方向性。
对于金属单质结构,几何因素起重要作用, 大多数金属单质晶体采取简单的密堆积结构。
共价键有饱和性和方向性。
非金属原子以共价单键结合时,周围通常配置8-N个原子,非金属间化合物配位也如此。
共轭配位聚合物全文共四篇示例,供读者参考第一篇示例:共轭配位聚合物是一类具有特殊结构和性质的高分子化合物,它们在配位作用下形成的长链结构具有共轭特性,表现出良好的电子传输性能和光电性能。
共轭配位聚合物在有机光电领域具有广泛的应用前景,被认为是一种有潜力的新型材料。
共轭配位聚合物的结构特点主要体现在其分子链上的配体和过渡金属离子的配位结合上。
配位键的形成使得分子链上的电子轻易扩散,形成共轭链结构,因此这类聚合物通常表现出较高的载流子迁移率和较低的电子能隙。
一些共轭配位聚合物还具有自组装性质,能够在溶液中自组装形成有序结构,有利于提高材料的性能。
共轭配位聚合物的合成方法多样,包括金属有机化学合成、还原-聚合反应、跨偶合反应等。
金属有机化学方法是较为常用的方法,通过金属离子和有机配体之间的配位反应,可以直接合成出具有共轭结构的聚合物。
而还原-聚合反应则是将含还原活性基团的单体与金属离子进行还原反应,生成含有金属-有机键的聚合物。
跨偶合反应则是通过金属催化将两个不同的单体进行偶合反应,生成具有跨链结构的聚合物。
共轭配位聚合物在有机光电领域具有广泛的应用,主要体现在有机太阳能电池、有机场效应晶体管、有机光电器件等方面。
有机太阳能电池是目前研究较为深入的领域之一,共轭配位聚合物作为其光电活性层材料,可以有效提高光电转化效率,并且具有较高的可调性和柔韧性。
共轭配位聚合物还可以作为有机场效应晶体管的载流子传输层材料,提高器件的性能稳定性和传输速度。
在有机光电器件方面,共轭配位聚合物也表现出优异的性能。
通过调控共轭聚合物的结构,可以实现器件的光电子转换效率的提高,同时还可以减少材料的成本和加工难度。
共轭配位聚合物还表现出在高电场下的稳定性好、溶液加工性好等优点,为有机光电器件的商业化应用提供了良好的基础。
第二篇示例:共轭配位聚合物是一种特殊的聚合物,其分子中含有共轭结构的配位基团。
这种聚合物具有许多独特的性质和应用潜力,因此吸引了广泛的研究兴趣。