离子交换层析讲解
- 格式:ppt
- 大小:436.00 KB
- 文档页数:67

离子交换层析名词解释
离子交换层析(Ion exchange chromatography,简称IEC)是一种分析和分离离子的技术方法。
在离子交换层析中,样品溶液被注入到一个含有离子交换树脂的柱子中,离子交换树脂具有特定的离子交换基团,可以选择性地吸附和释放样品溶液中的离子。
离子交换层析的分离原理基于离子交换树脂对溶液中的离子的亲和力不同。
当样品溶液通过柱子时,带有相同电荷的离子与离子交换树脂产生吸附作用,而带有相反电荷的离子则可以自由通过。
通过调节溶液的pH值、离子浓度和离子交换树脂的性质,可以实现对不同离子的选择性分离。
离子交换层析常用于分离和纯化蛋白质、核酸和多肽等生物大分子,并且在药物研发、环境分析和生命科学研究中得到广泛应用。




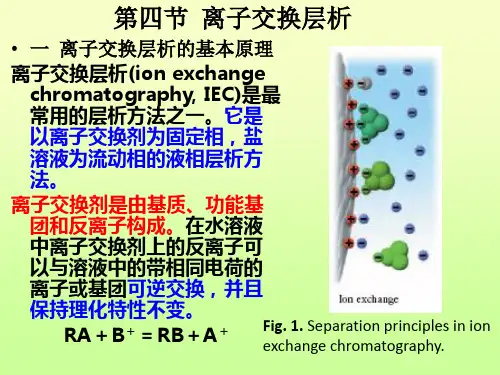
离子交换层析离子交换层析是常见的层析方式之一,它以离子交换剂为固定相,液体为流动相的系统中进行,广泛应用于氨基酸、多肽、蛋白质、糖类、核苷和有机酸等的分析、制备、纯化以及溶液的脱色、中和等方面。
离子交换层析(Ion Exchange Chromatography 简称为IEC )是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。
离子交换层析中,基质是由带有电荷的树脂或纤维素组成。
带有正电荷的称之阴离子交换树脂;而带有负电荷的称之阳离子树脂。
离子交换层析同样可以用于蛋白质的分离纯化。
由于蛋白质也有等电点,当蛋白质处于不同的pH 条件下,其带电状况也不同。
阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的蛋白质洗脱下来。
结合较弱的蛋白质首先被洗脱下来。
反之阳离子交换基质结合带有正电荷的蛋白质,结合的蛋白可以通过逐步增加洗脱液中的盐浓度或是提高洗脱液的pH 值洗脱下来。
基本原理离子交换剂的组成 离子交换剂是由基质、电荷基团(或功能基团)和反离子构成的。
离子交换层析(固定相)的特性 在水中呈不溶解状态,但能释放反离子,同时与溶液中其他离子或离子化合物可逆性结合,并且结合后本身的理化性质不变 如:RA + B+ RB + A+ 或RA + B- RB + A-离子交换层析的原理 由于离子交换剂的选择性,对不同的离子或离子化合物有不同的结合力,所以用洗脱剂洗脱时,结合力小的先被洗脱出来,结合力大的后被洗脱下来,从而达到分离混合物的目的(离子交换剂的选择性决定其与溶液中离子的结合力大小,通常用离子交换剂与溶液中离子的反应平衡常数表示)[RB][A +]= [RB][B +] 当[A+]=[B+]时若 K B A >1,即[RB]>[RA],表示离子交换剂对B+的结合力比A+ 大 若 K B A = 1,即[RB]=[RA],表示离子交换剂对B+的结合力与A+ 相等 若 K BA <1,即[RB]<[RA],表示离子交换剂对B+的结合力比A+ 小 KB A 值是反映离子交换剂对不同离子的结合力或选择性的参数 规 律①强酸性阳离子交换剂对H+的结合力比对Na+小 ②强碱性阴离子交换剂对OH-的结合力比对Cl-小得多 ③弱酸性离子交换剂对H+的结合力比对Na+大 ④弱碱性离子交换剂对OH-的结合力比对Cl-大B AK][][RA RB KB A对于呈两性离子的蛋白质、酶类、多肽和核苷酸等,与离子交换剂的结合力,主要取决于它们的理化性质及在特定pH条件下呈现的离子状态。


离子交换层析法的原理
离子交换层析法是一种根据物质带电性质差异,从而实现分离纯化的层析技术。
该方法的原理是以离子交换剂为固定相,以特定的含离子的溶液为流动相,利用离子交换剂对需要分离的各种蛋白质结合力的差异,而将混合物中不同蛋白质进行分离。
离子交换的本质是目标物和介质功能配基之间的静电相互作用,蛋白质的带电性是由蛋白质多肽中带电氨基酸决定的,而蛋白质中氨基酸的电性又取决于介质中的pH,所以蛋白质的带电性也就依赖于介质的pH。
层析时,离子交换树脂的分子中有活性基并带有阴、阳电荷,在水溶液中可与其它阴、阳离子起交换作用,这种交换作用是可逆的,遵循化学平衡原理。
通过连续添加洗脱液,溶液平衡向右进行,可以把原有离子交换树脂上的活性离子洗脱下来,而带有相同电荷的离子被交换吸附在树脂上,然后被吸附的物质又可用另一种洗脱液洗下来,从而达到分离提取的目的。


阴离子交换层析原理
1. 介绍阴离子交换层析
阴离子交换层析是一种将混合物中的阴离子分离出来的技术,主
要应用于化学分析、生物技术以及制药工业等领域。
其原理是利用带
有阴离子功能的吸附树脂,通过交换作用将阴离子从混合物中分离出来。
2. 阴离子交换层析的工作原理
阴离子交换层析的工作原理基于以下两个基本的物化过程:
1. 吸附过程:阴离子在吸附树脂上被电力吸附,形成固定的化学键,从而分离出混合物中的阴离子。
2. 解吸过程:通过改变交换树脂的化学环境(如改变pH值),
阴离子从吸附树脂上解离并返回混合物中。
3. 阴离子交换层析的应用
阴离子交换层析技术在生物技术和制药工业中具有广泛的应用。
例如,可以利用阴离子交换层析技术从细胞培养液中纯化蛋白质,或
从结晶体中提取及纯化核酸等。
此外,阴离子交换层析技术还可应用于水处理和环境保护领域,
如去除水中的离子和有机污染物,以及分离和分析空气中的有害物质。
4. 结论
阴离子交换层析技术是一种高效的分离和纯化技术,已广泛应用于各个领域。
通过深入研究阴离子交换层析的原理和应用,我们可以更好地开发和利用这一技术,为推动科学和工业的发展做出更大的贡献。